HPLC-DPPH快速測定枳殼抗氧化活性成分△
何英杰,謝紅旗*,伍睿宇,,唐其,,程辟,,周伊昀
(1.湖南農業大學 園藝園林學院,湖南 長沙 410128;2.國家中醫藥管理局 亞健康干預技術實驗室,湖南 長沙 410128;3.湖南省植物功能成分利用協同創新中心,湖南 長沙 410128;4.湖南湘眾中藥材種植貿易有限公司,湖南 郴州 423600)
·基礎研究·
HPLC-DPPH快速測定枳殼抗氧化活性成分△
何英杰1,2,3,謝紅旗1,2,3*,伍睿宇1,2,唐其1,3,程辟1,3,周伊昀4
(1.湖南農業大學 園藝園林學院,湖南 長沙410128;2.國家中醫藥管理局 亞健康干預技術實驗室,湖南 長沙410128;3.湖南省植物功能成分利用協同創新中心,湖南 長沙410128;4.湖南湘眾中藥材種植貿易有限公司,湖南 郴州423600)
目的:為高效利用枳殼(AurantiiFructus)中活性成分,建立測定枳殼中活性成分柚皮苷、橙皮苷和新橙皮苷的方法,并同時評價其抗氧化能力。方法:采用高效液相色譜聯用1,1-二苯基-2-三硝基苯肼(HPLC-DPPH)技術,Agilent-ZORBAXSB-C18色譜柱(150mm×4.6mm,5μm),流動相為0.04%磷酸水(A)-乙腈(B),采用梯度洗脫程序,檢測波長:283nm,柱溫:25℃,流速:0.8mL·min-1。結果:柚皮苷、橙皮苷及新橙皮苷質量分數分別為52.64、2.41、34.27mg·g-1;抗氧化能力貢獻率(AA*):柚皮苷(58.9%)>新橙皮苷(38.3%)>橙皮苷(2.8%),DPPH自由基清除率(AA**):柚皮苷(47.8%)>橙皮苷(38.1%)>新橙皮苷(36.2%)。結論:本文通過建立HPLC-DPPH法對枳殼抗氧化活性成分進行測定和評價,為開發利用枳殼中抗氧化活性成分提供一種新思路。
枳殼;柚皮苷;新橙皮苷;橙皮苷;HPLC-DPPH法
枳殼為蕓香科植物酸橙CitrusaurantiumL.及其栽培變種的未成熟果實,其性溫,具有理氣寬中、行滯消脹之功效,主治胸脅氣滯、脹滿疼痛、食積不化、痰飲內停、臟器下垂[1]。枳殼中主要含有黃酮[2]、生物堿[3]、揮發油[4]及少量的香豆素[5-6]等具有生物活性的化合物,其中含量最高的是二氫黃酮類化合物,如柚皮苷、新橙皮苷等[7]。測定物質抗氧化活性的方法有很多,如清除羥自由基法(OH·)[8]、超氧陰離子法(O·2-)[9]、DPPH法[10]等,這些方法通常用于藥用植物和中藥提取物抗氧化能力的評價。但這些方法通常測定的是提取物或某一類組分的總抗氧化能力。要想測定藥用植物或中藥中的某一種化學成分的抗氧化活性,需要經過大量的分離純化過程。因此建立一種從復雜混合物中快速、準確篩選和評價抗氧化活性成分的方法在中藥現代化研究中非常重要。
高效液相色譜聯用DPPH技術(HPLC-DPPH)是一種同時分析和評價藥用植物功能成分抗氧化活性的方法,該方法無需分離能夠快速評價復雜樣品中單一成分的抗氧化活性[11-12]。DPPH為小分子化合物,可以使用HPLC進行分離,而且活性成分與DPPH單電子配對使活性成分結構發生改變,反應后樣品在HPLC譜圖上表現為色譜峰面積降低或消失,峰面積降低的程度與化合物清除自由基的能力存在一定的關系,因此通過對比分析原色譜圖及與DPPH反應后的混合物的色譜圖即可確定天然產物中的抗氧化活性成分,該法快速、直觀、簡單易操作[13]。枳殼中抗氧化活性成分主要為黃酮類化合物,以往文獻報道的大多是評價枳殼提取物總黃酮的抗氧化效果[14],而對單一黃酮類化合物的抗氧化活性很少報道。本文通過建立HPLC聯用DPPH評價抗氧化活性方法來篩選和測定枳殼中抗氧化活性成分,該方法將為開發和利用枳殼中抗氧化活性成分提供一種新的思路。
1 材料與儀器
1.1材料
枳殼(湖南湘眾中藥材種植與貿易有限公司);對照品:柚皮苷(narigin,批號:B12594)、橙皮苷(hesperidin,批號:B20182)、新橙皮苷(neohesperidin,批號:B21390),均購自源葉生物有限公司,純度均≥98%;試劑:乙醇、甲醇、乙腈均為分析純(上海國藥集團試劑有限公司),DPPH(美國Sigma公司)。
1.2儀器
KM5200DV超聲波儀(昆山超聲儀器有限公司),1200Indinitely series高效液相色譜儀(美國安捷倫公司),XS205分析天平(METTLER TOLEDO)。
2 方法
2.1供試品與對照品溶液的配制
2.1.1供試品溶液制備 參考文獻[15],稍作修改,取枳殼樣品于烘箱內50℃下烘干24h,打粉,過100目篩,精密稱量0.20g樣品,用50mL60%乙醇水超聲15min,抽濾,濾渣用40mL60%乙醇水再次超聲10min,合并濾液,定容至100mL容量瓶,備用。
2.1.2對照品溶液制備 精密稱量一定量柚皮苷、橙皮苷及新橙皮苷對照品,分別用甲醇溶解并定容制成質量濃度為0.12mg·mL-1的對照品貯備溶液,對照品HPLC圖見圖1。
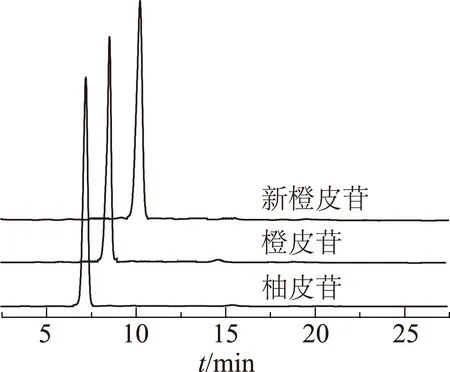
圖1 柚皮苷等3種對照品色譜圖
2.2高效液相色譜條件
Agilent-ZORBAX SB-C18色譜柱(150mm×4.6mm,5μm),流動相為0.04%磷酸水(A)-乙腈(B),采用梯度洗脫程序:0~5min,12%~20% B;5~15min,20%~25% B;15~25min,25%~12% B;25~30min,12% B。檢測波長:283nm,柱溫:25℃,進樣量:10μL,流速:0.8mL·min-1。
2.3活性成分測定
取制備好的供試品溶液,按照2.2色譜條件進樣,測定柚皮苷、橙皮苷、新橙皮苷含量。
2.4抗氧化能力測定
2.4.1DPPH溶液制備 取2.0mg DPPH試劑,乙醇溶解并定容于100mL容量瓶中,制成質量濃度為20μg·mL-1的DPPH溶液,4℃條件下避光備用。
2.4.2DPPH-HPLC聯用測定抗氧化活性成分 分別取供試品溶液2.0mL,置于a、b試管中,其中a試管加入DPPH溶液2.0mL作為實驗組,b試管加入乙醇溶液2.0mL作為對照組,充分混勻,35℃水浴條件下避光靜置30min;從a、b試管中各取1.0mL,過0.45μm液相膜,按照高效液相色譜條件進行檢測,實驗重復3次。
2.4.3抗氧化能力貢獻率 通過HPLC-DPPH聯用技術,初步分析枳殼提取物中抗氧化活性成分,實驗設計如圖2所示,以柚皮苷、橙皮苷及新橙皮苷為特征成分指標,對化合物的抗氧化能力貢獻率(AA*)進行測定,按公式(1)計算。
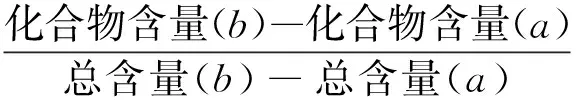
(1)
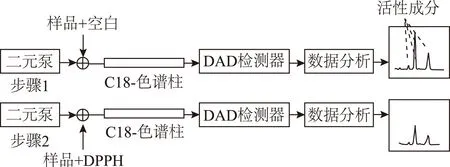
圖2 DPPH-HPLC聯用測定抗氧化活性成分
2.4.4DPPH自由基清除率 分別取柚皮苷、橙皮苷、新橙皮苷對照品貯備溶液2.0mL,各加入2.0mL DPPH溶液,充分混勻,35℃水浴條件下避光靜置30min,利用紫外分光光度計在517nm下檢測吸光度(A)變化,測定各化合物對DPPH自由基清除率(AA**),按公式(2)計算。
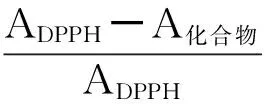
(2)
3 結果與分析
3.1色譜系統適用性優化
參考《中華人民共和國藥典》中枳殼黃酮檢測方法,加以改進。流動相選擇上,在水相中加入0.04%的磷酸即可達良好的峰型效果;柚皮苷與橙皮苷出峰時間過于接近,未能達到完全分離的效果,故而對流動相洗脫程序進行優化,流速降低至0.8mL·min-1,并采用梯度洗脫模式(見表1),能將各化合物之間完全分開,橙皮苷與相鄰化合物分離度大于1.5,各化合物峰型窄而對稱,表明色譜程序專屬性較高。
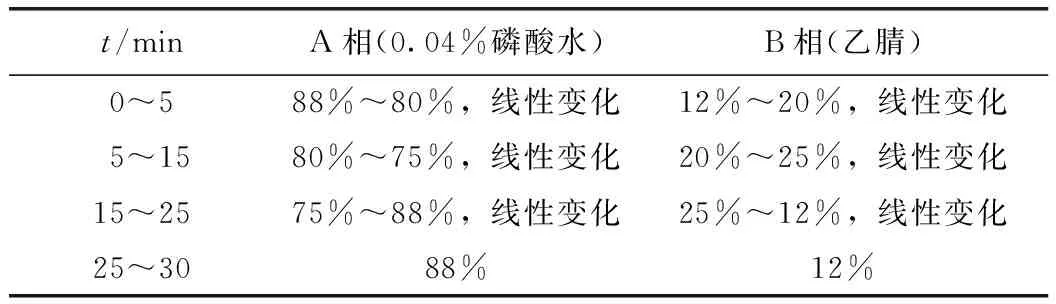
表1 流動相梯度洗脫程序
3.2方法學考察
3.2.1線性關系 取柚皮苷、橙皮苷、新橙皮苷對照品制成質量濃度分別為2、10、20、40、80、120μg· mL-1混合對照溶液,按2.2色譜條件進行分析,以對照品溶液質量濃度為橫坐標,各對照品色譜峰面積為縱坐標進行線性回歸,得到柚皮苷、橙皮苷、新橙皮苷線性回歸方程,結果如表2所示,表明各對照品質量濃度在2.0 ~120 μg· mL-1與色譜峰面積呈良好線性關系,檢測下限為0.05 μg· mL-1。

表2 柚皮苷、橙皮苷及新橙皮苷線性回歸方程
3.2.2 精密度、重復性及穩定性試驗 取柚皮苷、橙皮苷、新橙皮苷混合對照溶液,進樣6次,其RSD分別為0.89%、0.76%、0.81%,表明其精密度良好;取同一供試品6份,按照2.2色譜條件,測定柚皮苷、橙皮苷、新橙皮苷的含量,其RSD分別為1.1%、1.3%、1.2%,表明該色譜測定條件下方法重復性良好;取供試品溶液,分別于0、1、2、5、7、10、15、20、24 h后進行其供試品中柚皮苷、橙皮苷、新橙皮苷的含量測定,計算其RSD分別為0.8%、0.9%、0.85%,表明其穩定性良好。
3.2.3 加樣回收率試驗 精密稱取已知含量的枳殼樣品粉末0.1 g,共9份,每組按低、中、高濃度分別精密加入柚皮苷、橙皮苷、新橙皮苷對照品溶液,并按照2.1.1樣品提取方法進行提取定容,按2.2色譜條件進行測定分析,結果見表3。
3.3枳殼抗氧化物分析
3.3.1含量測定 按照2.1.1條件同時制備3組供試品溶液,通過高效液相色譜測定柚皮苷、橙皮苷、新橙皮苷含量,測得枳殼中三者質量分數分別為52.64、2.41、34.27mg·g-1,RSD分別為1.12%、1.67%、1.08%(見表4),表明實驗方法準確可靠。其中柚皮苷、新橙皮苷含量均高于《中華人民共和國藥典》標準,表明藥材品質較高。

表3 柚皮苷、橙皮苷及新橙皮苷加樣回收率試驗
3.3.2 抗氧化能力評價 HPLC-DPPH聯用技術對枳殼中黃酮類化合物進行抗氧化能力分析,通過高效液相色譜圖可以清晰判斷各抗氧化活性化合物對DPPH自由基產生了顯著的清除能力(P<0.05),峰面積響應減弱(見圖3)。結果表明柚皮苷、橙皮苷及新橙皮苷均具有較強的抗氧化能力,其中,抗氧化能力貢獻率(AA*):柚皮苷>新橙皮苷>橙皮苷,柚皮苷和新橙皮苷抗氧化貢獻率之和大于90%,表明二者是主導抗氧化活性成分。通過等質量濃度對照品對DPPH自由基清除能力進行比較,表明柚皮苷對DPPH自由基的清除率(AA**)最強,橙皮苷和新橙皮苷則基本一致,表明就單一化合物而言,柚皮苷具有更強的抗氧化能力(見表4)。
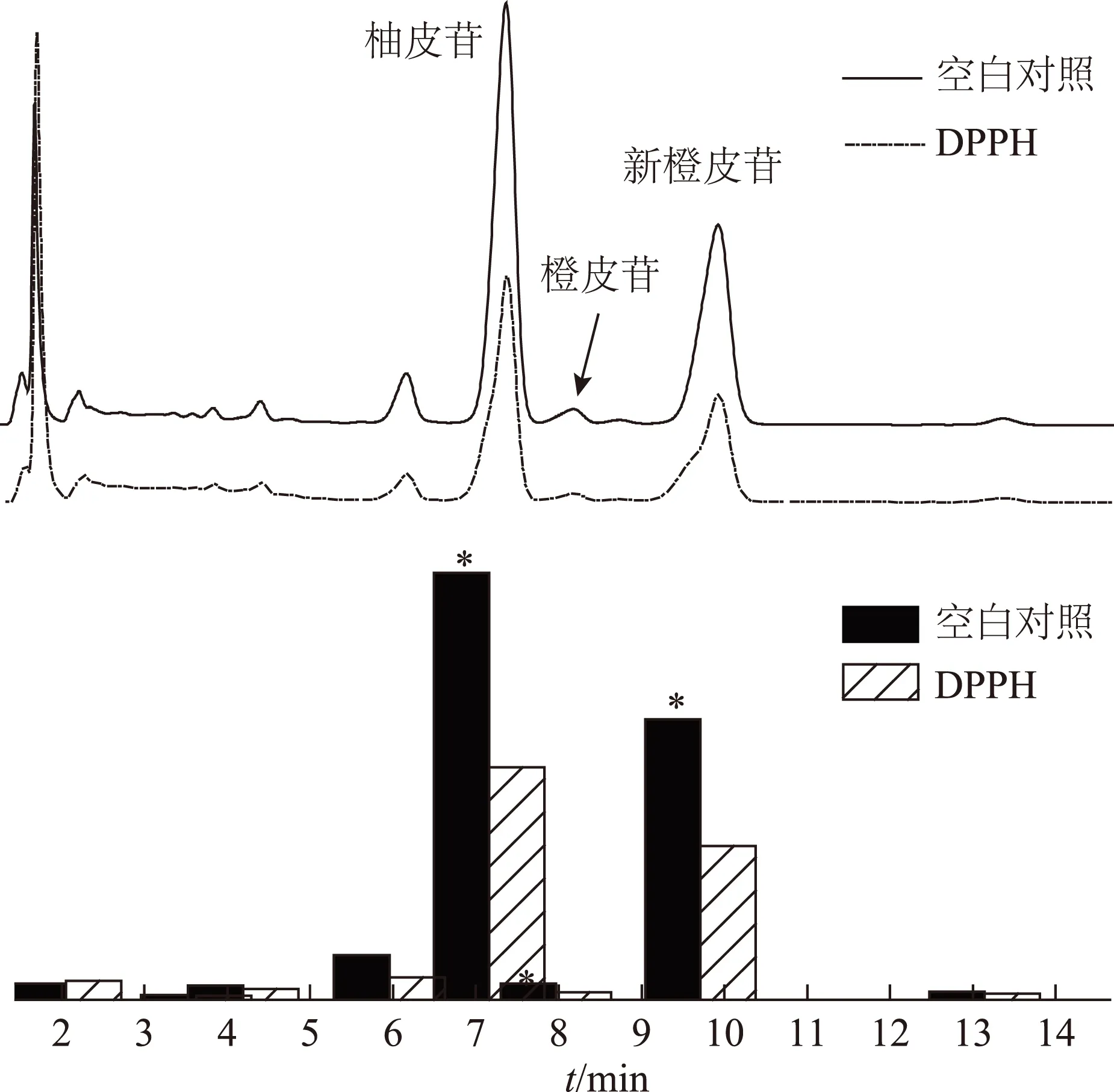
注:與DPPH比較,*P<0.05。圖3 枳殼中黃酮類化合物抗氧化能力分析
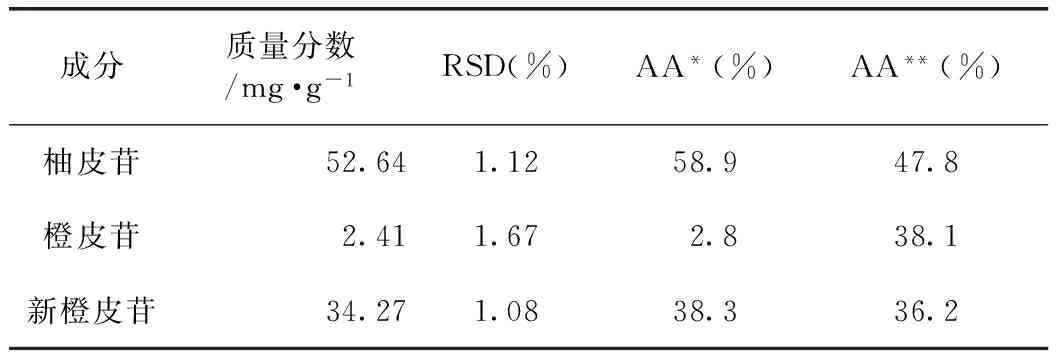
成分質量分數/mg·g-1RSD(%)AA*(%)AA**(%)柚皮苷52.641.1258.947.8橙皮苷2.411.672.838.1新橙皮苷34.271.0838.336.2
4 結論
枳殼提取物總抗氧化能力與抗氧化活性化合物的含量有直接關系,柚皮苷含量最高,對總提物總抗氧化能力貢獻最大,新橙皮苷次之,二者構成了枳殼黃酮中主要的抗氧化活性成分。黃酮化合物自身抗氧化能力則與其化學結構特殊性有關,其抗氧化能力強弱常常與化學結構、羥基化程度、取代基類型、共軛鍵及聚合程度等有重要關系[16]。從化學結構來看(見圖4),在黃酮母核結構的A、B環上,柚皮苷的C-4′ 及C-5位各含有一個酚羥基(-OH),表現出較強的供質子能力;新橙皮苷和橙皮苷除了C-7上的糖基取代基不同外,其余結構一致,故而抗氧化能力基本一致;二者在B環上的C-4′位上則被甲氧基(-OCH3)所取代,C-3′的-OH由于處于鄰位,導致供質子能力減弱,所以二者抗氧化能力低于柚皮苷。
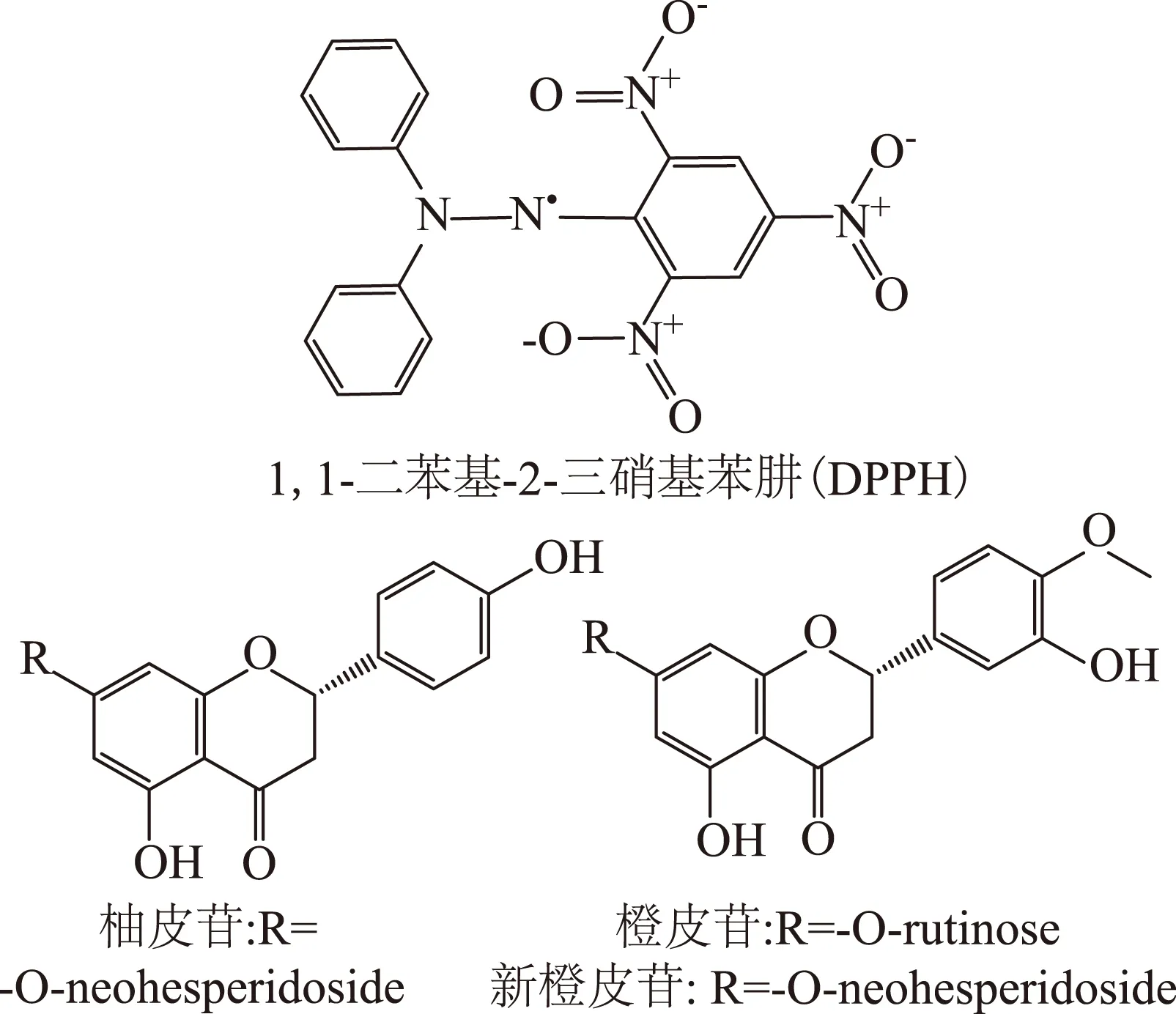
圖4 DPPH及枳殼主要抗氧化活性成分化學結構
實驗研究建立了HPLC-DPPH聯用快速測定枳殼中主要抗氧化活性成分并同時分析其抗氧化能力的方法;其優勢在于:第一,避免了傳統實驗方法測定植物提取物抗氧化能力過程中出現的操作繁瑣、耗時等缺點;第二,該方法能夠在分子水平對枳殼中抗氧化物進行分析討論,能更加深入分析各化合物的抗氧化能力以及各化合物對提取物總抗氧化能力貢獻。本文對枳殼中柚皮苷、橙皮苷和新橙皮苷的含量和抗氧化活性進行了評價,如能結合質譜方法對其他成分進行定性分析,將對枳殼中具有抗氧化活性的黃酮類化合物篩選提供一種非常便利的方法,也為其他天然藥用植物活性成分的篩選、評價、深入研究以及開發利用提供新思路。
[1] 國家藥典委員會.中華人民共和國藥典:一部[S].北京:中國醫藥科技出版社,2015:246.
[2] Lin Z,Wang H,Xu Y,et al.Identification of antioxidants in Fructus aurantii,and its quality evaluation using a new on-line combination of analytical techniques[J].Food Chem,2012,134(2):1181-1191.
[3] 彭國平,牛賀明,徐麗華.枳實活性成分的研究[J].南京中醫藥大學學報,2001,17(2):91-92.
[4] 曹君,王少軍,龔千鋒,等.不同產地枳殼飲片炮制前后揮發油成分的GC-MS分析[J].中草藥,2005,36(2):172-177.
[5] Cho H E,Ahn S Y,Kim S C,et al.Determination of fla-
vonoid glycosides,polymethoxyflavones,and coumarins in herbal drugs ofCitrusandPoncirusFruits by high performance liquid chromatography-electrospray ionization/tandem mass spectrometry[J].Anal Lett,2014,47(8):1299-1323.
[6] Chen H F,Zhang W G,Yuan J B,et al.Simultaneous quantification of polymethoxylated flavones and coumarins in Fructus aurantii,and Fructus aurantii immaturus,using HPLC-ESI-MS/MS[J].J Pharm Biomed Anal,2012,59(3):90-95.
[7] 賈強,白楊,馬燕,等.枳殼和枳實化學成分的HPLC-ESI-MS分析[J].中草藥,2005,36(2):169-172.
[8] Jung M J,Heo S I,Wang M H.Free radical scavenging and total phenolic contents from methanolic extracts ofUlmusdavidiana[J].Food Chem,2008,108(2):482-487.
[9] Tsukagoshi K,Saito T,Nakajima R.Analysis of antioxidants by microchip capillary electrophoresis with chemiluminescence detection based on luminol reaction[J].Talanta,2008,77(2):514-517.
[11]Du Q,Li B.Identification of antioxidant compounds ofMucunasempervirens,by high-speed counter-current chromatographic separation-DPPH radical scavenging detection and their oestrogenic activity[J].Food Chem,2012,131(4):1181-1186.
[12]And D B,Murkovic M.On-line HPLC-DPPH screening method for evaluation of radical scavenging phenols extracted from apples (MalusdomesticaL.)[J].J Agric Food Chem,2002,50(9):2482-2487.
[13]Yu L,Zhao J,Zhu Q,et al.Macrophage biospecific extraction and high performance liquid chromatography for hypothesis of immunological active components inCordycepssinensis[J].J Pharm Biomed Anal,2007,44(2):439.
[14]鄭雪良,劉春榮,王登亮,等.胡柚小青果的黃酮類化合物及抗氧化活性研究[J].浙江農業學報,2015,27(7):1185-1191.
[15]鄒建國,劉飛,劉燕燕,等.響應面法優化微波輔助提取枳殼中總黃酮工藝[J].食品科學,2012(2):24-28.
[16]Tripoli E,Guardia M L,Giammanco S,et al.Citrus,flavonoids:Molecular structure,biological activity and nutritional properties:A review[J].Food Chem,2007,104(2):466-479.
RapidDeterminationofAntioxidantConstituentsinAurantiiFructusbyHPLC-DPPHMethod
HE Yingjie1,2,3,XIE Hongqi1,2,3*,WU Ruiyu1,2,TANG Qi1,3,CHENG Pi1,3,ZHOU Yiyun4
(1.College of Horticulture and Landscape,Hunan Agricultural University,Changsha 410128,China;2.State Key Laboratory of Subhealth Intervention Technology,Changsha 410128,China;3.Hunan Co-innovation Center for Utilization of Botanical Functional Ingredients,Changsha 410128,China;4.Hunan Xiang Zhong Chinese herbal medicine planting and trade Co.,Ltd.,Chenzhou 423600,China)
Objective:In order to utilize the active ingredients effectively in Aurantii Fructus,a method of determination and evaluation the antioxidant capacity of naringin,hesperidin and neohesperidin simultaneously in Aurantii Fructus was established with high performance liquid chromatography combined with 1,1-diphenyl-2-picrylhydrazyl (HPLC-DPPH) technique.Methods:The determination conditions were as follows:HPLC separation was carried out with an Agilent-ZORBAX SB-C18column (150 mm×4.6 mm,5 μm) using 0.04% phosphoric acid (A)-acetonitrile(B) [0-5 min,12%-20% B;5-15 min,20%-25% B;15-25 min,25%-12% B;5-30 min,12% B] as mobile phase at a flow rate of 0.8 mL·min-1.The detection wavelength was 283 nm and the column temperature was maintained at 25 ℃.Results:The content of naringin,hesperidin and neohesperidin in Aurantii Fructus was 52.64,2.41,34.27 mg·g-1separately.The contribution rate of total antioxidant capacity(AA*) was naringin (58.9%) > neohesperidin (38.3%) > hesperidin(2.8%),and the DPPH free radical scavenging rate (AA**) was naringin(47.8%) > hesperidin (38.1%) > neohesperidin (36.2%).Conclusion:HPLC-DPPH method was efficiently established for the determination and evaluation of the antioxidant compounds of Aurantii Fructus, and this method could provide a new idea for the research and utilization of Aurantii Fructus.
Aurantii Fructus;naringin;hesperidin;neohesperidin;HPLC-DPPH assay
國家工信部中藥材扶持項目(2015);湖南省科技廳重大專項(2015SK1001);湖南省研究生科研創新項目(CX2016B311);湖南省科技項目(2016SK3043)
] 謝紅旗,博士,副教授,研究方向:天然產物分析;Tel:(0731)84617244,E-mail:xiehongqi2006@sohu.com
10.13313/j.issn.1673-4890.2017.8.016
2017-01-06)
*[

