碳源自供給潛流人工濕地中反硝化基因與碳氮比的關(guān)系
劉 暢,聞 岳,余雪岑,郭文瑞,周 琪
(同濟大學 環(huán)境科學與工程學院,上海 200092)
碳源自供給潛流人工濕地中反硝化基因與碳氮比的關(guān)系
劉 暢,聞 岳,余雪岑,郭文瑞,周 琪
(同濟大學 環(huán)境科學與工程學院,上海 200092)
本研究構(gòu)建了4套碳源自供給水平潛流人工濕地裝置,以香蒲生物質(zhì)發(fā)酵液作為外加碳源,考察了生物質(zhì)發(fā)酵液投加量(進水碳氮比CODAdd/NO3-N = 1, 2, 3, 4)與植物(Typha latifolia)對反硝化功能基因nirS、nirK和nosZ的影響。結(jié)果表明,三種基因在濕地系統(tǒng)中數(shù)量級分別為107~108、105和106~107拷貝數(shù)/g礫石。生物質(zhì)發(fā)酵液能促進含nirS、nirK和nosZ的微生物生長;植物能促進含nirS、nirK微生物生長。
水平潛流人工濕地;反硝化基因;生物質(zhì)發(fā)酵液;碳源;脫氮
人工濕地(CWs)污水處理技術(shù)具有高效、操作簡單、維護和運行費用低廉等優(yōu)點,已廣泛地應(yīng)用于城市污水處理廠二級出水的深度處理[1]。一般而言,反硝化是人工濕地的主要脫氮途徑[2-3]。然而,由于污水中可生物降解有機物在處理廠中被大量去除[4],因此,急需向人工濕地中補充足夠的碳源以提高系統(tǒng)反硝化效能。
張長城等開發(fā)了一個碳源自供給的人工濕地,將收割的香蒲生物質(zhì)產(chǎn)酸發(fā)酵后投加到自身系統(tǒng)中,可將硝酸鹽速率提高0.05~0.54 gN·m-2·d-1,且硝酸鹽的去除速率與CODAdd/NO3-N呈現(xiàn)出強烈的正相關(guān)性[5]。雖然該研究已取得了階段性進展,但是反硝化過程中關(guān)鍵的功能基因的檢測對于深刻理解碳源投加和微生物之間的關(guān)系也是至關(guān)重要的。已有研究表明,反硝化過程中的主要基因為亞硝酸鹽還原酶功能基因(nirS和nirK,可分別表達含有細胞色素cd1和銅元素的亞硝酸鹽還原酶[6])和一氧化二氮還原酶功能基因(nosZ,表達一氧化二氮還原酶[7]),它們的拷貝數(shù)可用于分析反硝化微生物的數(shù)量和豐度。同時,在張長城[5]等的濕地中,碳源投加和植物存在對于反硝化功能的影響還不得而知。
因此,本研究的主要目的:定量解析碳源自供給人工濕地中反硝化功能基因(nirS,nirK和nosZ)的豐度;識別植物和生物質(zhì)碳源對反硝化功能基因的影響。
1 實驗材料與方法
1.1 生物質(zhì)發(fā)酵液
使用取自實驗室附近河道處香蒲(Typha latifolia)生物質(zhì)(2012年12月),剪碎至1~1.5 cm,水洗風干,研磨至0.15 mm(100目)后置于40 ℃烘箱中烘干至恒重。設(shè)置5套有效容積為10 L的發(fā)酵罐,配備有攪拌槳和溫度自動控制器。接種污泥取自上海市某污水處理廠(缺氧-好氧工藝)的回流污泥泵房。生物質(zhì)發(fā)酵期間,需投加微量元素、無機鹽以及維生素等,其余操作細節(jié)在之前的研究中已經(jīng)給出[5]。連續(xù)發(fā)酵20 d后,取出發(fā)酵液,在11000 r/min的轉(zhuǎn)速下離心10min后將上清液保存于4 ℃的冰箱中待用。經(jīng)檢測,該生物質(zhì)發(fā)酵液中可利用碳源的主要成份是VFAs(86.2%),其中,乙酸在VFAs中含量最高(62.3%)[5]。
1.2 裝置設(shè)計與運行
溫室采用玻璃材質(zhì)以保證充足的陽光,室內(nèi)溫度通過空調(diào)維持在(25 ± 2)℃。設(shè)置4套水平潛流人工濕地裝置,材質(zhì)為PVC,尺寸:長1.5 m、寬0.4 m、高0.6 m,礫石基質(zhì)(φ8~13 mm)填充高度h = 0.5 m,有效水深0.45 m,基質(zhì)孔隙率為0.4。采用連續(xù)進水方式,水力停留時間(HRT)為4 d。每個濕地含進水區(qū)(0.15 m),工作區(qū)(1.2 m),出水區(qū)(0.15 m)。取樣管布設(shè)在進、出水區(qū)及濕地1/4、1/2和3/4長度處。分別為不種植香蒲和不投加生物質(zhì)發(fā)酵液(Wl)、種植香蒲(20株/m2)和不投加生物質(zhì)發(fā)酵液(W2)、不種植香蒲和投加生物質(zhì)發(fā)酵液(W3)和種植香蒲(20株/m2)和投加生物質(zhì)發(fā)酵液(W4)。在污水處理廠二級出水流入人工濕地前,先用KNO3溶液(100 g·L-1)將進水硝酸鹽濃度調(diào)節(jié)至15 mg·L-1,然后用蠕動泵將發(fā)酵液混入并抽入人工濕地,以達到調(diào)控W3和W4系統(tǒng)CODAdd/NO3-N分別為1、2、3和4的目的(本研究中的CODAdd/NO3-N指通過投加生物質(zhì)發(fā)酵液增加的進水COD濃度與進水NO3-N濃度的比值,每個工況運行45 d)。
1.3 DNA 提取
四個工況結(jié)束后,分別在濕地系統(tǒng)四等分處采集礫石樣品200 g,并將不同深度(距系統(tǒng)基質(zhì)頂層下方5 cm、20 cm和40 cm)的樣品混合。將礫石以225 r/min振蕩3 h,使樣品附著的生物膜充分浸提出來。將浸提液移至離心機中以5000 r/min離心20min,收集沉淀,上清液重復浸提一次。采用FastDNASPIN Kit for Soil(MPBiomedicals,Illkirch,法國)對樣品進行DNA 提取。
1.4 Real-Time PCR 分析

表1 Real-Time PCR引物設(shè)計信息[8]
分別利用引物nirSCd3aF/nirSR3cd,nirK876/nirK1040和nosZ2F/nosZ2R對反硝化功能基因nirS、nirK和nosZ進行定量分析(引物信息見表1)。本研究采用兩步擴增,PCR 循環(huán)條件如下:95℃保持3min;循環(huán)40 次:95℃保持15 s,57℃保持20 s,72℃保持30 s。完成上述步驟后,把加好樣品的96/384 孔板置于LightCycler 480 Software Setup(Roche 羅氏)中進行反應(yīng)。利用10倍梯度稀釋構(gòu)建好的各質(zhì)粒用于制備標準曲線。
2 結(jié)果與討論
2.1 總細菌及反硝化各功能基因
濕地系統(tǒng)在不同運行工況下其基質(zhì)的總細菌16S rRNA 基因拷貝數(shù)以及反硝化各功能基因拷貝數(shù)見圖1。由圖1a可知,在濕地系統(tǒng)中,未投加生物質(zhì)發(fā)酵液的W1和W2系統(tǒng)的總細菌16S rRNA 的拷貝數(shù)分別為2.21×108拷貝數(shù)/g礫石和2.34×108拷貝數(shù)/g礫石,在W3和W4系統(tǒng)中,隨CODAdd/NO3-N由1升至4,其值從3.46~3.65×108拷貝數(shù)/g礫石增大至8.15~8.21×108拷貝數(shù)/g礫石,分別是W1和W2系統(tǒng)的1.63~3.84倍和1.56~3.51倍,這是由于生物質(zhì)發(fā)酵液中的可利用碳源的增加為微生物的生長提供了有利的條件[9]。
又由圖1b可知,反硝化細菌在總細菌中所占比例范圍為21.2%~50.9%,與過往研究接近[10]。以無植物濕地系統(tǒng)為例,進一步分析可知,當CODAdd/NO3-N 由0增至4時,反硝化細菌在總細菌中所占百分比由21.2%逐步升至48.6%。這表明,投加生物質(zhì)發(fā)酵液促進反硝化細菌在總細菌群體的競爭優(yōu)勢,且隨投加量增大優(yōu)勢也增大。這是因為,生物質(zhì)發(fā)酵液中可利用碳源的主要成份是VFAs(86.2%)、糖類(2.2%)和蛋白質(zhì)(4.3%)等易于被微生物利用的有機物,利于反硝化細菌生長[5]。同時,植物濕地系統(tǒng)也發(fā)現(xiàn)了同樣的現(xiàn)象,且栽種植物也是提升反硝化細菌在總細菌中優(yōu)勢的有利因素。
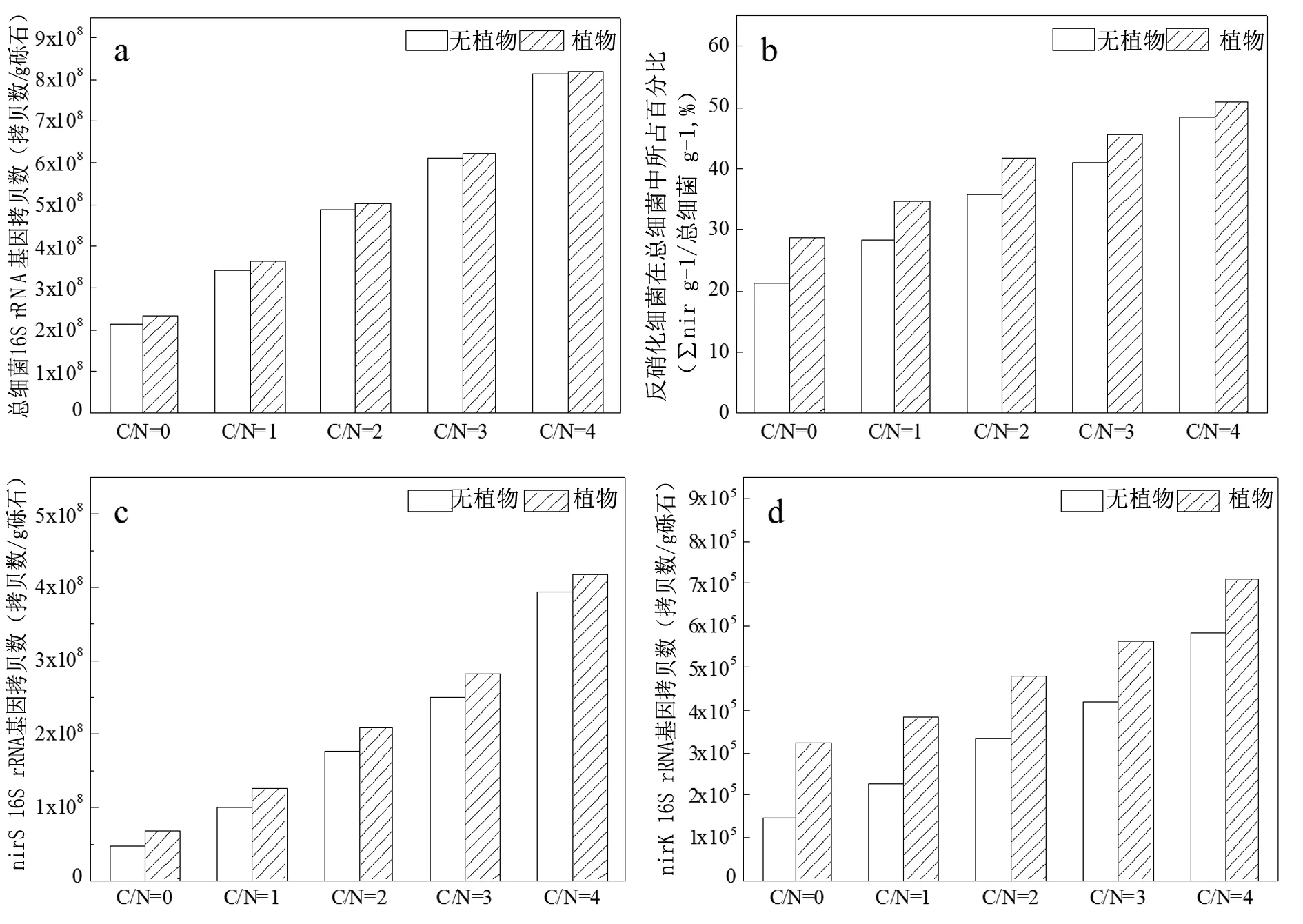

圖1 濕地基質(zhì)在不同運行工況下的 (a) 總細菌單位基因拷貝數(shù) (b) ∑nir /總細菌單位基因拷貝數(shù)比值 (c) nirS 單位基因 拷貝數(shù) (d) nirK單位基因拷貝數(shù) (e) nosZ 單位基因拷貝數(shù) (f) ∑nir 單位基因拷貝數(shù),∑nir= nirS +nirK (g) nosS/nirK 單位基因拷貝數(shù)比值 (h) ∑nir /nosZ單位基因拷貝數(shù)比值
2.2 nirS
由圖1c可知,在濕地系統(tǒng)中,nirS基因拷貝數(shù)的數(shù)量級分為107~108拷貝數(shù)/g礫石。在無植物系統(tǒng)中,隨CODAdd/NO3-N由1增至4,W3的nirS基因拷貝數(shù)呈現(xiàn)出明顯的遞增趨勢,說明生物質(zhì)發(fā)酵液碳源對含nirS基因微生物的生長具有促進作用。植物濕地也有上述趨勢,此外,栽種香蒲植物對濕地基質(zhì)上的nirS也有促進作用。與無植物系統(tǒng)相比,植物系統(tǒng)中nirS基因拷貝數(shù)基因拷貝數(shù)分別提高了49.7%~5.5%,隨著CODAdd/NO3-N的增大,植物對其促進作用越小。也說明了生物質(zhì)發(fā)酵液的投加對該類反硝化基因促進作用是主要的,微生物的反硝化作用始終是系統(tǒng)脫氮的主要途徑。這與Wen[9]和Chen[11]在以香蒲生物質(zhì)為外加碳源的批次潛流人工濕地系統(tǒng)中得出的結(jié)論一致。
2.3 nirK
由圖1 d可知,在濕地系統(tǒng)中,nirK基因拷貝數(shù)的數(shù)量級為105拷貝數(shù)/g礫石。與nirS相同,隨著CODAdd/NO3-N由0增至4,濕地系統(tǒng)中nirK基因拷貝數(shù)也呈現(xiàn)出明顯的遞增趨勢。同時,植物系統(tǒng)中nirK基因拷貝數(shù)較無植物系統(tǒng)提高了124.6%~22.0%,可見栽種植物對濕地基質(zhì)上的nirK基因拷貝數(shù)有促進作用,且植物促進作用隨著CODAdd/NO3-N的增大而減小。由圖1 g可知,不同工況下濕地中nirS基因拷貝數(shù)比nirK基因拷貝數(shù)大約高2個數(shù)量級,這與過往報道相似[12]。
2.4 nosZ
本試驗濕地中,nosZ基因拷貝數(shù)要少于∑nir等其它基因的拷貝數(shù),與以往的報道有相同的現(xiàn)象[10,14]。而由圖1e,投加生物質(zhì)發(fā)酵液可有利于提高系統(tǒng)內(nèi)nosZ基因拷貝數(shù)。由圖1h,觀察∑nir/nosZ比值可見,植物濕地系統(tǒng)高于無植物濕地系統(tǒng)。這表明,植物香蒲的存在可能導致溫室氣體N2O排放量的增加,與Picek T等的研究一致[15]。Cheneby等[16]研究發(fā)現(xiàn),不含nosZ基因的反硝化細菌是植物根系周圍最主要的反硝化細菌類型,這從基因水平上揭示了植物增加濕地系統(tǒng)中N2O釋放的微觀原理。
2.5 碳氮比與反硝化功能基因關(guān)系
利用∑nir(∑nir = nirS+nirK)的基因拷貝數(shù)可以反映反硝化細菌在系統(tǒng)內(nèi)的豐度與數(shù)量[8,13]。如圖1f所示,隨著發(fā)酵液投加量增大,濕地系統(tǒng)中∑nir拷貝數(shù)逐漸增加。在無植物系統(tǒng)中,當CODAdd/NO3-N逐漸增加時,∑nir拷貝數(shù)明顯多于未投加生物質(zhì)發(fā)酵液濕地系統(tǒng)。這表明,投加生物質(zhì)發(fā)酵液碳源能顯著促進反硝化細菌的生長。由圖1f還可知,栽種植物也能微弱的促進反硝化細菌生長。
3 結(jié)論
結(jié)果表明三種功能基因nirS,nirK和nosZ均能在本實驗中的連續(xù)流潛流人工濕地中檢出,其數(shù)量級范圍是105~108拷貝數(shù)/g礫石。生物質(zhì)發(fā)酵液的投加能促進含nirS,nirK和nosZ基因的反硝化細菌增長,而栽種香蒲植物有利于含nirS和nirK基因的反硝化細菌生長。
[1] Vymazal J.Natural and constructed wetlands: nutrients,metals and management[M]. Leiden :Backhuys Publishers,2005.
[2] Ingersoll T L,Baker L A.Nitratfe removal in wetland microcosms[J].Water research,1998,32(3):677-684.
[3] Lin Y F,Jing S R,Wang T W,et al.Effects of macrophytes and external carbon sources on nitrate removal from groundwater in constructed wetlands[J].Environmental Pollution,2002,119(3):413-420.
[4] Leverenz H L,Haunschild K,Hopes G,et al.Anoxic treatment wetlands for denitrification[J]. Ecological Engineering,2010,36(11):1544-1551.
[5] Zhang C,Yin Q,Wen Y,et al.Enhanced nitrate removal in self-supplying carbon source constructed wetlands treating secondary effluent: The roles of plants and plant fermentation broth[J].Ecological Engineering,2016,91:310-316.
[6] Braker G,Fesefeldt A,Witzel K P.Development of PCR primer systems for amplification of nitrite reductase genes (nirK and nirS) to detect denitrifying bacteria in environmental samples [J].Applied and Environmental Microbiology,1998,64(10):3769-3775.
[7] García-Lledó A,Vilar-Sanz A,Trias R,et al.Genetic potential for N2O emissions from the sediment of a free water surface constructed wetland[J].Water Research,2011,45(17):5621-5632.
[8] Warneke S,Schipper L A,Matiasek M G,et al.Nitrate removal,communities of denitrifiers and adverse effects in different carbon substrates for use in denitrification beds[J].Water Research,2011,45(17):5463-5475.
[9] Wen Y,Chen Y,Zheng N,et al.Effects of plant biomass on nitrate removal and transformation of carbon sources in subsurface-flow constructed wetlands[J].Bioresource Technology,2010,101(19):7286-7292.
[10] Chen Y,Wen Y,Zhou Q,et al. Effects of plant biomass on denitrifying genes in subsurface-flow constructed wetlands [J]. Bioresource Technology,2014,157: 341-345.
[11] Chen Y,Wen Y,Zhou Q,et al. Effects of plant biomass on nitrogen transformation in subsurface-batch constructed wetlands: a stable isotope and mass balance assessment[J]. Water Research,2014,63: 158-167.
[12] Ruiz Rueda O,Trias Mansilla R,Garcia-Gil L J,et al. Diversity of the nitrite reductase gene nirS in the sediment of a free-water surface constructed wetland [J]. International Microbiology,2007,10(4):253-260.

[14] Chon K,Chang J S,Lee E,et al. Abundance of denitrifying genes coding for nitrate (narG),nitrite (nirS),and nitrous oxide (nosZ) reductases in estuarine versus wastewater effluent-fed constructed wetlands [J]. Ecological Engineering,2011,37(1): 64-69.
[16] Cheneby D,Hartmann A,Hénault C,et al. Diversity of denitrifying microflora and ability to reduce N2O in two soils [J]. Biology and Fertility of Soils,1998,28(1): 19-26.
(本文文獻格式:劉 暢,聞 岳,余雪岑,等.碳源自供給潛流人工濕地中反硝化基因與碳氮比的關(guān)系[J].山東化工,2017,46(3):126-129.)
Relationships Between Denitrifying Genes and C/N Ratio in Self-supplying Carbon Source Constructed Wetlands
LiuChang,WenYue,YuXuecen,GuoWenrui,ZhouQi
(College of Environmental Science and Engineering,Tongji University,Shanghai 200092 China)
In this study,four HSSF CWs were set up to investigated the effects of plant fermentation broth ( CODAdd/NO3-N = 1,2,3,4 ) and plants (Typha latifolia) on the denitrification genes. The results showed that the magnitude of copy numbers of the three genes in the wetland systems were 107~108、105and 106~107copies g-1. The addition of fermentation broth could promote the growth of bacteria containing nirS、nirK and nosZ. Typha latifolia enhanced the growth of bacteria containing nirS and nirK.
horizontal subsurface flow constructed wetlands (HSSF CWs); denitrifying genes; plant litter leachate; carbon source; nitrate removal
2016-12-17
國家自然科學基金資助項目(51378372)
劉 暢(1991—),女,碩士,主要從事污水處理理論與技術(shù)研究。
X703.1
A
1008-021X(2017)03-00126-04

