生活方式干預對肥胖妊娠糖尿病患者外周血炎性指標的影響
孫海玲, 錢雷, 李明, 吳鳳會
(江蘇省濱海縣人民醫院1檢驗科,2婦產科,江蘇 鹽城 224500)
生活方式干預對肥胖妊娠糖尿病患者外周血炎性指標的影響
孫海玲1, 錢雷1, 李明1, 吳鳳會2*
(江蘇省濱海縣人民醫院1檢驗科,2婦產科,江蘇 鹽城 224500)
目的 探討生活方式干預對肥胖妊娠糖尿病 (GDM)患者外周血炎性指標的影響。方法 選取我院收治的56例肥胖GDM患者 (身體質量指數>30 kg/m2),隨機平均分為干預組和對照組。對照組接受孕期健康教育和常規產檢,干預組在此基礎上進行個體化飲食指導和運動干預。采用食物頻率調查表記錄兩組患者的孕期飲食,并檢測外周血APN、血脂、HOMA-IR、CRP、IL-6和TNF-α水平。結果 干預后,干預組的蛋白質、脂肪和總熱量攝入均低于對照組,差異有統計學意義 (P<0.05)。干預組的空腹血糖、HOMA-IR均低于對照組,HDL-C和APN均高于對照組,差異均有統計學意義 (P<0.05)。干預組的IL-6和CRP水平均低于對照組,差異有統計學意義 (P<0.05),但兩組的TNF-α水平比較差異無統計學意義 (P>0.05)。干預組的胰島素使用率、新生兒出生體重和孕期體重增加均明顯低于對照組,差異有統計學意義 (P<0.05)。結論 對肥胖GDM患者進行生活方式干預后,糖代謝得到較好的控制,其機制可能是生活方式干預降低了外周血炎性指標水平。
妊娠糖尿病;生活方式干預;肥胖;C反應蛋白;白細胞介素-6
妊娠糖尿病 (GDM)是指孕期首次發現或妊娠期發生的糖耐量異常[1]。孕期肥胖是GDM的高風險因素,與正常身體質量指數 (BMI)的孕婦相比,肥胖孕婦發展為GDM的風險增加了1.3~3.8倍[2]。孕期肥胖和GDM伴發的糖代謝和脂質代謝異常可對妊娠結局產生較多不良影響[3]。通過個體化飲食控制和運動等生活方式干預有利于改善GDM患者的糖代謝[4],但其作用機制尚不清楚。研究[2]表明,機體低密度炎性反應可引起母體胰島素抵抗,導致妊娠糖尿病的發生、發展。本研究通過檢測肥胖GDM患者生活方式干預后外周血急性C反應蛋白等炎性指標和代謝指標的變化,探討生活方式干預對GDM疾病炎性指標的影響,現報道如下。
1 資料與方法
1.1 研究對象
選取我院產科門診2015年4月至2016年7月收治的56例肥胖GDM孕婦,入選標準:肥胖 (BMI≥30 kg/m2)、單胎妊娠、無限制身體活動的疾病;在孕11~14周進行75 g葡萄糖耐量試驗,空腹 (FBG)、餐后1小時、2小時血糖值參考上限分別為5.1 mmol/L、10.0 mmol/L和8.5 mmol/L,任一時間點升高均診斷為GDM[5]。排除標準:糖尿病、感染或自身免疫性疾病。獲得患者知情同意后,將其按奇偶數隨機平均分為生活方式干預組和對照組各28例。對照組:年齡(27.2±3.11)歲,孕前 BMI(31.46±3.92)kg/m2。干預組:年齡 (27.9± 3.36)歲,孕前BMI(31.93±3.77)kg/m2。兩組患者的年齡和孕前BMI比較差異均無統計學意義 (P>0.05),具有可比性。本研究獲醫院倫理委員會批準 (倫研2015-05)。
1.2 儀器和試劑
采用COBAS6000電化學發光儀和配套試劑檢測空腹胰島素(FINS)。并計算胰島素抵抗指數 (HOMA-IR):HOMA-IR=(FBG×FINS)/22.5。采用美國Assay Max公司提供酶聯免疫吸附試驗 (ELISA)試劑盒檢測外周血脂聯素 (APN)。使用Beckman 7300生化分析儀檢測血脂、血糖水平,試劑由上海執誠公司提供。采用韓國艾科美熒光檢測系統檢測急性C反應蛋白 (CRP)。Luminex 200液相芯片檢測白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)水平。
1.3 方法
1.3.1 個體化飲食指導和運動
膳食干預由訓練有素的營養師管理,干預在入組后立即開始。營養師對所有患者進行飲食結構調查,兩組均接受孕期健康教育講座和常規產檢。干預組根據患者的孕周、身高、體重和勞動強度制定每日總熱量 (≥理想體重 ×30 kcal/kg+200 kcal),并制訂食譜,碳水化合物、脂肪和蛋白質等各營養要素的比例分別為45%~55%、20%~25%和25%~30%,堅持地中海飲食,每日按6餐分配總熱量,減少血糖波動。飲食中應富含維生素、礦物質、纖維素。責任護士每日采用微信查看患者當天記錄的食物種類及數量,錄入圍產營養管理系統,并對患者進行指導和培訓,直到分娩。身體活動干預包括鼓勵增加身體活動,至少11 000步/天,通過計步器監測活動。
1.3.2 臨床指標檢測
兩組患者入院分娩時抽取靜脈血3 mL,檢測血清中血糖、總膽固醇、高密度脂蛋白膽固醇 (HDL-C)、甘油三酯、胰島素、CRP、IL-6、TNF-α、外周血APN水平。并記錄胰島素使用率、孕期體重增加、新生兒出生體重等臨床指標。
1.4 統計學分析
采用Stata 7.0統計軟件分析,計數資料采用χ2檢驗,正態性分布計量資料以均數 ±標準差 (±s)表示,采用t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 生活方式干預對營養素攝入量的影響
干預后,干預組的蛋白質、脂肪、總能量攝入均低于對照組,差異均有統計學意義 (P<0.05),而兩組患者的碳水化合物攝入比較差異無統計學意義 (P>0.05)。見表1。
2.2 生活方式干預對生化指標的影響
干預組的空腹血糖、HOMA-IR均低于對照組,HDL-C和 APN均高于對照組,差異均有統計學意義 (P<0.05);兩組患者的甘油三酯和總膽固醇水平比較差異均無統計學意義 (P>0.05)。見表2。
表1 兩組患者干預后的飲食結構比較 (±s)
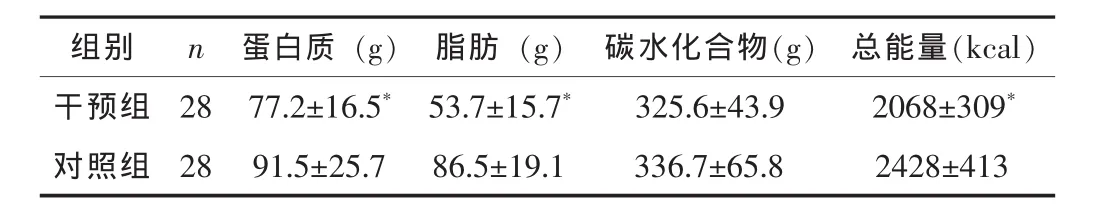
表1 兩組患者干預后的飲食結構比較 (±s)
注:與對照組比較,*P<0.05。
組別 n 蛋白質 (g) 脂肪 (g) 碳水化合物(g) 總能量(kcal)干預組 28 77.2±16.5* 53.7±15.7* 325.6±43.9 2068±309*對照組 28 91.5±25.7 86.5±19.1 336.7±65.8 2428±413
表2 兩組患者干預后的生化指標比較 (±s)
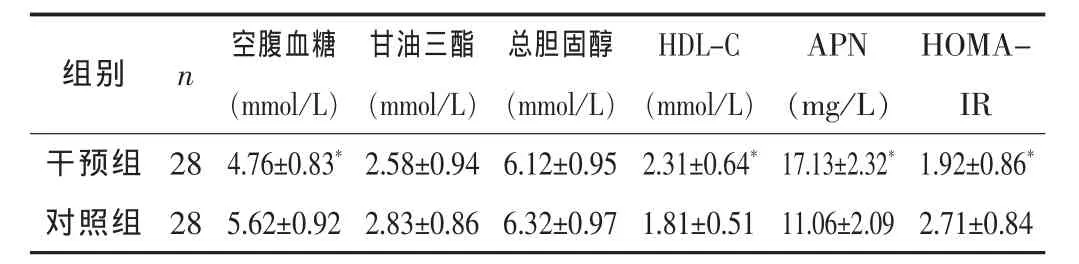
表2 兩組患者干預后的生化指標比較 (±s)
注:與對照組比較,*P<0.05。
組別 n 空腹血糖(mmol/L)甘油三酯(mmol/L)總膽固醇(mmol/L)HDL-C(mmol/L)APN(mg/L)HOMAIR干預組 28 4.76±0.83*2.58±0.94 6.12±0.95 2.31±0.64*17.13±2.32*1.92±0.86*對照組 28 5.62±0.92 2.83±0.86 6.32±0.97 1.81±0.51 11.06±2.092.71±0.84
2.3 生活方式干預對炎性指標的影響
干預組的IL-6和CRP水平均低于對照組,差異有統計學意義 (P<0.05),兩組患者的TNF-α水平比較差異無統計學意義 (P>0.05)。見表3。
表3 兩組患者干預后的炎性指標比較 (±s)
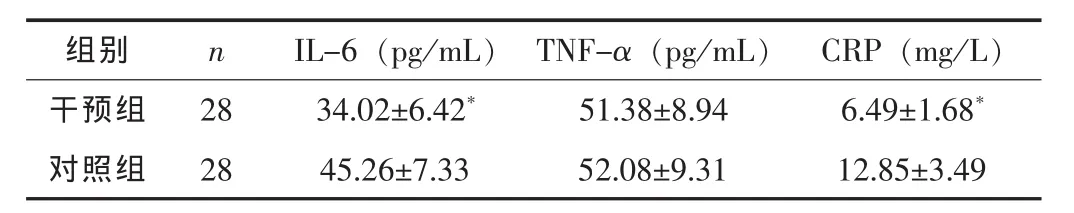
表3 兩組患者干預后的炎性指標比較 (±s)
注:與對照組比較,*P<0.05。
組別 n IL-6(pg/mL) TNF-α(pg/mL) CRP(mg/L)干預組 28 34.02±6.42* 51.38±8.94 6.49±1.68*對照組 28 45.26±7.33 52.08±9.31 12.85±3.49
2.4 生活方式干預對相關臨床指標的影響
干預組的孕期體重增加、新生兒體重和胰島素使用率均顯著低于對照組,差異有統計學意義 (P<0.05),但兩組的羊水過多、早產發生率比較,差異均無統計學意義 (P>0.05)。見表4。
表4 兩組患者的相關臨床指標比較 [±s,n(%)]

表4 兩組患者的相關臨床指標比較 [±s,n(%)]
注:與對照組比較,*P<0.05。
體重 (g) 早產 羊水過多組別 n 孕期體重增加 (kg)新生兒出生 胰島素使用干預組 28 14.26±2.11* 3352±357* 0(0.0) 0(0.0) 0(0.0)*對照組 28 18.73±3.15 3602±438 1(3.57) 1(3.57) 4(14.3)
3 討論
肥胖可誘導機體形成慢性低密度炎癥,是由過度的營養物代謝引發,并使脂肪、肝和胰腺形成促炎免疫細胞聚集的環境。肥胖誘導機體形成的慢性低密度炎癥可引起機體胰島素抵抗,脂肪組織、肌肉和肝臟對胰島素的敏感性降低。其機制是營養物或炎性細胞因子可引起胰島素受體信號途徑中的絲氨酸磷酸化, 從而抑制胰島素受體信號傳導級聯反應[6]。 肥胖、GDM、炎癥和胰島素抵抗之間存在密切的聯系,GDM患者的脂肪組織和胎盤中與營養轉運有關的蛋白表達信號通路表達和活性增加[7], 此功能的變化可能與炎性反應有關[8], 導致并發癥的發生。
肥胖和GDM的基本治療方法是生活方式干預,高達90%的GDM患者可通過運動和個體化飲食控制而得到良好的妊娠結局[9],僅極少部分患者需要進行藥物治療。生活方式干預的類型較多,包括健康宣教、運動和個體化飲食指導,能夠控制孕期體質量[10]。 運動形式包括散步、 慢跑、 快走、 孕婦操、爬樓梯、游泳、瑜伽等[11]。本研究采用個體化飲食控制聯合散步,較好地控制了患者的病情。Quinlivan等[12]對孕前肥胖孕婦進行飲食指導和體質量控制,明顯降低了GDM的發生率,與本研究結果一致。
研究[13]表明,每日膳食攝入總熱量超標和三大營養素供能比不合理是GDM的發病率上升的重要因素。孕期飲食結構中脂肪供能比高、碳水化合物供能低可增加GDM發生風險。相反,降低脂肪的供能比和提高碳水化合物供能對糖尿病發病具有預防作用。本研究對干預組進行飲食結構干預調整,降低脂肪、蛋白質和總熱量的攝入,較好地控制了生化指標,空腹血糖、HOMA-IR均低于對照組 (P<0.05)。APN是一種在脂肪組織中高表達的生物多肽,可增加胰島素敏感性,促進糖吸收,抑制糖異生,預防GDM的發生。
較多研究調查了肥胖、GDM患者外周血炎性指標的變化。Christian等[14]檢測孕早期、孕中期、孕晚期和分娩后4周肥胖孕婦外周血炎性細胞因子濃度,發現肥胖孕婦的 IL-6和CRP水平均顯著高于正常BMI孕婦 (P<0.05)。CRP和IL-6水平同步升高的機制是IL-6可誘導CRP從肝臟釋放。另外,Kuzmicki等[15]的研究證實GDM患者外周血IL-6水平升高,且皮下脂肪組織 (SAT)中IL-6 mRNA表達增加。本研究發現,生活方式干預可降低GDM患者外周血IL-6、CRP水平,但對TNF-α水平沒有影響。
GDM是一種圍產期對母嬰產生嚴重危害的妊娠疾病,可導致早產、 羊水過多、 新生兒窘迫、 死胎、 巨大兒等并發癥[1]。發病機制與肌肉、肝臟和脂肪組織的靶細胞及組織降低了對胰島素的敏感性有關。胰島素抵抗是妊娠期女性的一個普遍生理現象,特別是在妊娠晚期,胰島素敏感性下降可達50%左右,而GDM患者的胰島素抵抗程度更為嚴重,并導致并發癥的發生[3]。本研究通過對GDM患者采用生活方式干預,妊娠結局良好,胰島素的使用率明顯下降,孕期體重增加和新生兒出產體重均顯著降低。
綜上所述,對肥胖GDM患者進行生活方式干預,結合個體化飲食指導和運動,降低膳食結構中的脂肪和總熱量,可降低血糖水平、胰島素抵抗和胰島素使用率,GDM患者的糖代謝明顯改善,其機制可能是生活方式干預降低患者的CRP和IL-6等炎性細胞因子水平,減輕了機體的炎性反應,從而降低胰島素抵抗水平,改善糖代謝狀況。但因本研究為調查性研究,肥胖、GDM、炎癥、胰島素抵抗與生活方式干預之間的內在聯系仍需進一步的研究和驗證。
[1] Koning SH,Hoogenberg K,Scheuneman KA,et al.Neonatal and obstetric outcomes in diet-and insulin-treated women with gestational diabetes mellitus:a retrospective study[J].BMC En docr Disord, 2016,16(1):52.
[2] Pantham P,Aye IL,Powell TL.Inflammation in maternal obesity and gestational diabetes mellitus[J].Placenta,2015,36(7):709-715.
[3] Renault KM,Carlsen EM,Haedersdal S,et al.Impact of lifestyle intervention for obese women during pregnancy on maternal metabolic and inflammatory markers[J].Int J Obes(Lond),2017,41(4): 598-605.
[4] Santangelo C,Zicari A,Mandosi E,et al.Could gestational diabetes mellitusbe managed through dietary bioactive compounds?Current knowledge and future perspectives[J].Br J Nutr,2016,115(7): 1129-1144.
[5] International Association of Diabetes and Pregnancy Study Groups Consensus Panel,Metzger BE,Gabbe SG,et al.International Association of Diabetes and Pregnancy Study Groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy[J].Diabetes Care,2010,33(3):676-682.
[6] Gregor MF,Hotamisligil GS.Inflammatory mechanisms in obesity[J]. Annu Rev Immunol,2011,29:415-445.
[7] Kleiblova P,Dostalova I,Bartlova M,et al.Expression of adipokines and estrogen receptors in adipose tissue and placenta of patients with gestational diabetes mellitus [J].Mol Cell Endocrinol,2010,314 (1):150-156.
[8] Jansson N,Rosario FJ,Gaccioli F,et al.Activation of placental mTOR signaling and amino acid transporters in obese women giving birth to large babies[J].J Clin Endocrinol Metab,2013,98(1):105-113.
[9] Nasiri-Amiri F,Bakhtiari A,Faramarzi M,et al.The association between physical activity during pregnancy and gestational diabetes mellitus:a case-control study[J].Int J Endocrinol Metab,2016,14 (3):e37123.
[10]Kmpi-Hyovalti E,Schwab U,Laaksenen DE,et al.Effect of intensive'counselling on the quality of dietary fats in pregnant women at high risk of gestational diabetes mellitus[J].Br J Nutr,2012,108 (5):910-917.
[11]Malzer K,Schuts Y,Boulvain M,et al.Physical activity and pregnancy:cardiovascular adaptations,recommendations and pregnancy outcomes[J].Sports Med,2010,40(6):493-507.
[12]Quinlivan JA,Lam LT,Fisher J.A rondomised trial of a four-step multidisciplinary approach to the antenatal care of obese pregnant women[J].Aust N Z J Obstet Gynaecol,2011,51(2):141-146.
[13]Ley SH,Hanley AJ,Retnakran R,et al.Effect of macronutrient intake during the second trimester on glucose metabolism later in pregnancy [J].Am J Clin Nutr,2011,94(5):1232-1240.
[14]Christian LM,Porter K.Longitudinal changes in serum proinflammatory markers across pregnancy and postpartum:Effects of maternal body mass index[J].Cytokine,2014,70(2):134-140.
[15]Kuzmicki M,Telejko B,Lipinska D,et al.The IL-6/IL-6R/sgp130 system and Th17 associated cytokines in patients with gestational diabetes[J].Endokrynol Pol,2014,65(3):169-175.
(責任編輯:何華)
Effect of Lifestyle Intervention on Inflammatory Indicators of Obese Patients with Gestational Diabetes Mellitus
SUN Hailing1,QIAN Lei1,LI Ming1,WU Fenghui2*
(1Clinical Laboratory,2Department of Obstetrics and Gynecology,the People's Hospital of Binhai County,Yancheng 224500,China;*
WU Fenghui,E-mail:qianleiyc@163.com)
Objective To study the effect of lifestyle intervention on peripheral blood inflammatory indicators in obese patients with gestational diabetes mellitus(GDM).Methods 56 cases of obese patients(body mass index>30 kg/m2)with GDM were selected and randomly divided into intervention group and control group equally.The control group
pregnancy health education and routine health check,while the intervention group received individual diet guidance and exercise intervention on this basis.The food frequency questionnaire was used to investigate the prenatal diet of two groups.The APN of peripheral blood,blood lipid,HOMA-IR,CRP,IL-6 and TNF-α levels were measured.Results After intervention,the intake of protein,fat and total calorie of intervention group was lower than that of control group,with statistical difference(P<0.05).The fasting blood glucose and HOMA-IR of intervention group were lower than those of control group,and HDL-C and APN were higher than those of control group,with statistical differences(P<0.05).The IL-6 and CRP levels of intervention group were lower than those of control group(P<0.05),but no statistical difference was found in TNF-α level between two groups(P>0.05).The insulin use rate,neonatal birth weight and weight gain during pregnancy of intervention group were significantly lower than those of control group(P<0.05).Conclusions After lifestyle intervention,the glucose metabolism of obese patients with GDM is better controled,which mechanism is probably through lifestyle interventions to reduce peripheral blood inflammatory indicators.
Gestational diabetes mellitus;Lifestyle intervention;Obesity;C-reactive protein;Interleukin-6
R715.3
:A
10.3969/j.issn.1674-4659.2017.09.1213
2017-03-02
2017-05-07
江蘇省鹽城市醫學科技發展計劃項目 (項目編號:YC2015065)
孫海玲 (1966-),女,江蘇鹽城人,本科學歷,副主任技師,從事免疫學檢驗工作。
*通訊作者:吳鳳會 (1972-),女,江蘇鹽城人,本科學歷,副主任護師,E-mail:qianleiyc@163.com。

