黃顙魚MHC class II基因全長的克隆及飼料維生素D3對其組織表達的影響
馮美惠 陳 沛 雷 文 李大鵬 王春芳
(華中農業大學水產學院, 淡水水產健康養殖湖北省協同創新中心, 池塘健康養殖湖北省工程實驗室, 武漢 430070)
黃顙魚MHC class II基因全長的克隆及飼料維生素D3對其組織表達的影響
馮美惠 陳 沛 雷 文 李大鵬 王春芳
(華中農業大學水產學院, 淡水水產健康養殖湖北省協同創新中心, 池塘健康養殖湖北省工程實驗室, 武漢 430070)
為進一步豐富魚類MHC class II基因的研究, 同時也為進一步探討低磷飼料中添加維生素D3對魚類免疫功能可能的影響, 實驗利用RACE (Rapid-amplification of cDNA ends) 即cDNA末端快速擴增技術, 成功克隆出黃顙魚(Pelteobagrus fulvidraco)主要組織相容性復合體(Major histocompatibility complex, MHC) class II基因, 全長1074 bp, 其中ORF (Open reading frame)708 bp, 編碼236個氨基酸, 5′UTR (5′端非翻譯區)78 bp, 3′UTR (3′端非翻譯區)259 bp。進行氨基酸序列比對分析得到: 黃顙魚MHC class II基因ORF氨基酸序列與長吻逘(Leiocassis longirostris)的氨基酸序列相似度最高為69.5%, 與錦鯉(Cyprinus carpio)的氨基酸序列相似度最低為50.4%。利用qPCR對黃顙魚MHC class II基因進行組織表達分析, 結果表明MHC class II在小腸、肝臟、鰓中表達較高; 在肌肉、鰭條中表達較低; 而在腎、脾臟、腦、頭腎中表達量極低(幾乎檢測不到)。在低磷飼料中添加維生素D3顯著誘導了該基因的上調表達。研究結果展示了黃顙魚MHC class II基因的分子結構、組織表達以及維生素D3的作用, 在降低磷排放的同時, 為今后黃顙魚免疫抗病及分子選育等方向的深入研究及免疫型飼料的使用奠定了基礎。
黃顙魚; MHC class II; 飼料維生素D3; 基因表達
主要組織相容性復合體(Major histocompatibility complex, MHC) 可抵抗致病菌的侵入, 在脊椎動物免疫系統中扮演著十分重要的角色[1], 主要分為MHC class I和MHC class II兩大類, 研究表明由MHC編碼的細胞表面轉膜蛋白與抗原結合后, 呈遞給T淋巴細胞CD4+和CD8+, 從而激發機體免疫反應[2]。早在20世紀初期, 就已經發現了這一人類紅細胞同種抗原, 然而在20世紀30—40年代, Gorer等[3]才發現小鼠H-2系統及其與組織移植的關系, 并正式命名為MHC, 這也是主要組織相容性復合體這一概念的首次出現。隨后, 眾多學者對于MHC的研究也逐漸深入, 其在人類[4]及家禽[5]中的研究也慢慢走入人們的視線。而對于水產動物MHC真正意義上的研究, 是時隔近百年時間Hashimoto等[6]于1990年通過比較其他動物的MHC基因結構,分析其保守區序列特點, 從而設計兼并引物擴增出鯉的部分MHC序列, 為水產動物MHC的研究打開了一扇新的大門, 目前在魚類中MHC class II基因的研究還有待更進一步豐富。
黃顙魚(Pelteobagrus fulvidraco)是我國重要的小型淡水經濟名優養殖品種, 近幾年來生產者不斷地加大黃顙魚的養殖力度, 創造出了極大的經濟價值[7,8]。水溫過高且水體質量差時, 黃顙魚易患“紅頭病”、“細菌性爛鰓病”、“腸炎病”、“車輪病”等疾病, 常伴有其他病癥并發[9]。目前對于黃顙魚疾病防控的研究還主要停留在化學藥物中, 但這類治療方法因藥物殘留、抗藥性等水產品安全問題, 受到國內外廣泛關注; 而現流行的疫苗預防法, 由于其特異性和操作性困難, 使其存在較大局限性[10]。近年來, 通過合理飼料配方等營養免疫措施, 來提高魚類自身疾病抵抗力和抗應激能力, 從而預防疾病發生, 因其對環境污染小且安全可靠, 而成為研究熱點[11]。有研究表明[12], 通過飼料中氨基酸、脂肪酸、維生素以及營養性添加物等可以提高魚類對疾病的抵抗力及免疫力。與氨基酸、脂肪酸等營養成分相比, 動物對維生素的需求量甚微, 但對免疫系統的影響似乎更加深刻而廣泛[13]。
維生素D在動物生長發育過程中有著極為重要的作用, 其有內分泌、旁分泌和自分泌的功能, 其中內分泌功能主要在維持動物體內鈣磷平衡方面起著重要作用, 旁分泌和自分泌功能依賴于表達核維生素D受體(VDR)的不同細胞獨特的基因轉錄調節功能, 作用于抑制細胞增殖, 促進細胞分化和凋亡[14]。在哺乳動物中, 維生素D與免疫系統的相互作用也逐漸被證實[15], 有研究報道VDR在許多免疫細胞(T細胞、B細胞、巨噬細胞、樹突狀細胞)中存在, 其具有調節先天及適應性免疫系統的功能[16,17]。人類醫學研究顯示在抵御流感病毒時, 補充維生素D比抗病毒藥物和疫苗更有效果[18]。維生素D3能夠抑制腫瘤生長[19]、臨床乳腺癌的轉移[20],并且具有抗腫瘤血管生成作用[21], 與此同時維生素D3還參與了多條免疫相關通路, 如PKC、MAP kinases、phos-phoinositides 和 cAMP[22—24], 動物細胞實驗也證明維生素D有直接抗病毒作用[25]。目前, 維生素D3對水產動物分子免疫方面相關研究還為數不多, 當下研究顯示, 飼料中添加維生素D3對多種水產動物松浦鏡鯉(Cyprinus carpio)[26]、草魚(Ctenopharyngodon idella)[27]、黃顙魚(Pelteobagrus fulvidraco)[28]、黃鱔(Monopterus albus)[29]等的生長、基礎生理免疫等指標都存在一定的影響,而在分子水平上對于維生素D3和魚類免疫方面的研究還很少見到, 其對魚類營養免疫的作用機理有待深入探索。
本研究利用RACE技術擴增出黃顙魚MHC class II基因, 比較其與其他物種氨基酸序列的相似性, 分析其基因序列特點, 并分析了其組織分布情況以及飼料中添加維生素D3對其組織分布及表達產生何種影響, 為水產動物MHC class II基因的深入研究提供了一定依據, 同時也為進一步探討低磷飼料中添加維生素D3對魚類免疫功能可能的影響,為實現既能降低磷排放又能提高免疫力的飼料制作的目標奠定研究基礎。
1 材料與方法
1.1 實驗材料
養殖試驗魚苗購于武漢正好漁場, 實驗前先于華中農業大學水產實驗創新中心實驗基地暫養, 待魚體大小適中至2 g左右, 開始為期2個月的養殖實驗(表 1), 共分為2組(對照組維生素的添加水平為0,實驗組維生素的添加水平為5000 IU/kg), 每組設置3個平行缸, 每缸30尾魚。實驗采取飽食性投喂策略, 每天投喂2次(8:30和14:30)。在實驗結束后, 分別取對照及處理組黃顙魚的腸、腎、肝3種組織及普通黃顙魚的腸、腎、肝、鰭條、肌肉、皮膚、鰓、腦和頭腎9種組織于1.5 mL EP管并迅速置于液氮中, 最后放在–80℃冰箱中保存。

表 1 實驗用飼料化學組成及營養成分Tab. 1 Formulation and chemical composition of experimental diets
1.2 RNA提取及cDNA的合成(qPCR)
實驗器材(解剖工具等)預先用雙蒸水浸泡后高溫滅菌8h, 實驗采取RNA提取經典TRIZOL法, 將盛有各組織的1.5 mL EP管中加入1 mL Trizol, 使用勻漿機進行研磨。實驗方法完全按照說明書進行, 得到RNA后進行瓊脂糖凝膠電泳并使用NANODROP (Applied Biosystems#9902 VeritiTM96-Well Thermal Cycler)檢測其完整度、濃度及相關比值(A260/280=2.08)。使用TaKaRa公司的RNA反轉錄試劑盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)。
1.3 引物設計
根據本課題組獲得的黃顙魚轉錄組數據(Accession No.SRR2239572), 利用軟件primer 5.0設計引物(MHC-F, MHC-R), 克隆獲得核心序列, 并根據核心序列設計特異性引物(MHC-SP1和MHCSP2)進行后續cDNA全長的擴增, 熒光定量PCR以β-actin (EU161066.1)作為內參基因, 擴增引物為actin-F和actin-R。引物均由武漢天一輝遠公司合成, 具體信息見表 2。
1.4 黃顙魚MHC class II基因cDNA全長的克隆
反轉錄實驗使用Clontech公司SMARTer?RACE 5′/3′Kit, 取濃度為1 μg/μL RNA作為模版, 按照說明書進行, 最終cDNA產物根據要求進行稀釋(本實驗5倍稀釋)。實驗采用試劑盒中兼并引物UPM, 特異性引物MHC-SP1和MHC-SP2進行PCR擴增, 序列5′端使用TaKaRa LA Taq通過普通溫度梯度PCR得到, 3′端則使用SMARTer?RACE 5′/3′試劑盒中試劑通過touchdown PCR得到。普通PCR程序為: 94℃變性30s, 60—68℃退火30s, 72℃延伸1—2min, 25—30個循環。Touchdown PCR程序為: 94℃變性30s, 72℃退火30s, 72℃延伸1—2min, 5個循環; 94℃變性30s, 70℃退火30s, 72℃延伸1—2min, 5個循環; 94℃變性30s, 68℃退火30s, 72℃延伸1—2min, 25個循環。PCR得到目的片段后將其回收并克隆, 挑選多個陽性克隆, 最終送往武漢擎科公司進行測序。測序后找到特異性引物并使用Seqman軟件將兩端序列和核心序列拼接, 得到cDNA序列全長。
1.5 序列生物信息學分析
使用Editseq軟件預測黃顙魚MHC class II序列ORF (開放閱讀框)并進行氨基酸翻譯, 并將其與其他10個物種的16條氨基酸序列進行相似度比較, 利用MegAlign軟件進行氨基酸相似度分析, Prot-Param tool (http://www.expasy.org/)對其編碼蛋白質的分子量、等電點等基本性質進行理論預測; 利用MEGA5.05采用NJ法(Neighbor-joining method)建立系統發育進化樹, 自展值(Boot-strap)重復1000次。
1.6 熒光定量PCR
模版采用1.2中合成的cDNA, 使用Easydilution稀釋5倍后, 取2 μL作為熒光定量PCR模版, 陰性對照同樣取2 μL無菌水為模版, 均設置3個重復。選取黃顙魚β-actin為內參基因, 內參基因引物采用表 2中出現的actin-F和actin-R, 根據MHC class II保守區設計出特異性定量引物QMHC-F和QMHC-R。實驗儀器為Roter-GeneQ (QIAGEN, GERMAN), PCR反應體系為: 模版2 μL, 上下游引物各0.5 μL, TaKaRa公司SYBR?Premix EX TaqTMII 10 μL,無菌水7 μL, 共20 μL。反應程序為: 95℃變性30s, 95℃變性5s, 60℃退火20s, 72℃延伸30s, 40個循環。目的基因和內參基因的標準曲線R2均大于0.99, 擴增效率(E)均大于90%, 最后進行溶解曲線的測定。所有目的基因相對表達量的數據結果采用雙標曲法計算得到, 其數值用平均值±標準誤表示。使用GraphPad Prism.v 5.0軟件作柱狀圖, 并用SPSS 21.0軟件進行單因素方差分析(one-way ANOVA), Duncan′s multiple-range test比較各組之間表達差異, 存在顯著差異用(P<0.05)表示。

表 2 本研究使用所有引物序列Tab. 2 Primers used in the study
2 結果
2.1 基因cDNA全長的克隆及序列分析
根據課題組已獲得黃顙魚轉錄組序列, 得到長度為515 bp的黃顙魚MHC class II基因序列。根據此序列設計特異性引物對其進行驗證, 得到長度為457 bp的核心序列, 再根據核心序列設計RACE特異性引物MHC-F和MHC-R, 擴增得到長度分別為125 bp和624 bp的基因5′端和3′端。最后使用Seqman軟件拼接后得到長度為1078 bp的黃顙魚MHC class II基因全長(KX532169)。NCBI Blast比對發現, 黃顙魚MHC class II基因與長吻逘MHC class II基因相似性高達91%。根據ProtParam tool預測黃顙魚MHC class II蛋白分子式為C1178H1808N306O362S10、分子量大小為26.37 kD、等電點為4.97、總平均疏水指數(GRAVY)為–0.323。ProtParam tool發現MHC class II蛋白含有免疫球蛋白(aa119—190)及MHC蛋白信號(aa22—101), 且具有5個N-豆蔻酰化位點(N-myristoylation sit)(G-E/D/R/K/H/P/F/Y/WX-X-S/T/A/G/C/N)aa29—34: GCseSE, aa117—122: GSqnTL, aa188—193: GSadTR, aa213—218: GLfvGL, aa220—225: GVatGT, 5個酪蛋白激酶II磷酸化位點(Casein kinase II phosphorylation site)(S/T-X-X-D/E) aa31—34: SesE, aa33—36: SekE, aa76—79: SvsE, aa78—81: SeqD, aa171—174: TpqE, 3個蛋白激酶C磷酸化位點(Protein kinase C phosphorylation site) (S/T-X-R/K) aa33—35: SeK, aa126—128: SaR, aa146—148: TvK。
使用Megalign軟件對黃顙魚MHC class II氨基酸ORF序列與其他硬骨魚類進行比較, 得到其與長吻逘的氨基酸序列相似度最高為69.5%, 與錦鯉的氨基酸序列相似度最低為50.4%(表 3)。
2.2 黃顙魚MHC class II系統進化樹的構建
在NCBI中選取了12種水產動物已知或預測MHC class II蛋白序列進行系統進化樹的構建, 發現黃顙魚與長吻逘、斑點叉尾親緣關系較近, 屬于同一分支(圖 1)。
2.3 黃顙魚MHC class II的組織差異表達
實驗共選取了黃顙魚9種組織, 包括: 小腸、腎、肝、鰭條、肌肉、脾臟、鰓、腦和頭腎。其中在小腸、鰭條、肌肉、肝臟和鰓5種組織中MHC class II基因有表達, 且小腸、肝臟和鰓3種組織中表達量相對較高, 肌肉和鰭條表達量相對較低, 而在脾臟、頭腎、腎臟、和腦中未檢測到表達(圖 2)。
2.4 飼料維生素D3對黃顙魚典型組織中MHC class II的表達影響
養殖實驗對照組和處理組取小腸、腎臟和肝臟3種組織, 實驗結果顯示, 小腸和腎臟對照組無表達, 但在處理組(飼料中添加維生素D3組)中顯著表達(P<0.05); 肝臟對照及處理組均無表達(圖 3)。
3 討論
MHC基因家族廣泛存在于脊椎動物中, 具有極高的基因多態性, 在遺傳育種、免疫抗病等方面的研究中備受青睞, 目前主要研究熱點為I、II兩類, MHC-I類基因區包括經典的A、B、C基因和非經典的E、F、G基因; MHC-II類基因被命名為MHCD, 并劃分為MHC-DR、MHC-DQ、MHC-DP等亞區, 此外還有DMA、DMB、LMP2、LMP7、TAP及TAP2等基因位點[30]。目前在水產動物中MHC class II基因的研究已較為廣泛, 現已得到多種魚類MHC class II類基因cDNA全長, 其中包括: 斑馬魚(Danio rerio)[31]、軍曹魚(Rachycentron canadum)[32]、牙鲆(Paralichthys olivaceus)[33]、草魚[34]、大西洋鮭(Salmo salar)[35]、大菱鲆(Scophthatmus maximus)[36]、虹鱒(Oncorhynchus mykiss)[37]等, 但相較于哺乳動物和家禽類的研究, 還顯得有些匱乏, 尤其是小型經濟魚類研究并不十分常見。本文使用Race技術,擴增得到MHC class II基因cDNA全長1074 bp, 編碼235個氨基酸, 具有明顯的轉錄終止信號AATAAA及poly A尾巴。通過將黃顙魚MHC class II基因的ORF與其他多種水產動物的MHC class II氨基酸序列比較后發現, 存在明顯的MHC class II alpha蛋白結構、Ig免疫球蛋白結構以及保守蛋白結構, 氨基酸C段相似性極高, 且轉膜區附近保守性較高, 轉膜區高度保守。建立進化樹結果顯示, 黃顙魚MHC class II基因和長吻逘、斑點叉尾親緣關系更近。
MHC基因群與免疫有著密不可分的聯系, 關于哺乳動物[38,39]、家禽[40,41]、水產動物[42,43]MHC基因研究表明MHC基因家族在動物遺傳多樣性分析、動物遺傳結構分析、動物抗病能力、異種移植、基因治療等方面都發揮了極大的作用[30,44]。而較MHC I類基因, II類基因的研究相對較少, 研究發現在不同魚類中, MHC II類基因的組織表達也具

表 3 12種魚類MHC-II氨基酸序列相似度比較Tab. 3 Alignment of MHC-II amino acid sequence identity of 12 species

圖 1 MHC class II基因系統進化樹Fig. 1 Phylogenetic tree of MHC class II gene
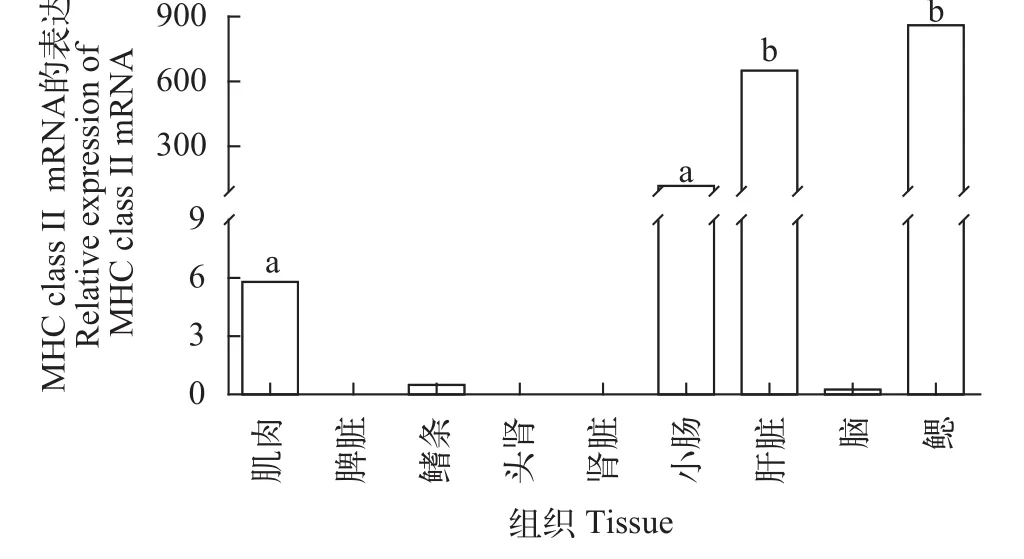
圖 2 黃顙魚MHC class II mRNA的組織分布

圖 3 在飼料中添加VD3后黃顙魚MHC class II mRNA在腸和腎中的相對表達Fig. 3 Relative mRNA level of MHC class II in intestine and kidney of yellow catfish by feeding VDIC、ID分別表示小腸對照組及VD3處理組; KC、KD分別表示腎臟對照組及VD3處理組; LC、LD 分別表示肝臟對照組及VD3處理組IC. intestinal control; ID. intestinal deal; KC. kidney control; KD. kidney deal; LC. liver control; LD. liver deal
注: Onc. Oncorhynchus mykiss虹鱒(CAB96451.1); Cyp. Cyprinus carpio錦鯉(CAA64708.1); Cte. Ctenopharyngodon idella草魚(ABW37740.1); Meg. Megalobrama amblycephala團頭魴(AGV52142.1); Osm. Osmerus mordax胡瓜魚(ACO09715.1); Sal. Salmo salar大馬哈魚(AGH92604.1); Sin. Sinocyclocheilus anshuiensis金線鲃(XP_016360726.1); Eso. Esox lucius白斑狗(XP_010894456.1); Dan. Danio rerio斑馬魚(NP_571565.1); Ict. Ictalurus punctatus斑點叉尾(AAD39869.1); Lei. Leiocassis longirostris長吻逘(AEI55830.1); Pel. Pelteobagrus fulvidraco黃顙魚(AOO96598.1); 下同The same applies below有差異性[32,45,46]。根據實時熒光定量PCR結果顯示, 本實驗得到黃顙魚MHC class II基因在肌肉、鰭條、小腸、肝臟、鰓5種組織中都有表達, 且小腸、肝臟、鰓3種組織中表達量相對較高, 肌肉、鰭條表達量相對較低。小腸、肝臟、鰓都是與免疫密切相關的組織器官, 肌肉和鰭條在先前的研究中未見表達或表達量低, 推測原因是實驗操作過程中肌肉和鰭條極易接觸體液, 沾染部分體表黏液所致。非特異性免疫因子存在于魚體血液及黏液中,而MHC class II基因參與細胞及體液免疫過程, 因此導致MHC class II基因在2種組織中發生表達。在飼料中添加VD3后, 熒光定量結果顯示, MHCclass II基因小腸和腎臟處理組(飼料中添加維生素D3組)中顯著表達(P<0.05); 肝臟對照及處理組均無表達, 猜測原因是MHC class II組織表達實驗中(圖2)使用普通黃顙魚即投喂商品飼料的暫養黃顙魚,而取小腸、腎臟、肝臟實驗用黃顙魚(圖 3)投喂的是低磷飼料(表 1), 且黃顙魚不屬同一批, 內部及各個外部環境的差異也會對結果產生一定影響。研究結果表明, 在低磷飼料中添加VD3對黃顙魚小腸、腎臟中MHC class II基因的表達有顯著促進作用, 維生素D3不僅可以調節機體的鈣、磷平衡[44],還具有免疫調節效應, 這種免疫調節效應既發生于多種免疫細胞中, 如: 巨噬細胞、B淋巴細胞、T淋巴細胞等, 其中對于T淋巴細胞的直接作用表現在其對細胞和多種細胞因子產生的調節作用, 包括: IL-1、IL-2、IL-4、IL-6、IL-10、IL-17、(TNF)-α and interferon (IFN)-γ[47—50]等, 與此同時, 在轉錄組水平上, 維生素D3也參與了多種信號通路[51], 但具體作用機制還需進一步深入研究。
本研究獲得了黃顙魚MHC class II基因的全長,對其基因序列及結構、氨基酸序列及特點進行了分析, 構建進化樹, 對水產動物MHC class II物種進化進行了闡述, 豐富了MHC class II基因庫; 通過熒光定量PCR分析發現低磷飼料中添加維生素D3對小腸和腎臟MHC class II基因顯著表達, 顯示該基因表達受到飼料維生素D3的影響, 為制作既能降低磷排放, 又能提高魚類免疫飼料提供研究基礎。
[1]Grimholt U. MHC and evolution in teleosts [J]. Biology, 2016, 5(1): 6
[2]Adriana R. M, Joao G M, Sebastian A, et al. Presentation of phagocytosed antigens by MHC class I and II [J]. NIH Public Access, 2013, 14(2): 135—152
[3]Wang C Q. The Foundation of the Molecular Immunology [M]. Beijing: Beijing University Press. 1997, 139—140 [王重慶. 分子免疫學基礎. 北京: 北京大學出版社. 1997, 139—140]
[4]Du J Y, Ding S X, Zhang Z W, et al. The progress of major histocompatibility complex (MHC) gene researches in fish [J]. Journal of Xiamen University (Natural Science), 2006, 45(2): 116—124 [杜佳瑩, 丁少雄, 張之文, 等. 魚類MHC基因的研究進展. 廈門大學學報(自然科學版), 2006, 45(2): 116—124]
[5]Schierman L W, Nordskog A W. Relationship of blood type to histocompatibilityin chickens [J]. Science, 1961, 134(3484): 1008—1009
[6]Hashimoto K, Nakanishi T, Kurosawa Y. Isolation of carp genes encoding major histocompatibility complex antigens [J]. Proceedings of the National Academy of Sciences, 1990, 87(17): 6863—6867
[7]Zhao X W, Yuan X C, Zhao W W, et al. China Fishery Statistical Yearbook [M]. Beijing: China Agriculture Press. 2015, 30—31 [趙興武, 袁曉初, 趙文武, 等. 中國漁業統計年鑒. 北京:中國農業出版社, 2015, 30—31]
[8]Ma L Q, Li D P, Tian X, et al. The muscular nutritional components and flesh quality of farmed Pelteobagrus fulvidraco yearlings [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 193—196 [馬玲巧, 李大鵬, 田興, 等. 1齡黃顙魚的肌肉營養成分及品質特性分析. 水生生物學報, 2015, 39(1): 193—196]
[9]Guo H S, Zhang H L. Diagnosis and treatment technology of yellow catfish common diseases [J]. Journal of Aquaculture, 2014, 35(8): 44—46 [郭海山, 張洪利. 黃顙魚常見疾病的診斷與防治技術. 水產養殖, 2014, 35(8): 44—46]
[10]Ai Q H, Mai K S. Advance on nutiritional immunity of fish [J]. Acta Hydrobiologica Sinica, 2007, 31(3): 425—430 [艾慶輝, 麥康森. 魚類營養免疫研究進展. 水生生物學報, 2007, 31(3): 425—430]
[11]Zuo R T, Ai Q H, Mai K S. Effects of dietary n-3 highly unsaturated fatty acids on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irr) [J]. Fish & Shellfish Immunology, 2012, 32(2): 249
[12]Zhou X Q, Feng L, Jiang W D, et al. Advanced research in nutrition and fish immunity [J]. Chinese Journal of Animal Nutrition, 2014, 26(10): 3175—3184 [周小秋, 馮琳,姜維丹, 等. 營養與魚類免疫研究進展. 動物營養學報, 2014, 26(10): 3175—3184]
[13]Mora J R, Iwata M, von Andrian U H. Vitamin effects on the immune system: vitamins A and D take centre stage [J]. Nature Reviews Immunology, 2008, 8(9): 685—698
[14]Mostafa W Z, Hegazy R A. Vitamin D and the skin: focus on a complex relationship: A review [J]. Journal of Advanced Research, 2015, 6(6): 793—804
[15]Lai Y X, Fang D Z. Recent advanced in vitamin D [J]. Internal Medicine, 2014, 25: 7—14 [賴宇軒, 方德昭. 維生素D的最新進展. 內科學志, 2014, 25: 7—14]
[16]Calton E K, Keane K N, Newsholme P, et al. The impact of vitamin D levels on inflammatory status: a systematic review of immune cell studies [J]. PloS One, 2015, 10(11): e0141770
[17]Aranow C. Vitamin D and the immune system [J]. Journal of Investigative Medicine, 2011, 59(6): 881—886
[18]Torres M. Vitamin D proven more effective than both anti-viral drugs and vaccines at preventing the flu. 2016, 1, 10. http://www.worldhealth.net/forum/thread/99358/ vitamin-d-proven-more-effective-than-bo/?page=1
[19]Deeb K K, Trump D L, Johnson C S. Vitamin D, signalling pathways in cancer: potential for anticancer therapeutics [J]. Nature Reviews Cancer, 2007, 7(9): 684—700
[20]Welsh J. Vitamin D and prevention of breast cancer [J]. Acta Pharmacologica Sinica, 2007, 28(9): 1373—1382
[21]Bernardi R J, Johnson C S, Modzelewski R A, et al. Antiproliferative effects of 1α, 25-dihydroxyvitamin D3and vitamin D analogs on tumor-derived endothelial cells [J]. Endocrinology, 2002, 143(7): 2508—2514
[22]Norman A W. Receptors for 1-α, 25(OH)2D3: past, present, and future [J]. Journal of Boneand Mineral Research, 1998, 13(9): 1360—1369
[23]Schwartz Z, Ehland H, Sylvia V L, et al. 1α, 25-dihydroxyvitamin D3and 24R, 25-dihydroxyvitamin D3modulate growth plate chondrocyte physiology via protein kinase C-dependent phosphorylation of extracellular signal-regulated kinase 1/2 mitogen-activated protein kinase [J]. Endocrinology, 2002, 143(7): 2775—2786
[24]Fleet J C. Rapid, membrane-initiated actions of 1,25-dihydroxyvitamin D: what are they and what do they mean? [J]. Journal of Nutrition, 2004, 134(12): 3215—3218
[25]Beard J A, Bearden A, Striker R. Vitamin D and the antiviral state [J]. Journal of Clinical Virology, 2011, 50(3): 194—200
[26]Zhang T, XU Q Y, Xu H, et al. Effects of dietary vitamin D3supplementation on body composition and activity of alkaline phosphatase in the serum of juvenile mirror carp (C. carpio Songpu mirror carp) [J]. Acta Agriculturae Boreali-Sinica, 2011, 26(Suppl1): 258—263 [張桐, 徐奇友, 許紅, 等. 飼料中維生素D3對松浦鏡鯉幼魚體成分和血清堿性磷酸酶的影響. 華北農學報, 2011, 26(增刊1): 258—263]
[27]Jiang M, Wu F, Wen H, et al. Effects of dietary vitamin D3supplementation on growth and body composition of juvenile grass carp (Ctenopharyngodon idellus) [J]. Freshwater Fisheries, 2009, 39(5): 38—42 [蔣明, 吳凡,文華, 等. 飼料中添加不同水平的維生素 D3對草魚幼魚生長和體成分的影響. 淡水漁業, 2009, 39(5): 38—42]
[28]Duan M M, Wang C F, Xie C X. Effects of dietary vitamin D3on antioxidant andimmune capacity of juvenile Pelteobagrus fulvidraco [J]. Freshwater Fisheries, 2014, 44(3): 80—84 [段鳴鳴, 王春芳, 謝從新. 維生素D3對黃顙魚幼魚抗氧化能力及疫功能的影響. 淡水漁業, 2014, 44(3): 80—84]
[29]Li D B, Li C, Zhang G W, et al. Effects of dietary vitamin D3level on expression of antimicrobial peptide hepcidin gene in Monopterus albus [J]. Chinese Journal of Animal Nutrition, 2012, 24(8): 1520—1526 [黎德兵, 李超,張龔煒, 等. 飼料中維素D3水平對黃鱔抗菌肽hepcidin基因表達的影響. 動物營養學報, 2012, 24(8): 1520—1526]
[30]Kang L Z, Erdemtu, Jiang J Q, et al. Research progress on major histocompatiblity complex (MHC) gene [J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(5): 28—33 [亢孝珍, 額爾敦木圖, 姜建強, 等. 主要組織相容性復合體(MHC)基因研究進展. 中國畜牧獸醫, 2014, 41(5): 28—33]
[31]Hideki O, Dagmar K, Vladimir V, et al. Major histocompatibility complex class II genes of zebrafish [J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(24): 11886—11890
[32]Mao L N, Feng J, Li Y G, et al. Full length cDNA cloning and tissue expression of major histocompatibility complex (MHC)-Ⅱα from Cobia (Rachycentron canadum) [J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(10): 48—56 [茅莉娜, 馮娟, 李玉谷, 等.軍曹魚MHC-Ⅱα基因全長cDNA的克隆及其組織表達分析. 中國畜牧獸醫, 2010, 37(10): 48—56]
[33]Prapansak S, Tsuyoshi O, Ikuo H, et al. Cloning, characterization and expression of cDNA containing major histocompatibility complex class I, IIa and IIb genes of Japanese flounder Paralichthys olivaceus [J]. Fisheries Science, 2004, 70(2): 264—276
[34]VanErp S H M, Egberts E, Stet R. Characterization of major histocompatibility complex class IIA and B genes in gynogenetic carp clone [J]. Immunogenetics, 1996, 44(3): 192—202
[35]Hordvik I, Grimholt U V M, Lie F, et al. Cloning and sequence analysis of cDNA sencoding the MHC class II chain in Altlantic salmon (Salmon salar) [J]. Immunogenetics, 1993, 37(6): 437—441
[36]Zhang Y X, Chen S L. Molecular identification, polymorphism, and expression analysis of major histocompatibility complex class IIA and B genes of turbot (Scophthal musmaximus) [J]. Marine Biotechology, 2006, 8(6): 611—623
[37]Dorschner M O, Duris T, Bront C R, et al. High levels of MHC class II allelic diversity in lake trout from lake superior [J]. Heredity, 2000, 91(5): 359—363
[38]Katarzyna K, Wies?aw B, Katarzyna B, et al. Evolution of major histocompatibility complex class I and class II genes in the brown bear [J]. BMC Evolutionary Biology, 2012, 12: 197
[39]?opucki R, Mróz I. An assessment of non-volant terrestrial vertebrates response to wind farms-a study of small mammals [J]. Environmental Monitoring and Assessment, 2016, 188(2): 122
[40]Zhou H J, Lamont J. Chicken MHC class I and II gene effects on antibody response kinetics in adult chickens [J]. Immunogenetics, 2003, 55(3): 133—140
[41]Hou Z C, Yang N. Advances in major histocompatibilitycomplex research in poultry [J]. Hereditas (Beijing), 2002, 24(1): 72—76 [侯卓成, 楊寧. 家禽主要組織相容性復合體的研究進展. 遺傳, 2002, 24(1): 72—76]
[42]Ruan R, Ruan J, Wan X L, et al. Organization and characteristics of the major histocompatibility complex class II region in the Yangtze finless porpoise (Neophocaenaasiaeorientalis asiaeorientalis) [J]. Scientific Reports, 2016, 6: 22471
[43]Johannes M D, Unni G, Jong L, et al. Comprehensive analysis of MHC class II genes in teleost fish genomes reveals dispensability of the peptide-loading DM system in a large part of vertebrates [J]. BMC Evolutionary Biology, 2013, 13: 260
[44]Ma L Y, Yue B F. Advances in research on major histocompatibility complex [J]. Chinese Journal of Comparative Medicine, 2005, 15(3): 182—185 [馬麗穎, 岳秉飛.主要組織相容性復合體(MHC)研究進展. 中國比較醫學雜志, 2005, 15(3): 182—185]
[45]Liu Y, Kasshara M, Rumfelt L L, et al. Xenopous classⅡ A genes: studies of genetic, polymorphism, and expression [J]. Developmental and Comparative Immunology, 2002, 26(8): 735—750
[46]Chen S L, Xu M Y, Hu S N, et al. Molecular polymorphism and expression analysis of MHC class IIB gene from red sea bream (Chrysophrys major) [J]. Developmental and Comparative Immunology, 2006, 30: 407—418
[47]Michelino D R, Michele M, Ferdinando N. Vitamin D3: a helpful immunomodulator [J]. Immunology, 2011, 134: 123—139
[48]Martin E, O’sullivan B, Low P, et al. Antigen-specific suppression of a primed immune response by dendritic cells mediated by regulatory T cells secreting in terleukin-10 [J]. Immunity, 2003, 18(1): 155—167
[49]Qi X P. Immunomodulatory effects of 1,25-dihydroxyvitamin D3[J]. Parenteral & Enteral Nutrition, 2006, 13(2): 105—108 [祁曉平. 1,25-二羥維生素D3的免疫調節作用. 腸外與腸內營養, 2006, 13(2): 105—108]
[50]LeibundGut-Landmann S, Waldburger J M, Krawczyk M, et al. Mini-review: Specificity and expression of CIITA, the master regulator of MHC class II genes [J]. European Journal of Immunology, 2004, 34(6): 1513—1525
[51]Mari O H, Yohei M, Mari M Y, et al. Cutting edge: requirement of MARCH-I-mediated MHC II ubiquitination for the maintenance of conventional dendritic cells [J]. In The Journal of Immunology, 2009, 183(11): 6893—6897
FULL-LENGTH cDNA CLONING AND THE EFFECT OF DIETARY VITAMIN D3ON TISSUE EXPRESSION OF MAJOR HISTOCOMPATIBILITY COMPLEX-ⅡIN YELLOW CATFISH (PELTEOBAGRUS FULVIDRACO)
FENG Mei-Hui, CHEN Pei, LEI Wen, LI Da-Peng and WANG Chun-Fang
(Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Hubei Provincial Engineering Laboratory for Pond Aquaculture, the College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China)
To study the relationship between vitamin D3(VD3) and the major histocompatibility complex (MHC) class II gene, the MHC class II antigen gene of yellow catfish was cloned by rapid-amplification of cDNA ends. The fulllength cDNA of MHC class II is 1074 bp long and comprises a 78 bp 5′ untranslated region (UTR_, 259 bp 3′UTR, and a 708 bp open reading frame that encodes 236 amino acids. The deduced amino acid sequence showed the highest identity (69.5%) and the lowest identity (50.4%) with Leiocassis longirostris and Cyprinus carpio, respectively. Expression of the MHC class II antigen gene was relatively high in the small intestine, liver, and gill, but low in muscles and tail. It was nearly undetectable in the other tissues. Vitamin D3(0, 5000 IU/kg) was added to low phosphorus diets in the growth trial. The addition of dietary VD3significantly stimulated MHC class II gene expression in the small intestine and kidney. This study describes the molecular structure, tissue expression of the MHC class II antigen gene, and possible effects of dietary VD3on tissue expression of the MHC class II gene in yellow catfish, providing useful information for further studies of the function of this gene in yellow catfish.
Yellow catfish; MHC class II; Dietary VD3; Gene expression
S965.1; Q344+.1
A
1000-3207(2017)05-0992-08
10.7541/2017.124
2016-09-30;
2017-03-15
國家自然科學基金(31172421和31672667); 現代農業產業技術體系建設專項基金(CARS-46)資助 [Supported by the National Natural Science Foundation of China (31172421, 31672667); the Earmarked Fund for China Agriculture Research System (CARS-46)]
馮美惠(1991—), 女, 天津人; 碩士; 主要研究方向為分子營養免疫。E-mail: f03011018@163.com
王春芳(1975—), 副教授; 主要研究方向為魚類營養與環境。E-mail: cfwang@mail.hzau.edu.cn

