基于GC/MS技術的產后卵巢靜止奶牛血漿代謝譜分析
范子玲,許楚楚,舒適,肖鑫煥,王剛,白云龍,張江,趙暢,夏成
?
基于GC/MS技術的產后卵巢靜止奶牛血漿代謝譜分析
范子玲,許楚楚,舒適,肖鑫煥,王剛,白云龍,張江,趙暢,夏成
(黑龍江八一農墾大學動物科技學院,黑龍江大慶163319)
【目的】運用代謝組學中氣相色譜/質譜聯用技術(GC/MS)篩選卵巢靜止奶牛和正常發情奶牛的血漿差異代謝物,探究奶牛發生卵巢靜止時其體內代謝的變化。【方法】在黑龍江省某集約化牛場選取產后60—90 d,年齡、胎次、體況相近的經產高產奶牛為實驗動物。根據奶牛的發情表現、直腸檢查、B超檢查及激素檢測的結果,將奶牛分為發情組(A)22頭和卵巢靜止組(B)20頭。應用GC/MS對兩組奶牛的血漿樣品進行檢測得到其代謝組圖譜,利用Chroma TOF軟件對得到的峰圖進行分析,得到原始數據。將標準化的GC/MS數據矩陣導入SIMCA-P+14.0軟件包中,進行多元統計分析,先進行無監督的主成分分析PCA來觀察各樣本之間的總體分布和整個分析過程的穩定性,然后用有監督的(正交)偏最小二乘法分析(O)PLS-DA來區分各組間代謝輪廓的總體差異,找到組間的差異代謝物。為防止模型過擬合,采用七次循環交互驗證和200次響應排序檢驗的方法來考察模型的質量。采用多維分析(O)PLS-DA和單維分析(-test)相結合的辦法,來篩選組間差異代謝物。在(O)PLS-DA分析中,變量權重值VIP>1的變量為差異變量;在-test中,<0.05的變量為差異變量。篩選VIP>1且<0.05的代謝物作為差異代謝物,最后采用KEGG途徑數據庫對兩組奶牛血漿樣本進行代謝組學差異代謝物通路富集及互作網絡構建分析。【結果】與正常發情奶牛相比,卵巢靜止奶牛血漿中共有20種代謝產物表現異常,其中17種差異表達代謝物與奶牛卵巢靜止的發生密切相關,包括水平增加的膽酸,水平下降的香草扁桃酸、煙酸甘氨酸、6-羥基煙酸、β-丙氨酸、L-酪氨酸、苯丙酮酸等,這些代謝產物參與了苯丙氨酸、酪氨酸、色氨酸的生物合成,并參與了丙酸乙酯、煙酸煙堿、苯丙氨酸和酪氨酸的代謝,它們通過單一途徑或綜合途徑對奶牛卵泡的正常生長產生干擾,從而引起卵巢靜止。另外3種化合物亞氨基二乙酸、N-甲基-L-谷氨酸、3-氨基異丁酸可能與氨基酸代謝和細胞能量轉運有關,其在奶牛卵巢靜止中的生物學作用有待進一步證實。【結論】應用GC/MS技術有效的篩選出正常發情奶牛和卵巢靜止奶牛之間的血漿差異代謝物,這些差異代謝物提示奶牛產后發生卵巢靜止與體內多種物質代謝紊亂有關。這為今后深入探索奶牛產后卵巢靜止的發病機理以及防治策略奠定了基礎。
氣相色譜/質譜聯用技術;奶牛;卵巢靜止;多元統計分析;差異代謝物
0 引言
【研究意義】卵巢靜止是由奶牛產后卵泡生長障礙,卵巢機能暫時性紊亂,卵泡不出現周期性活動所造成。該病是高產奶牛產后乏情發生的主要卵巢疾病[1]。而且,在奶牛遺傳改良和良好的管理條件下,奶牛產奶量不斷提高,但繁殖效率卻逐漸下降[2]。對于現代奶牛養殖業,繁殖率低下正嚴重制約著奶牛養殖業的發展與經濟效益[3]。因此,奶牛卵巢靜止的發病機理以及防治已成為世界奶牛疾病領域的一項重要研究課題。【前人研究進展】卵巢靜止的發生常與營養、季節、泌乳量和應激因素等有關。其主要原因是產后飼料中某些營養物質如蛋白質、維生素或生長因子的缺乏,使得奶牛營養狀況不良,抑制了GnRH和LH的分泌[4-5],卵巢對激素的反應性降低,引起卵巢靜止。另外,飼養管理不善,泌乳過度,子宮、卵巢疾病,全身性的疾病等也會引起卵巢靜止。代謝組學技術現已在獸醫領域中得到較多應用。許楚楚等應用核磁共振(nuclear magnetic resonance, NMR)技術確立了奶牛產后乏情的差異代謝物[6]。然而,氣相色譜/質譜聯用(gas chromatography/mass spectrometry, GC/MS)技術可以對血漿樣品進行有效的定性定量分析,具有高效的分離率和良好的靈敏度[7]。孫玲偉等[8-9]應用該技術篩選了酮病和亞臨床酮病以及脂肪肝奶牛血清代謝標識物,豐富了酮病、脂肪肝的發病機理和評估疾病病情。【本研究切入點】有關奶牛卵巢靜止的病因、臨床病理學及其生殖激素等已有報道,但是缺乏全景式的、系統的深入研究,即沒有從整體對發生卵巢靜止的奶牛血液中代謝物進行研究。【擬解決的關鍵問題】本試驗首次應用GC/MS技術篩選卵巢靜止奶牛和健康奶牛血漿差異代謝物,確定其參與的代謝通路及其差異代謝物網絡,以便更好地了解卵巢靜止的發生機制,為預防卵巢靜止的發生奠定理論基礎。
1 材料與方法
1.1 試驗時間與地點
本試驗于2015年5月在黑龍江8511牛場內進行。
1.2 試驗動物
隨機選取年齡、胎次相近的年泌乳量10噸左右的健康經產奶牛共206頭,作為試驗動物。按中國泌乳奶牛飼養標準進行規范管理,飼喂泌乳盛期全混日糧(TMR),主要成分:青貯32.60 kg,豆粕3.37 kg,濕玉米4.00 kg,膨大豆1.58 kg等;營養水平:干物質(DM):40.84%、粗蛋白:16.51%;脂肪:5.98%;鈣:180.07 g;磷:89.96 g;酸性洗滌纖維(ADF):16.63%;中性洗滌纖維(NDF):30.97%;產奶凈能:1.66 mcal/DM。平均每頭奶牛每天的干物質采食量為21 kg,每天榨乳3次,持續供應干凈的水。
正常發情奶牛:在產后60—90 d表現發情癥狀,直腸檢查和B超檢查子宮、卵巢無異常,通過直腸檢查有優勢卵泡的生長,B超檢查卵泡大小為正常的15—20 mm。
卵巢靜止奶牛:產后60—90 d仍未見發情表現,直腸檢查和B超檢查子宮無異常,通過直腸檢查卵巢上沒有優勢卵泡的生長,B超檢查卵泡直徑小于8 mm。
根據奶牛發情和卵巢靜止判定標準,同時排除異常樣本,本試驗共選取22頭表現發情且臨床檢查無其他疾病的健康奶牛為發情組(A),20頭無發情表現且臨床檢查無其他疾病的奶牛為卵巢靜止組(B)。試驗動物臨床資料及四種生殖激素水平見表1。
1.3 血液樣品采集
所有試驗奶牛于上午采食和榨乳前經尾靜脈采血,每頭采集全血10 mL并置于加有3—5滴肝素鈉的抗凝管中,將抗凝管緩慢倒置一次充分混勻后靜置。5 min低速(4 000 r/min)離心,將600 μL上清液放于1.5 mL離心管中,再進行5 min高速(12 000 r/min)離心,將500 μL上清液放于1.5 mL離心管中,于-80℃冷凍保存,待測。
1.4 血液生殖激素分析
采用雙抗體夾心法測定奶牛血漿中P4、E2、FSH和LH的水平,FSH酶聯免疫分析試劑盒(SBJ- B0061)、LH酶聯免疫分析試劑盒(SBJ-B0064)、P4酶聯免疫分析試劑盒(SBJ-B0063)、E2酶聯免疫分析試劑盒(SBJ-B0062)均購自南京森貝伽生物科技有限公司。
1.5 血液樣品GC/MS分析
1.5.1 樣品預處理 血漿樣品室溫下解凍后,每50 μL樣品中加入10 μL的L-2-氯-苯丙氨酸作為內標物,漩渦震蕩10 s后,再加入150 μL甲醇-乙腈混合溶液進行蛋白沉淀,渦旋震蕩1 min 后,-20℃靜置10 min;蛋白沉淀后的樣品在低溫下超聲提取5 min,之后置于-20℃,靜置10 min,隨后樣品在低溫下離心10 min(15 000 r/min,4℃),并提取150 μL上清液于玻璃衍生瓶中,衍生瓶中的液體用快速離心濃縮儀揮干成固體;之后在玻璃衍生瓶中加入15 mg·mL-1的甲氧胺鹽酸吡啶溶液80 μL,渦旋震蕩2 min,放入震蕩培養箱中37℃肟化反應90 min;之后在樣品中加入含1%TMCS的BSTFA衍生試劑80 μL和20 μL的正己烷,渦旋震蕩2 min,70℃恒溫箱反應60 min后樣本取出,室溫下放置30 min后進行GC/MS分析。
1.5.2 測定條件 本試驗的分析儀器為Agilent公司的7890A-5975C氣相色譜飛行時間質譜聯用儀(Agilent,USA),采用無分流模式,在氣相色譜質譜儀器中加入1 μL經過衍生化的提取物,經過毛細管柱后,樣品經過分離進入質譜儀進行檢測。在質譜儀中利用高純氦氣作中間載氣,氦氣負載的氣流速1.0 mL·min-1。氣相色譜的程序升溫為:15℃·min-1,50—125℃;5℃·min-1,125—210℃;10℃·min-1,210—270℃;20℃·min-1,270—305℃,305℃維持5 min。在進樣口時的溫度為260℃,EI源溫度為230℃,電壓為-70 V。質量掃描范圍:m/z 50—600,延遲5 min開始采集,采集速度為20譜/秒。
1.5.3 GC/MS數據預處理 將GC/MS的原始數據經ChromaTOF (v 4.34, LECO, St Joseph, MI)軟件進行預處理,將數據矩陣(CSV格式)導出。分析樣本共得到380個特征,內標用于數據的質量控制。一些特別影響結果的峰被從峰圖中刪除,包括內標峰和任何已知的假陽性峰(包括噪音、柱流失和衍生物化試劑峰),提出的矩陣經過去冗余和峰合并后[10],得到109個代謝物。用峰面積歸一化法對樣本質譜峰的響應強度進行歸一化,得到歸一化的數據矩陣[11]。
1.5.4 代謝物的鑒定 差異代謝物的鑒定通過如下方式進行:GC/MS工作站軟件會自動地把每個化合物的特征離子片段譜(fragmentation patterns)的碎片質荷比和豐度與NIST數據庫、Feihn代謝組學數據庫的標準離子片段譜庫比對,一般而言,匹配度超過70%的檢測物均可被認為是標準物質[12]。
1.6 統計分析
發情奶牛和卵巢靜止奶牛臨床資料及四種生殖激素檢測結果用SPSS17.0進行單因素方差分析(one- way, ANOVA),肩注“*”表示差異顯著(<0.05),肩注“**”表示差異極顯著(<0.01);血漿樣品的GC/MS標準化數據矩陣導入SIMCA-P+14.0軟件包(Umetrics,Ume?,Sweden),進行多元統計分析,先采用無監督的主成分分析(PCA)來觀察各樣本之間的總體分布和整個分析過程的穩定性,然后用有監督的(正交)偏最小二乘法(O)PLS-DA分析來區分各組間代謝輪廓的總體差異,找到組間的差異代謝物。為防止模型過擬合,采用七次循環交互驗證和200次響應排序檢驗的方法來考察模型的質量。采用多維分析(O)PLS-DA和單維分析(t檢驗)相結合的辦法,來篩選組間差異代謝物。PLS-DA分析中,變量權重值(variable important in projection, VIP)大于1的變量被認為是差異變量。篩選VIP>1;<0.05的代謝物作為差異代謝物,最后進行差異代謝物代謝通路歸屬分析,采用KEGG pathway數據庫對兩組奶牛血漿樣本進行代謝組學差異代謝物的互作網絡構建分析。
2 結果
2.1 血液生殖激素檢測
卵巢靜止組和發情組奶牛的年齡、胎次、體況和日均泌乳量沒有差異。發情組與卵巢靜止組相比,奶牛血中FSH,LH和P4含量無顯著的差異,而E2含量顯著的高于卵巢靜止組(表1)。
2.2 GC/MS檢測結果
2.2.1 代謝物總離子圖(TIC)分析 對質控樣本(QC)的GC/MS總離子流圖(TIC)進行重疊,初步考察分析方法的重現性。由圖1可知,QC樣本質譜峰的保留時間和相應強度重現性都很好,說明整個分析方法穩定可靠。
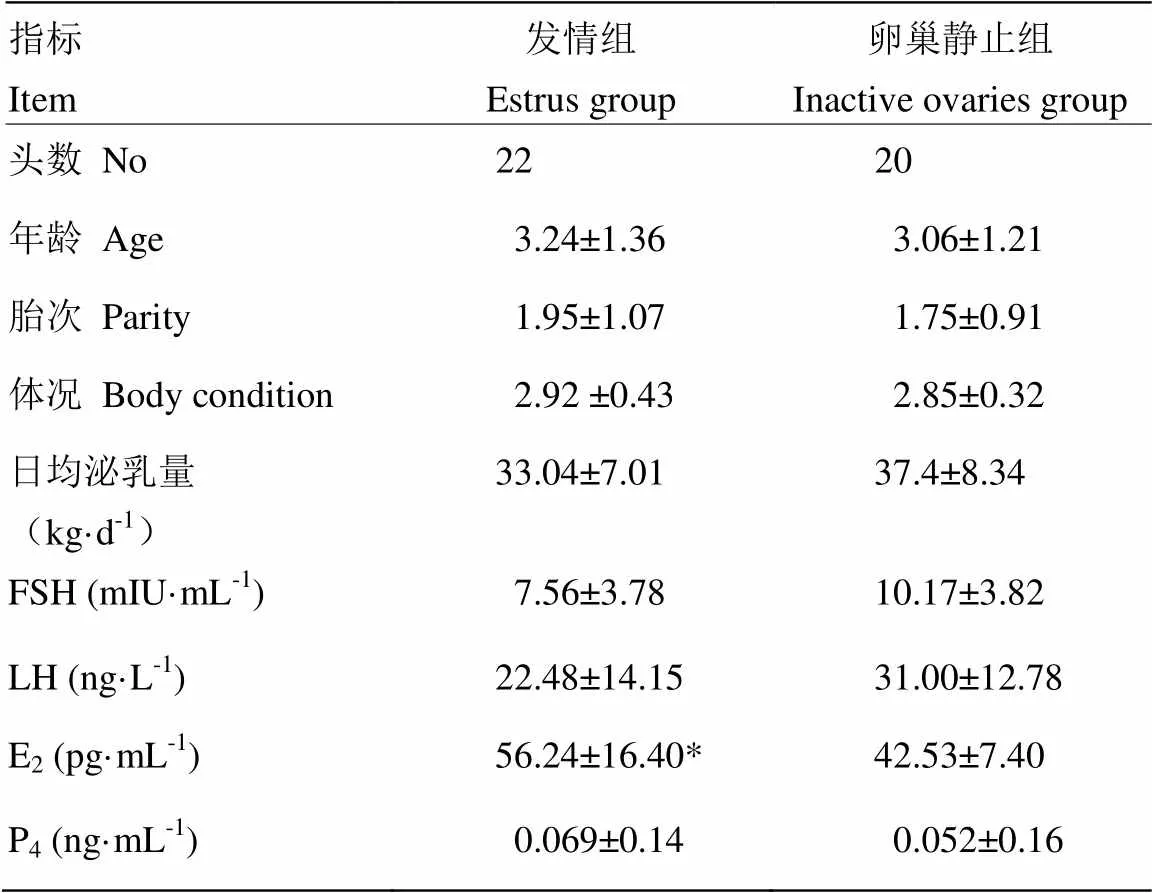
表1 卵巢靜止奶牛和發情奶牛臨床資料及四種血漿生殖激素水平(均值±標準差)
表中同行間注“*”表示組間差異顯著(<0.05)
Within the same row with “*” means significant difference (<0.05)
2.2.2 多元統計分析 對A組和B組樣本分別進行PCA、PLS-DA、OPLS-DA分析,得分圖分別見圖2—4。通過對PCA得分圖分析,可知A組樣本和B組樣本分離較為明顯,進一步采用PLS-DA和OPLS-DA對數據進行分析,從兩個得分圖可以得出A組和B組之間的代謝物存在顯著差異;排列試驗結果顯示2和Q2值均大于0.5,且比值接近于1;A組與B組的OPLS-DA得分圖結合排列試驗驗證結果共同提示所建的模型成立,說明組間代謝出現了顯著性差異。
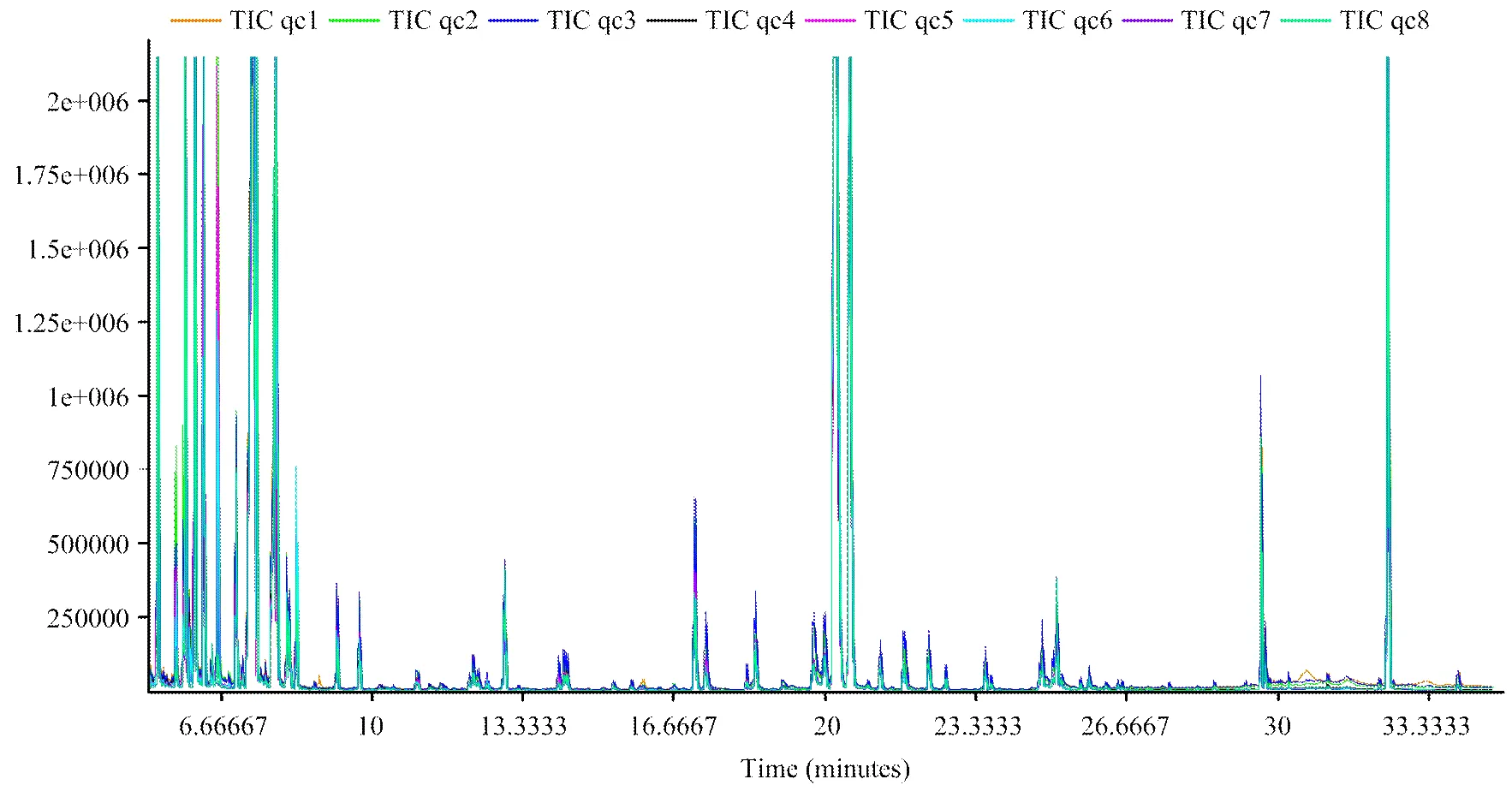
圖1 QC 樣本的總離子流圖(TIC)進行重疊
2.2.3 差異代謝物篩選和代謝通路分析 通過VIP值和值共篩選出20種差異代謝物,通過KEGG通路分析進一步篩選與奶牛代謝相關的代謝物共17種,如表2所示。表中列出17種代謝物在KEGG中匹配的ID、氣相色譜化合物的保留時間、篩選時VIP和值、卵巢靜止組相對于發情組的變化趨勢和差異代謝物以及主要參與的代謝通路。
由表2可知,有16種代謝物在卵巢靜止組含量低于發情組。它們涉及的通路包括氨基酸代謝,煙酸和煙堿的代謝,糖代謝和能量代謝等方面。僅膽酸的含量在卵巢靜止組明顯的高于發情組,與膽汁酸的生物合成有關。此外,通過CHEBI網站(http://www.ebi. ac.uk/ chebi/)查詢3種代謝物(亞氨基二乙酸、N-甲基-L-谷氨酸、3-氨基異丁酸)的生物功能,根據文獻資料顯示與奶牛的代謝通路無關,可能與細胞能量代謝傳導有關。
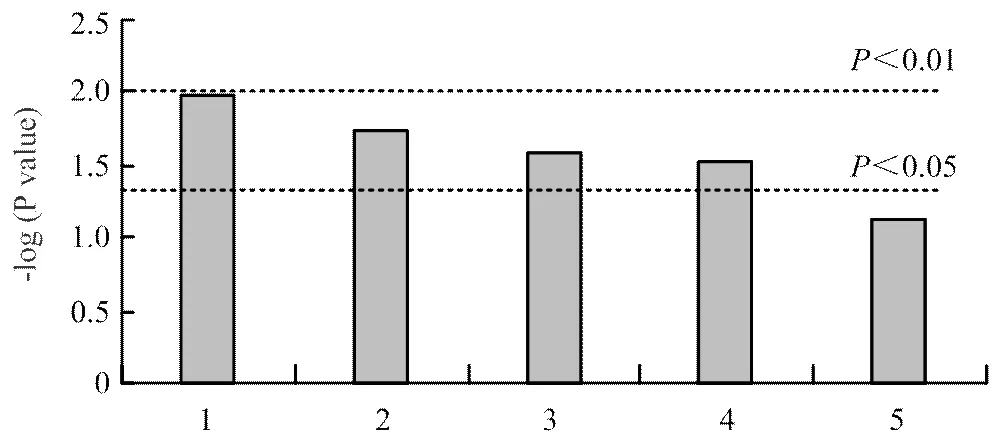
圖5顯示了通過值的負log計算出17種代謝物的豐度,并進行通路富集分析。它們涉及較多的通路為苯丙氨酸、酪氨酸、色氨酸的生物合成,其次為丙酸乙酯、煙酸煙堿、苯丙氨酸和酪氨酸代謝。
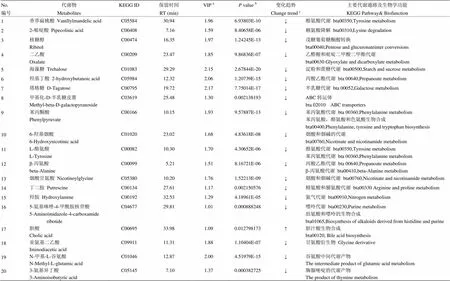
表2 奶牛卵巢靜止和發情組血漿差異代謝物
aPLS-DA模型中VIP值>1;b值為t-檢驗所得(閾值為0.05);c“↓”表示卵巢靜止組比發情組含量低;“↑”表示卵巢靜止組比發情組含量高
aVariable importance in the projection (VIP) is obtained from PLS-DA models with value higher than 1.0;bThevalue is calculated from the student's t test;cCompared to the estrous cows, metabolites in the cows with ovarian inactivity are down-regulated expression (↓) and metabolites in the cows with ovarian inactivity are up-regulated expression (↑)
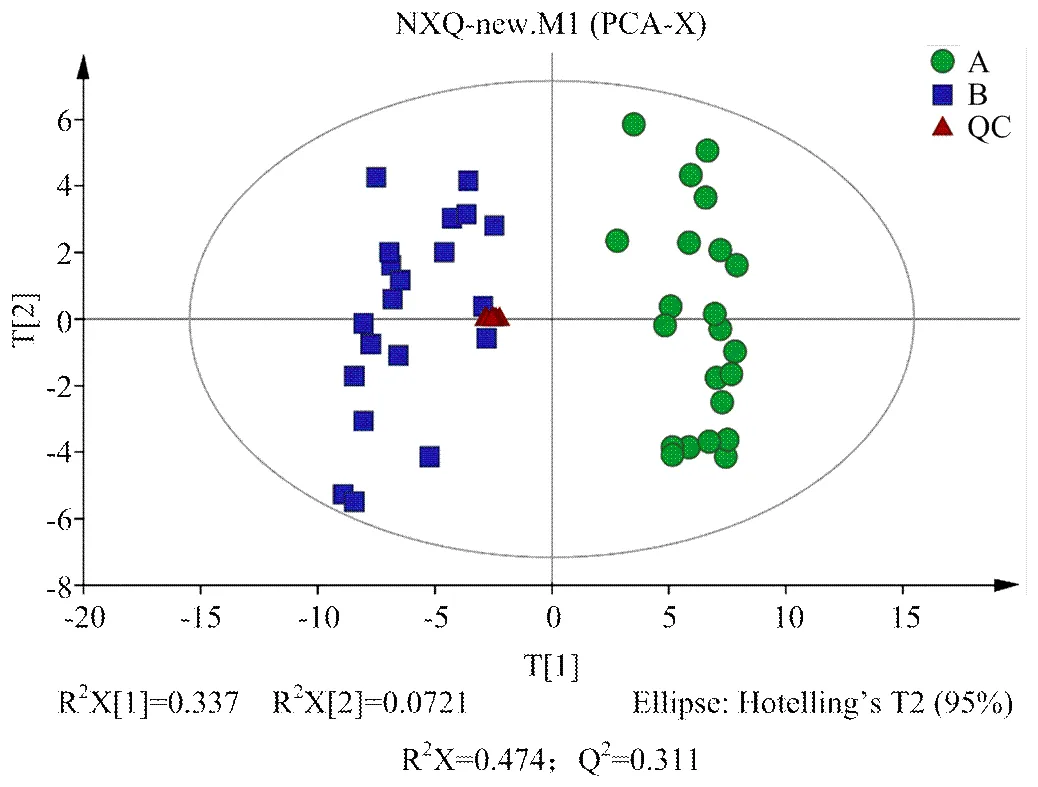
組A(發情組):圓點();組B(卵巢靜止組):方塊();t[1]和t[2]表示構建模型的前兩個主成分;R2X和Q2分別代表模型可解釋的變量和模型的可預測度
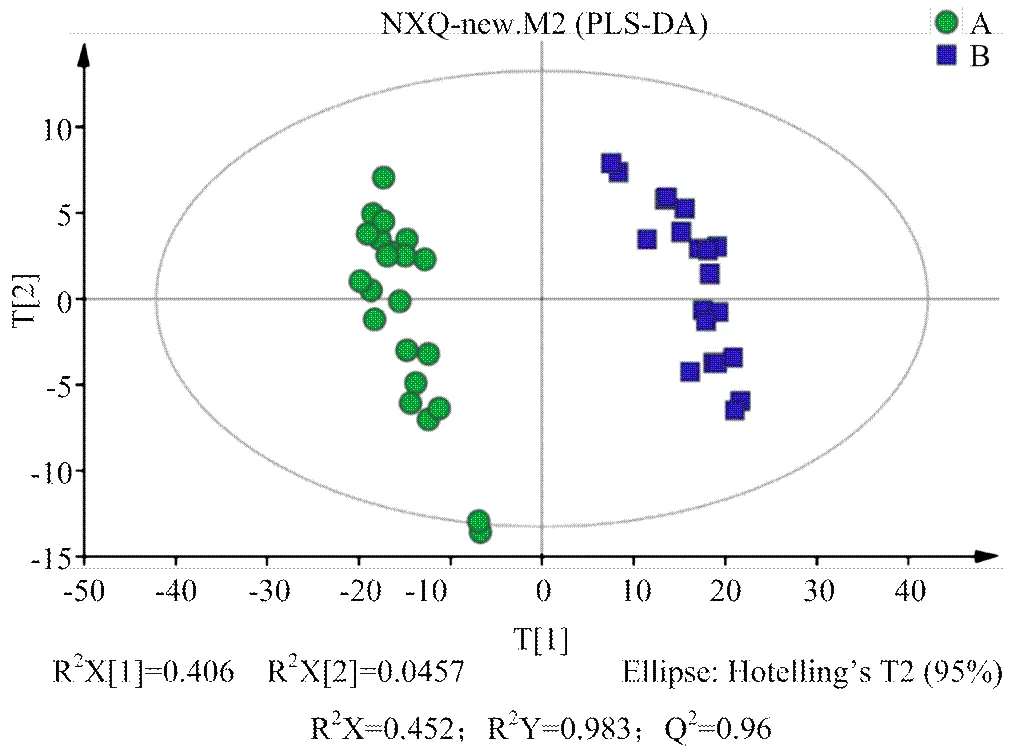
組A(發情組):圓點();組B(卵巢靜止組):方塊();t[1]和t[2]表示構建模型的前兩個主成分
3 討論
3.1 卵巢靜止與血液生殖激素的關系
卵巢靜止組和發情組FSH,LH和P4的含量無顯著差異。本試驗中發情奶牛樣品采集的時間為優勢卵泡生長至排卵階段,而FSH的含量在卵泡從開始生長至優勢卵泡階段上升,在卵泡生長至優勢卵泡階段開始下降,因而與沒有卵泡生長的卵巢靜止奶牛的FSH水平相近。在優勢卵泡的生長階段,LH呈脈沖式分泌,其每天的變化不定[13]。KAWASHIMA等報道不排卵奶牛的LH脈沖的頻率相比排卵奶牛較低[14]。由于試驗現場條件的局限性,僅能在60—90 d依據是否發情以及直腸檢查和B超檢查卵巢卵泡狀況隨機確立發情和卵巢靜止奶牛對應的相近天數采集血液,再者,因未做到連續每2 h或在每天的同一時間點跟蹤采樣,因此,結果呈現為兩組奶牛的LH含量無顯著差異。P4在排卵后,黃體形成階段分泌增加,因而未排卵階段發情奶牛和卵巢靜止奶牛P4含量無顯著差異。相對于卵巢靜止組,發情組奶牛的E2水平顯著升高,在卵泡從初始卵泡生長至優勢卵泡時,卵泡分泌的E2會增加,而卵巢靜止奶牛的卵泡不生長或停止生長,因而發情組奶牛的E2含量顯著高于卵巢靜止組。Beam等[15]報道排卵奶牛在產后8—14 d產生第一次卵泡波時,E2水平比不排卵奶牛高。P4濃度在奶牛排卵沒有差異,在排卵后排卵奶牛的P4濃度高于不排卵奶牛。
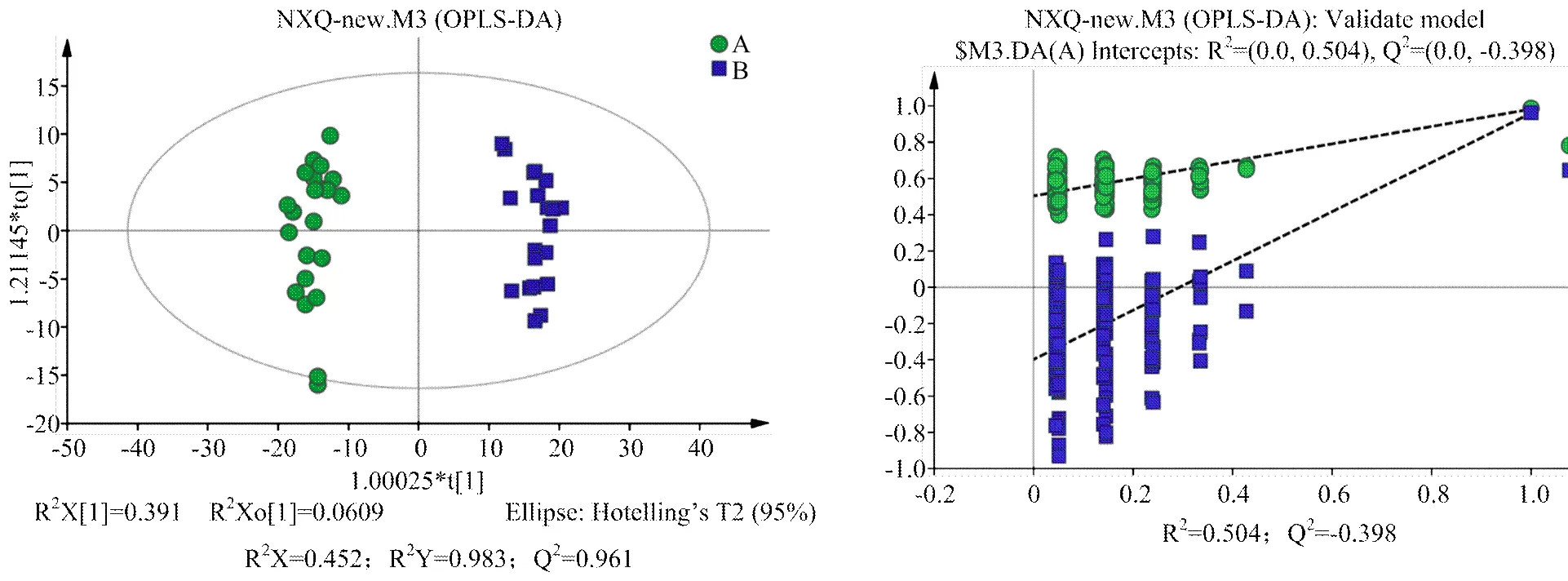
組A(發情組):圓點();組B(卵巢靜止組):方塊();t[1]和t[2]表示構建模型的前兩個主成分;R2和Q2分別代表模型的可解釋率和可預測度,兩者比值越接近1說明模型越可靠
1:苯丙氨酸,酪氨酸和色氨酸生物合成 Phenylalanine, tyrosine and tryptophan biosynthesis;2:丙酸乙酯代謝 Propanoate metabolism;3:煙酸和煙堿代謝 Nicotinate and nicotinamide metabolism;4:苯丙氨酸代謝 Phenylalanine metabolism;5:酪氨酸代謝 Tyrosine metabolism
3.2 卵巢靜止與差異代謝物的關系
目前,代謝組學技術已經成為有機體疾病模型和疾病生物標記物篩選,疾病診斷和生物途徑表達的一個強有力的分析工具。本試驗共篩選出20種差異代謝物,其中17種代謝物與奶牛體內代謝密切相關。而且,卵巢靜止組相對于發情組,除膽酸含量升高外,其余16種代謝物含量均降低。通過差異代謝物的KEGG分析,總結了其參與的代謝通路,并對其可能的影響機制進行討論。
3.2.1 氨基酸代謝異常 差異代謝物富集到的通路中,關于氨基酸代謝的較多,包括酪氨酸、苯丙氨酸、色氨酸的生物合成,苯丙氨酸、丙酸乙酯和酪氨酸代謝。卵巢靜止組中,篩選到的差異代謝物L-酪氨酸、β-丙氨酸和苯丙酮酸表達降低。L-酪氨酸和苯丙酮酸參與苯丙酮酸/色氨酸/酪氨酸的生物合成,L-酪氨酸和香草扁桃酸參與酪氨酸的代謝,這三種物質在卵巢靜止組含量均下降,說明這兩個通路的氨基酸合成減少或降解增加。在賴氨酸分解通路中,賴氨酸的下游產物,差異代謝物2-哌啶酸含量下降,由此推測賴氨酸在卵巢靜止奶牛體內含量可能減少。另外兩個通路,在丙酸乙酯代謝中β-丙氨酸含量下降,且其下游產物羥基丁酸含量也下降,說明此代謝通路合成減少或降解增強。在精氨酸脯氨酸代謝通路中,精氨酸和脯氨酸的上游代謝物,丁二胺含量在卵巢靜止組下降,由此推測精氨酸和脯氨酸含量應下降,實際變化還應用后續試驗驗證。
氨基酸在卵泡生長中有著至關重要的作用,許多研究通過卵母細胞的體外培養,驗證了卵泡液中不同代謝物對卵泡生長的作用。SINCLAIR等的研究表明,甘氨酸和丙氨酸是卵泡液中含量最豐富的兩種氨基酸[16]。這兩種氨基酸有許多功能與細胞生長相關,除了合成蛋白,還可參與核苷酸的生物合成,滲透調節[17]和解銨類物質的毒性[18]。Matoba等人用代謝組學方法比較體外培養的卵母細胞,分析其正常生長和中途停止生長條件下,卵泡液中代謝物的差異,結果發現甘氨酸、L-丙氨酸和L-谷氨酸與卵泡生長成正相關[19]。一些特定的氨基酸(甘氨酸,丙氨酸,脯氨酸等)通過顆粒細胞攝取,進而轉到卵母細胞中,只有絲氨酸和谷氨酸在整個發情周期都維持著相同模式[20]。這說明氨基酸會進入卵泡腔中支持顆粒細胞層的發育。本試驗中L-酪氨酸、賴氨酸、精氨酸、β-丙氨酸、脯氨酸在卵巢靜止奶牛體內含量下降,提示產后奶牛體內氨基酸含量下降會影響或阻礙卵泡生長,進而會促發卵巢靜止。因此,奶牛體內氨基酸的充足和平衡對卵泡生長發育以及發情有很大的影響。
3.2.2 煙酸代謝異常 相對于卵巢靜止組,煙酸甘氨酸和6-羥基煙酸兩種代謝物在發情組的含量高,均參與煙酸和煙堿代謝,均為煙酸的下游代謝產物。煙酸作為輔酶煙酰胺腺嘌呤二核苷酸和煙酰胺腺嘌呤二核苷酸磷酸(NAD+ 和NADP+)的前體,在能量代謝中是重要的參與者,能維持細胞的氧化還原狀態,維持機體免疫功能,調控細胞的存活時間和細胞凋亡[21]。煙酸有強大的抗脂作用,可以在能量負平衡狀態下減少非酯化脂肪酸(NEFA)水平。其在體內可以抑制脂肪細胞中腺苷環化酶的活性或增加環磷腺苷(CAMP)磷酸二酯酶的活性[22],進而抑制脂肪分解,減少血中NEFA濃度。卵巢靜止奶牛煙酸含量下降,從而造成脂質分解成脂肪酸的能力增強,奶牛體內脂肪酸含量增多。這不僅會造成脂肪肝綜合癥,還會增加細胞毒性,甚至造成細胞死亡[23]。此外,血中NEFA的增加可以引起卵泡液中脂肪酸的增加,會影響卵母細胞復合體的形態和胚胎的質量[24]。卵母細胞周圍包圍卵丘細胞,一起構成卵母細胞復合體(COC),直接與卵泡液接觸。卵丘細胞通過細胞間的間隙相連,且細胞間隙允許小分子代謝物在卵丘細胞和卵母細胞之間相互聯系,促進卵母細胞的生長和成熟[25]。在卵泡液中,卵丘細胞是第一個受NEFA影響的代謝區域。之后卵母細胞從卵丘細胞攝取NEFA,在細胞內轉化成中性脂肪,最后轉化成脂質供后期胚胎的營養[26]。在卵母細胞內NEFA比例的增多可以通過促進神經酰胺形成、線粒體釋放細胞色素C和激活半胱天冬酶來增加脂肪毒性[27],進而影響卵泡初期的生長。
3.2.3 糖類代謝異常 差異代謝物核糖醇、海藻糖、塔格糖,分別參與戊糖葡萄糖酮酸轉換、淀粉和蔗糖代謝、半乳糖代謝等與糖代謝相關的三個通路。在卵巢靜止組,三種物質的含量均降低,且其下游代謝產物丙酮酸、葡萄糖參與三羧酸循環。戊糖葡萄糖酮酸轉換通過D-核酮糖-5-磷酸進入磷酸戊糖途徑(PPP)。通過5-磷酸核糖基二磷酸(PRPP)進入嘌呤代謝途徑參與嘌呤生成和代謝。在嘌呤代謝中氨基咪唑-4-甲酰胺核苷酸(AICAR)含量下降,它參與嘌呤代謝生成尿酸,其下游產物二乙酸和羥胺都呈下降趨勢,分別參與乙醛酸和吡啶二甲酸二甲酯代謝、NH3代謝。葡萄糖是卵巢的重要能量來源。它可能會在卵巢中經厭氧途徑代謝成乳酸。Nandi等研究了葡萄糖、乳酸、丙酮酸對體外培養的卵泡細胞和顆粒細胞的作用,發現卵泡直徑隨著卵泡液中葡萄糖濃度的增加而增加。在小卵泡中乳酸的濃度增加,這可能會改變卵泡細胞的能量來源[28]。卵母細胞和卵泡細胞可以通過三個主要的通路利用葡萄糖:葡萄糖氧化(糖酵解,檸檬酸循環(TCA)和氧化磷酸化),戊糖磷酸途徑(PPP),或轉換成細胞外代謝,用于細胞外基質擴張[29]。本試驗結果涉及到三個與糖代謝相關的代謝通路,且在卵巢靜止組代謝物呈下降趨勢,說明卵巢靜止奶牛的糖代謝通路受阻,進而影響糖酵解和磷酸戊糖途徑,使卵泡中ATP和嘌呤生成減少,從而影響細胞的發育、細胞核的生長和細胞穩態的維持。
3.2.4 膽酸代謝異常 相對于發情組,卵巢靜止組膽酸含量高。由于膽酸參與膽汁酸的合成,膽酸含量的升高,提示奶牛膽汁酸合成增加或分泌減少,這與Sejersen的結果一致,當奶牛泌乳開始時肝臟合成膽汁酸的能力增強[30]。在泌乳期血清膽汁酸增加,同時膽固醇和甘油三酯也會增加[31]。膽汁酸通過膜受體的內分泌信號,使G蛋白偶聯膽汁酸受體1(GPBAR1),對細胞和器官發揮調節作用[32]。由于GPBAR1的廣泛表達,膽汁酸可以在不同的組織調節細胞功能。卵巢靜止奶牛體內膽汁酸合成增加,從而影響GPBAR1的表達,進而影響卵巢顆粒細胞的生長。膽汁酸可以通過核受體亞家族NR1H4介導的NR0B2阻止靶基因的轉錄,進而抑制其他核受體,NR5A2[33]。NR0B2會通過其對核受體NR5A2的抑制作用抑制類固醇類急性調節蛋白的表達,因此,NR5A2對卵巢的功能有重要的作用[34],并推測與膽汁酸代謝相關基因的表達可能會對顆粒細胞的生長有作用,這有待于進一步驗證。
3.2.5 其他差異代謝物異常 亞氨基二乙酸是甘氨酸的一種氨基羧酸,是甘氨酸的一種衍生物[35],其在卵巢靜止組含量下降。甘氨酸在卵泡生長過程中起到重要作用,但該衍生物的生物學作用尚不清楚。N-甲基-L-谷氨酸是谷氨酸的一種化學衍生物,是甲烷代謝的中間代謝產物。其由谷氨酸N-甲基甲胺酶催化甲胺和谷氨酸發生反應生成。其也可以被甲基谷氨酸脫氫酶催化生成谷氨酸[36]。在卵巢靜止組,N-甲基-L-谷氨酸含量下降,但有關谷氨酸對奶牛卵巢靜止的影響尚不知曉。3-氨基異丁酸是胸腺嘧啶的分解產物,由運動的肌肉中釋放到血中,到達脂肪組織激活產熱基因,從而使得白色脂肪褐變。最近有人推斷,3-氨基異丁酸在細胞代謝中起作用,其燃燒脂肪調節胰島素,總膽固醇和甘油三酯的代謝[37]。在卵巢靜止奶牛體內檢測到其含量下降,說明卵巢靜止奶牛的細胞能量代謝可能處于減弱狀態,造成產能減少,從而影響卵泡生長。
4 結論
本研究應用氣相色譜/質譜聯用技術篩選出了產后卵巢靜止奶牛血漿差異代謝物,揭示了奶牛卵巢靜止代謝輪廓以及可能的發病機理。相對于正常發情奶牛,卵巢靜止奶牛血漿中有20種代謝物表現異常,其中17種與卵巢靜止密切相關。通過對卵巢靜止奶牛和發情奶牛不同代謝特征的分析,闡明了差異代謝物與奶牛卵巢的內在聯系以及潛在的生物作用,并且新發現一些奶牛卵巢靜止的差異代謝物,為今后深入探討奶牛產后卵巢靜止的發生機制和防治措施提供了新的方向。
References
[1] YáNIZ J, LóPEZ-GATIUS F, BECH-SàBAT G, GARCíA- ISPIERTO I, SERRANO B, SANTOLARIA P. Relationships between milk production, ovarian function and fertility in high-producing dairy herds in north-eastern Spain., 2008, 43(s4): 38-43.
[2] ROCHE J F. The effect of nutritional management of the dairy cow on reproductive efficiency., 2006, 96(3/4): 282.
[3] 吳俊靜, 楊利國, 宴邦富, 劉曉華, 錢運國, 金爾光, 滕茂平, 李開橋, 熊敏, 程橙, 張淑君. 奶牛繁殖性能的分析研究. 中國奶牛, 2010(11): 28-32.
WU J J, YANG L G, YAN B F, LIU X H, QIAN Y G, JIN E G, TENG M P, LI K J, XIONG M, CHENG C, ZHANG S J. Analysis and research on reproductive performance of dairy cows., 2010(11):28-32. (in Chinese)
[4] FAIR T. Mammalian oocyte development: checkpoints for competence., 2009, 22(1): 13-20.
[5] COMIN A, GERIN D, CAPPA A, MARCHIC V, RENAVILLED R, MOTTAE M, FAZZINIA U, PRANDIA A. The effect of an acute energy deficit on the hormone profile of dominant follicles in dairy cows., 2002, 58(5): 899-910.
[6] XU C C, XIA C, SUN Y H, XIAO X H, WANG G, FAN Z L, SHU S, ZHANG H Y, XU C C, YANG W. Metabolic profiles using1H-nuclear magnetic resonance spectroscopy in postpartum dairy cows with ovarian inactivity., 2016, 86(6): 1475-1481.
[7] 賈偉, 蔣健, 劉平, 趙立平, 陳閩軍, 周明眉, 楊麗萍, 王米渠, 邱明豐, 張永煜. 代謝組學在中醫藥復雜理論體系研究中的應用. 中國中藥雜志, 2006, 31(8): 621-624.
JIA W, JIANG J, LIU P, ZHAO L P, CHEN M J, ZHOU M M, YANG L P, WANG M Q, QIU M F, ZHANG Y Y. Application of metabonomics in complicated theory system research of traditional Chinese medicine., 2006, 31(8): 621-624. ( in Chinese)
[8] 孫玲偉, 包凱, 李影, 李蘭, 張洪友, 夏成, 吳凌. 奶牛臨床和亞臨床酮病的血漿代謝組學研究. 中國農業科學, 2014, 47(8): 1588-1599.
SUN L W, BAO K, LI Y, LI L, ZHANG H Y, XIA C, WU L. Plasma metabolomics study of dairy cows with clinical and subclinical ketosis., 2014, 47(8): 1588-1599. ( in Chinese)
[9] IMHASLY S, NAEGELI H, BAUMANN S, BERGEN M V, LUCH A, JUNGNICKEL H, POTRATZ S, GERSPACH C. Metabolomic biomarkers correlating with hepatic lipidosis in dairy cows., 2014, 10(1): 1.
[10] 任洪燦, 王廣基, 阿基業, 郝海平, 孫建國, 查偉斌, 嚴蓓. 代謝組學分析技術平臺和數據處理的新進展. 中國臨床藥理學與治療學, 2007, 12(12):1332-1338.
REN H C, WANG G J, A J Y, HAO H P, SUN J G, ZHA W B, YAN B. Metabolomics analysis technology platform and new progress in data processing., 2007, 12(12):1332-1338. (in Chinese)
[11] 李晶, 吳曉健, 劉昌孝, 元英進. 代謝組學研究中數據處理新方法的應用. 藥學學報, 2006, 41(1):47-53.
LI J, WU X J, LIU C X, YUAN Y J. Application of new methods of data processing in metabolomics research., 2006, 41(1):47-53. (in Chinese)
[12] CHAN E C, KOH P K, MAL M, CHEAH P Y, EU K W, BACKSHALL A, CAVILL R, NICHOLSON J K, KEUN H C. Metabolic profiling of human colorectal cancer using high-resolution magic angle spinning nuclear magnetic resonance (HR-MAS NMR) spectroscopy and gas chromatography mass spectrometry (GC/MS)., 2016, 8(1):352-361.
[13] LISTED N. Relationship of fertility to patterns of ovarian follicular development and associated hormonal profiles in dairy cows and heifers. Cooperative Regional Research Project., 1996, 74(8):1943-1952.
[14] KAWASHIMA C, MATSUI M, SHIMIZU T, Kida K, Miyamoto A. Nutritional factors that regulate ovulation of the dominant follicle during the first follicular wave postpartum in high-producing dairy cows., 2012, 58(58):10-16.
[15] BEAM S W, BUTLER W R. Energy balance, metabolic hormones, and early postpartum follicular development in dairy cows fed prilled lipid., 1998, 81(1):121-131.
[16] SINCLAIR K D, LUNN L A, KWONG W Y, WONNACOTT K, LINFORTH R S T, CRAIGON J. Amino acid and fatty acid composition of follicular fluid as predictors ofembryo development., 2008, 16(6): 859-868.
[17] STEEVES C L, HAMMER M-A, WALKER G B, RAE D, STEWART N A, BALTZ J M. The glycine neurotransmitter transporter GLYT1 is an organic osmolyte transporter regulating cell volume in cleavage-stage embryos., 2003, 100(24): 13982-13987.
[18] HUMPHERSON P, LEESE H, STURMEY R. Amino acid metabolism of the porcine blastocyst., 2005, 64(8): 1852-1866.
[19] MATOBA S, BENDER K, FAHEY A G, MAMO S, BRENNAN L, LONERGAN P, FAIR T. Predictive value of bovine follicular components as markers of oocyte developmental potential., 2014, 26(2): 337-345.
[20] COLONNA R, MANGIA F. Mechanisms of amino acid uptake in cumulus-enclosed mouse oocytes., 1983, 28(4): 797-803.
[21] SINTHUPOOM N, PRACHAYASITTIKUL V, PRACHAYASITTIKUL S, RUCHIRAWAT S, PRACHAYASITTIKUL V. Nicotinic acid and derivatives as multifunctional pharmacophores for medical applications., 2015, 240(1): 1-17.
[22] PIRES J, GRUMMER R. The use of nicotinic acid to induce sustained low plasma nonesterified fatty acids in feed-restricted Holstein cows., 2007, 90(8): 3725-3732.
[23] Cusi K. Role of obesity and lipotoxicity in the development of nonalcoholic steatohepatitis: pathophysiology and clinical implications., 2012, 142(4): 711-725.
[24] JUNGHEIM E S, MACONES G A, ODEM R R, PATTERSON B W, LANZENDORF S E, RATTS V S, MOLEY K H. Associations between free fatty acids, cumulus oocyte complex morphology and ovarian function duringfertilization., 2011, 95(6): 1970-1974.
[25] GILCHRIST R B, LANE M, THOMPSON J G. Oocyte-secreted factors: regulators of cumulus cell function and oocyte quality. Human reproduction update, 2008, 14(2): 159-177.
[26] FERGUSON E M, LEESE H J. A potential role for triglyceride as an energy source during bovine oocyte maturation and early embryo development., 2006, 73(9): 1195-1201.
[27] HENIQUE C, MANSOURI A, FUMEY G, LENOIR V, GIRARD J, BOUILLAUD F, PRIP-BUUS C, COCHEN I. Increased mitochondrial fatty acid oxidation is sufficient to protect skeletal muscle cells from palmitate-induced apoptosis., 2010, 285(47): 36818-36827.
[28] NANDI S, KUMAR V G, MANJUNATHA B M, RAMESH H S, GUPTA P S P. Follicular fluid concentrations of glucose, lactate and pyruvate in buffalo and sheep, and their effects on cultured oocytes, granulosa and cumulus cells., 2008, 69(2): 186-196.
[29] MCDOWALL M L. The rational development of improvedmaturation of bovine oocytes[D]. Adelaide City: University of Adelaide, 2004.
[30] SEJERSEN H, S?RENSEN M T, LARSEN T, BENDIXEN E, INGVARTSEN K L. Liver protein expression in dairy cows with high liver triglycerides in early lactation., 2012, 95(5): 2409-2421.
[31] SMITH J L, LEAR S R, FORTE T M, KO W, MASSIMI M, ERICKSON S K. Effect of pregnancy and lactation on lipoprotein and cholesterol metabolism in the rat., 1998, 39(11): 2237-2249.
[32] SMITH Z, RYERSON D, KEMPER J K. Epigenomic regulation of bile acid metabolism: emerging role of transcriptional cofactors., 2013, 368(1): 59-70.
[33] GOODWIN B, JONES S A, PRICE R R, WATSON M A, MCKEE D D, MOORE L B, GALARDI G, WILSON J G, LEWIS M C, ROTH M E, MALONEY P R, WILLSON T M, KLIEWER S. A regulatory cascade of the nuclear receptors FXR, SHP-1, and LRH-1 represses bile acid biosynthesis., 2000, 6(3): 517-526.
[34] ZHANG C, LARGE M J, DUGGAVATHI R, DEMAYO F J, LYDON J P, SCHOONJANS K, KOVANCI E, MURPHY B D. Liver receptor homolog-1 is essential for pregnancy., 2013, 19(8): 1061-1066.
[35] LIU Z Q, LI F F, CHENG F, ZHANG T, YOU Z Y, XU J M, XUE Y P, ZHENG Y G, SHEN Y C. A novel synthesis of iminodiacetic acid: Biocatalysis by whole Alcaligenes faecalis ZJB-09133 cells from iminodiacetonitrile., 2011, 27(3): 698-705.
[36] SHAW W, TSAI L, STADTMAN E. The enzymatic synthesis of N-methylglutamic acid.1966, 241(4): 935-945.
[37] BEGRICHE K, MASSART J, FROMENTY B. Effects of β-aminoisobutyric acid on leptin production and lipid homeostasis: mechanisms and possible relevance for the prevention of obesity., 2010, 24(3): 269-282.
(責任編輯 林鑒非)
Plasma Metabolic Profiling of Postpartum Dairy Cows with Inactive Ovaries Based on GC/MS Technique
FAN ZiLing, XU ChuChu, SHU Shi, XIAO XinHuan, WANG Gang, BAI YunLong, ZHANG Jiang, ZHAO Chang, XIA Cheng
(College of Animal Science and Veterinary Medicine, Heilongjiang Bayi Agricultural University, Daqing 163319, Heilongjiang)
【Objective】This trial was designed to screen plasma differential metabolites between postpartum dairy cows with inactive ovaries and estrous cows and to clarify the changes of metabolites in dairy cows suffering from inactive ovaries by gas chromatography/mass spectrometry technique (GC/MS).【Method】Dairy cows which had similar age, parity and body condition score were selected at 60-90 d postpartum from an intensive dairy farm in Heilongjiang Province. According to clinical manifestations, B-ultrasound scan, rectal palpation and hormone tests, 22 cows were divided into estrous group (A) and 20 to the inactive ovaries group (B). All plasma samples were detected by GC/MS to obtain plasma metabolic profiles between the groups, and ChromaTOF software was used to analyze peak figures and obtain raw data. The standardized GC/MS data matrix was imported into SIMCA-p+14 to conduct multivariate statistical analysis including principal component analysis (PCA) to observe the overall distribution between the samples and the stability of the whole analysis process, and (orthogonal) signal correction-partial least squares-discriminant analysis (O)PLS-DA to distinguish the overall differences in metabolic profiles between groups and find differential metabolites between groups. In order to prevent the model from over-fitting, the quality of the model was examined by seven cycles of reciprocal verification and 200 response sequencing tests. Differential metabolites between groups were screened by (O)PLS-DA and t-test. In the PLS-DA analysis, the variable weight value VIP>1 was considered as the difference variable; in the t-test, the variable with<0.05 was considered as the difference variable. The metabolites with VIP>1 and<0.05 were screened as differential metabolites. Finally, plasma differential metabolites between two groups were analyzed by KEGG pathway database including channel enrichment and interaction network construction.【Result】Compared to estrous cows, there were 20 differential metabolites in cows with ovarian inactivity, of which 17 differential metabolites were closely related to cows with ovarian inactivity, including level increased cholic acid and decreased vanillylmandelic acid, nicotinoylglycine, 6-hydroxynicotinic acid, beta-alanine, L-Tyrosine, phenylpyruvate and so on. These metabolites were involved in biosynthesis of phenylalanine, tyrosine and tryptophan, and metabolism of ethyl propionate, nicotinic acid, nicotine, phenylalanine and tyrosine. The normal growth of follicle in cows was interfered with these differential metabolites by a single or comprehensive pathway. The other three compounds, Iminodiacetic acid, N-Methyl-L-glutamic acid and 3-Aminoisobutyric acid, may be related to amino acid metabolism and cell energy transport, and their biological role in dairy cows’ inactive ovaries remains to be further confirmed.【Conclusion】The plasma differential metabolites between cows with inactive ovaries and estrous cows were identified effectively by GC/MS technology. These differential metabolites suggested that the occurrence of ovarian inactivity may be related with metabolic disorders of various substances. Results of this study will lay a foundation for further study on the pathogenesis, prevention and treatment of postpartum inactive ovaries in dairy cows.
gas chromatography/mass spectrometry; dairy cows; inactive ovaries; multivariate statistical analysis; differential metabolites
2016-09-18;接受日期:2017-05-23
國家自然科學基金面上項目(31372488)
范子玲,E-mail:973514036@qq.com。通信作者夏成,Tel:0459-6819202;E-mail:xcwlxyf@sohu.com

