體外消化/Caco-2細胞模型分析發酵對面粉鐵生物利用率的影響
雷 激,黃承鈺
體外消化/Caco-2細胞模型分析發酵對面粉鐵生物利用率的影響
雷 激1,黃承鈺2
(1.西華大學食品與生物工程學院,四川 成都 610039;2.四川大學華西公共衛生學院,四川 成都 610041)
中國居民膳食以谷物為主食,谷物中鐵吸收率低是造成營養性貧血的主要原因,適當的加工方式可緩解谷物中植酸、多酚等物質對鐵生物利用率(Fe bioavailability,Fe BV)的影響。為考察酵母發酵對面粉Fe BV的影響,采用體外消化/Caco-2細胞模型。結果表明,面團在發酵后pH值呈下降趨勢,酸度呈上升趨勢;多酚、植酸含量降低,植酸酶活性升高,以上各指標在發酵前后差異均具有統計學意義(P<0.05)。發酵后面粉樣品的Fe BV增加約5%~38%,大多數面粉Fe BV發酵前后比較,差異具有統計學意義(P<0.05)。結論:發酵可降低面粉的pH值,增加酸度,有利于面粉多酚和植酸的降解以及植酸酶活力的升高,可有效提高面粉Fe BV。
小麥面粉;鐵生物利用率;發酵;體外消化/Caco-2細胞模型
據世界衛生組織統計,缺鐵性貧血是全球普遍存在的營養性缺乏癥,其發生率為兒童43%,非孕期婦女29%,孕婦38%[1];中國居民膳食以小麥等谷物為主食,缺鐵現象在國內尤其是貧困地區普遍存在。谷物類主食中含有大量的植酸、多酚類等抑制鐵吸收的因子,嚴重影響了鐵的生物利用率(Fe bioavailability,Fe BV),導致人體鐵的普遍缺乏,谷物的鐵吸收率低是造成營養性貧血的主要原因[2]。
植酸、多酚等因素對小麥等谷物中鐵吸收利用的影響已被廣泛認同[3-4],如果能找到一種經濟適用、操作簡便、符合人們飲食習慣的加工方法對小麥面粉進行合理加工,降低面粉中植酸、多酚等抑制因子的含量,可望提高小麥的Fe BV,這對指導人們正確加工面粉、合理食用面粉、充分發揮小麥的功能、改善缺鐵人群的健康現狀將會產生積極的影響。資料顯示,適當的食品加工方式如浸泡、發芽、發酵等可緩解植酸對非血紅素鐵吸收的抑制作用[5-7],國外有對小麥麩皮添加酵母[8]以及對面團進行乳酸發酵研究發現植酸含量可降低[9],也有報道浸泡發芽處理蠶豆可降解其植酸和多酚[10],還有研究發現發酵可降低高粱和小米中多酚含量[11],而有關面粉進行酵母發酵對Fe BV的影響還鮮見報道。對面粉進行酵母發酵是面粉加工常用的方法,人們食用的面包、饅頭、花卷、包子等食物都是面粉經酵母發酵的產物,據統計,中國北方約70%的小麥面粉用來做饅頭。
體外消化/Caco-2細胞模型法(in vitro/Caco-2 cell culture model)可經濟、快速、簡便地評估食物中Fe BV,目前該模型已成為食物實驗應用最廣泛的模型,用于嬰兒食品的開發、農業中富鐵植物品種的批量快速準確篩選、藥物生產方面改良鐵補充劑的開發等,已有實驗證明此法所測得的結果與人體實驗鐵吸收率顯著相關[12-14]。
本研究通過對面粉添加酵母進行發酵,采用體外消化/Caco-2細胞模型法考察發酵對其Fe BV的影響,從而為通過食品加工途徑改善植物性谷物中Fe BV提供理論依據,為人們合理加工和食用面粉提供參考。
1 材料與方法
1.1 材料與試劑
小麥面粉:選取不同品種的小麥籽粒,采用蒸餾水沖洗并嚴格控制灰塵等的污染,晾干,Buhler實驗磨制粉,共10 種樣品,分別是出粉率78%的京冬8號、安陽中優9507、北京中優9507、新疆中優9507、中麥9號、豫麥18、中麥175、豫麥2號和出粉率40%的豫麥18、中麥175。制粉后嚴密包裝-20 ℃保存。
人結腸腺癌細胞株(Caco-2) 四川大學華西藥學院保藏;低糖高活性干酵母 安琪酵母股份有限公司。
MWCO15000透析膜 美國Spectrum Medical公司;6 孔板插入環 美國Corning公司;細胞培養液、MEM營養液等組成參照文獻[2];VC、Chelex-100離子交換樹脂 美國Bio-Rad公司;鼠尾Ⅰ型膠原蛋白 美國BD生物公司;豬膽汁提取物、豬胰酶、豬胃酶、植酸鈉、植酸酶 美國Sigma公司。
1.2 儀器與設備
CO2孵箱 日本Sanyo公司;純水儀 美國Millipore公司;JY92-Ⅱ細胞超聲破碎儀 寧波新芝生物科技股份有限公司;酶標儀 美國Bio-Rad公司;SOLAAR M6原子吸收儀 美國Thermal Element公司;Lyolab 3000型真空冷凍干燥機、Ultra Freeze 3410型超低溫冰箱 丹麥Heto公司;5810R冷凍離心機 德國Eppendorf公司;pHs-3C+型酸度計 成都世紀方舟科技有限公司。
1.3 方法
1.3.1 細胞處理與指標測定
細胞培養、樣品體外消化與吸收、細胞收集、細胞中蛋白質和鐵蛋白測定、面粉植酸磷含量測定等操作參考文獻[2]。
1.3.2 小麥面粉發酵
按照活性干酵母說明書,每份面粉稱取100 g,加入面粉質量0.5%的活性干酵母攪拌混勻,緩慢加入30~35 ℃超純水44~50 mL進行攪拌和面,攪拌好的面團放入30 ℃恒溫培養箱中發酵50 min。將發酵好的面團迅速放入-70 ℃超低溫冰箱中冷凍3 h,取出放入凍干機中進行干燥,36 h后取出粉碎,裝袋密封,于-20 ℃儲存備用[2],供發酵后面粉多酚、植酸(磷)、植酸酶、Fe BV的測定。
1.3.3 指標測定
發酵前后及發酵過程中面粉pH值和酸度測定參考GB/T 5517—2010《糧油檢驗 糧食及其制品酸度測定》方法[15]。各稱取面粉15 g,采用1.3.2節方法進行面粉發酵,分別發酵0、10、20、30、40、50 min,于120 ℃加熱迅速終止酵母的作用,然后立即按GB/T 5517—2010方法制備樣液并測定面粉酸度,同時用酸度計測定面粉樣液的pH值,酸度以中和10 g糧食試樣所需0.1 mol/L堿液的體積來表示。
面粉總多酚含量采用Folin-Ciocalteu比色法,以沒食子酸為標準品[16]。
面粉植酸酶活力測定參考GB/T 18634—2009《飼用植酸酶活性的測定 分光光度法》[17]并稍作修改,反應條件改為1.5 mmol/L植酸鈉、55 ℃、pH 5.15。酶活力單位定義為樣品(植酸酶)在55 ℃、pH 5.15條件下每分鐘使1.5 mmol/L植酸鈉溶液釋放1.0 μmol無機磷,即為一個植酸酶活力單位(U),其余同國標。
1.3.4 面粉Fe BV計算
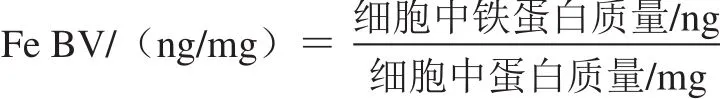
1.4 統計分析
2 結果與分析
2.1 發酵過程中面團pH值和酸度的變化如表1所示,面團在發酵后pH值總體上呈下降趨勢,降幅絕對值為1.28~1.52,酸度則呈上升趨勢,升幅絕對值為0.11~2.28 mL/10 g。
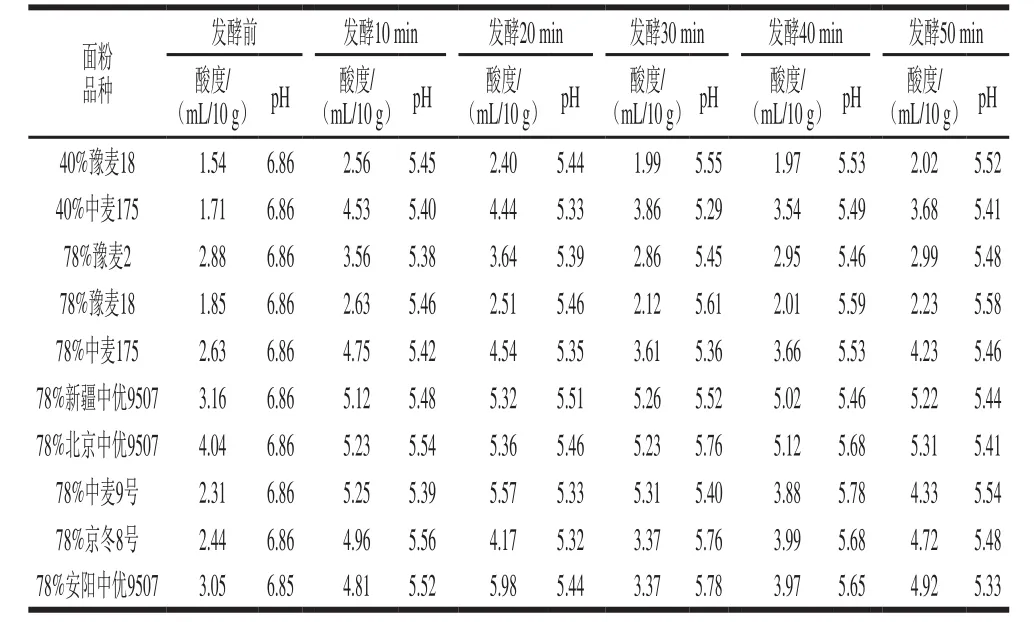
表1 發酵過程中面粉pH值和酸度的變化Table 1 Changes in pH and acidity in wheat flour dough during yeast fermentation
2.2 發酵后面粉植酸酶活性和植酸磷含量的變化

表2 面粉發酵前后植酸磷含量和植酸酶活力變化Table 2 Changes in phytate phosphorus content and phytase activity before and after yeast fermentation
由表2可知,發酵后面粉中植酸酶活力上升約9%~40%,植酸磷(植酸)降低約6%~31%。經t檢驗,發酵前后植酸磷、植酸酶活力差異均有統計學意義(P<0.05),說明發酵有利于面粉植酸的降解和植酸酶活力的升高。
2.3 發酵后面粉多酚含量的變化
10 種面粉發酵后多酚含量均呈下降趨勢,降幅約15%~42%,結果見表3。經t檢驗,發酵前后面粉多酚含量差異有統計學意義(P<0.05),說明發酵有利于面粉多酚的降解。
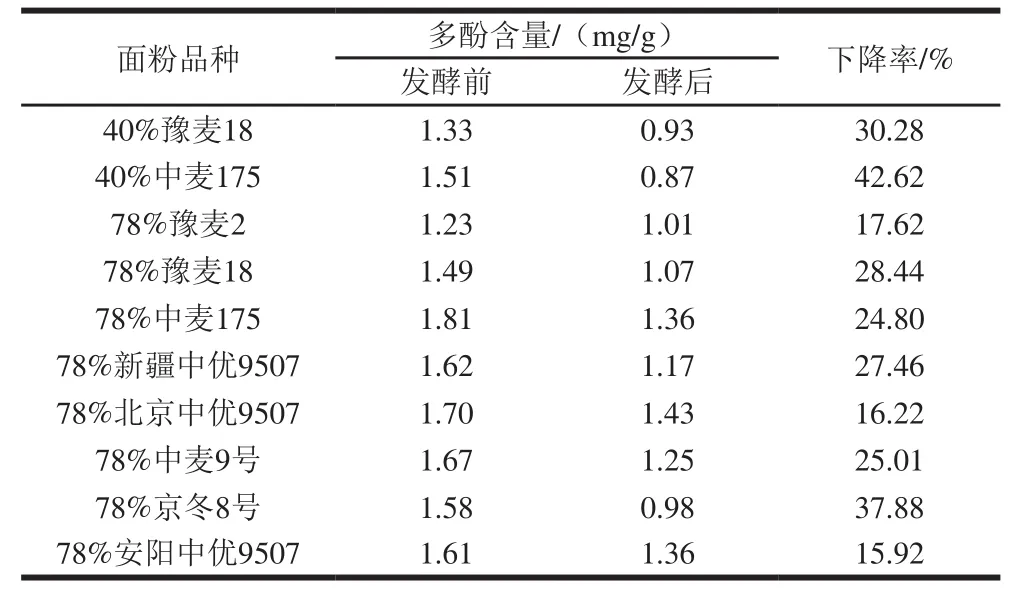
表3 發酵前后面粉多酚含量的變化Table 3 Changes in polyphenol content before and after yeast fermentation
2.4 發酵后面粉Fe BV的變化

表4 發酵前后面粉Fe BV比較Table 4 Fe bioavailability in 10 wheat flours before and after fermentation
由表4可知,發酵后10 個樣品的Fe BV比發酵前增加約5%~38%,對每一種面粉發酵前后的Fe BV進行t檢驗,發現除了40%出粉率的豫麥18和中麥175以及78%出粉率的新疆中優9507之外,其余面粉的Fe BV在發酵后都顯著高于發酵前(P<0.05),這說明發酵可顯著改善和提高大多數面粉Fe BV。
3 討 論
3.1 發酵過程中pH值變化的原因及其對其他因素的影響
發酵初期,由于剛攪拌的面團中充有大量的空氣,酵母進行旺盛的有氧呼吸,隨著發酵的進行,CO2氣體的不斷增多,面團中的CO2是發酵過程中pH值下降的原因之一,同時氧氣被消耗,酵母又進行無氧發酵。無氧發酵中在乙醛向酒精的轉化過程中酵母體內也可能生成乙酸,會擴散到面團中,雖然它不是主要產物,但對pH值是有影響的。同時來自面粉的乳酸菌利用面粉的營養物開始發酵,生成乳酸等產物,由于乙酸、乳酸等酸的生成,使面團的pH值下降[18-19]。
發酵過程中pH值的降低會使面粉中植酸和多酚含量產生不同程度的降低,從而改善面粉中鐵等微量元素的吸收率,原因如下陳述。
3.2 面粉發酵前后植酸、植酸酶變化的原因及其對Fe BV的影響
要提高食物中營養素的吸收率,食品加工方法非常重要,應該是簡單易懂易接受、易制作的食物,在經濟和勞動力方面可行。發酵是眾所周知的降解植酸的方法之一,從實驗結果可以看到發酵后面粉植酸酶活性都有所升高,增幅約為9%~40%,而植酸含量則降低約6%~31%,同時面粉Fe BV則增加約5%~38%,各指標變化在發酵前、后均具有統計學意義。發酵使植酸酶活性升高和植酸含量降低的原因與面粉內源性植酸酶和外源性植酸酶(來自干酵母)有關,發酵過程中pH值降低會激發植酸酶活性[20-21]。植酸酶是一類水解植酸的磷酸酶類,大多數微生物植酸酶適宜pH值在酸性范圍內,植物植酸酶適宜pH值在4.8~6.0之間。天然植物食品中含有內源性植酸酶,一定條件下可以催化其中的植酸水解。酵母菌也會分泌產生植酸酶,Towo等[22]在對高梁粉進行發酵時發現,發酵后高梁粉的植酸含量降低,原因是來自谷物和微生物的植酸酶使植酸含量下降,發酵時pH值在5.0左右與植酸酶最適pH值接近;植酸酶存在于多種谷物中,在發酵過程中會被激活,白色高粱發酵后植酸下降可溶性鐵大大增加;Frontela等[23]對出粉率分別為95%和80%的全麥面粉和普通面粉進行發酵、焙烤制作面包,發現發酵后兩種面粉的植酸含量均顯著降低;Caputo等[24]發現一種釀酒酵母能顯著降低全麥面包中植酸的含量(約下降79%);上述報道都與本實驗結果吻合,面粉發酵過程中可達到植酸酶的最適pH值,因此推測發酵后面粉植酸含量降低是因為發酵過程中pH值下降到了植酸酶的最適pH值范圍,來自面粉和酵母菌的植酸酶活性都得到提高,從而降解植酸,由此減少了由植酸導致的對鐵等微量元素吸收的抑制作用,使Fe BV提高。
3.3 面粉發酵前后多酚變化的原因及其對Fe BV的影響
Prom-u-thai等[25]發現在糙米中Fe BV與多酚含量負相關,說明除植酸外多酚也可能是低生物利用率的原因之一,由于多酚往往與谷物顏色有關,其將水稻谷皮的顏色作為高Fe BV水稻篩選的指標之一。本研究發現面粉發酵后多酚含量減少約16%~43%,面粉Fe BV增加約5%~38%,這2 個指標在發酵前后的變化均具有統計學意義。面粉發酵所致多酚含量降低的原因可能是兩方面:發酵后多酚氧化酶(polyphenol oxidase,PPO)活性升高及有機酸的生成。PPO可氧化多酚生成醌類化合物,導致食品褐變,表現出面粉顏色加深[26],這方面的研究很多[27];同時PPO也可用于含多酚類的植物中以提高鐵等微量元素的利用率。多酚成分中有鄰位-二羥基基團,可螯合鐵離子,使其在胃腸不被吸收。酚類物質氧化后可減少螯合的鐵離子,從而提高鐵利用率[28-29]。Elyas等[30]發現珍珠米發酵后PPO活性被激活,多酚含量降低,Matuschek等[28]對去除了植酸的高單寧高粱粉用多種水果汁孵育,發現高梁粉經果汁處理后多酚含量降低,體外可利用鐵增加,究其原因,主要還是水果中豐富的PPO使多酚氧化,其次是水果中有機酸的作用,提高了鐵利用率。這與本實驗有相似之處,面粉發酵后有機酸生成,酸性條件下鐵溶解性增加,同時pH值降低后接近小麥PPO的最適pH 6.0[31],使PPO活性上升,鐵吸收率增加。
4 結 論
對面粉進行酵母發酵處理,發酵后面團pH值降低,酸度增加,植酸酶活性顯著上升,植酸和多酚含量顯著下降,各方面的因素促進了面粉發酵后Fe BV增加,可以認為發酵可有效提高面粉Fe BV。
[1] GARCíA-CASAL M N. Planning and implementing food fortification programs to combat micronutrient malnutrition: iron[J]. Food & Nutrition Sciences, 2014, 5(10): 880-888. DOI:10.4236/ fns.2014.510097.
[2] LEI J, ZHANG Y, CHEN X G, et al. Assessment of iron bioavailability in ten kinds of Chinese wheat flours using an in vitro digestion/Caco-2 cell model[J]. Biomedical and Environmental Sciences, 2012, 25(5): 502-508. DOI:10.3967/0895-3988.2012.05.002.
[3] KRUGER J, TAYLOR J R N, OELOFSE A. Effects of reducing phytate content in sorghum through genetic modification and fermentation on in vitro iron availability in whole grain porridges[J]. Food Chemistry, 2012, 131(1): 220-224. DOI:10.1016/ j.foodchem.2011.08.063.
[4] LUO Y W, XIE W H. Effect of phytase treatment on iron bioavailability in faba bean (Vicia faba L.) flour[J]. Food Chemistry, 2012, 134(3): 1251-1255. DOI:10.1016/j.foodchem.2012.03.082.
[5] FRONTELA C, GARCíA-ALONSO F J, ROS G, et al. Phytic acid and inositol phosphates in raw flours and infant cereals: the effect of processing[J]. Journal of Food Composition and Analysis, 2008, 21(4): 343-350. DOI:10.1016/j.jfca.2008.02.003.
[6] LIANG J F, HAN B Z, NOUT M J R, et al. Effects of soaking, germination and fermentation on phytic acid, total and in vitro soluble zinc in brown rice[J]. Food Chemistry, 2008, 110(4): 821-828. DOI:10.1016/j.foodchem.2008.02.064.
[7] SOKRAB A M, AHMED I A M, BABIKER E E. Effect of germination on antinutritional factors, total, and extractable minerals of high and low phytate corn (Zea mays L.) genotypes[J]. Journal of the Saudi Society of Agricultural Sciences, 2012, 11(2): 123-128. DOI:10.1016/j.jssas.2012.02.002.
[8] SERVI S, ?ZKAYA H, COLAKOGLU A S. Dephytinization of wheat bran by fermentation with bakers’ yeast, incubation with barley malt flour and autoclaving at different pH levels[J]. Journal of Cereal Science, 2008, 48(2): 471-476. DOI:10.1016/j.jcs.2007.10.011.
[9] CORSETTI A, SETTANNI L. Lactobacilli in sourdough fermentation[J]. Food Research International, 2007, 40(5): 539-558. DOI:10.1016/j.foodres.2006.11.001.
[10] LUO Y W, XIE W H, JIN X X, et al. Impact of sprouting pretreatment on phytic acid and polyphenol level of faba bean (Vicia faba L.) flour[J]. International Food Research Journal, 2013, 20(3): 1133-1138.
[11] TAYLOR J R, DUODU K G. Effects of processing sorghum and millets on their phenolic phytochemicals and the implications of this to the health-enhancing properties of sorghum and millet food and beverage products[J]. Journal of the Science of Food & Agriculture, 2014, 95(2): 225-237. DOI:10.1002/jsfa.6713.
[12] TAKO E, BLAIR M W, GLAHN R P. Biofortified red mottled beans (Phaseolus vulgaris L.) in a maize and bean diet provide more bioavailable iron than standard red mottled beans: studies in poultry (Gallus gallus) and an in vitro digestion/Caco-2 model[J]. Nutrition Journal, 2011, 10: 113. DOI:10.1186/1475-2891-10-113.
[13] DELLAVALLE D M, VANDENBERG A, GLAHN R P. Seed coat removal improves iron bioavailability in cooked lentils: studies using an in vitro digestion/Caco-2 cell culture model[J]. Journal of Agricultural & Food Chemistry, 2013, 61(34): 8084-8089. DOI:10.1021/jf4022916.
[14] YUN S M, HABICHT J P, MILLER D D, et al. An in vitro digestion/ Caco-2 cell culture system accurately predicts the effects of ascorbic acid and polyphenolic compounds on iron bioavailability in humans[J]. Journal of Nutrition, 2004, 134(10): 2717-2721.
[15] 國家質量監督檢疫檢疫總局. 糧油檢驗 糧食及制品酸度測定: GB/T 5517—2010[S]. 北京: 中國標準出版社, 2010.
[16] 梅進, 丁文平, 熊金娟, 等. Folin-Ciocalteu比色法測定大麥糟中總酚條件的優化[J]. 食品與機械, 2016, 32(2): 51-54.
[17] 國家質量監督檢疫檢疫總局. 飼用植酸酶活性的測定 分光光度法: GB/T 18634—2009[S]. 北京: 中國標準出版社, 2009.
[18] 韓丹丹. 面食用酵母發酵特性對比研究[D]. 鄭州: 河南工業大學, 2014: 16-33.
[19] 張一. 面團發酵過程控制對饅頭品質的影響研究[D]. 長春: 吉林大學, 2011:18-38.
[20] HUMER E, SCHEDLE K. Fermentation of food and feed: a technology for efficient utilization of macro and trace elements in monogastrics[J]. Journal of Trace Elements in Medicine and Biology, 2016, 37: 69-77. DOI:10.1016/j.jtemb.2016.03.007.
[21] ZHAO H M, GUO X N, ZHU K X. Impact of solid state fermentation on nutritional, physical and flavor properties of wheat bran[J]. Food Chemistry, 2017, 217: 28-36. DOI:10.1016/j.foodchem.2016.08.062.
[22] TOWO E, MATUSCHEK E, SVANBERG U. Fermentation and enzyme treatment of tannin sorghum gruels: effects on phenolic compounds, phytate and in vitro accessible iron[J]. Food Chemistry, 2006, 94(3): 369-376. DOI:10.1016/j.foodchem.2004.11.027.
[23] FRONTELA C, ROS G, MARTíNEZ C. Phytic acid content and“in vitro” iron, calcium and zinc bioavailability in bakery products: The effect of processing[J]. Journal of Cereal Science, 2011, 54(1): 173-179. DOI:10.1016/j.jcs.2011.02.015.
[24] CAPUTO L, VISCONTI A, DE ANGELIS M. Selection and use of a Saccharomyces cerevisae strain to reduce phytate content of wholemeal flour during bread-making or under simulated gastrointestinal conditions[J]. LWT-Food Science and Technology, 2015, 63(1): 400-407. DOI:10.1016/j.lwt.2015.03.058.
[25] PROM-U-THAI C, HUANG L, GLAHN R P, et al. Iron (Fe) bioavailability and the distribution of anti‐Fe nutrition biochemicals in the unpolished, polished grain and bran fraction of five rice genotypes[J]. Journal of the Science of Food and Agriculture, 2006, 86(8): 1209-1215. DOI:10.1002/jsfa.2471.
[26] MARTIN J M, BERG J E, HOFER P, et al. Allelic variation of polyphenol oxidase genes impacts on Chinese raw noodle color[J]. Journal of Cereal Science, 2011, 54(3): 387-394. DOI:10.1016/ j.jcs.2011.08.003.
[27] ALTUNKAYA A, G?KMEN V. Partial purification and characterization of polyphenoloxidase from durum wheat (Triticum durum L.)[J]. Journal of Cereal Science, 2012, 55(3): 300-304. DOI:10.1016/j.jcs.2011.12.013.
[28] MATUSCHEK E, SVANBERG U. The effect of fruit extracts with polyphenol oxidase (PPO) activity on the in vitro accessibility of iron in high-tannin sorghum[J]. Food Chemistry, 2005, 90(4): 765-771. DOI:10.1016/j.foodchem.2004.06.002.
[29] SHARMA P, GUJRAL H S. Antioxidant and polyphenol oxidase activity of germinated barley and its milling fractions[J]. Food Chemistry, 2010, 120(3): 673-678. DOI:10.1016/ j.foodchem.2009.10.059.
[30] ELYAS S H A, TINAY A H E, YOUSIF N E, et al. Effect of natural fermentation on nutritive value and in vitro protein digestibility of pearl millet[J]. Food Chemistry, 2002, 78(1): 75-79. DOI:10.1016/ S0308-8146(01)00386-7.
[31] 黃海霞, 張真, 吳金芝. 小麥多酚氧化酶特性及褐變控制研究[J].安徽農業科學, 2008, 36(31): 13574-13575.
Effects of Fermentation on Iron Bioavailability in Wheat Flour Assessed with an in Vitro Digestion/Caco-2 Cell Model
LEI Ji1, HUANG Chengyu2
(1. School of Food and Biotechnology, Xihua University, Chengdu 610039, China; 2. West China School of Public Health, Sichuan University, Chengdu 610041, China)
Cereals are the most important staple crops in China. However, cereals are low in iron (Fe) absorption, which is attributed as the major reason of nutritional anemia. Proper processing can relieve the inhibition of substances like phytic acid and polyphenol in grains on iron bioavailability (Fe BV). In this experiment, an in vitro digestion/Caco-2 cell model was used to assess the impact of yeast fermentation on Fe BV in wheat flour. Results demonstrated that after fermentation, the pH of wheat flour dough declined and consequently the acidity showed a rising trend. In addition, the contents of polyphenol and phytic acid declined and the phytase activity increased. All the above changes were statistically significant (P < 0.05). Fe BV of flour samples increased by 5%–38% after fermentation, with significant differences (P < 0.05) being observed for most wheat flours compared with that measured before fermentation. Fermentation can reduce the pH of wheat flour and increase the acidity, thereby promoting the degradation of polyphenol and phytic acid, increasing phytase activity, and effectively improving Fe BV in wheat flour.
wheat flour; Fe bioavailability; fermentation; in vitro digestion/Caco-2 cell model
10.7506/spkx1002-6630-201716015
R282.75
A
1002-6630(2017)16-0099-05
雷激, 黃承鈺. 用體外消化/Caco-2細胞模型觀察發酵對面粉鐵生物利用率的影響[J]. 食品科學, 2017, 38(16): 99-103. DOI:10.7506/spkx1002-6630-201716015. http://www.spkx.net.cn
LEI Ji, HUANG Chengyu. Effects of fermentation on iron bioavailability in wheat flour assessed with an in vitro digestion/ Caco-2 cell model[J]. Food Science, 2017, 38(16): 99-103. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716015. http://www.spkx.net.cn
2016-09-04
西華大學人才基金項目(R0910507);四川省科技廳項目(2014NZ0078;2016NZYZF0028)
雷激(1966—),女,教授,博士,研究方向為食品科學。E-mail:jil765@163.com

