性別、年齡、空腹血糖對血清堿性磷酸酶升高體檢人群發生骨質疏松的影響
林曦陽,袁雪,劉俊田,李會強
(1天津醫科大學醫學檢驗學院,天津300070;2天津太山腫瘤醫院;3天津醫科大學第二醫院;4天津醫科大學腫瘤醫院)
性別、年齡、空腹血糖對血清堿性磷酸酶升高體檢人群發生骨質疏松的影響
林曦陽1,2,袁雪3,劉俊田4,李會強1
(1天津醫科大學醫學檢驗學院,天津300070;2天津太山腫瘤醫院;3天津醫科大學第二醫院;4天津醫科大學腫瘤醫院)
目的 探討性別、年齡、空腹血糖(FBG)對血清總堿性磷酸酶(TALP)水平升高體檢人群發生骨質疏松(OP)的影響。方法 選擇2013~2015年在天津醫科大學腫瘤醫院體檢的血清TALP水平升高者2 741例,男1 050例、女1 691例,年齡28~87歲。于體檢當日清晨空腹抽取靜脈血,應用日立7600全自動生化分析儀檢測血清FBG、TALP水平。體檢后1周內,電話告知體檢者于1個月內行骨密度檢查,按照是否確診為OP將受檢者分為OP組986例、非OP組1 755例。比較兩組不同性別、年齡、FBG的構成比。應用Logistic回歸模型分析性別、年齡、FBG是否為血清TALP水平升高者發生OP的影響因素。結果 OP組中女性、年齡≥40歲、FBG>5.85 mmol/L者的構成比均高于非OP組(P均<0.01)。女性(OR=1.889,95%CI為1.043~3.261)、年齡≥40歲(OR=1.986,95%CI為1.145~3.290)、FBG>5.85 mmol/L(OR=2.299,95%CI為1.690~3.128)均為患OP的危險因素(P均<0.01)。結論 女性、年齡≥40歲、FBG>5.85 mmol/L均為血清TALP水平升高體檢者發生OP的危險因素,對此類體檢者應建議行骨密度檢查,以及早發現、預防OP的發生。
堿性磷酸酶;骨質疏松;女性;年齡;空腹血糖;健康查體
血清總堿性磷酸酶(TALP)是一種廣泛存在于各種組織的含鋅糖蛋白酶[1]。生理情況下,兒童及青少年骨骼發育期和孕婦的血清中TALP水平較高;在病理狀態下如發生肝膽系統疾病以及骨骼疾病時,血清TALP水平顯著升高,且不同性別、不同年齡者血清TALP水平存在明顯差異。在排除非骨源性疾病因素后,TALP作為骨代謝轉換生化指標,其水平升高者的慢性流行性骨骼疾病骨質疏松(OP)發生率較高。但目前對于血清TALP水平增高者,其OP發生率增高的原因及影響因素尚不明確。我們對2013~2015年天津市2 741例血清TALP水平升高的健康查體人群進行骨密度檢測回訪,分析性別、年齡、FBG對該類人群發生OP的影響,以更好地指導對OP的篩查與控制。
1 資料與方法
1.1 臨床資料 選擇2013~2015年在天津醫科大學腫瘤醫院體檢中心體檢的血清TALP水平升高者3 451例,其中男1 548例、女1 903例,年齡26~90歲。血清TALP水平均>130 U/L。排除標準:與骨代謝疾病無關的引起TALP升高的因素;血清ALT、AST異常;確診為肝膽系統疾病;妊娠期;嚴重溶血;嚴重高脂血癥(血清TC≥6 mmol/L);影響骨代謝的疾病;服用影響骨代謝藥物;已確診OP;長期糖尿病患者。最終納入受檢者2 741例,男1 050例、女1 671例,年齡28~87歲,血清TALP水平131~355(150±25)U/L。
1.2 血清FBG、TALP檢測 于體檢當日清晨空腹抽取受檢者靜脈血4 mL,分離血清后應用日立7600全自動生化分析儀,檢測血清FBG、TALP水平。
1.3 骨密度檢測方法 納入受檢者體檢后1周內,電話告知其于1個月內行骨密度檢查,以確診是否發生OP。骨密度測量儀為Hologic公司的Discorage A型。數據庫使用儀器自帶的中國地區正常人骨密度標準數據庫,以雙能X射線(DEXA)測定的骨密度值作為OP診斷標準[2]:骨密度≤-2.5 s為OP,骨密度>-1.0 s為正常。
1.4 統計學方法 應用SPSS17.0統計軟件。計數資料比較用χ2檢驗。應用Logistic回歸模型,對性別(1=男,2=女)、年齡(<40歲=1,≥40歲=2)、FBG(按照既往3年總體檢人群FBG水平的上四分位數5.85 mmol/L 為標準,以≤5.85 mmol/L=1,>5.85 mmol/L=2)進行分類變量賦值。P<0.05為差異有統計學意義。
2 結果
2.1 OP確診情況 共確診OP 986例、非OP 1 755
例,分別納入OP組、非CP組。
2.2 不同性別人群各年齡段血清TALP、FBG水平比較 血清TALP水平升高者中,男性、女性人群在不同年齡間的血清TALP、FBG水平差異均有統計學意義(F分別為3.91、7.781、8.75、6.01,P<0.01),男性和女性人群中均表現為≥40歲者的血清TALP、FBG水平高于<40歲者(P均<0.01)。見表1。
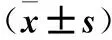
表1 不同性別人群各年齡段血清TALP、FBG水平比較
注:與40~<50歲者比較,*P<0.05。
2.3 兩組不同性別、年齡、FBG構成比比較 OP組中女性、年齡≥40歲、FBG>5.85 mmol/L者的構成比均高于非OP組(P均<0.01)。見表2。
2.4 血清TALP水平升高者發生OP的影響因素 將2.2、2.3中差異有統計學意義的結果帶入Logistic回歸模型,分析結果顯示女性、年齡≥40歲、FBG>5.85 mmol/L均為患OP的危險因素(P均<0.01)。見表3。
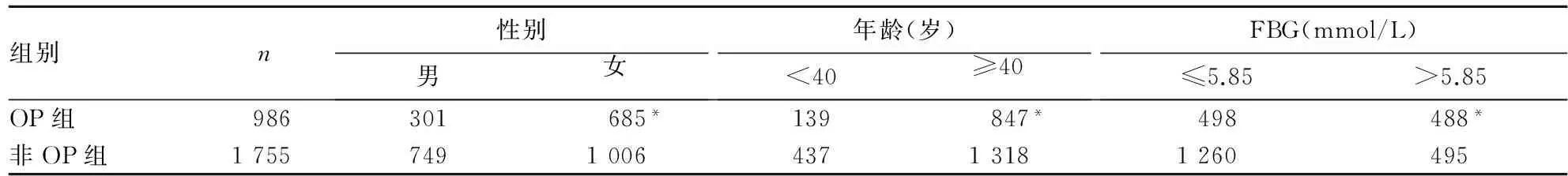
表2 兩組中不同性別、年齡、FBG構成比比較(例)
注:與非OP組比較,*P<0.01。
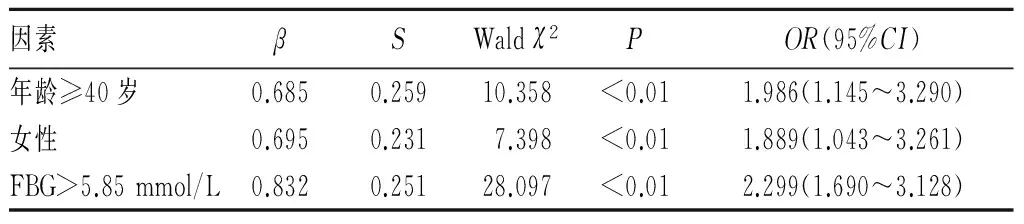
表3 血清TALP水平升高者發生OP的影響因素
3 討論
骨代謝轉換包括由破骨細胞介導的骨吸收和由成骨細胞介導的骨形成兩個動態變化過程,任何因素導致破骨-成骨失衡、骨吸收超過骨形成,均可以引起OP。血清TALP作為在日常健康查體過程中惟一一項骨代謝轉換生化指標,其作用及意義與血清骨特異性堿性磷酸酶(sBAP)、骨鈣素(sOC)和Ⅰ型膠原氨基末端肽(sNTX)相比,往往由于缺乏特異性、無顯著差異而容易忽視[3~5]。但TALP是參與骨代謝的重要酶類蛋白質,成骨細胞的活性及成骨作用的變化與血清TALP的活性密切相關[6]。OP的發生無論是破骨-成骨失衡還是骨吸收超過骨形成,均引起成骨細胞活性和成骨作用改變,進而血清TALP活性會有相應變化。本研究依據大量臨床實踐,針對血清TALP升高的體檢者,在排除與骨代謝疾病無關的引起TALP升高的患者后,結合年齡、性別、FBG等體檢較易獲得的因素,討論此類患者以上因素的差異與發生OP的相關性,指導體檢者及早行進一步檢查以早期發現OP。
性別是影響激素水平乃至發生OP的因素之一。研究發現,男性性激素中除睪酮外,其余激素水平并不隨年齡的增長有較大變化;而女性40歲后開始進入圍絕經期和絕經期,可出現雌激素水平明顯下降。由于雌激素水平對于維持骨代謝的穩定是必須的[7],因此女性40歲后易發生絕經后骨質疏松癥(PMOP)。PMOP患者骨吸收大于骨形成,表現為骨形成與骨吸收加快的高轉換狀態,所以血清TALP作為骨代謝轉換生化指標,會隨著骨密度減少率的增加而增加[12]。本研究發現,OP組中女性的構成比高于非OP組,且女性為患OP的危險因素,提示女性血清TALP水平升高者發生OP的風險較高,應將該部分人群作為重點觀察人群,進一步檢查以排除OP。
年齡是影響血清TALP水平的重要因素之一。研究發現,<30歲者的血清TALP水平最高,與年輕人骨生化指標濃度達到最高水平以及骨礦化達到峰值骨量有關,表明峰值骨量時骨生化指標水平最高,血清TALP也處于最高水平[8]。40~69歲者的血清TALP水平相對穩定,但骨形成與骨吸收處于動態平衡之中,骨轉換最低[9]。與<40歲者相比,≥40歲者男性無論家庭還是工作,正值中堅力量,應酬中大量乙醇的攝入、原發性高血壓的發生、甲狀腺功能亢進均可以導致TALP明顯升高,而這些引起血清TALP升高的機制基本都是由于OP的發生[10~12]。而女性≥40歲者血清TALP水平升高則主要與雌激素水平下降、發生絕經后OP有關。本研究發現,OP者中≥40歲者的構成比高于非OP者,且年齡≥40歲為患OP的危險因素。提示血清TALP水平升高者如年齡≥40歲,其OP發生風險明顯增加,應將該部分人群作為重點觀察人群,進一步檢查以排除OP。
大樣本量查體過程發現,血清TALP水平升高常伴隨FBG升高。但目前關于TALP、FBG對發生OP的影響尚不明確。研究發現,FBG升高時,滲透性利尿作用可導致低鈣血癥,誘發甲狀旁腺功能增強,加重骨生化指標異常;高血糖可以作用于骨細胞,使成骨細胞分化減少,破骨細胞活性增強;高血糖可使糖基化終末產物生成增加,沉積于膠原上,影響成骨細胞和破骨細胞功能;高血糖降低維生素D3水平,促進甲狀旁腺激素的釋放;長期血糖升高可以引起慢性并發癥,干擾血鈣磷及維生素D代謝[13]。因此,TALP、FBG在OP的發病中具有密切聯系。本研究發現,OP組中FBG>5.85 mmol/L者的構成比高于非OP組,血糖>5.85 mmol/L為患OP的危險因素。提示血清TALP水平升高者如出現FBG>5.85 mmol/L,其OP發生風險明顯增加,應將該部分人群作為重點觀察人群,進一步檢查以排除OP。
綜上所述,女性、年齡≥40歲、FBG>5.85 mmol/L均為血清TALP水平升高者發生OP的危險因素,因此對于女性、年齡≥40歲、FBG>5.85 mmol/L的血清TALP水平升高的體檢者,在排除非骨源性疾病影響后,應積極建議行骨密度檢查,以及早發現、預防OP的發生。
[1] 周新,涂植光,尹一兵,等.臨床生物化學和生物化學檢驗[M].3版.北京:人民衛生出版社,2005:170-175.
[2] 中華醫學會骨質疏松和骨礦鹽疾病分會.原發性骨質疏松癥診治指南(2011)[J].中國骨質疏松和骨礦鹽疾病雜志,2011,4(1):2-17.
[3] Nishizawa Y, Ohta H, Miura M, et al. Guidelines for the use of bone metabolic markers in the diagnosis and treatment of osteoporosis (2012 edition)[J]. J Bone Miner Metab, 2013,31(1):1-15.
[4] Lau WL, Kalantar-Zadeh K. Towards the revival of alkaline phosphatase for the management of bone disease, mortality and hip fractures[J]. Nephrol Dial Transplant, 2014,29(8):1450-1452.
[5] Hlaing TT, Compston JE. Biochemical markers of bone turnover-uses and limitations[J]. Ann Clin Biochem,2014 ,51(Pt 2):189-202.
[6] 諶紅珊,胡藩,劉冬梅.中老年人群骨密度與血鈣、血磷、骨轉換指標的關系[J].中國老年學雜志,2017,37(1):380-382.
[7] Cauley JA. Estrogen and bone health in men and women[J]. Steroids, 2015,99(Pt A):11-15.
[8] Drweska MN, Wolski H, Seremak MA, et al. Modern diagnostics of osteoporosis based on the use of biochemical markers of bone turnover[J]. Ginekol Pol, 2014,85(11):852-859.
[9] Singer FR, Eyre DR. Using biochemical markers of bone turnover in clinical practice[J]. Cleve Clin J Med, 2008,75(10):739-750.
[10] Fini M, Salamanna F, Veronesi F, et al. Role of obesity , alcohol and smoking on bone health[J]. Front Biosci, 2012,4:2686-2706.
[11] Schutte R, Huisman HW, Malaan I, et al. Alkaline phosphatase and arterial structure and function in hypertensive African men The SABPA study[J]. Int J Cardiol, 2013,167(5):1995-2001.
[12] Svare A, Nilsen TI, Bjoro T, et al. Hyperthyroid levels of TSH correlate with low bone mineral density: the HUNT 2 study[J]. Eur J Endocrinol, 2009, 161(5):779-786.
[13] Starup LJ, Eriksen SA, Lykkeboe S, et al. Biochemical markers of bone turnover in diabetes patients—a meta-analysis, and a methodological study on the effects of glucose on bone markers[J]. Osteoporos Int, 2014,25(6):1697-1608.
10.3969/j.issn.1002-266X.2017.30.015
R851.3;R714.257
B
1002-266X(2017)30-0050-03
2016-08-29)

