NaCl脅迫對藜麥種子萌發和幼苗生理特性的影響
楊宏偉,劉文瑜,沈寶云,李朝周*
(1.甘肅農業大學生命科學技術學院,甘肅 蘭州 730070;2.甘肅省作物遺傳改良和種質創新重點實驗室,甘肅 蘭州 730070;3.甘肅省農業科學院畜草與綠色農業研究所,甘肅 蘭州 730070;4.甘肅條山農林科學研究所,甘肅 白銀 730400)
NaCl脅迫對藜麥種子萌發和幼苗生理特性的影響
楊宏偉1,2,劉文瑜3,沈寶云4,李朝周1,2*
(1.甘肅農業大學生命科學技術學院,甘肅 蘭州 730070;2.甘肅省作物遺傳改良和種質創新重點實驗室,甘肅 蘭州 730070;3.甘肅省農業科學院畜草與綠色農業研究所,甘肅 蘭州 730070;4.甘肅條山農林科學研究所,甘肅 白銀 730400)
本研究報道了不同濃度NaCl處理對藜麥種子萌發及幼苗生理特性的影響,以確定藜麥的耐鹽閾值,為藜麥在鹽漬土地種植提供理論依據。結果表明,不同濃度NaCl處理對藜麥種子萌發和幼苗生理特性均產生顯著影響,主要表現為,1)隨著NaCl濃度的升高,藜麥種子的發芽率、發芽勢、發芽指數和活力指數均呈逐漸降低的趨勢,當NaCl濃度達到3.0%時,藜麥種子幾乎不發芽;2)幼苗葉片含水量逐漸降低,可溶性糖、脯氨酸、丙二醛含量、相對電導率及O2-·產生速率呈逐漸升高的趨勢,葉綠素含量、超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)活性在NaCl濃度為1.8%時達到最大值,而后隨著NaCl濃度的升高呈降低的趨勢;3)NaCl脅迫顯著抑制了藜麥幼苗株高、莖粗的增加,根長的生長隨著NaCl濃度的升高呈先增加后減少的趨勢,在NaCl濃度為1.8%時根長最長,達到11.73 cm。說明低濃度(≤1.8%)NaCl處理對藜麥幼苗生長具有促進作用,而高濃度的NaCl處理則對其有抑制作用。藜麥耐鹽閾值為1.8%。
NaCl;藜麥;種子萌發;生理特性
土壤鹽漬化是影響農業生產的主要因素之一[1]。全世界鹽堿地面積約9.54億hm2,其中我國為9913萬hm2。由于全球氣候變化、人口不斷增長、工業污染加劇、灌溉農業的發展和化肥使用不當等因素影響,導致土壤次生鹽漬化問題不斷加劇,給農業生產帶來了嚴重威脅,已成為阻礙現代農業生產發展的重要因素之一[2]。鹽脅迫對植物的傷害主要有4種表現形式,分別為滲透脅迫、離子毒害、營養失衡和氧化破壞[3]。當植物遭受鹽脅迫時其自身可通過合成滲透調節物質、產生抗氧化酶等來緩解由于鹽脅迫所造成的損傷。不同植物的耐鹽性表現各異,因此通過研究植物在鹽生環境中適應性表現,揭示其耐鹽機理,為解決鹽漬化對植物生長發育產生的不良影響,具有一定的理論指導和現實意義。
藜麥(Chenopodiumquinoa)是莧科藜亞科藜屬一年生自花授粉植物[4]。原產于南美洲安第斯山區,是印加土著居民的主要傳統食物,至今已有5000~7000多年的種植歷史。由于其營養豐富,食用價值高且植株在自然肥力低的情況下仍能生長良好,因此被譽為未來最具潛力的農作物之一[5]。近年來,相關研究發現藜麥具有全方位的營養價值,尤其在預防肥胖、心血管疾病、糖尿病和癌癥等方面具有顯著的功效,尤其是從2000年以后藜麥的營養價值被眾多的營養學家所認可,將其推薦為20世紀末的特色農作物,以藜麥為原料的食品和保健品得到了消費者的熱烈追捧[6]。藜麥具有耐鹽、耐寒、耐旱、耐貧瘠等生物學特性,Jacobsen等[7]和 Prado等[8]研究發現,藜麥是一種耐鹽性強的鹽生物種,其中許多品種能夠在濃度類似海水鹽濃度(4 S/m)的條件下生長,這一特征使其深受一些鹽漬問題突出地區的青睞。由于藜麥原產地在海拔3000 m以上的高山區,氣候及環境條件相對惡劣,產量低而不穩,難以滿足市場需求,2014年南美洲總產量約為6萬t,其中85%以上出口到美國、歐洲及日本、新加坡等國家和地區,其強勁的需求使目前許多國家和地區開始引種栽培。中國西藏農牧學院和西藏農業科學院早在1987年就開始了藜麥的引種栽培實驗,隨后在西藏境內試種成功,目前在中國的甘肅、青海、陜西、浙江等地均有種植[9]。為了使藜麥在甘肅地區更好的引種和適種,本研究設置了5個NaCl濃度梯度,以蒸餾水為對照(CK),根據不同鹽濃度處理下藜麥種子的萌發率及幼苗生長的生理形態特征來探討不同濃度鹽處理對藜麥種子萌發和幼苗生長的影響,以確定藜麥的耐鹽閾值,為藜麥在鹽漬土地種植提供理論依據。
1 材料與方法
1.1 材料及處理
1.1.1 種子萌發試驗 試驗材料為藜麥(品種為Kasala quinoa),由甘肅省景泰縣農林科學研究所提供。實驗于2016年5月在甘肅農業大學生命科學技術學院植物生理實驗室進行。共設置6個NaCl濃度梯度,分別為CK(蒸餾水),0.6%,1.2%,1.8%,2.4%,3.0%。選取籽粒飽滿、大小均勻一致的藜麥種子,經75% 的酒精消毒1 min后用去離子水反復沖洗數次,置于墊有雙層濾紙的培養皿(φ=9 cm)中,每皿均勻放入50粒種子,每個濃度處理重復3次,加入10 mL處理鹽溶液,以蒸餾水為對照,將所有培養皿置于(25±1) ℃,12 h光照/12 h黑暗、濕度80%恒溫培養箱中培養,每天早晚各一次用稱重法補充蒸發失去的水分以保持鹽濃度的恒定,培養7 d,統計每天種子發芽數。
1.1.2 幼苗生長試驗設計 本試驗于2016年5-7月在甘肅農業大學生命科學技術學院植物生理實驗室進行。選取籽粒飽滿、大小均勻一致的藜麥種子,經75%的酒精消毒1 min后用自來水和去離子水沖洗干凈并自然風干后,均勻播入裝有1 kg蛭石、直徑26 cm、高8 cm的塑料花盆中,每盆播種50粒種子,每個鹽濃度設3次重復,正常澆水,待幼苗長至四葉時進行定苗,每盆留苗10株,在第10天分別向各花盆中加入等量的不同濃度的NaCl鹽溶液進行鹽脅迫處理,以蒸餾水處理為對照(CK),所加溶液使土壤完全浸透,處理20 d后測定藜麥幼苗相關生理指標。
1.2 測定指標與方法
1.2.1 種子發芽指標 發芽以胚根長為種子長的2倍,胚芽與種子等長作為萌發標準,每天統計發芽的種子數后計算發芽率、發芽勢、發芽指數和活力指數。計算公式如下:
發芽率(germination percentage,GP)=(7 d發芽種子數/測試種子總數)×100%[10]
發芽勢(germination energe,GE)=(前3 d發芽種子數/種子總數)×100%[10-11]
發芽指數(germination index,GI) =∑(Gt/Dt)[12]
式中:Dt為日發芽種子數;Gt為與Dt相應的每天的發芽種子數。
活力指數(vigor index,VI)=GI×第7天正常幼苗平均鮮重[13]
式中:幼苗鮮重為稱取5株幼苗的重量。
1.2.2 生長指標的測定 直接用尺子測量各處理下藜麥幼苗的株高和主根長,莖粗以植株與土面的交界處地上莖直徑代表,用游標卡尺測量。每處理取樣5株,取其平均值。
1.2.3 生理指標測定 葉片含水量采用稱重法[14];葉綠素含量采用乙醇提取法[15];脯氨酸(Pro)含量采用水合茚三酮法[15];可溶性糖含量采用蒽酮比色法[15];MDA含量采用硫代巴比妥酸法[15];超氧陰離子產生速率采用王愛國等[16]的方法;相對電導率采用電解質外滲法[15];超氧化物歧化酶(SOD)活性采用Giannopolitis等[17]的方法;過氧化物酶(POD)活性采用Shi等[18]的方法;過氧化氫酶(CAT)活性采用Aebi[19]的方法。
1.3 數據分析
采用Office 2010軟件對數據進行處理和繪圖,數據用“平均值±標準誤”表示,采用SPSS 17.0統計分析軟件對數據進行差異顯著性檢驗,取P<0.05為顯著相關,各項指標測定重復3次。
2 結果與分析
2.1 不同濃度NaCl處理對藜麥種子萌發的影響
發芽率是衡量種子質量好壞的重要指標。隨著NaCl濃度的升高,藜麥種子的發芽率、發芽勢、發芽指數和活力指數均呈現逐漸下降的趨勢,各處理間變化差異顯著(P<0.05)(表1)。當NaCl濃度升高到1.8%時,藜麥種子發芽率雖有顯著降低,但發芽個數仍達到供試種子的一半以上,當NaCl濃度增加到2.4%時,藜麥種子的發芽率、發芽勢、發芽指數和活力指數顯著降低,僅為5.36%、0.00%、0.82和0.01。當NaCl濃度為3.0%時,種子幾乎不發芽。由此說明,鹽濃度1.8%是藜麥種子萌發的耐鹽閾值,高濃度的NaCl處理抑制種子萌發。
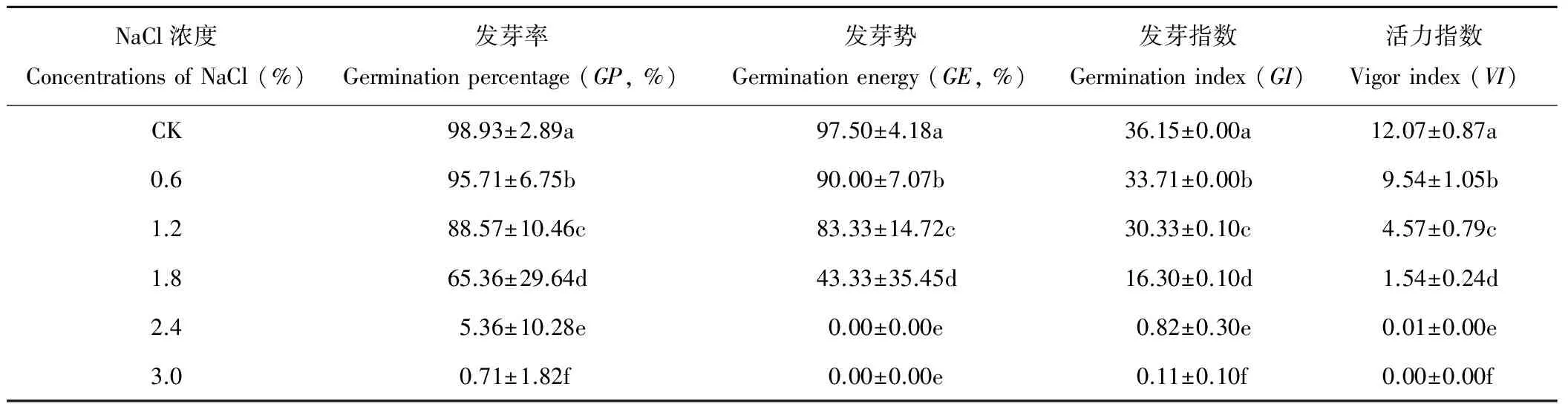
表1 不同濃度NaCl處理對藜麥種子萌發的影響
注:同列不同小寫字母表示差異顯著(P<0.05),下同。
Note:The different lowercase letters in the same column indicate significant differences (P<0.05), the same below.
2.2 不同濃度NaCl處理對藜麥幼苗葉片含水量及葉綠素含量的影響
由圖1可知,藜麥葉片含水量隨著NaCl濃度的升高呈現下降的趨勢,其中對照(CK)的葉片含水量顯著高于鹽脅迫處理,當NaCl濃度為3.0%時,藜麥幼苗葉片含水量由CK的90.34%下降為86.67%(圖1A)。葉綠素含量隨著NaCl濃度的升高呈先升高后下降的趨勢,其中1.2%處理下的葉綠素含量達到最大值,較CK增加了27.96%(圖1B)。
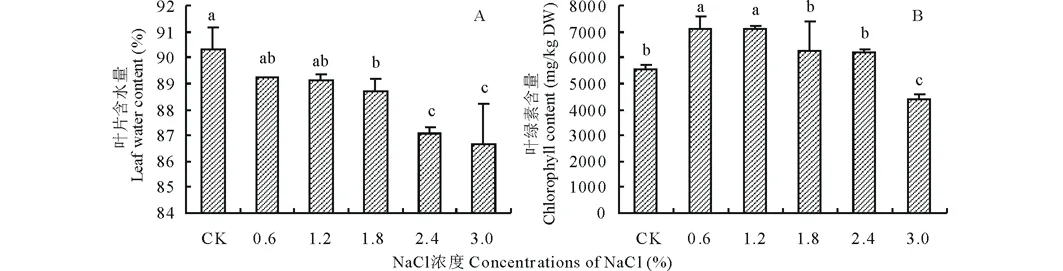
圖1 不同濃度NaCl處理對藜麥幼苗葉片含水量及葉綠素含量的影響Fig.1 Effect of different concentrations of NaCl on leaf water and chlorophyll contents of C. quinoa seedlings 不同小寫字母表示差異顯著(P<0.05),下同。The different lowercase letters indicate significant differences (P<0.05), the same below.
2.3 不同濃度NaCl處理對藜麥幼苗葉片滲透調節物質含量的影響
隨著NaCl濃度的升高,藜麥幼苗葉片可溶性糖和脯氨酸含量整體均呈現逐漸升高的變化趨勢(圖2),在3.0%NaCl濃度處理下達到最大值,其中可溶性糖含量較CK處理增加了31.2%。脯氨酸含量在0~1.8%NaCl濃度處理下差異不顯著,升高趨勢緩慢,在NaCl濃度為2.4%和3.0%時,脯氨酸含量急劇上升,分別是CK處理下的3.5和6.8倍。
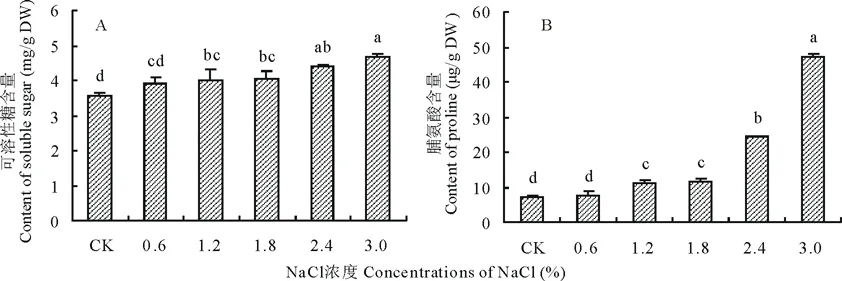
圖2 不同濃度NaCl處理對藜麥幼苗葉片可溶性糖和脯氨酸含量的影響Fig.2 Effects of different concentrations of NaCl on soluble sugar and proline contents of C. quinoa seedlings
2.4 不同濃度NaCl處理對藜麥幼苗葉片活性氧含量的影響
隨NaCl濃度升高,藜麥幼苗葉片丙二醛含量、相對電導率以及超氧陰離子產生速率均呈現升高的變化趨勢(圖3)。當鹽濃度≤1.2%時,葉片丙二醛含量和相對電導率升高緩慢,在3.0%NaCl濃度下,丙二醛含量較CK處理下增加了478.31%,相對電導率較CK處理下增加了515.9%,O2-·產生速率較CK處理下增加了93.5%。
2.5 不同濃度NaCl處理對藜麥幼苗葉片抗氧化酶活性的影響
植物在受到外界脅迫時,體內細胞代謝的動態平衡會被打破,引起代謝紊亂,此時植物自身會啟動由SOD、POD、CAT等組成的抗氧化酶促系統,來維持植株的正常生理功能。隨著NaCl濃度的升高,藜麥幼苗葉片中抗氧化酶活性均呈先升高后降低的趨勢,各處理間差異顯著(P<0.05)(圖4)。在0.6%~1.8%鹽濃度范圍內藜麥幼苗葉片中SOD、POD以及CAT活性均顯著高于CK(P<0.05),在1.8%NaCl濃度處理下較CK處理分別高出42.6%、110.7%和50.0%。在2.4%和3.0%NaCl濃度處理下SOD和CAT活性均顯著低于CK。
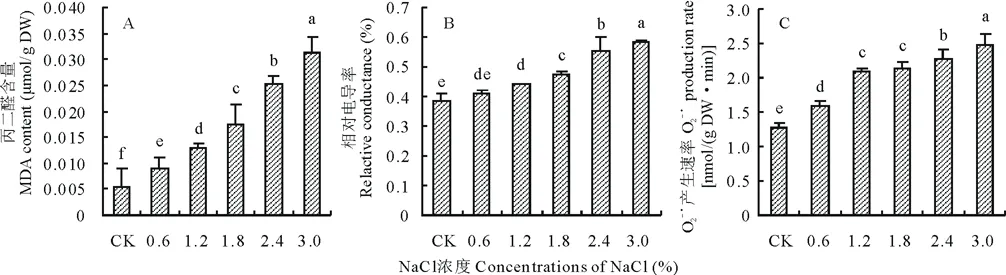
圖3 不同濃度NaCl處理對藜麥幼苗葉片丙二醛含量、相對電導率及O2-·產生速率的影響Fig.3 Effects of different concentrations of NaCl on MDA content, relative conductance and O2-·production rate of C. quinoa seedlings
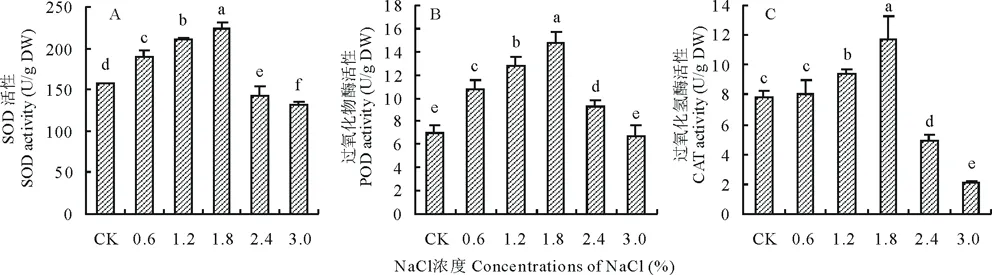
圖4 不同濃度NaCl處理對藜麥幼苗葉片SOD、POD和CAT活性的影響Fig.4 Effects of different concentrations of NaCl on activities of SOD, POD and CAT of C. quinoa seedlings
2.6 不同濃度NaCl處理對藜麥幼苗生長發育的影響
藜麥在NaCl脅迫下生長受到抑制,不同NaCl濃度處理對藜麥幼苗地上和地下生物量的影響不同。由表2可知,隨著NaCl濃度的升高,藜麥的株高和莖粗呈現逐漸降低的變化趨勢,而根長、地上部鮮干比以及地下部鮮干比均呈現先升高后降低的變化趨勢,各處理間差異顯著(P<0.05),在1.8%NaCl濃度處理下達到最大值,藜麥根長、地上部鮮干比和地下部鮮干比分別比CK增加了126.8%、26.4%和40.7%。
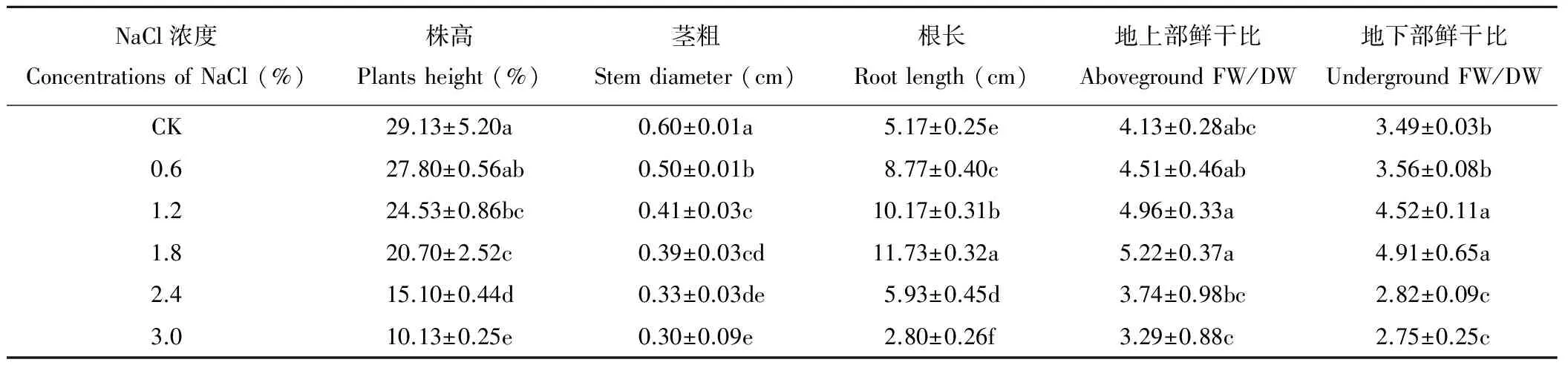
表2 不同濃度NaCl處理對藜麥幼苗生長發育的影響
FW: Fresh weight; DW: Dry weight.
3 討論
鹽分類型及濃度直接影響種子萌發質量,表現為降低種子的發芽率,推遲種子的初始萌發時間、延長種子的萌發時間等[20-22]。Waisel[23]認為鹽生植物在鹽脅迫時種子發生休眠,高鹽濃度脅迫時不萌發或延緩萌發,從而避免植株受高濃度的鹽害。本試驗結果表明隨著NaCl濃度的升高,藜麥種子的發芽率,發芽勢,發芽指數以及活力指數均顯著降低,當鹽濃度達到1.8%時,其發芽率仍保持在50%以上,而當濃度達到2.4%時藜麥種子的發芽率降為5.36%,當濃度達到3.0%時藜麥種子幾乎不萌發,說明藜麥種子萌發的耐鹽閾值為1.8%。
形態變化是植物遭受逆境脅迫時最直接的反映。研究表明鹽脅迫下由于植物碳同化量減少,滲透調節能耗和維持生長能耗增加等原因,常導致植株生長量減少[24-25]。本試驗中,鹽脅迫下藜麥的株高、莖粗均有不同程度降低,而根長隨著NaCl濃度的增加呈先升高后降低的趨勢。這與 Jaleel等[26]的報道一致。這可能是藜麥幼苗對低濃度NaCl 脅迫的一種應激反應,通過促進根的生長以增強根系吸收水的面積,從而抵抗高鹽濃度引起的滲透脅迫[27],但是關于它發生的機制還需進一步研究,而地上部分生長均受NaCl脅迫所抑制。葉綠素是植物進行光合作用所必需的,植物在受到鹽脅迫時會積累光合色素,有利于植株在鹽脅迫下維持正常的光合作用,從而增強植株對鹽脅迫的耐受能力[28]。本試驗結果表明藜麥幼苗葉片葉綠素含量在0.6%~1.2%NaCl濃度下顯著升高,之后隨著NaCl濃度的升高,葉綠素含量急劇下降,說明低鹽濃度處理可促進藜麥幼苗生長,這與對超大甜椒種子的研究結果相近[29]。
可溶性糖和脯氨酸作為滲透調節物質在植物適應鹽分環境中發揮著重要作用,能夠提高細胞的滲透調節能力,降低因滲透失水而造成的細胞膜、酶及蛋白質結構與功能的損傷[30]。本研究發現隨著NaCl濃度的升高,藜麥幼苗葉片可溶性糖和脯氨酸含量均顯著升高,造成這一結果可能是由于鹽脅迫導致藜麥幼苗葉片細胞內外出現滲透不平衡,可溶性糖和脯氨酸含量大量增加,以提高植株吸水能力、抵御鹽脅迫造成的損傷。植物遭受鹽脅迫后體內活性氧產生和清除動態被破壞,活性氧水平上升導致MDA大量累積,造成膜脂過氧化作用,使膜蛋白受損,細胞結構損害[31]。本研究結果表明,當鹽濃度低于1.2%時,藜麥幼苗葉片MDA含量、相對電導率和超氧陰離子產生速率增加平緩,當鹽濃度高于1.8%時,藜麥幼苗葉片中上述各指標急劇增加,這與NaCl脅迫對茄子幼苗生理指標的影響[29]結果相近,表明NaCl脅迫破壞了藜麥幼苗葉片的質膜結構和功能,加劇了膜脂過氧化作用,細胞膜受到損傷。植物的保護酶體系可以清除體內累積的活性氧來緩解由鹽脅迫對植物造成的損傷,SOD作為膜保護的第一道防線,將毒性較強的O2-·轉化為毒性較輕的H2O2,最終由POD和CAT將H2O2歧化為H2O和O2[11]。本試驗結果表明,NaCl濃度在0.6%~1.8%時,藜麥幼苗葉片中SOD、POD和CAT活性顯著升高,說明低鹽脅迫下藜麥植株葉片能夠通過提高自身的 SOD 活性來清除過量積累的活性氧;當NaCl濃度在2.4%~3.0%時,藜麥植株葉片SOD和CAT活性顯著低于對照,說明過高的鹽濃度導致藜麥植株的抗氧化酶系統受損,清除活性氧能力下降,導致藜麥生長發育受阻,最終死亡。
References:
[1] Yang S H, Ji J, Wang G,etal. Effect of salt stress on the plant.Molecular Plant Breeding, 2006, 4(3): 139-142. 楊少輝, 季靜, 王罡, 等. 鹽脅迫對植物影響的研究進展. 分子植物育種, 2006, 4(3): 139-142.
[2] Lv J Y, Zhao H, Feng W J. Effect of NaCl stress on activity of protective enzyme and physiological characteristics in sweet sorghum.Agricultural Research in Arid Areas, 2008, 26(6): 133-137. 呂金印, 趙暉, 馮萬健. NaCl 脅迫對甜高粱幼苗保護酶活性等生理特性的影響. 干旱地區農業研究, 2008, 26(6): 133-137.
[3] Royar, Aliakbar E, Nagib A,etal. Proteome analysis of tobacco leaves under salt stress. Peptides, 2009, 30(9): 1651-1659.
[4] Zhou H T, Liu H, Yao Y,etal. Evaluation of agronomic and quality characters of quinoa cultivated in Zhangjiakou. Journal of Plant Genetic Resources, 2014, 15(1): 222-227. 周海濤, 劉浩, 么楊, 等. 藜麥在張家口地區試種的表現與評價. 植物遺傳資源學報, 2014, 15(1): 222-227.
[5] Tan B, Tan H Z, Liu M,etal. Making activated protein feed from starch Wastewater. Journal of the Chinese Cereals and Oils Association, 2010, (4): 100-107. 譚斌, 譚洪卓, 劉明, 等. 糧食(全谷物)的營養與健康. 中國糧油學報, 2010, (4): 100-107.
[6] Wang L M, Ma N, Li S,etal. Nutritional properties of quinoa and its application prospects. Science and Technology of Food Industry, 2014, (1): 381-389. 王黎明, 馬寧, 李頌, 等. 藜麥的營養價值及其應用前景.食品工業科技, 2014, (1): 381-389.
[7] Jacobsen S E, Quispe H. An alternative crop for saline soils in Ands[R]// Scientists and Farmer-Partners in Research for the 21st Century. CIP Program Report, 1999-2000: 403-408.
[8] Prado F E, Boero C, Gallardo M,etal. Effect of NaCl on germination, growth, and soluble sugar content inChenopodiumquinoaseeds. Botanical Bulletin of Academia Sinica, 2000, 41: 27-34.
[9] Wang C J, Zhao X W, Lu G Q,etal. A review of characteristics and utilization ofChenopodiumquinoa. Journal of Zhejiang Agricultural and Forestry University, 2014, 31(2): 296-301. 王晨靜, 趙習武, 陸國權, 等. 藜麥特性及開發利用研究進展. 浙江農林大學學報, 2014, 31(2): 296-301.
[10] Li B B, Wei X H, Xu Y. The causes ofGentianastramineaMaxim. seeds dormancy and the methods for its breaking. Acta Ecologica Sinica, 2013, 33(15): 4631-4638. 李兵兵, 魏小紅, 徐嚴. 麻花秦艽種子休眠機理及其破除方法. 生態學報, 2013, 33(15): 4631-4638.
[11] Liu W Y, Yang H W, Wei X H,etal. Effect of exogenous nitric oxide on seed germination, physiological characteristics and active oxygen metabolism ofMedicagotruncatulaunder NaCl stress. Acta Prataculturae Sinica, 2015, 24(2): 85-95. 劉文瑜, 楊宏偉, 魏小紅, 等. 外源NO調控鹽脅迫下蒺藜苜蓿種子萌發生理特性及抗氧化酶的研究. 草業學報, 2015, 24(2): 85-95.
[12] Zeng X L, Cao C Y, Gao F F,etal. Toxicological effects of Cd2+and Pb2+on the seed germination and seedling growth ofAstragalusadsurgens. Acta Prataculturae Sinica, 2008, 17(4): 71-77. 曾祥玲, 曹成有, 高菲菲, 等. 鎘、鉛對沙打旺種子萌發及早期生長發育的毒性效應. 草業學報, 2008, 17(4): 71-77.
[13] Jiang Y B, Zheng Q H, Wang C Z,etal. Effects of ultradrying storage on vigor and antioxidase activity ofCichoriunintybusseeds. Acta Prataculturae Sinica, 2009, 18(5): 93-97. 姜義寶, 鄭秋紅, 王成章, 等. 超干貯藏對菊苣種子活力與抗氧化性的影響. 草業學報, 2009, 18(5): 93-97.
[14] Guo Z P. Effects of Phosphorus and Potassium Fertilizers Influence Tuber Yield and Quality and Relevant Physiological Processes of Potatoes[D]. Wuhan: Huazhong Agricultural University, 2009. 郭志平. 施用磷鉀肥對馬鈴薯產量和品質及相關生理指標的影響[D]. 武漢: 華中農業大學, 2009.
[15] Li H S. The Experiment Principle and Technique on Plant Physiology and Biochemistry[M]. Beijing: Higher Education Press, 2000: 169-184. 李合生. 植物生理生化實驗原理與技術[M]. 北京: 高等教育出版社, 2000: 169-184.
[16] Wang A G, Luo G H. Quantitative relation between the of hydroxylamine and superoxide anion radicals in plants. Plant Physiology Communication, 1990, 26(2): 55-57. 王愛國, 羅廣華. 植物的超氧自由基與羥胺反應的定量關系. 植物生理學通訊, 1990, 26(2): 55-57.
[17] Giannopolitis C N, Ries S K. Purification and quantitative relationship with water-soluble protein in seedling. Plant Physiology, 1977, 59: 315-318.
[18] Shi J, Fu X Z, Peng T,etal. Spermine pretreatment confers dehydration tolerance of citrusinvitroplants via modulation of antioxidative capacity and stomatal response. Tree Physiology, 2010, 30(7): 914-922.
[19] Aebi H. Catalaseinvitro. Methods in Enzymology, 1984, 105: 121-126.
[20] Macke A J, Unger I A. The effect of salinity on germination and early growth ofPuccinellanuttalliana. Canadian Journal of Botany, 1971, 49: 515-520.
[21] Liu F Q, Liu J L, Zhu R F,etal. Physiological responses and tolerance of four oat varieties to salt stress. Acta Prataculturae Sinica, 2015, 24(1): 183-189. 劉鳳岐, 劉杰琳, 朱瑞芬, 等. 4種燕麥對NaCl脅迫的生理響應及耐鹽性評價. 草業學報, 2015, 24(1): 183-189.
[22] Wang F, Liu S Z, Liu Y J,etal. Response ofPiceamongolicaandPiceacrassifoliaseed germination and seedling growth to drought and salt stress. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(11): 2309-2316. 王飛, 劉世增, 劉有軍, 等. 沙地云杉和青海云杉種子萌發和幼苗生長對干旱鹽堿脅迫的響應. 西北植物學報, 2014, 34(11): 2309-2316.
[23] Waisel Y. Biology of Halophytes[M]. New York: Academic Press, 1972.
[24] Li Y, Zhang Y P, Sun M,etal. Research advance in the effects of salt stress on plant and the mechanism of plant resistance. Chinese Agricultural Science Bulletin, 2008, 24(1): 258-263. 李彥, 張英鵬, 孫明, 等. 鹽分脅迫對植物的影響及植物耐鹽機理研究進展. 中國農學通報, 2008, 24(1): 258-263.
[25] Duan J J, Zhang C, Zheng M M,etal. Evaluation for salt tolerance ofMarigoldcultivars. Journal of Nuclear Agricultural Sciences, 2015, 29(7): 1406-1418. 段九菊, 張超, 鄭梅梅, 等. 萬壽菊不同品種的耐鹽性綜合評價. 核農學報, 2015, 29(7): 1406-1418.
[26] Jaleel C A, Gopi R, Sanka R B,etal. Studies on germination, seedling vigour, lipid peroxidation and proline metabolism inCatharanthusroseusseedlings under salt stress. South African Journal of Botany, 2007, 73(2): 190-195.
[27] Song X L, Hou X L, Hu C M,etal. Seed germination and seedling growth of sweet pepper under NaCl stress. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(3): 569-575. 宋旭麗, 侯喜林, 胡春梅, 等. NaCl脅迫對超大甜椒種子萌發和幼苗生長的影響. 西北植物學報, 2011, 31(3): 569-575.
[28] Ding J, Huang Z, Zhang X X,etal. Physiological effects onBrassicanapusseedling under NaCl stress. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(11): 2270-2276. 丁娟, 黃鎮, 張學賢, 等. 甘藍型油菜苗期生長階段對NaCl脅迫的生理響應. 西北植物學報, 2014, 34(11): 2270-2276.
[29] Zhang L, Wang H, Xu Q,etal. Effects of NaCl stress on physiological indexes of eggplant seedlings. Journal of Anhui Agricultural University, 2014, 41(6): 965-970. 張玲, 王華, 徐強, 等. NaCl脅迫對茄子幼苗生理指標的影響. 安徽農業大學學報, 2014, 41(6): 965-970.
[30] Liu Y H, Wang X P, Zhang G X,etal. Study on selection of physiological indices for salt tolerance and comprehensive evaluation of cotton during seedling stage. Chinese Agricultural Science Bulletin, 2012, 28(6): 73-78. 劉雅輝, 王秀萍, 張國新, 等. 棉花苗期耐鹽生理指標的篩選及綜合評價. 中國農學通報, 2012, 28(6): 73-78.
[31] Wang Y X, Sun G R, Wang J B,etal. Relationships among MDA content, plasma membrane permeability and the chlorophyll fluorescence parameters ofPuccinelliatenuifloraseedlings under NaCl stress. Acta Ecologica Sinica, 2006, 26(1): 122-129. 汪月霞, 孫國榮, 王建波, 等. NaCl脅迫下星星草幼苗MDA含量與膜透性及葉綠素熒光參數之間的關系. 生態學報, 2006, 26(1): 122-129.
Seed germination and physiological characteristics ofChenopodiumquinoaunder salt stress
YANG Hong-Wei1,2, LIU Wen-Yu3, SHEN Bao-Yun4, LI Chao-Zhou1,2*
1.CollegeofLifeScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China; 2.GansuKeyLaboratoryofCropGenetics&GermplasmEnhancement,Lanzhou730070,China; 3.AnimalHusbandryPastureandAgricultureInstitute,GansuAcademyofAgricultureScience,Lanzhou730070,China; 4.JingtaiTiaoshanResearchInstituteofAgricultureandForestry,Baiyin730400,China
In this study, we evaluated the effects of different concentrations of NaCl on seed germination and seedling growth ofChenopodiumquinoa. Seeds and seedlings ofC.quinoawere exposed to different concentrations of NaCl, and seed germination, physiological indexes, and biochemical indexes were determined. The germination percentage, germination energy, germination index, and vigor index ofC.quinoaseeds decreased as the concentration of NaCl increased. When the concentration of NaCl was 3.0%, none of the quinoa seeds germinated. As the concentration of NaCl increased, the leaf water content decreased, the contents of soluble sugars, proline, malondialdehyde, relative conductance, and O2-·production rate increased, and the activities of superoxide dismutase, peroxidase, and catalase increased and then decreased. The plant height and stem diameter decreased as the NaCl concentration increased, but root lengths increased and then decreased. The longest root length was in the 1.8% NaCl treatment. In conclusion, seedling growth ofC.quinoawas promoted by low concentrations of NaCl, but inhibited by high concentrations of NaCl. The threshold of salt tolerance was 1.8% NaCl.
NaCl;Chenopodiumquinoa; seed germination; physiological characteristics
10.11686/cyxb2016394
http://cyxb.lzu.edu.cn
2016-10-31;改回日期:2017-01-10
國家科技支撐計劃項目(2012BAD06B03)和十三五馬鈴薯產業體系(CARS-10-02A,CARS-10-07B)資助。
楊宏偉(1992-),男,甘肅莊浪人,在讀碩士。E-mail:yiluxiangbei0676@163.com*通信作者Corresponding author. E-mail:licz@gsau.edu.cn
楊宏偉, 劉文瑜, 沈寶云, 李朝周. NaCl脅迫對藜麥種子萌發和幼苗生理特性的影響. 草業學報, 2017, 26(8): 146-153.
YANG Hong-Wei, LIU Wen-Yu, SHEN Bao-Yun, LI Chao-Zhou. Seed germination and physiological characteristics ofChenopodiumquinoaunder salt stress. Acta Prataculturae Sinica, 2017, 26(8): 146-153.

