仙靈骨葆膠囊上市后用藥安全性系統評價
章軼立+廖星+劉福梅+王桂倩+謝雁鳴
[摘要]系統評價仙靈骨葆膠囊上市后用藥安全性,計算機檢索Medline,EMbase,the Web of Science,Clinical Trials gov,the Cochrane Library,CNKI,VIP,WanFang Data,CBM。按納入、排出標準篩選文獻,依據國際公認的質量評價標準進行各類研究質量的評價,提取資料并進行分析。該研究最終納入156篇文獻,隨機對照試驗117篇,半隨機對照試驗11篇,非隨機對照試驗10篇,病例系列 11 篇,個案報告7篇,共分析167項研究。7 496例患者使用仙靈骨葆膠囊,累計發生不良反應共377例,嚴重不良反應4例,其中包含1例死亡病例,1例腦血管意外,1例皮膚過敏反應和1例胃腸道不適;輕度ADR中最常見為胃腸損害。該研究分析發現仙靈骨葆膠囊總體安全性可接受,雖系統分析了關于該藥安全性病例報告的直接證據,但缺少針對該藥上市后安全性的機制研究或前瞻性長期的臨床觀察性研究,因此關于其安全性研究還需進一步深入;同時仙靈骨葆膠囊在適應癥方面,臨床中存在超說明書使用范圍,因此需要相關部門盡快制定用藥規范,給臨床用藥提供更好的指導。
[關鍵詞]仙靈骨葆膠囊; 不良反應; 系統評價; 安全性
Systematic review on safety of Xianling Gubao capsule
ZHANG Yili, LIAO Xing, LIU Fumei, WANG Guiqian, XIE Yanming*
(Institute of Basic Research in Clinical Medicine, China Academy of Chinese Medical Sciences, Beijing 100700, China)
[Abstract]To systemically evaluate the safety of Xianling Gubao capsule after launching Computer retrieval of Medline, EMbase, the Web of Science, Clinical Trials gov, the Cochrane Library, CNKI, VIP, WanFang Data and CBM was conducted to collect information on all the research types of Xianling Gubao capsule The literature was screened according to inclusion and exclusion criteria, and the quality of the studies was assessed according to the internationally accepted quality evaluation standards for data extraction and analysis A total of 156 papers were included in this study, including 117 randomized control trials, 11 quasirandomized control trials, 10 nonrandomized control trials, 11 case report series, and 7 individual case reports; a total of 167 studies were analyzed Xianling Gubao capsules were used in 7 496 patients, with an accumulative 377 cases of adverse reactions (ADR) and 4 cases of severe adverse reactions, including 1 death, 1 cerebrovascular accident, 1 case of skin allergy reaction, and 1 case of gastrointestinal discomfort; gastrointestinal system damage was most common in mild ADRs In this study, we found that the overall safety of Xianling Gubao capsule was acceptable, but it lacked the mechanism study on the safety of the drug after marketing or the prospective longterm clinical observation study, so the further studies on the safety of drug use should be conducted Meanwhile, the application scope of Xianling Gubao capsules was beyond the manual, in urgent needs of the relevant departments to formulate norms and provide better guidance for clinical medication
[Key words]Xianling Gubao capsule; evidencebased medicine; systematic review; safety
仙靈骨葆膠囊是在苗族民間驗方的基礎上,采用現代科研手段研制成的新型民族藥。本方由著名骨傷科專家時光達教授對苗族驗方進行收集、整理和篩選,最終將淫羊藿、續斷、補骨脂、地黃、丹參、知母等9味中藥配伍而成,主要用于治療骨質疏松、骨折、骨關節炎、骨無菌性壞死等[1]。目前,由貴州同濟堂制藥有限公司獨家生產(國藥準字Z20025337)[2],并作為防治骨質疏松癥的首選藥物入選《國家基本藥物目錄》[3]。仙靈骨葆膠囊具有滋補肝腎、活血通絡、強筋壯骨等功效,主要活性成分包括淫羊藿苷、川續斷皂苷、補骨脂素[45]。現代藥理實驗證明,仙靈骨葆膠囊入血成分主要為淫羊藿、補骨脂、續斷和知母4味中藥,可能是該復方在體內發揮抗骨質疏松等藥效的物質基礎[6]。
2013年,國家藥品不良反應監測中心曾開展對仙靈骨葆膠囊的安全性評價,并要求企業修訂藥品說明書,提示肝損傷風險。此后,國家藥品不良反應監測中心持續、密切監測該品種[7]。2016年12月8日,國家食品藥品監督管理總局(CFDA)藥品不良反應信息通報發布《警惕仙靈骨葆膠囊引起的肝損傷風險》,提示廣大醫務人員、藥品生產企業和公眾了解該品種的安全性問題,指導臨床合理用藥,降低用藥風險[8]。目前,仙靈骨葆膠囊在治療絕經后骨質疏松癥、膝骨關節炎、骨質疏松性骨折、骨質疏松性疼痛方面,通過循證醫學研究,已確認其有效性和安全性[912],但此類評價側重于有效性,對安全性的評價尚不全面。本研究將系統收集有關仙靈骨葆膠囊用藥不良反應/事件的各類研究,對仙靈骨葆膠囊臨床使用的安全性進行全面評估,以期為今后相關臨床實踐指南的制定,以及該品種臨床安全用藥提供參考。
1資料與方法
11納入標準
111研究類型隨機對照試驗(randomized controlled trial,RCT)、非隨機對照試驗、隊列研究、病例對照、病例系列、病例報告。
112研究對象單獨或聯合服用仙靈骨葆膠囊的患者,無疾病診斷、病程、服藥時間限制,無性別、年齡、地域限制。
113結局指標ADR/AE或其他毒副作用。不良反應結局分級標準[13]:①導致死亡;②危及生命;③致癌、致畸、致出生缺陷;④導致顯著的或永久的人體傷殘或者器官功能損傷;⑤導致住院或住院時間延長;⑥導致其他重要醫學事件,如不進行治療可能出現上述所列情況,因使用藥品出現以上損害情景反應之一的稱為藥品嚴重不良反應。其他為輕度不良反應。同時對照現有最新說明書記載,如果說明書上無,則歸為新的不良反應。
12排除標準
重復文獻、重復發表或所用文獻有明顯數據重疊的文獻;文中未提及“不良反應”或“安全性”或“毒副作用”,且未報告不良反應;相關的橫斷面研究,如一些基于個別醫院的調研;無法提取數據的文獻。
13檢索方法
在the Cochrane Library (1993—2017年3月),PubMed(1997—2017年3月),EMbase (1974—2017年4月),the Web of Science (1997—2017年4月),Clinical trialsgov(2017年5月)數據庫中,分別以英文檢索詞"xianlinggubao","xian ling gu bao","xianlinggubao capsule"組合檢索。中文檢索以“仙靈骨葆”為檢索詞在題名或摘要中檢索:中國期刊全文數據庫CNKI(1979—2017年3月),中國生物醫學文獻數據庫CBM(1978—2017年3月),中文科技期刊全文數據庫VIP(1989—2017年3月),萬方數據庫(1998—2017年3月)。相關會議論文、學位論文均已檢索。
14文獻篩選與數據提取
141文獻篩選2名研究人員根據納入、排除標準篩選文獻,將題錄導入Note Express 31軟件,進行文獻查重、剔除,閱讀全文并篩選不符合的文獻最終匯總。當篩選不一致時由第3方定奪。
142數據提取在Excel中制定“文獻信息提取表”,2位研究者根據預先設計要求提取關于病人性別、年齡、樣本數、疾病診斷、干預措施、觀察的安全性結局指標等方面的數據。如遇分歧,交由第3位研究者核對。提取數據時特殊情況根據Cochrane手冊[14]處理,如:①3組對照試驗:2組未使用仙靈骨葆膠囊的試驗合在一起對比仙靈骨葆膠囊組;2組均使用仙靈骨葆膠囊的按病例系列提取。②隨機對照試驗:2組均使用仙靈骨葆膠囊降級為2個病例系列提取。
143納入研究偏倚風險評估隨機對照試驗采用Cochrane系統評價員手冊510的偏倚風險評估工具[15]進行質量評價,包括隨機分配系列的生成,分配隱藏,對病人、試驗人員實施盲法,對結局評估者實施盲法,結局數據不完整,選擇性報告,其他偏倚等7個條目,其他偏倚主要包括某些特定的情況下出現的特殊情況,有些主要在特定的試驗設計中出現(如交叉試驗中的后遺效應、整群隨機試驗招募偏倚);有些可在廣泛的試驗中找到,但只針對某些特殊情況(如試驗組和控制組干預措施混用造成的沾染,例如受試者共用他們的藥物);有些偏倚來源于特定的臨床環境。將納入RCTs分為3個質量等級:A級(低度偏倚),上述7條均滿足者;B級(中度偏倚),1條或多條部分滿足者;C級(高度偏倚),7條全部完全不滿足者;并使用Revma
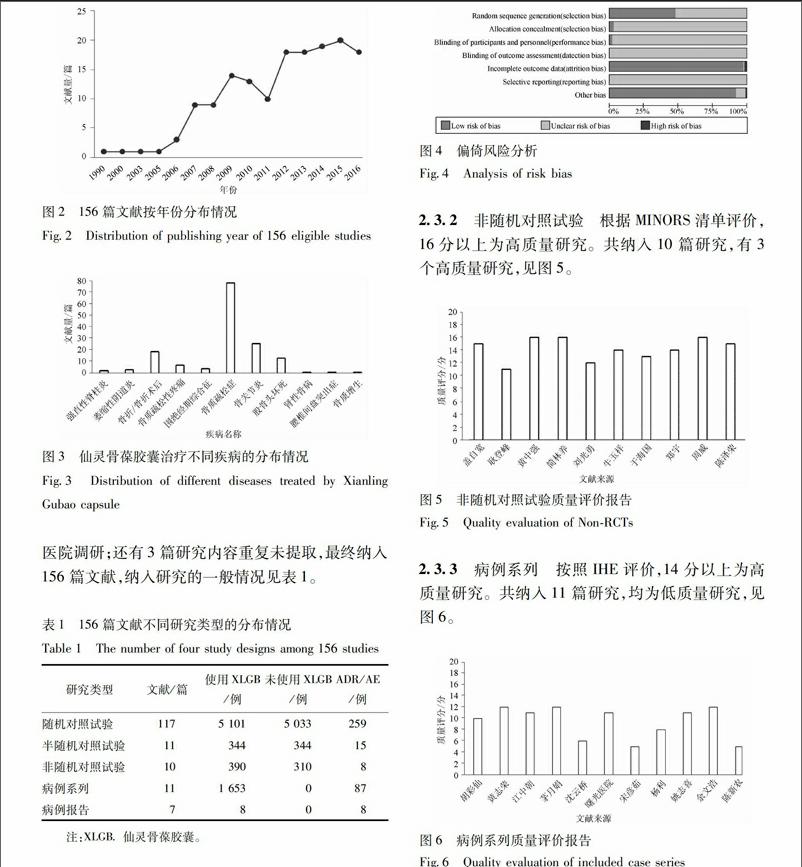
n 53軟件生成文獻質量評估圖。非隨機對照試驗采用MINORS清單[16]進行質量評價,評價指標共12條,每條記0~2分。前8條針對無對照組的研究,最高分為16分;后4條與前8條一起針對有對照組的研究,最高分共24分。0分表示未報道;1分表示報道了但信息不充分;2分表示報道了且提供了充分的信息。選擇總分≥13分的文獻作為治療性建議證據。觀察性研究如隊列、病例對照等依據STROBE[17]報告標準進行逐條對照評價。病例系列采用IHE[18]進行質量評價,主要包括20個條目,滿足14個條目以上即認為文獻質量較高。病例報告基于CARE[19]報告標準逐條對照評價,主要包括14個條目,對每個做出“是”、“否”、“不清楚”、“不適合”的判斷,滿足7條以上即認為文獻質量較高。
2結果
21文獻檢索
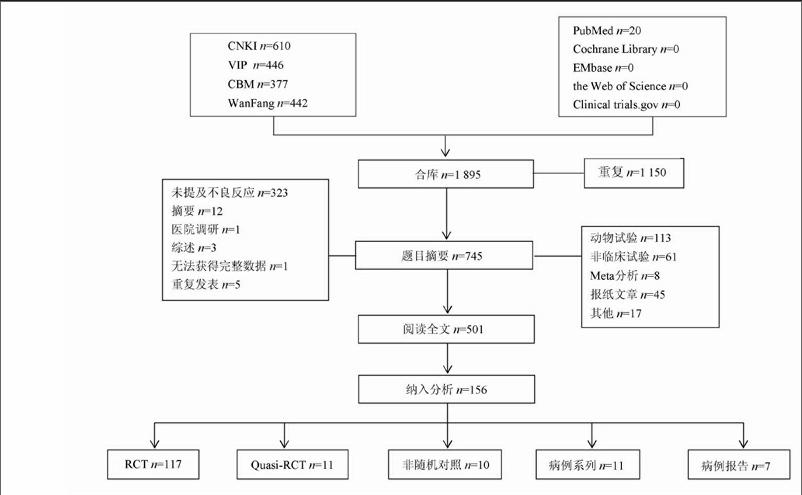
初始檢索相關文獻1 895篇,最終納入單獨或聯合使用仙靈骨葆膠囊,并且文獻中提及了ADR/AE的研究共156篇,具體流程見圖1,按年份檢索研究情況見圖2,按疾病檢索研究情況見圖3。由圖2可知,仙靈骨葆膠囊自2005 年后,隨著臨床用藥的普及,相關文獻研究報告逐年增多,2011年后增長尤其明顯。仙靈骨葆說明書明確規定該藥主要用于骨質疏松和骨質疏松癥、骨折、骨關節炎、骨無菌性壞死等疾病的治療,但據圖3可知,臨床存在嚴重超說明書用藥情況。
22納入研究的一般情況
4篇在研究目的或觀測指標中提及ADR/AE,但在結果中未進行描述,此類研究不做質量評價和信息提取;1篇文獻無法獲得完整數據;1篇文獻為
23方法學質量評價
231隨機對照試驗采用Cochrane系統評價員手冊510的偏倚風險評估工具進行質量評價,共納入117篇研究。方法學質量評估,偏倚風險分析結果見圖4。
研究中,2篇研究未明確提出使用劑量[2021],僅有1篇研究服藥頻次為每日1次[25],余下均為每日2次,均未超出說明書范圍;用藥方式均為口服;所有研究的仙靈骨葆膠囊廠家均為貴州同濟堂制藥有限公司,只有2項研究[20,23]說明了藥品批次;不良反應的出現時間跨度很大,1例[22]用藥后5 h就出現,1例[24]用藥后2個月后才出現;1例[20]出現嚴重不良反應,患者最終死亡;另有1例[22]出現皮膚丘疹等,2例[21,26]出現肝功能異常,3例[2325]出現胃腸道癥狀。所有研究均采用停藥、對癥處理等方法;最終癥狀都緩解或恢復正常。
243其他研究類型(RCTs、NonRCTs、病例系列)本系統評價納入的其他研究,已形成《仙靈骨葆安全性系統評價報告》,相關原始研究可見參考文獻[28176]。對部分研究數據處理:共納入149篇研究,其中117個RCTs研究中,8篇研究試驗組和對照組均使用仙靈骨葆膠囊[166173],將研究降級,數據拆分為16個病例系列。11個半隨機對照研究中,2篇研究試驗組和對照組均使用仙靈骨葆膠囊[174175],將研究降級數據拆分為4個病例系列。經過拆分和轉變后,最終得到159篇研究,包括109個RCTs,9個半隨機對照試驗,10個非隨機對照試驗,31個病例系列。根據《WHO藥品不良反應術語集》中累及的系統器官代碼檢索目錄分類[27]不良反應發生情況特點見表3。
不良事件中,1篇研究明確提及了116名患者出現23例AEs[92],其中包括7例肝功能異常、4例胃部不適,另有高血壓2例,以及血壓升高、頻繁室性早搏、雙側膝關節疼痛、右踝關節扭傷、子宮切除、肺癌切除、面部帶狀皰疹、頸部濕疹、便秘、胃酸反流各1例,其余研究均未明確提及AE發生情況。
不良反應中,鑒于原始研究中少有明確區分不良事件和不良反應,故本研究將所有未明確區分的ADR/AE,均算為ADR。共有3篇研究報告了ADR[50,68,113],但未進行具體有關ADR人數的統計;1篇研究報告了ADR人數但未說明組別[122],以上4篇研究不做分析。155篇研究共報告了369例ADRs,其中1例[32]嚴重不良反應,表現為腦血管意外。
3討論
31仙靈骨葆膠囊不良反應發生的影響因素探討
本研究共分析了156篇研究,共計167項研究,報告了377例ADRs,其中4例[20,22,24,32]為嚴重ADRs,其余均為輕度ADRs。4例嚴重ADRs中包含1例死亡病例,1例腦血管意外,1例為皮膚過敏反應和1例胃腸道不適;輕度ADR中最常見為胃腸系統損害。目前研究顯示產生ADR/AE可能與仙靈骨葆膠囊藥物成分、超說明書用藥(超適應癥、超劑量)、聯合用藥情況有關。
311藥物成分因素仙靈骨葆膠囊由黔嶺粗毛淫羊藿(以下簡稱淫羊藿)、補骨脂、川續斷等組成。其中淫羊藿與補骨脂同為溫補腎陽的中藥[177],是仙靈骨葆膠囊的主要成分。文獻報道[178],淫羊藿苷既是淫羊藿中的主要成分,也是淫羊藿藥理活性的代表化合物;補骨脂素與異補骨脂素亦是補骨脂中的主要活性成分,因此三者既是指標成分又是活性成分。根據現有檢索,本研究尚未發現有關仙靈骨葆膠囊發生ADR的人體機制研究。但動物實驗表明[179],補骨脂水提物中主要存在的補骨脂苷、異補骨脂苷、補骨脂素和異補骨脂素,可以導致大鼠肝損害,具有一定的肝毒性。
312用藥劑量和方式仙靈骨葆膠囊說明書中規定:“本品規格為05 g×1粒,口服,一次3粒,一日2次;4~6周為一療程;或遵醫囑”,即每日最大攝入藥量為3 g。目前所納入的研究均采用口服;4篇研究未提及用藥劑量[2021,125,168],25篇研究每日攝入藥量超過3 g,療程從4周~1年不等,在不符合說明書規定用藥劑量的研究中,共出現ADR/AEs 51例。目前,仙靈骨葆膠囊用藥劑量與用藥安全性的研究缺乏證據支持,故作為臨床工作者還應嚴格遵循說明書用藥,盡量避免ADR發生。
313聯合用藥仙靈骨葆膠囊說明書注意事項中指出“如與其他藥物同時使用可能會發生藥物相互作用”。本研究從統計數據看出,仙靈骨葆膠囊單用或聯合用藥時,發生ADR/AE情況基本持平(單用142例,聯合用藥139例)。仙靈骨葆膠囊屬于復方中成藥制劑,其有效成分的含量及性質較為復雜,尤其是口服中成藥本身的特點以及骨傷科中成藥的組方配伍特殊性決定了與其他藥物配伍時容易發生各種化學變化,臨床運用時須十分注意特殊人群的體質、用法用量、其他禁忌等[180181]。從本研究總結內容來看,仙靈骨葆聯合骨質疏松常規西藥(骨化三醇、鈣劑、阿侖膦酸鈉等)、中藥注射劑(骨瓜注射液)、溫陽活血類湯劑(加味陽和湯、二仙湯、補腎活血湯等)、常用骨傷科中成藥(骨舒康顆粒、復元膠囊、鹿角壯骨膠囊等)、針刺、穴位埋線等治療方法時,出現的ADR/AEs較多。因此,仙靈骨葆膠囊臨床使用應謹慎聯合用藥。如需聯合療法治療時,應基于中醫藥辨證施治、藥物配伍理論,謹慎考慮與仙靈骨葆膠囊的服藥間隔時間以及藥物相互作用等問題。
314適應癥情況納入分析的165篇研究,符合適應癥的研究有137篇。其中61篇研究,2 918例患者使用了仙靈骨葆膠囊,報告了249例ADRs/AEs,發生率約為853%;超出適應癥的研究有20篇,約占總研究數的12%。其中11篇研究,597例患者使用了仙靈骨葆膠囊,報告了51例ADRs/AEs,發生率為854%。本研究認為,超說明書適應癥的藥物治療需要高級別證據的支持,目前對于仙靈骨葆膠囊的基礎研究較多,臨床研究的數量近年雖有提升,但研究方法、報告質量仍有待進一步提高。通過加大對超說明書用法進行循證醫學確認,并取得國家藥監部門認可以確保臨床合理使用。同時建議相關部門應對超說明書用藥患者開展藥物檢測工作,對超說明書用藥療效進行認真分析,對超說明書導致的不良事件進行認真審查,查明導致不良事件發生的原因上報有關部門,發表相關報告研究,指導臨床醫生合理用藥。避免臨床醫生因不正確使用仙靈骨葆膠囊,直接導致ADR/AE的發生。
32對于ADR/AE的判斷
藥品不良反應(ADR)是指合格藥品在正常用法用量下出現的與用藥目的無關的有害反應[182]。藥品不良反應是藥品固有特性所引起的,任何藥品都有可能引起不良反應。藥品不良事件(AE)是指藥物治療過程中出現的不良臨床事件,不一定與該藥有因果關系。ADR是指因果關系已確定的反應,而AE是指因果關系尚未確定的反應。目前國內不良反應因果判斷標準主要有:衛生部藥物不良反應監察中心制定的藥品與不良反應因果關系判斷標準[183]、Naranjo提出的判定標準[184]。而本研究所納入的文獻所關注的ADR/AE均未按ADR/AE因果判斷標準進行評估;所納入的研究中,只有1篇研究報告了AE,其余均未提及AE發生情況。建議應在醫療一線的醫護人員中明確ADR/AE概念,大力支持醫護人員上報ADR/AE,同時醫護人員應嚴格執行ADR/AE判定相關標準,以便于相關人員研究與借鑒,更好地服務于臨床。
33研究局限性
本系統評價的報告盡可能參考Liliane Zorzela等[185]制定的最新安全性系統評價的報告規范,但由于沒有定量合成,所以有些條目并不完全適用。本研究對仙靈骨葆膠囊已發表的文獻進行充分的檢索,但納入文獻的方法學質量評價都較低,可能存在選擇性偏倚,且全部研究為中國內地研究;大部分研究只討論發生了不良反應,具體何種不良反應及詳細情況并未提及,給安全性評價帶了很多不便。同時本研究納入的原始研究中很大一部分為聯合其他藥物治療某種疾病,無法客觀正確地判斷發生的不良反應到底是有何種藥物引起。
通過本研究可清楚地認識到仙靈骨葆膠囊臨床用藥安全性尚可,但存在一些問題急需關注并解決。第一,仙靈骨葆膠囊存在較為嚴重的超說明書用藥情況,包括用藥劑量和適應癥兩方面,臨床醫生應嚴格遵守說明書用藥,同時需要有關部門進行規范管理或開展進一步研究拓寬該藥的適應癥及用藥范圍;第二,用藥說明書需進一步完善及補充關于配伍禁忌;第三,相關仙靈骨葆膠囊原始文獻用藥安全性的報告不夠不規范,對ADR與AE概念混淆不清,導致無法準確估計其發生率;第四,關于仙靈骨葆膠囊臨床質量普遍較低,有待未來各種類型的研究提高質量并進行規范報告。第五,由于本研究是基于文獻的二次研究,對于真實世界中該藥ADR/AE的發生情況,需要進行高質量的大樣本、前瞻性、多中心、長時間的監測研究,以確定仙靈骨葆膠囊的用藥安全性。
[參考文獻]
[1]戚新明,任進 兩種仙靈骨葆提取液對肝臟線粒體的作用[J] 中國藥物警戒,2016(4):201
[2]趙陽,魯俊山,馬勇 骨質疏松癥的中醫藥臨床治療研究[J]. 長春中醫藥大學學報,2012(1):96
[3]黃多臨 仙靈骨葆膠囊治療骨質疏松癥研究述評[J] 中醫學報,2013(2):285
[4]龔琴丹,陳宗良,陳桂茜 HPLC法測定仙靈骨葆膠囊中川續斷皂苷Ⅵ、補骨脂素及異補骨脂素[J] 中草藥,2016(16):2868
[5]伍慶,周寧,馮澤熹,等 HPLC測定仙靈骨葆膠囊中淫羊藿苷和淫羊藿定C含量[J] 中成藥,2009(8):1211
[6]秦子飛,姚志紅,戴毅,等 “仙靈骨葆”灌胃給藥大鼠后吸收入血成分的HPLCMS/MS分析[J] 分析測試學報,2013(4):420
[7]胡彩仙,程梅芬 仙靈骨葆膠囊治療骨質收松癥30例的臨床觀察[J] 中成藥,2000,22(3):246
[8]國家食品藥品監督管理總局警惕仙靈骨葆肝損傷風險[J]. 浙江中西醫結合雜志,2017(2):160
[9]薛小鑾,陳永法 芪骨膠囊與仙靈骨葆膠囊治療原發性骨質疏松癥的Meta分析[J] 中國藥物經濟學,2016(11):7
[10]孫麗,唐漢武 仙靈骨葆膠囊輔助治療骨質疏松性疼痛療效與安全性的Meta分析[J] 中國藥物警戒,2016(7):422
[11]黃冬,官堂明,馬曉鸝 仙靈骨葆膠囊對骨質疏松性骨折預后的Meta分析[J] 今日藥學,2015(10):694
[12]趙宜軍,胡晶,陳靜,等 仙靈骨葆膠囊治療絕經后骨質疏松的系統評價[J] 天津中醫藥,2010(4):279
[13]房書亭,翁維良 臨床中藥學[M] 鄭州:河南科學技術出版社,1998:1256
[14]陳洪 仙靈骨葆對骨密度作用的觀察[J] 貴陽中醫學院學報,1999(4):61
[15]Collaborationtc Cochrane handbook for systematic reviews of intervetion[M]. New Jersey:WileyBlackwell, 2005
[16]虞金龍 仙靈骨葆膠囊治療良性前列腺增生癥臨床觀察[J]. 中華現代臨床醫學雜志,2005,3(20):2156
[17]流行病學觀察性研究報告規范——STROBE聲明介紹[J] 第三軍醫大學學報,2014(13):1444
[18]Moga C, Guo B, Schopflocher D, et al Development of a quality appraisal tool for case series studies using a modified Delphi technique[M] Edmonton AB: Institute of Health Economics,2012
[19]Gagnier J J, Kienle G, Altman D G, et al The CARE guidelines: consensusbased clinical case report guideline development[J] J Clin Epidemiol,2014,67(1):46
[20]鄭明節,周耘,呂小琴 仙靈骨葆膠囊與雙氯芬酸鈉緩釋膠囊合用致肝衰竭1例[J] 中國藥物警戒,2014(8):507
[21]劉玉妮,韋文合 抗骨質疏松藥物致肝損害1例[J] 右江民族醫學院學報,2014(2):164
[22]劉彩虹,何勇 仙靈骨葆膠囊致全身皮疹[J] 藥物不良反應雜志,2013(5):297
[23]楊良芹,彭官良 仙靈骨葆膠囊致重度肝損害1例[J] 中國藥物警戒,2013(1):62
[24]趙曉衛,徐燦麗 仙靈骨葆膠囊與奧美拉唑聯用致肝損害及乙型肝炎再活動[J] 藥物不良反應雜志,2012(1):60
[25]裴冬萍,操銀針 仙靈骨葆膠囊致急性藥物性肝損傷1例[J] 肝臟,2009(6):457
[26]楊毅恒,周艷莉 仙靈骨葆膠囊致肝功能異常2例[J] 藥物不良反應雜志,2007(3):214
[27]WHO藥品不良反應術語集累及的系統器官代碼檢索[J] 中國藥物警戒,2009(1):63
[28]劉寶玉,白蓉 仙靈骨葆膠囊對中老年骨質疏松患者的臨床研究[J] 陜西中醫,2016(10):1364
[29]段小鋒,陳俊君 仙靈骨葆膠囊聯合地奧司明治療腰椎間盤突出癥的臨床研究[J] 現代藥物與臨床,2016(8):1236
[30]郭永賢,宋世江,喬培柳,等 高黏度骨水泥經皮椎體成形術聯合仙靈骨葆膠囊治療骨質疏松性椎體壓縮性骨折的臨床研究[J] 中國醫藥導報,2016(24):93
[31]趙子春,李凌偉 高壓氧治療聯合仙靈骨葆膠囊對老年股骨近端骨折延遲愈合患者的臨床療效[J] 中國生化藥物雜志,2016(6):133
[32]侯曉升,姜文曉,莊建 仙靈骨葆聯合阿侖膦酸鈉治療骨質疏松癥的臨床觀察[J] 中國藥房,2016(17):2391
[33]葉必宏 電熱針治療早中期膝關節骨性關節炎臨床療效觀察[D] 杭州:浙江中醫藥大學,2016
[34]蒙錫波 觀察仙靈骨葆膠囊治療老年骨質疏松胸腰壓縮性骨折20例的療效[J] 北方藥學,2016(11):78
[35]龍千里,姬芝栩,龍征忠,等 仙靈骨葆治療絕經后骨質疏松性Colles骨折的臨床觀察[J] 藥物評價研究,2016(2):254
[36]李偉舉 筋骨膠嚢對SOP患者血清OC及PINP水平影響的研究[D] 廣州:廣州中醫藥大學,2016
[37]朱曉波 仙靈骨葆膠囊聯合透明質酸對膝骨性關節炎患者血清炎癥因子水平的影響及療效觀察[J] 新中醫,2016(3):104
[38]董君博 骨肽片聯合仙靈骨葆膠囊對經傷椎置釘結合植骨治療骨質疏松性胸腰椎骨折術后恢復效果的影響[J] 中國藥房,2016(6):746
[39]樓小英 中西醫結合療法聯合康復護理干預脛腓骨骨干雙骨折臨床研究[J] 新中醫,2016(2):202
[40]符楚迪,張弢,董千峰 鈣爾奇D仙靈骨葆膠囊及阿侖膦酸鈉片三聯治療老年骨質疏松臨床療效與安全性分析[J] 浙江臨床醫學,2016,18(12):2193
[41]李紅 仙靈骨葆膠囊聯合骨化三醇治療絕經后骨質疏松癥30例[J] 河南中醫,2015(12):3000
[42]秦海云 仙靈骨葆膠囊促進全髖關節置換術患者康復60例[J] 中國藥業,2015(24):250
[43]莊至坤 壯骨通痹丸在肝腎虧虛型膝骨關節炎膝內翻微創截骨外固定術后的應用[D] 福州:福建中醫藥大學,2015
[44]王海燕,孫艷,陳立忠,等 加味舒筋壯骨湯治療絕經后骨質疏松癥療效評價[J] 創傷與急危重病醫學,2015(5):301
[45]孫艷,王海燕,陳立忠,等 疏筋壯骨湯治療絕經后骨質疏松癥[J] 長春中醫藥大學學報,2015(3):585
[46]曾文叢,何偉 仙靈骨葆膠囊聯合阿侖膦酸鈉片、鮭降鈣素對骨質疏松癥患者的治療作用[J] 上海醫藥,2015(17):27
[47]王小平,鄭小清,林羽慧,等 仙靈骨葆聯合獨一味治療骨關節炎的臨床療效觀察[J] 今日藥學,2015(7):532
[48]吳大華 仙靈骨葆膠囊聯合鹽酸氨基葡萄糖片治療膝骨性關節炎效果探究[J] 新中醫,2015(6):115
[49]劉銅龍,張鴿,畢煥杰,等 仙靈骨葆膠囊與利塞膦酸鈉用于老年腰椎手術后骨組織修復的臨床觀察[J] 中國藥房,2015(15):2062
[50]趙蒙軍 參威骨痹湯治療膝骨關節炎肝腎虧虛證臨床觀察[D] 昆明:云南中醫學院,2015

