茶樹WRKY轉(zhuǎn)錄因子基因CsWRKY57的克隆及表達(dá)分析
郭俊紅,王偉東,谷星,郭莎莎,高岳芳,楊亞軍,2,肖斌*
1. 西北農(nóng)林科技大學(xué)園藝學(xué)院,陜西 楊陵 712100;2. 中國農(nóng)業(yè)科學(xué)院茶葉研究所,浙江 杭州 310008
茶樹WRKY轉(zhuǎn)錄因子基因CsWRKY57的克隆及表達(dá)分析
郭俊紅1,王偉東1,谷星1,郭莎莎1,高岳芳1,楊亞軍1,2,肖斌1*
1. 西北農(nóng)林科技大學(xué)園藝學(xué)院,陜西 楊陵 712100;2. 中國農(nóng)業(yè)科學(xué)院茶葉研究所,浙江 杭州 310008
WRKY轉(zhuǎn)錄因子是植物特有的一類轉(zhuǎn)錄因子,在植物生長發(fā)育及脅迫應(yīng)答過程中均發(fā)揮重要的調(diào)控作用。為探究WRKY轉(zhuǎn)錄因子與茶樹抗旱及耐鹽性的關(guān)系,本研究基于茶樹轉(zhuǎn)錄組數(shù)據(jù)庫中的檢索結(jié)果,以陜茶1號(hào)1年生茶樹為試驗(yàn)材料,克隆獲得了1個(gè)WRKY轉(zhuǎn)錄因子基因,命名為CsWRKY57。生物信息學(xué)分析表明,CsWRKY57基因cDNA全長為1 222 bp,編碼303個(gè)氨基酸,預(yù)測(cè)分子量為33.5 kD,理論等電點(diǎn)為5.49;另外,蛋白比對(duì)分析顯示,CsWRKY57包含1個(gè)典型的WRKY核心序列和1個(gè)C2H2型鋅指結(jié)構(gòu),屬于WRKYIIc家族。實(shí)時(shí)熒光定量PCR分析結(jié)果顯示,CsWRKY57基因在高鹽、干旱、ABA脅迫下均被誘導(dǎo)表達(dá),且表現(xiàn)出先增加后降低的趨勢(shì),表明CsWRKY57基因參與了茶樹體內(nèi)干旱、高鹽和ABA的調(diào)控途徑。轉(zhuǎn)錄激活活性試驗(yàn)表明,CsWRKY57無轉(zhuǎn)錄激活活性,意味著CsWRKY57可能需要與其他元件結(jié)合才能啟動(dòng)基因的表達(dá)。
茶樹;CsWRKY57;克隆;表達(dá)分析
植物在生長發(fā)育過程中,經(jīng)常受到各種生物(如:蟲害、病原菌等)和非生物(如:干旱、鹽、高溫等)的脅迫,與之進(jìn)化形成的逆境脅迫響應(yīng)機(jī)制是植物產(chǎn)生適應(yīng)性和抗逆性的關(guān)鍵,而轉(zhuǎn)錄因子調(diào)控是其主要方式之一。其中,WRKY轉(zhuǎn)錄因子作為植物特有的一類轉(zhuǎn)錄因子家族,在植物響應(yīng)逆境脅迫過程中發(fā)揮重要作用。最早,WRKY轉(zhuǎn)錄因子從甜土豆中被克隆[1],具有一段約 60個(gè)氨基酸組成的高度保守結(jié)構(gòu)域,因其N端含有WRKY結(jié)構(gòu)域的核心序列,C端含有C2H2或C2HC型鋅指結(jié)構(gòu)而得名。隨著現(xiàn)代分子生物學(xué)技術(shù)的發(fā)展,越來越多的WRKY轉(zhuǎn)錄因子被鑒定,它們廣泛參與了植物的生長發(fā)育、形態(tài)建成、生物調(diào)控途徑,如AtWRKY71/EXB1通過調(diào)控RAX1、RAX2、RAX3基因的表達(dá),在擬南芥?zhèn)戎π纬蛇^程中發(fā)揮重要作用[2];OsWRKY6通過調(diào)控OsICS1基因的表達(dá),增加水稻體內(nèi)SA的含量[3]。另外,有研究報(bào)道 VqWRKY52可以提高擬南芥抵抗白粉病的能力[4];OsWRKY4通過JA/ET信號(hào)調(diào)節(jié)途徑控制一些與水稻紋枯病相關(guān)基因的表達(dá),增強(qiáng)水稻對(duì)紋枯病的抵抗能力[5]。近年來,關(guān)于 WRKY轉(zhuǎn)錄因子參與植物非生物脅迫的研究已有報(bào)道,例如,Raineri等[6]通過研究水稻 OsWRKY47的突變體和 OsWRKY47過表達(dá)植株,發(fā)現(xiàn)OsWRKY47能夠增加水稻的抗旱性;He等[7]研究發(fā)現(xiàn)小麥TaWRKY33基因參與小麥高溫、低溫、ABA和MeJA脅迫的調(diào)控途徑;Jaffar等[8]的研究則證實(shí)菊花 CmWRKY10基因通過調(diào)控與干旱脅迫相關(guān)的一些基因的表達(dá)參與菊花干旱脅迫途徑的調(diào)控。最近,有研究顯示W(wǎng)RKY57轉(zhuǎn)錄因子參與了植物對(duì)生物和非生物脅迫的響應(yīng)過程。如擬南芥中 AtWRKY57基因依靠JA信號(hào)調(diào)節(jié)途徑降低對(duì)灰霉菌的抗性[9];同時(shí),AtWRKY57基因功能缺失,可加速JA誘導(dǎo)的葉片衰老,表明AtWRKY57基因在葉片衰老過程中起負(fù)調(diào)控作用[10]。另外,有研究表明 AtWRKY57也參與了干旱脅迫調(diào)控途徑,AtWRKY57通過提高ABA的含量增加擬南芥的抗旱性[11];而Jiang等[12]的研究進(jìn)一步證實(shí)AtWRKY57通過降低失水率、增加脯氨酸含量等使水稻 AtWRKY57的過表達(dá)植株抗旱性增加。然而,其它物種中關(guān)于WRKY57轉(zhuǎn)錄因子的功能研究,尤其是在干旱和高鹽脅迫下的分子調(diào)控機(jī)制尚未見報(bào)道。
茶樹[Camellia sinensis (L.) O. Kuntze]在其生長發(fā)育過程中,容易遭受干旱和鹽脅迫,從而導(dǎo)致茶葉產(chǎn)量和品質(zhì)降低,進(jìn)而造成嚴(yán)重的經(jīng)濟(jì)損失[13]。因此,明確茶樹脅迫響應(yīng)的分子調(diào)控機(jī)制,發(fā)掘茶樹的抗性基因,對(duì)培育茶樹抗逆新品種具有重要意義。本研究基于茶樹轉(zhuǎn)錄組數(shù)據(jù)庫中檢索到的基因序列,以陜茶1號(hào)品種茶樹葉片cDNA為模板,克隆獲得了茶樹轉(zhuǎn)錄因子編碼基因 CsWRKY57的 cDNA全長,并初步分析了該基因的結(jié)構(gòu)、進(jìn)化關(guān)系及其在不同處理下的差異表達(dá)情況,驗(yàn)證了其編碼蛋白的轉(zhuǎn)錄活性,以期為深入研究該基因在茶樹逆境響應(yīng)過程中的分子生物學(xué)功能提供理論參考。
1 材料與方法
1.1 植物材料與處理
試驗(yàn)材料為1年生陜茶1號(hào)品種茶樹水培茶苗,預(yù)培養(yǎng)于西北農(nóng)林科技大學(xué)科研溫室(晝夜溫度25℃/17℃,光周期14 h/10 h,相對(duì)濕度65%~75%)。選取生長健壯、無病原菌侵染、長勢(shì)一致的水培茶苗同時(shí)進(jìn)行干旱(20% PEG 6000)、高鹽(300 mmol?L-1NaCl)和外源脫落酸(100 μmol?L-1ABA)處理,分別在處理后 0、1、2、4、8、12、24、48 h剪取茶苗幼嫩的葉片,液氮速凍,存于-80℃冰箱,備用。
1.2 總RNA的提取及cDNA第1鏈的合成
茶樹葉片總RNA的提取采用CTAB法[14]提取,利用 5×All-In-One RT MasterMix(abm,加拿大),將提取的總RNA反轉(zhuǎn)錄成cDNA。
1.3 茶樹CsWRKY57基因的克隆
根據(jù)在茶樹轉(zhuǎn)錄組數(shù)據(jù)庫中檢索到的基因序列,分別設(shè)計(jì) PCR上下游引物CsWRKY57 F和CsWRKY57 R(表1),以陜茶1號(hào)葉片的cDNA為模板,進(jìn)行PCR擴(kuò)增,PCR 反應(yīng)程序?yàn)?94℃ 5 min;94℃ 30 s,56℃30 s,72℃ 2 min,35個(gè)循環(huán),最后72℃延伸7 min。PCR擴(kuò)增產(chǎn)物經(jīng)1.0%的瓊脂糖凝膠電泳檢測(cè)后,按照Gel Extraction Kit(OMEGA,美國)說明書回收目的片段,連接到PGEM-T-Easy Vector(Promega,美國)(4℃,過夜)并轉(zhuǎn)化至大腸桿菌菌株DH5α,選取陽性克隆送北京奧科鼎盛生物科技有限公司測(cè)序。
1.4CsWRKY57生物信息學(xué)分析
利用NCBI完成CsWRKY57的ORF查找和氨基酸序列的推導(dǎo);用ProtParam tool完成蛋白分子量和理論等電點(diǎn)的分析;用MEGA7.0軟件中的最大似然法(Maximum Likelihood Tree)構(gòu)建系統(tǒng)進(jìn)化樹;用DNAMAN8.0完成多序列氨基酸的比對(duì);用NetPhos 2.0 Server完成蛋白磷酸化位點(diǎn)預(yù)測(cè);用 ProtScale Sever完成蛋白疏水性分析;用TMHMM Server完成蛋白跨膜區(qū)預(yù)測(cè)。

表1 引物序列Table 1 Primer sequences
1.5CsWRKY57實(shí)時(shí)熒光定量PCR分析
1.6 CsWRKY57轉(zhuǎn)錄激活活性驗(yàn)證
根據(jù)基因全長的 ORF序列以及酵母表達(dá)載體pGBKT7序列,設(shè)計(jì)帶有酶切位點(diǎn)SmaI和 SalI的上、下游引物 jCsWRKY57 F和jCsWRKY57 R,以pGEM-T/CsWRKY57質(zhì)粒為模板進(jìn)行PCR擴(kuò)增,將CsWRKY57基因克隆至酵母表達(dá)載體pGBKT7上。以pCL1載體為陽性對(duì)照,pGBKT7載體為陰性對(duì)照,將CsWRKY57/pGBKT7、pGBKT7和 pCL1質(zhì)粒分別轉(zhuǎn)化至MATa型Y2H酵母感受態(tài)中,將CsWRKY57/pGBKT7和 pGBKT7涂抹在SD/-Trp,pCL1涂抹在 SD/-Leu培養(yǎng)基上,30℃倒置培養(yǎng) 3 d,然后把長出的酵母菌落轉(zhuǎn)到SD/-His-Ade上進(jìn)行篩選,并用 X-α-Gal驗(yàn)證激活活性。
1.7 數(shù)據(jù)統(tǒng)計(jì)與分析
使用SPSS20.0對(duì)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)處理,采用Duncan’s新復(fù)極差法進(jìn)行分析。
2 結(jié)果與分析
2.1 CsWRKY57基因克隆與序列分析
以陜茶 1號(hào)葉片 cDNA為模板,用CsWRKY57 F和CsWRKY57 R引物經(jīng)PCR擴(kuò)增得全長 1 222 bp的cDNA序列(圖 1-A),其中包含912 bp完整的ORF,編碼303個(gè)氨基酸,預(yù)測(cè)分子量為 33.5 kD,理論等電點(diǎn)為5.49。利用NCBI分析獲得的氨基酸序列的結(jié)構(gòu)域,在NCBI里經(jīng)ORF Finder查找該序列的ORF,并經(jīng)BlastX比對(duì)發(fā)現(xiàn),該序列ORF完整,并與檢索得到的結(jié)果一致(圖1-B)。
2.2 茶樹CsWRKY57蛋白的生物信息學(xué)分析
2.2.1 CsWRKY57蛋白系統(tǒng)進(jìn)化樹分析和多序列比對(duì)
選擇14個(gè)與CsWRKY57同源性較高的蛋白序列,利用MEGA7.0軟件,采用最大似然法(Maximum Likelihood)構(gòu)建系統(tǒng)發(fā)育樹。由圖 2-A可知,茶樹 CsWRKY57與煙草NaWRKY57和番茄 SlWRKY57親緣關(guān)系最近。根據(jù)系統(tǒng)進(jìn)化樹的分析結(jié)果,從中選出部分蛋白的氨基酸序列,進(jìn)行多序列比對(duì)(圖2-B),結(jié)果表明,在保守氨基酸序列之間,N端均含有1個(gè)典型的WRKYGQK核心序列,C端均含有1個(gè)Cx4Cx23HxH型鋅指結(jié)構(gòu),表明CsWRKY57屬于WRKYIIc家族。
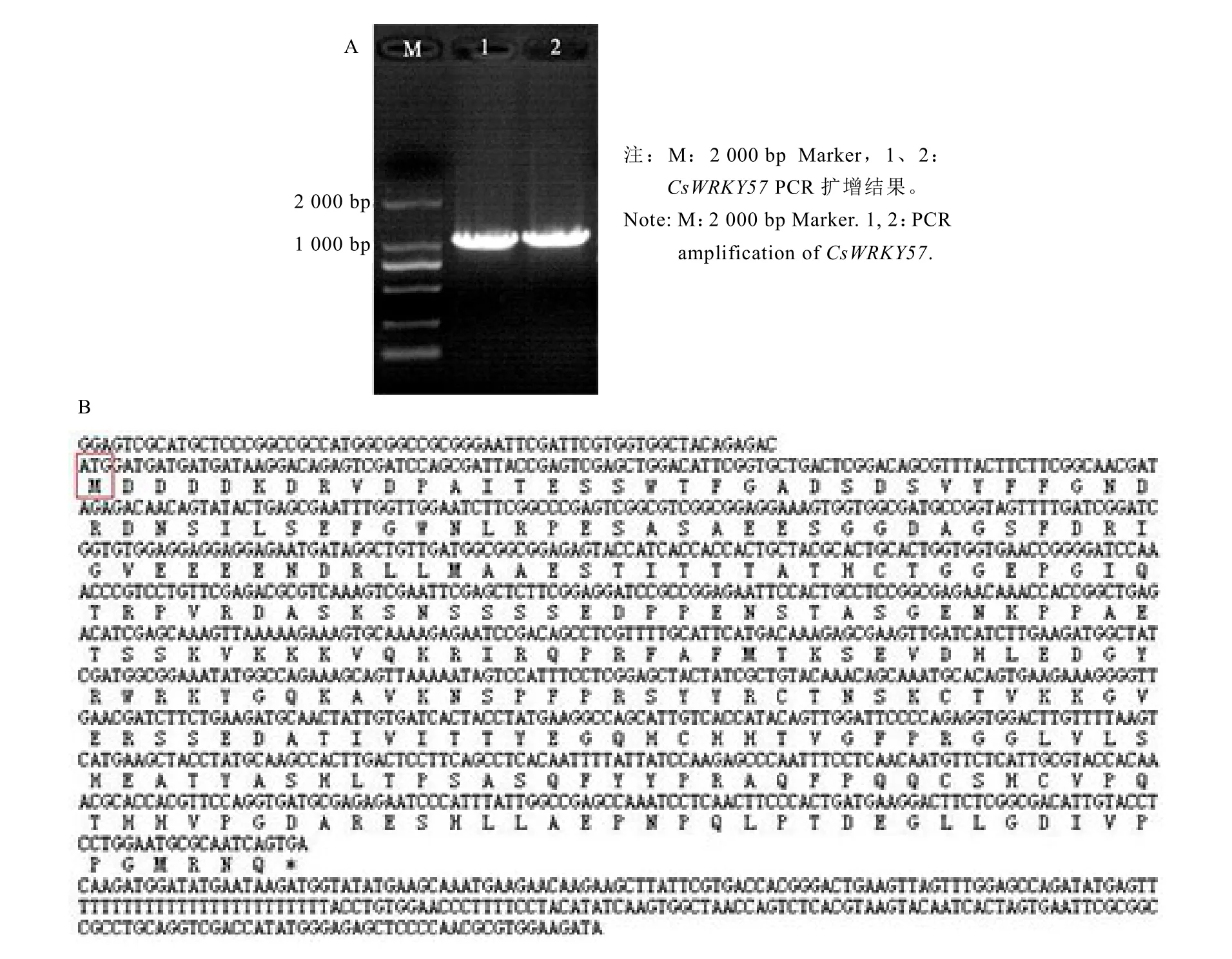
圖1 茶樹CsWRKY57基因的PCR擴(kuò)增和氨基酸序列分析Fig. 1 PCR amplification and amino acid sequence analysis of CsWRKY57 in tea plant

圖2 CsWRKY57系統(tǒng)進(jìn)化樹分析和同源氨基酸序列比對(duì)Fig. 2 Phylogenetic relationship and alignments of homologous amino acid sequences of CsWRKY57
2.2.2 CsWRKY57蛋白磷酸化位點(diǎn)預(yù)測(cè)
用 NetPhos 2.0 Serve預(yù)測(cè)蛋白的磷酸化位點(diǎn),結(jié)果顯示,CsWRKY57含有絲氨酸、蘇氨酸和酪氨酸共42個(gè)磷酸化位點(diǎn),其中以絲氨酸位點(diǎn)最多,有26個(gè),蘇氨酸和酪氨酸位點(diǎn)分別有 13個(gè)和 3個(gè)(圖 3),由此推測(cè)CsWRKY57蛋白的活性可能受到磷酸化作用的調(diào)控。
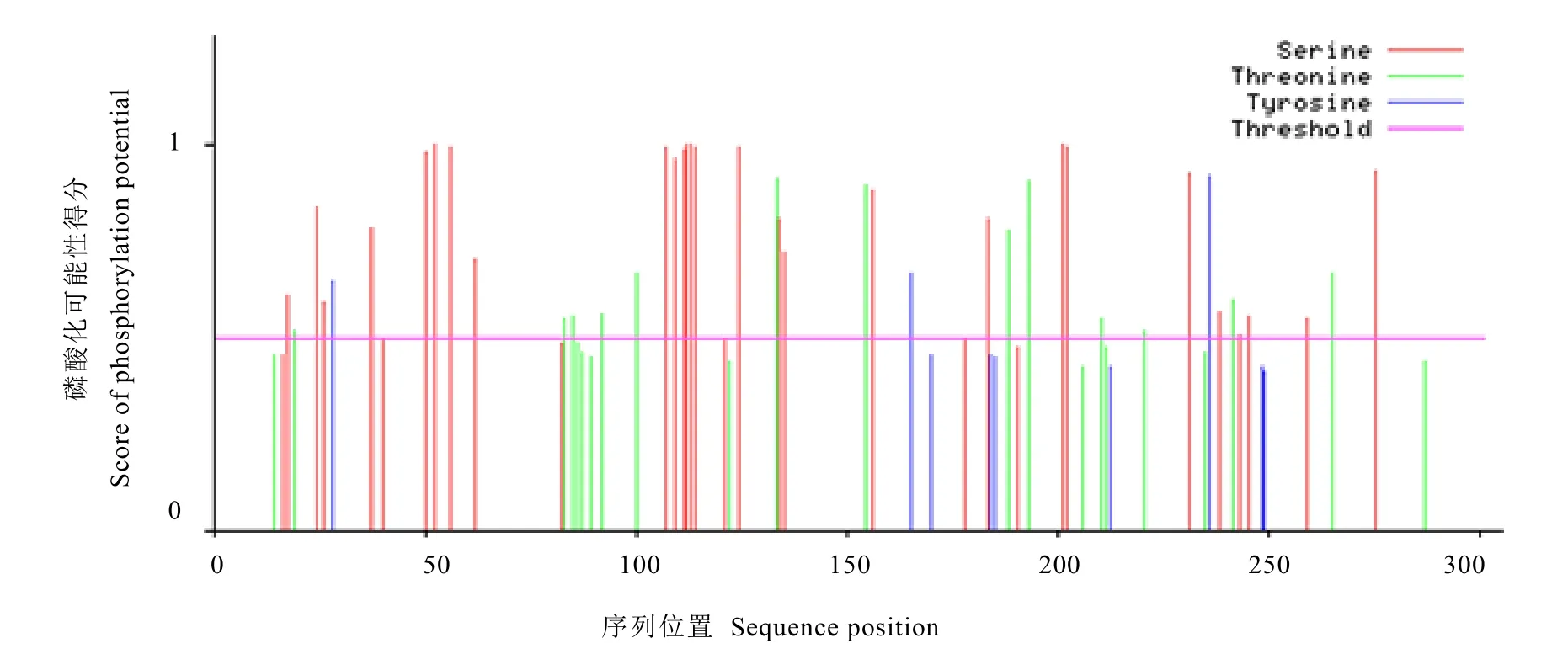
圖3 CsWRKY57磷酸化位點(diǎn)預(yù)測(cè)Fig. 3 Phosphorylation site prediction of CsWRKY57
2.2.3 CsWRKY57蛋白親水/疏水性預(yù)測(cè)
利用 ProtScale Sever在線分析軟件中的Hyhob/Kyte & Doolittle法預(yù)測(cè)該蛋白的親水性和疏水性,預(yù)測(cè)結(jié)果顯示(圖 4-A),最大正值為1.400,最小負(fù)值為-2.800,總平均親水性為-0.894,表明該蛋白屬于親水性蛋白。
2.2.4 CsWRKY57蛋白跨膜結(jié)構(gòu)域預(yù)測(cè)
利用在線軟件 TMPRED對(duì) CsWRKY57編碼的蛋白進(jìn)行跨膜區(qū)預(yù)測(cè),預(yù)測(cè)結(jié)果顯示(圖 4-B),該蛋白不存在跨膜螺旋區(qū),不屬于跨膜蛋白,這與疏水性結(jié)果區(qū)域分析一致(圖 4-A)。
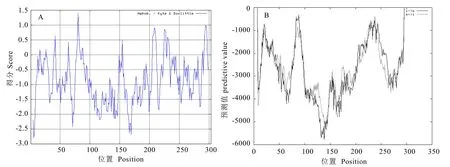
圖4 CsWRKY57蛋白親/疏水性分析和跨膜結(jié)構(gòu)域預(yù)測(cè)Fig. 4 Hydrophilic/hydrophilicity analysis and prediction model for transmembrane domain of CsWRKY57 protein
2.3 茶樹 CsWRKY57基因在不同脅迫下的差異表達(dá)分析
在ABA脅迫誘導(dǎo)下,茶樹CsWRKY57基因表達(dá)量在短時(shí)間迅速增加,并在2 h達(dá)到高峰,約為脅迫前的 4倍(圖 5),之后逐漸下降,表明ABA脅迫可以誘導(dǎo)CsWRKY57基因的表達(dá)。
在 PEG模擬干旱脅迫處理下,茶樹葉片中CsWRKY57基因表達(dá)量在1~2 h內(nèi)出現(xiàn)爆發(fā)性增加,并在 2 h達(dá)到最大,約為 0 h的 12倍(圖 5),之后迅速下降。表明 CsWRKY57基因在干旱脅迫下,表達(dá)量總體呈現(xiàn)先急劇增加后急劇下降的趨勢(shì)。
在高鹽脅迫處理下,茶樹葉片中CsWRKY57基因的表達(dá)量在 0~4 h內(nèi)逐漸增加,在脅迫處理4 h時(shí),CsWRKY57基因的表達(dá)量達(dá)到最大,約為對(duì)照的 5倍(圖 5),之后迅速下降,說明該基因參與了茶樹鹽脅迫應(yīng)答途徑。
2.4 茶樹CsWRKY57蛋白轉(zhuǎn)錄激活活性驗(yàn)證
通過 SmaI和 SalI雙酶切和連接,將CsWRKY57構(gòu)建到 pGBKT7載體上,構(gòu)建酵母表達(dá)載體CsWRKY57/pGBKT7,pGBKT7為陰性對(duì)照,pCL1為陽性對(duì)照。試驗(yàn)結(jié)果表明(圖6):陰性對(duì)照pGBKT7和CsWRKY57-pGBKT7不能在SD/-Ade-His二缺的板子上生長,而陽性對(duì)照pCL1可以在SD/-Ade-His二缺的板子上生長,并在含有 X-α-Gal的SD/-Ade-His二缺板子上顯藍(lán)色,表明CsWRKY57蛋白無轉(zhuǎn)錄激活活性。
3 討論
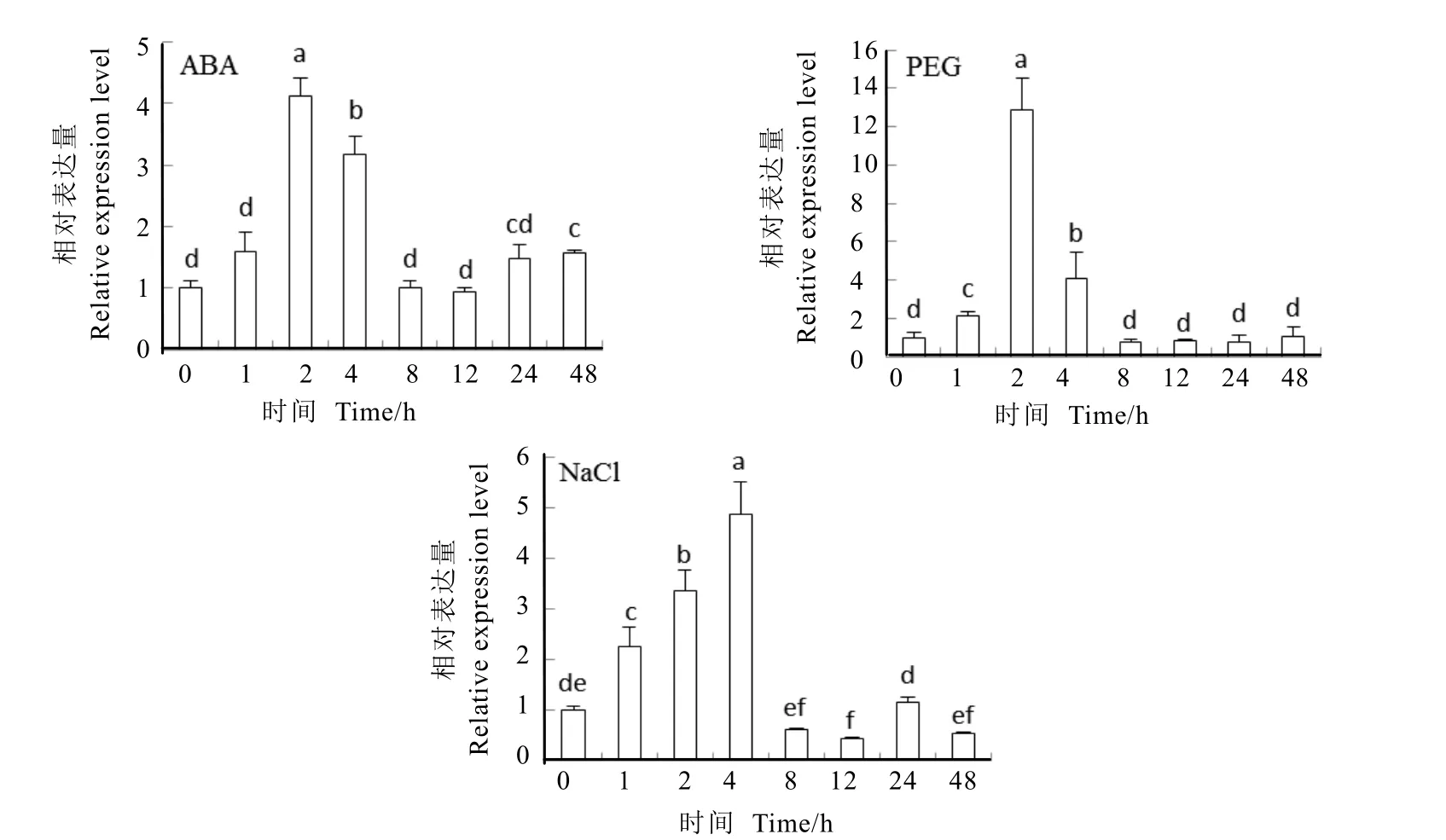
圖5 CsWRKY57基因在不同脅迫處理下的表達(dá)量Fig. 5 Expression analysis of CsWRKY57 under different stresses treatments

圖6 CsWRKY57轉(zhuǎn)錄激活活性分析Fig. 6 Transcriptional activation analysis of CsWRKY57
轉(zhuǎn)錄因子調(diào)控是植物在各種環(huán)境脅迫下的重要調(diào)控方式之一,其中WRKY轉(zhuǎn)錄因子是植物特有的一類轉(zhuǎn)錄因子,廣泛參與植物響應(yīng)逆境和生長發(fā)育的過程[16]。本研究從茶樹品種陜茶1號(hào)中克隆出1個(gè)茶樹WRKY基因,序列分析表明該基因編碼蛋白與煙草WRKY57和番茄WRKY57同源性最高。另外,CsWRKY57具有WRKY轉(zhuǎn)錄因子第II家族c亞族的典型特點(diǎn):含有1個(gè)典型的WRKYGQK結(jié)構(gòu)域和1個(gè)Cx4Cx23HxH型鋅指結(jié)構(gòu),表明該基因?qū)儆赪RKYIIc亞族。
近年來,關(guān)于WRKY轉(zhuǎn)錄因子家族基因的功能在多種植物中被鑒定。其中大量研究表明,WRKY轉(zhuǎn)錄因子參與了植物對(duì)干旱脅迫的響應(yīng),如 Tang等[17]的研究發(fā)現(xiàn)異源表達(dá)GsWRKY20能夠顯著增強(qiáng)擬南芥和紫花苜蓿的抗旱性;Yan等[18]研究報(bào)道則證實(shí)陸地棉GhWRKY17在轉(zhuǎn)基因煙草中負(fù)調(diào)控?zé)煵莸目购敌浴1狙芯恐校铇湓诟珊得{迫處理下,CsWRKY57基因表達(dá)量出現(xiàn)爆發(fā)性增加,這與Jiang等[11]研究的AtWRKY57結(jié)果相一致,表明 CsWRKY57基因參與了茶樹干旱脅迫響應(yīng)的調(diào)控途徑。另一方面,WRKY轉(zhuǎn)錄因子亦被證實(shí)在植物鹽脅迫應(yīng)答中扮演重要角色,如鹽脅迫下 MtWRKY76表達(dá)量增加且其過表達(dá)植株抗鹽能力顯著高于野生型[19];AtWRKY25或 AtWRKY33過表達(dá)可以增加轉(zhuǎn)基因擬南芥的耐鹽性[20]。本研究發(fā)現(xiàn),CsWRKY57的表達(dá)量在 NaCl處理下呈現(xiàn)出先增加后降低的趨勢(shì),表明 CsWRKY57基因亦參與了茶樹對(duì)高鹽脅迫的響應(yīng)過程。此外,有研究表明外源ABA處理誘導(dǎo)黃瓜CsWRKY46基因的表達(dá),進(jìn)而增強(qiáng)黃瓜的耐寒性[21];而 Wang等[13]通過外源 ABA及其生物合成抑制劑證實(shí)茶樹CsWRKY2作為 ABA信號(hào)途徑的下游調(diào)控因子參與了茶樹對(duì)干旱脅迫的應(yīng)答過程。本研究亦發(fā)現(xiàn)外源 ABA處理可以顯著誘導(dǎo)茶樹CsWRKY57基因的表達(dá),這與Wang等[13]的研究結(jié)果相似,意味著 CsWRKY57基因亦可能參與了茶樹響應(yīng)干旱和鹽脅迫過程中的 ABA信號(hào)調(diào)控途徑,但詳細(xì)的分子調(diào)控機(jī)制需要進(jìn)一步驗(yàn)證。
作為轉(zhuǎn)錄因子,轉(zhuǎn)錄激活相關(guān)基因表達(dá)是其行使功能的主要形式,亦有部分轉(zhuǎn)錄因子通過結(jié)合其他基因的啟動(dòng)子或形成同源二聚體發(fā)揮其功能。例如,Li等[22-23]的研究發(fā)現(xiàn)菊花 CmWRKY22、CmWRKY48具有轉(zhuǎn)錄自激活活性,而 CmWRKY17、CmWRKY21、CmWRKY40、CmWRKY42卻不具有轉(zhuǎn)錄激活活性,說明WRKY轉(zhuǎn)錄因子家族并非全都具有轉(zhuǎn)錄激活活性。本研究中,我們驗(yàn)證了CsWRKY57蛋白的轉(zhuǎn)錄激活活性,結(jié)果顯示,CsWRKY57蛋白無轉(zhuǎn)錄激活活性。Zhou等的研究發(fā)現(xiàn) GmWRKY27通過形成二聚體而具有轉(zhuǎn)錄激活活性,因此筆者推測(cè) CsWRKY57蛋白可能通過形成同源二聚體或與其他順式作用元件結(jié)合[24],才可能具有轉(zhuǎn)錄激活活性,從而激活相關(guān)基因的表達(dá),參與茶樹體內(nèi)相關(guān)的調(diào)節(jié)途徑[25]。
總之,本研究從茶樹品種陜茶1號(hào)中克隆出1個(gè)WRKY轉(zhuǎn)錄因子CsWRKY57基因,對(duì)其進(jìn)行了系統(tǒng)的生物信息學(xué)分析,為之后研究該基因和蛋白的功能提供前期基礎(chǔ)。同時(shí),qRT-PCR分析表明,CsWRKY57基因參與了茶樹對(duì)干旱和鹽脅迫的響應(yīng),為培育抗鹽抗旱的茶樹新品種提供了一定的分子基礎(chǔ)。轉(zhuǎn)錄激活活性試驗(yàn)表明,CsWRKY57蛋白無轉(zhuǎn)錄激活活性,因此,明確 CsWRKY57基因的轉(zhuǎn)錄調(diào)控機(jī)制是下一步研究工作的重點(diǎn)。
[1] Chi Y, Yang Y, Zhou Y, et al. Protein-protein interactions in the regulation of WRKY transcription factors [J]. Mol Plant,2013, 6(2): 287-300.
[2] Guo D, Zhang J, Wang X, et al. The WRKY transcription factor WRKY71/EXB1 controls shoot branching by transcriptionally regulating RAX genes in Arabidopsis [J].Plant Cell, 2015, 27(11): 3112-3127.
[3] Choi C, Hwang S H, Fang I R, et al. Molecular characterization of Oryza sativa WRKY6, which binds to W-box-like element 1 of the Oryza sativa pathogenesis-related (PR) 10a promoter and confers reduced susceptibility to pathogens [J]. New Phytologist, 2015,208(3):846-859.
[4] Wang X, Guo R, Tu M, et al. Ectopic expression of the wild grape WRKY transcription Factor VqWRKY52 in Arabidopsis thaliana enhances resistance to the biotrophic pathogen powdery mildew but not to the necrotrophic pathogen Botrytis cinerea [J]. Frontiers in Plant Science,2017, 8: 97.
[5] Wang H, Meng J, Peng X, et al. Rice WRKY4 acts as a transcriptional activator mediating defense responses toward Rhizoctonia solani, the causing agent of rice sheath blight[J]. Plant Molecular Biology, 2015, 89(1): 157-171.
[6] Raineri J, Wang S, Peleg Z, et al. The rice transcription factor OsWRKY47 is a positive regulator of the response to water deficit stress [J]. Plant Molecular Biology, 2015, 88(4):401-413.
[7] He G H, Xu J Y, Wang Y X, et al. Drought-responsive WRKY transcription factor genes TaWRKY1 and TaWRKY33 from wheat confer drought and/or heat resistance in Arabidopsis [J]. BMC Plant Biology, 2016, 16(1): 116-131.
[8] Jaffar M A, Song A, Faheem M, et al. Involvement of CmWRKY10 in drought tolerance of chrysanthemum through the ABA-signaling pathway [J]. International Journal of Molecular Sciences, 2016, 17(5): 693-706.
[9] Jiang Y, Yu D. The WRKY57 transcription factor affects theexpression of jasmonate ZIM-Domain genes transcriptionally to compromise Botrytis cinerea resistance[J]. Plant Physiology, 2016, 171(4): 2771-2782.
[10] Jiang Y, Liang G, Yang S, et al. Arabidopsis WRKY57 functions as a node of convergence for jasmonic acid- and auxin-mediated signaling in jasmonic acid-induced leaf senescence [J]. Plant Cell, 2014, 26(1): 230-245.
[11] Jiang Y, Liang G, Yu D. Activated expression of WRKY57 confers drought tolerance in Arabidopsis [J]. Mol Plant,2012, 5(6):1375-1388.
[12] Jiang Y, Qiu Y, Hu Y, et al. Heterologous expression of AtWRKY57 confers drought tolerance in oryza sativa [J].Frontiers in Plant Science, 2016, 7(145): 145.
[13] Wang Y, Shu Z, Wang W, et al. CsWRKY2, a novel WRKY,gene from Camellia sinensis, is involved in cold and drought stress responses [J]. Biologia Plantarum, 2016, 60(3):443-451.
[14] 楊桂燕, 賈彩霞, 孫宇棟, 等. 核桃 JrsHSP17.3基因克隆及溫度脅迫響應(yīng)模式分析[J]. 西北植物學(xué)報(bào), 2015, 35(9):1752-1756.
[15] 錢文俊, 岳川, 曹紅利, 等. 茶樹中性/堿性轉(zhuǎn)化酶基因CsINV10的克隆與表達(dá)分析[J]. 作物學(xué)報(bào), 2016(3):376-388.
[16] Yamasaki K, Kigawa T, Seki M, et al. DNA-binding domains of plant-specific transcription factors: structure, function,and evolution [J]. Trends in Plant Science, 2013, 18(5):267-76.
[17] Tang L, Cai H, Zhai H, et al. Overexpression of Glycine soja WRKY20 enhances both drought and salt tolerance in transgenic alfalfa (Medicago sativa L.) [J]. Plant Cell,Tissue and Organ Culture (PCTOC), 2014, 118(1): 77-86.
[18] Yan H, Jia H, Chen X, et al. The cotton WRKY transcription factor GhWRKY17 Functions in drought and salt stress in transgenic Nicotiana benthamiana through ABA signalling and the modulation of reactive oxygen species production [J].Plant & Cell Physiology, 2014, 55(12): 2060-2076.
[19] Liu L, Zhang Z, Dong J, et al. Overexpression of MtWRKY76,increases both salt and drought tolerance in Medicago truncatula [J]. Environmental & Experimental Botany, 2016,123: 50-58.
[20] Jiang Y Q, Deyholos M K. Functional characterization of Arabidopsis NaCl-inducible WRKY25 and WRKY33 transcription factors in abiotic stresses [J]. Plant Molecular Biology, 2009, 69(1): 91-105.
[21] Ying Z, Yu H, Yang X, et al. CsWRKY46, a WRKY transcription factor from cucumber, confers cold resistance in transgenic-plant by regulating a set of cold-stress responsive genes in an ABA-dependent manner [J]. Plant Physiology & Biochemistry Ppb, 2016, 108: 478-487.
[22] Li P, Song A, Gao C, et al. The over-expression of a chrysanthemum WRKY transcription factor enhances aphid resistance [J]. Plant Physiology & Biochemistry, 2015, 95:26-34.
[23] Li P, Song A, Gao C, et al. Chrysanthemum WRKY gene CmWRKY17 negatively regulates salt stress tolerance in transgenic chrysanthemum and Arabidopsis plants [J]. Plant Cell Reports, 2015, 34(8): 1365-1378.
[24] Zhou Q Y, Tian A G, Zou H F, et al. Soybean WRKY-type transcription factor genes, GmWRKY13, GmWRKY21, and,GmWRKY54, confer differential tolerance to abiotic stresses in transgenic Arabidopsis plants [J]. Plant Biotechnol J,2008, 6(5): 486-503.
[25] 王濤. 青蒿AaGL2基因的克隆及轉(zhuǎn)基因青蒿遺傳分析[D].上海: 上海交通大學(xué), 2012.
Cloning and Expression Analysis of WRKY Transcription Factor Gene CsWRKY57 in Tea Plant (Camellia sinensis)
GUO Junhong1, WANG Weidong1, GU Xing1, GUO Shasha1, GAO Yuefang1, YANG Yajun1,2, XIAO Bin1*
1. College of Horticulture, Northwest A&F University, Yangling 712100, China;2. Tea Research Institute of the Chinese Academy of Agricultural Sciences, Hangzhou 310008, China
The WRKY is one of the characteristic transcription factors in plants, which play important roles in plant growth, development and stress regulation. In order to study the relationship between WRKY transcription factors and stress tolerance of tea plant (Camellia sinensis), a WRKY transcription factor was cloned from tea cultivar‘Shanchayihao’ and named CsWRKY57, based on the searching result of tea plant transcriptome database.Bioinformatics analysis showed that the full-length sequences of CsWRKY57 was 1 222 bp encoding 303 amino acids.The molecular weight of CsWRKY57 was 33.5 kD and theoretical isoelectric point was 5.49. The BLAST results showed that CsWRKY57 contained one typical WRKY domain and one zinc finger motif (C2H2), suggesting that it was a member of the WRKYIIc family. In addition, quantitative real-time PCR (qRT-PCR) analysis showed that the expression of CsWRKY57 was induced by salt, drought and ABA stresses, and showed a tendency to increase first and then decrease, which implies that CsWRKY57 is involved in the process of tea plant responses to salt, drought and ABA.Furthermore, transcriptional activation activity assays indicated that CsWRKY57 didn't have transcriptional activation activity, which means that CsWRKY57 may be needed to combine with other elements to activate gene expression.
tea plant (Camellia sinensis), CsWRKY57, cloning, expression analysis
S571.1;Q52
A
1000-369X(2017)04-411-09
2017-05-05
2017-05-21
陜西省茶葉產(chǎn)業(yè)技術(shù)體系(K3330215131)、陜西省科技統(tǒng)籌創(chuàng)新(KTZB02-01)、中央高校基本科研業(yè)務(wù)費(fèi)專項(xiàng)資金(No. 2452017074)
郭俊紅,女,碩士研究生,主要從事茶樹分子育種技術(shù)研究。*通訊作者:1647785720@qq.com

