L—半胱氨酸與槲皮素對大豆分離蛋白穩定性的影響
孟春雨 曾永昶 林玉惠
摘要[目的]抑制大豆分離蛋白(SPI)中的美拉德反應,提高產品穩定性。[方法]向SPI-葡萄糖混合體系中添加不同量的L-半胱氨酸、槲皮素,通過測定溶解度、紫外和熒光吸收來判定各添加劑對蛋白溶解性下降和美拉德反應的抑制作用。[結果]添加1%的L-半胱氨酸能明顯改善SPI溶解度下降和美拉德反應的問題,而槲皮素未能提高該體系的貯藏穩定性。[結論]該研究為SPI貯藏穩定性的有效控制提供了途徑。
關鍵詞 大豆分離蛋白;L-半胱氨酸;槲皮素;穩定性;溶解性
中圖分類號 TS201.2+1 文獻標識碼 A 文章編號 0517-6611(2017)03-0083-03
Abstract[Objective] This research was performed in order to inhibit the Maillard reaction and improve the storage stability of soybean protein isolate (SPI). [Method]Different amounts of Lcysteine and quercetin were added into SPI to investigate their effects on the solubility and Maillard reaction of protein by determining its solubility, UV and fluorescence absorbance. [Result]1%Lcysteine inhibited the solubility decrease and Maillard reaction of SPI during storage, while quercetin had no inhibitive effect on them. [Conclusion] This result provided one effective control method to the storage stability of SPI.
Key words Soy protein isolate (SPI);Lcysteine;Quercetin;Stability;Solubility
大豆分離蛋白(SPI)是一種在食品工業中非常重要的植物蛋白產品,其蛋白質含量高達90%以上,且消化利用率較高,可達93%~97%;含有8種人體必需氨基酸,且某些氨基酸含量超過聯合國糧農組織/世界衛生組織(FAO/WHO)所推薦標準。SPI的主要組成元素為C、H、O、N、S、P,其氨基酸組成有甘氨酸、酪氨酸、苯丙氨酸、胱氨酸、脯氨酸、賴氨酸和色氨酸等,同時還含有大量人體必需脂肪酸、磷脂,豐富的鈣、磷等礦物質,而且不含膽固醇,有益于人體健康,具有較高的營養價值[1-2]。SPI已被廣泛應用于食品及其他行業中,可用于改善肉制品凝膠性,提高冰淇淋產品的膨脹率,還可用于改善面制品中小麥粉的加工性能,提高小麥粉的蒸煮品質和營養價值等。
SPI在常溫貯藏中溶解性質下降顯著,嚴重影響了其工業應用價值,但目前尚無很好的解決方法。研究證明,蛋白在固態下會發生物理變化和化學變化。物理變化有變性、非共價聚集、沉淀;化學變化包括共價聚集、去酰化、氧化、美拉德反應等[3]。Davies等[4]研究發現,在不同的溫度和水分活度下貯藏,SPI發生了褐變。通過進一步研究發現,SPI中的染料木素是造成非酶褐變的重要反應物之一,暗示SPI的長期貯藏會導致染料木素的損失。所以針對蛋白在固態下的品質損失,人們可使用相應的抑制劑來阻斷其中某種或某幾種途徑的進行。
筆者以葡萄糖和SPI的混合物為模擬體系,研究L-半胱氨酸和槲皮素對固態SPI結構和功能性的影響,并進一步探討造成功能性下降的內在原因,以及相應的控制方法,以期為提高SPI貯藏穩定性和延長產品貯藏期提供依據。
1 材料與方法
1.1 材料
低溫脫脂豆粕,蛋白質含量46.96%,水分6.67%,秦皇島金海糧油集團;槲皮素,美國Sigma公司;其他試劑(AR),國藥集團化學試劑有限公司。
主要設備:
機械攪拌器、磁力攪拌器,廣州儀科實驗儀器有限公司;650-60型熒光分光光度計,日本HITACHI公司;UV-2800H型紫外可見分光光度計,尤尼柯(上海)儀器有限公司。
1.2 方法
1.2.1 SPI的提取工藝。
脫脂豆粉粉碎過80目篩,豆粉與水1∶8(W/V),用3 mol/L NaOH調pH至7.8,50 ℃攪拌45 min,離心10 min(6 527 r/min,4 ℃),取上清液。用3 mol/L HCl將上清液pH調至4.5,40 ℃下攪拌10 min,離心10 min(6 527 r/min,4 ℃),取沉淀。將沉淀復溶,配制成10%的SPI溶液,調pH到7.0,均質(40 MPa),噴霧干燥(進風溫度180 ℃,出風溫度80 ℃)即得SPI。
1.2.2 SPI的貯藏。
將提取出的SPI進行水分調節,使其水分含量保持在4%左右,密封于PE袋中,置于37 ℃恒溫生化培養箱中避光保存。
1.2.3 溶解度的測定。
蛋白質的溶解度用氮溶解指數(NSI)表示[5]。將濃度約10 mg/mL的蛋白溶液,在室溫下磁力攪拌1 h,取5 mL樣液用凱式定氮法測定蛋白含量,即為總蛋白含量。然后離心15 min(6 527 r/min),取上清液5 mL,采用凱式定氮法測定可溶性蛋白含量。凱式定氮相關操作參照GB/T 5009.5—2010食品中蛋白質的測定方法。
NSI=可溶性蛋白量/總蛋白量×100%
1.2.4 紫外吸收的測定。
參考Ajandouz等[6]的方法,用去離子水將已知蛋白濃度的樣液稀釋至1 mg/mL,于室溫下在294 nm處使用紫外分光光度計測定其紫外吸光值,空白為去離子水。
1.2.5 熒光測定。
參考Morales等[7]的試驗方法,將樣品稀釋至蛋白濃度為1 mg/mL,使用650-60型熒光分光光度計在激發波長347 nm、發射波長415 nm處(狹縫5 nm)測定熒光強度,空白為去離子水。
1.3 數據統計分析
該試驗所有數據均為2次重復3次平行得到的平均值。使用Statistix軟件,采用LSD方法對數據進行顯著性統計分析(P≤0.05)。
2 結果與分析
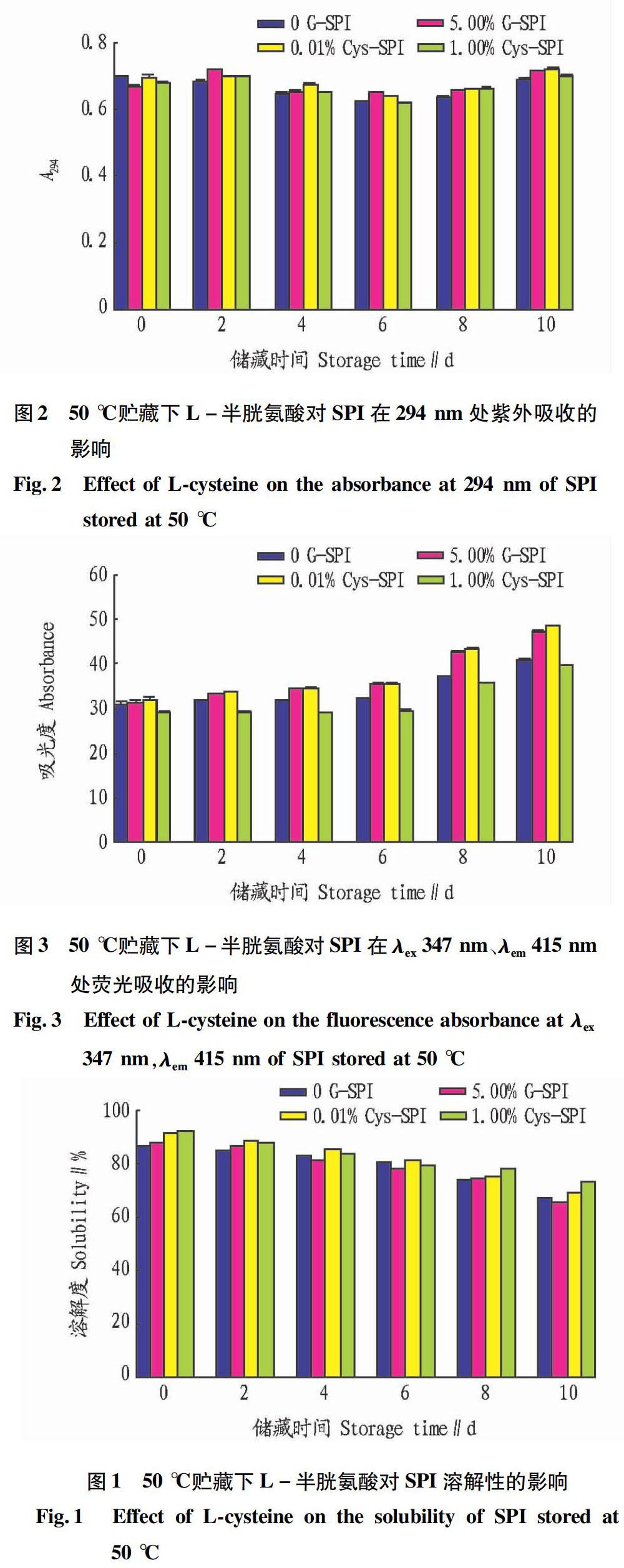
2.1 L-半胱氨酸對SPI貯藏穩定性的影響
由圖1可知,在50 ℃下貯藏10 d內,各組蛋白的溶解度均有不同程度的降低。0 G-SPI降低了21%,5.00%G-SPI降低25%,0.01%Cys-SPI降低25%,1.00%Cys-SPI降低20%,且添加L-半胱氨酸的蛋白溶解度始終高于0 G-SPI和5.00%G-SPI的溶解度。可見,L-半胱氨酸對高糖含量大豆蛋白溶解度的下降有明顯的抑制作用,且抑制程度隨著L-半胱氨酸添加量的增加而增強。
圖2顯示了各組大豆蛋白在294 nm處的紫外吸收強度隨貯藏時間的變化情況。4組蛋白的吸收強度大體上都呈現出相同的變化趨勢,在前6 d都顯著下降,可能是由于前期蛋白氧化聚集較明顯,蛋白本身的酪氨酸、色氨酸等在280 nm附近與有強吸收的氨基酸發生了交聯反應,導致294 nm處的吸光強度降低,而6 d以后各組蛋白的紫外吸收又大幅度增大。可見,294 nm處的紫外吸收也并不是完全由美拉德反應決定的,還受蛋白本身內源熒光的影響。但就貯藏末期和初期相較而言,0 G-SPI的紫外吸收減小1.4%,5.00%G-SPI增大6.0%,0.01%Cys-SPI增大2.9%,1.00%Cys-SPI增大2.9%,可見L-半胱氨酸還是抑制了在294 nm處有吸收的物質的生成。
由圖3可見,各組SPI在λex=347 nm、λem=415 nm處的熒光吸收隨貯藏時間的變化顯示,熒光強度均在貯藏期間有不同程度的增大。0 G-SPI增大35%,5.00% G-SPI增大50%,0.01% Cys-SPI增大52%,1.00% Cys-SPI增大33%。可見,1.00%的L-半胱氨酸顯著減緩了蛋白熒光吸收的增強,而0.01%的L-半胱氨酸對其熒光吸收的變化無明顯作用。由此可見,1.00%的L-半胱氨酸對美拉德反應有明顯的抑制效應。Scaman等[8]研究發現,在不同pH和溫度的反應條件下,L-半胱氨酸都能抑制糖基化反應,因為它所含的巰基不論在體內還是體外,都能起到類似于還原劑的作用,并具有很強的親核性,能截留親電性的化合物和中間體。
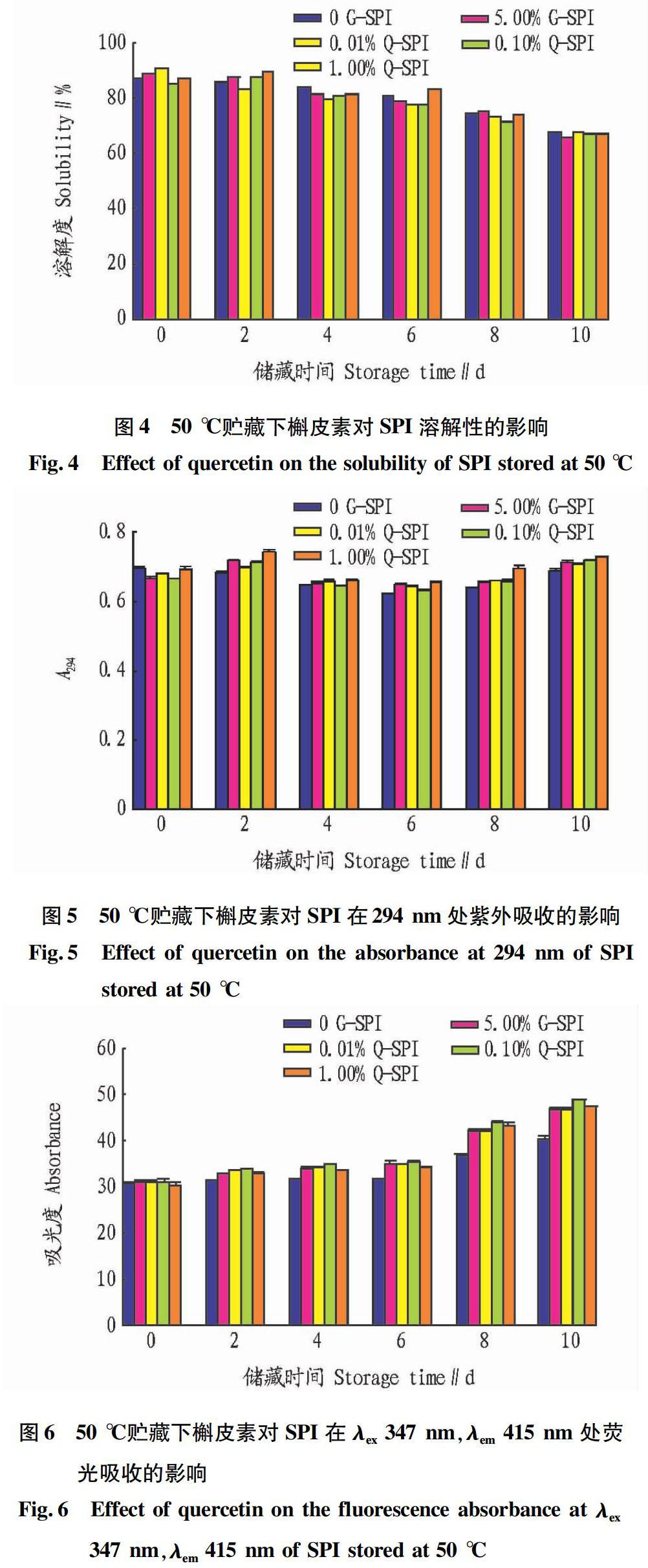
2.2 槲皮素對SPI貯藏穩定性的影響
由圖4可以看出,槲皮素的添加并沒有顯著緩解溶解度降低的趨勢,除了前2 d略有增大外,整個貯藏期間依然有明顯下降。這種變化暗示槲皮素在貯藏前期可能對氧化反應起到了一定的抑制效應,但在中后期的貯藏過程中,可能與大分子的蛋白作用不大,因而對大豆蛋白溶解度沒有太大影響。
而在294 nm處紫外吸收的變動則比較復雜,由圖5可知,在貯藏前2 d,1.00% Q-SPI的吸收強度有較大增加,然后又顯著減小,再逐漸增大,這種變化可能是由于槲皮素本身與蛋白分子結合,導致蛋白構象發生了一系列變化而引起的。在整個貯藏期間,0 G-SPI的紫外吸收強度下降了1.4%,5.00% G-SPI上升6.0%,0.01% Q-SPI上升4.4%,0.10% Q-SPI上升7.5%,1.00% Q-SPI上升5.8%,可見槲皮素的添加量不同,對紫外吸收的影響也不同。
從圖6中的熒光吸收強度來看,0.10% Q-SPI在貯藏期間熒光強度反倒增大了55%,略高于5.00% G-SPI,0.01% Q-SPI和1.00% Q-SPI的變化則與5.00% G-SPI無明顯差別。可見,槲皮素在該體系中并未對美拉德反應表現出抑制作用。可能是由于槲皮素本身水溶性較差,又在低水分體系中,所以其穩定性較好,而且槲皮素的分子大小與蛋白懸殊較大,因而其作用機制也與之前的研究有較大差別,所以在該體系中槲皮素未能有效抑制美拉德反應。
3 結論
L-半胱氨酸是一種具有生理功能的氨基酸,是組成蛋白質的20多種氨基酸中唯一具有還原性基團巰基(-SH)的氨基酸,通過改變蛋白質分子之間和蛋白質分子內部的二硫鍵,減弱了蛋白質的結構,使蛋白質結構伸展開來。
槲皮素是黃酮類化合物的一種,具有抑制非酶褐變的效用。Rawel等[9]研究槲皮素與乳清蛋白的相互作用時發現,槲皮素能有效阻斷蛋白中的賴氨酸、胱氨酸和色氨酸殘基,并且槲皮素能改變蛋白的疏水性,從而導致蛋白結構發生變化,影響其功能性質。
該研究發現,L-半胱氨酸能顯著抑制大豆蛋白溶解度的下降,并對美拉德反應也有顯著的抑制效應,同時也可能存在強還原作用,而槲皮素的添加并沒有顯著緩解溶解度降低的趨勢且未能有效抑制美拉德反應。
參考文獻
[1] 李玉珍,肖懷秋,蘭立新.大豆分離蛋白功能特性及其在食品工業中的應用[J].中國食品添加劑,2008(1):121-124.
[2] 田琨,管娟,邵正中,等.大豆分離蛋白結構與性能[J].化學進展,2008,20(4):565-573.
[3] CHANG L Q,PIKAL M J.Mechanisms of protein stabilization in the solidstate[J].Journal of pharmaceutical science,2009,98(9):2886-2908.
[4] DAVIES C G A,NETTO F M,GLASSENAP N,et al.Indication of the Maillard reaction during storage of protein isolates[J].Journal of agricultural and food chemistry,1998,46(7):2485-2489.
[5] WAGNER J R,SORGENTINI D A,AN M C.Relation between solubility and surface hydrophobicity as an indicator of modifications during preparation processes of commercial and laboratoryprepared soy protein isolates[J].Journal of agricultural and food chemistry,2000,48(8):3159-3165.
[6] AJANDOUZ E H,TSCHIAPE L S,DALLE ORE F,et al.Effects of pH on caramelization and Maillard reaction kinetics in fructoselysine model systems[J].Journal of food science,2006,66(7):926-931.
[7] MORALES F J,JIMNEZPREZ S.Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence[J].Food chemistry,2001,72(1):119-125.
[8] SCAMAN C,NAKAI S,AMINLARI M.Effect of pH,temperature and sodium bisulfite or cysteine on the level of Maillardbased conjugation of lysozyme with dextran,galactomannan and mannan[J].Food chemistry,2006,99(2):368-380.
[9] RAWEL H M,ROHN S,KROLL J.Influence of a sugar moiety(rhamnosylglucoside)at 3O position on the reactivity of quercetin with whey proteins[J].International journal of biological macromolecules,2003,32(3/4/5):109-120.

