交叉引物擴增法對初診肺結核患者檢測效能的多中心研究
姜曉穎 尹韶華 黃海榮 戴廣明 張治國 張立 張麗霞 楊永輝 毛秀君 王瑜玲 白廣紅 梁煊 黃玉平 鄧云 趙延旭 朱敏 龔玉華 陳蘇芳 朱帆 譚耀駒 任易 劉玉琴 紀濱英 譚雷 劉文 劉宇紅 李亮
?
·論著·
交叉引物擴增法對初診肺結核患者檢測效能的多中心研究
姜曉穎 尹韶華 黃海榮 戴廣明 張治國 張立 張麗霞 楊永輝 毛秀君 王瑜玲 白廣紅 梁煊 黃玉平 鄧云 趙延旭 朱敏 龔玉華 陳蘇芳 朱帆 譚耀駒 任易 劉玉琴 紀濱英 譚雷 劉文 劉宇紅 李亮
目的 評估交叉引物擴增法(cross priming amplication,CPA)對初診疑似肺結核患者的檢測效能及推廣價值。方法 選取2015年2—12月于首都醫科大學附屬北京胸科醫院、北京市昌平區結核病防治所、天津市海河醫院等21家醫療機構門診就診的初診疑似肺結核患者作為研究對象,共1020例。收集研究對象3份痰標本,由實驗室人員按要求對痰標本進行痰涂片和痰培養[17家單位使用羅氏固體培養檢測819例患者,4家單位只使用BACTEC MGIT 960培養(檢測151例)或其他液體培養(檢測50例)]和CPA檢測,評估CPA檢測效能,并于試驗結束后對實驗室操作人員進行CPA檢測技術可接受度問卷調查。結果 現場共納入肺結核可疑癥狀的初診患者1020例,涂陽患者334例,涂陰患者685例,1例無涂片結果。痰培養陽性率為45.3%(462/1020),CPA檢測陽性率為47.6%(485/1019)。以培養法作為參照,CPA檢測結核分枝桿菌的敏感度為89.8%(415/462),特異度為87.4%(487/557);在涂陽患者中,CPA檢測結核分枝桿菌的敏感度為93.8%(289/308),特異度為34.6%(9/26);在涂陰患者中,CPA檢測結核分枝桿菌的敏感度為81.8%(126/154),特異度為90.0%(478/531)。CPA檢測法與固體(液體)培養法一致性較好(Kappa=0.769)。通過可接受度問卷調查,81.8%(18/22)的操作人員認為CPA檢測操作比較容易和便捷;相比培養法,所有操作人員均認為CPA檢測對實驗室人員的感染風險較小。結論 CPA檢測方法具有較高的敏感度和特異度,并且與培養法一致性較好,有助于早期、快速發現結核病患者,在我國結核病診斷發現中具有推廣應用的前景。
分枝桿菌,結核; 核酸擴增技術; 評價研究; 多中心研究
結核病實驗室檢查是結核病診斷、治療方案制定和治療效果評估的重要依據。目前,結核病實驗室診斷國際上最常用的細菌學檢查方法是涂片法,但其敏感度和特異度不高[1]。固體培養是目前結核分枝桿菌檢測的金標準,敏感度高,但獲得結果需要2~6周的時間[2],不利于及時發現和治療患者。后來發展了以核酸擴增技術為基礎的快速診斷方法,其中很多方法都顯示了更高的敏感度和優于傳統固體培養的一些優點[3-4]。準確、快速的診斷方法對于臨床管理和感染控制來說非常重要[4],以基因檢測為基礎的診斷方法雖然快速、敏感,但儀器、設備和試劑都比較昂貴,一定程度上限制了其推廣使用[5]。發展中國家的結核病防治機構和患者都亟需快速、準確、操作方便、價格適宜、可及性強的結核病快速診斷方法。交叉引物擴增(cross priming amplication,CPA)是一種用于結核病和其他免疫性、傳染性等疾病診斷的新型的恒溫核酸擴增技術,本研究旨在對其檢測效能進行評估。
對象和方法
一、研究對象
1.樣本量估算:假設CPA檢測在初診可疑肺結核癥狀者中敏感度為80%(基于預實驗的估計值),允許誤差5%,則在α=0.05時,需要納入患者數為:1.962×0.8×0.2/0.052≈246例;按照各醫院初診患者培陽率為25%計算,需要可疑癥狀者983例。為避免污染等原因造成樣本損失,增加3%的患者,因此,本研究需要至少1013例可疑肺結核癥狀者。
2.對象選擇:選取2015年2—12月于首都醫科大學附屬北京胸科醫院、北京市昌平區結核病防治所、天津市海河醫院、河北省胸科醫院、唐山市第四醫院、石家莊市第五醫院、陜西省結核病防治院、沈陽市胸科醫院、開封市結核病防治所、山東省胸科醫院、青島市胸科醫院、杭州市紅十字會醫院、鎮江市第三人民醫院、蘇州市第五人民醫院、成都市傳染病醫院、廣州市胸科醫院、武漢市肺科醫院、黑龍江省傳染病防治院、哈爾濱市胸科醫院、四平市結核病醫院、棗莊市王開結核病防治院等21家醫療機構門診就診的初診疑似肺結核患者作為研究對象,共1020例。研究對象中包括男704例(69.02%),女315例(30.98%),1例性別未記錄;年齡(47.78±18.54)歲。
3.納入和排除標準:(1)納入標準:①具有咳嗽、咯痰>2周等呼吸道癥狀,疑似肺結核的初診患者;②同意留取合格的痰標本并進行檢測。(2)排除標準:①隨訪的結核病患者;②已經使用抗結核藥物治療>2周的患者。
4.標本收集及檢測:由門診醫生按照項目要求連續納入初診可疑肺結核癥狀者,每例患者留取3份合格痰標本。由實驗室人員按要求對收集到的痰標本進行痰涂片鏡檢、固體(液體)培養和CPA檢測。試驗結束后對實驗室操作人員進行CPA檢測技術滿意度問卷調查。
二、研究方法
本研究共21家單位參與,其中17家單位使用羅氏固體培養檢測819例患者,4家單位只使用BACTEC MGIT 960培養(檢測151例)或其他液體培養(檢測50例)。
1.實驗試劑:EasyNATTMTB試劑盒(A盒組分:脫氧核糖核酸提取液、恒溫擴增玻璃化試劑管、復溶緩沖液、水、陽性對照、石蠟油;B盒組分:一次性核酸檢測裝置、備用液泡),購自杭州優思達生物技術有限公司。
2.痰涂片和痰培養檢測:(1)符合納入標準的肺結核可疑患者提供3份合格痰液標本;(2)3份痰標本均進行涂片檢查,痰涂片采用直接涂片萋-尼抗酸染色顯微鏡檢查法,或熒光染色應用熒光顯微鏡檢查(包括傳統熒光顯微鏡和LED顯微鏡)[6];(3)選取2份陽性或陽性級別高的標本,或是在涂片陰性時選取性狀較好的痰標本進行羅氏培養。采用簡單法羅氏培養基或液體快速培養法,培養陽性的菌株應用對硝基苯甲酸(PNB)培養基法進行結核分枝桿菌復合群和非結核分枝桿菌的鑒定。(4)將2份培養后剩余的液化痰液合并,進行CPA檢測。
3.CPA檢測:(1)痰標本的處理:①液化:在痰液中加入2~3倍體積的4% NaOH溶液,充分混勻,常溫下放置20~30 min,使其充分液化;②清洗:冷卻后>8000×g離心10 min,完全倒盡上清,剩余的少量液體用移液器吸凈(不要碰觸沉淀物);用1 ml 生理鹽水懸浮沉淀。同上條件離心洗滌2次。(2)DNA提取:向含沉淀物的離心管中加入40 μl的DNA提取液,震蕩混勻或移液器吹打混勻(提取液內含不溶于水的物質,需充分混勻后吸取),沸水浴(95~100 ℃)10 min,然后冷卻至室溫;>8000×g離心>5 min,上清液作為模板備用(應避免將DNA提取液中的顆粒物質吸出)。(3)模板加樣和恒溫擴增:依據樣本數量取出玻璃化試劑管。建議每次檢測均設置陽性對照和陰性對照;每管加入15 μl復溶緩沖液(含有核酸擴增所需的引物、dNTP、Mg2+等物質,同時還含有參與擴增的內參系統,包括人工合成的內參模板和引物),再滴加20 μl石蠟油,室溫靜置2~3 min使玻璃化試劑充分溶解;在一管反應液中加4 μl的ddH2O混勻,作為陰性對照;在其余的反應液中加入模板液或陽性對照(陽性對照為攜帶結核分枝桿菌特征核酸片段的大腸桿菌質粒,每次檢測設置至少1管陽性對照和1管陰性對照,每個待檢樣本使用1管玻璃化試劑)4 μl,用移液器吹打充分混勻后蓋緊;將反應管以>1000×g瞬時離心3~5 s;將反應管置恒溫儀上,63 ℃溫浴60 min。(4)快速檢測:將完成擴增的反應管取出,置入一次性防污染檢測裝置,扣緊,1~2 min讀取結果。(5)結果判定:先觀察檢測線(T線),如果T線出現紅色,則判定為陽性,即當前樣本中有結核分枝桿菌核酸檢出;如果T線沒有出現紅色,而質控線(C線)出現紅色,則判定為陰性,即沒有從當前樣本中檢出結核分枝桿菌核酸;如果T線和C線都沒有出現紅色,說明檢測失敗。
4.問卷評估:所有評估點實驗人員在CPA檢測現場試驗結束后,進行一次CPA技術操作體驗的問卷調查,內容包括操作人員的基本信息、CPA試驗操作體會、對CPA檢測的建議和設想。問卷用來評估該技術的易操作性、方便性、安全性、結果可靠性等。
5.質量控制:試驗開展前對實驗室人員進行項目實施和試驗操作的培訓;現場實施期間對各評估點提供現場技術支持和培訓。使用統一的實驗室記錄表格記錄各種實驗檢測結果、患者登記號等信息。
6.生物安全:結核分枝桿菌痰涂片、培養均在符合生物安全二級的實驗室進行。CPA檢測滅活活菌前的操作也在符合生物安全二級的實驗室中進行。各項試驗操作、實驗室廢棄物處理需按照有關標準化操作程序和規定進行[7]。
三、統計學處理
以培養法作為金標準計算CPA檢測效能。應用SPSS 17.0軟件進行統計學分析,按下列公式計算各方法診斷效能指標:敏感度=真陽性例數/(真陽性例數+假陰性例數)×100%;特異度=真陰性例數/(真陰性例數+假陽性例數)×100%;陽性預測值=真陽性例數/(真陽性例數+假陽性例數)×100%;陰性預測值=真陰性例數/(真陰性例數+假陰性例數)×100%[8]。
采用Kappa分析評價兩種檢驗方法和同一方法兩次檢測結果的一致性。Kappa值的取值范圍介于-1~1之間。如Kappa值<0,說明由機遇所致一致率大于觀察一致性;Kappa值為0,表示觀察一致性完全由機遇所致;Kappa值為-1,說明兩結果完全不一致。如Kappa值>0,說明觀察一致性大于因機遇所致一致的程度;Kappa值為1,說明兩結果完全一致。一般認為Kappa值為在0.4~0.75為中、高度一致,Kappa值≥0.75為一致性較好,Kappa值≤0.40時為一致性較差。不同方法之間檢測效能的比較采用χ2檢驗,以P<0.05為差異有統計學意義。
結 果
一、基本情況
現場實施期間共納入肺結核可疑癥狀的初診患者1020例,涂陽患者數334例,涂陰患者數685例,1例無涂片結果。痰培養陽性率為45.3%(462/1020);CPA檢測陽性率為47.6%(485/1019,1例標本缺失)。21家醫院實驗室涂陽培陰率為7.8%(26/334),達到國家要求;培養污染率為0,非結核分枝桿菌檢出率為5.0%(24/482;482例做了分型,其余未做分型)。
二、CPA檢測效能評估
以培養法作為參照,對所有研究對象檢測中,CPA檢測結核分枝桿菌的敏感度為89.8%,特異度為87.4%,陽性預測值為85.6%,陰性預測值為91.2%;在涂陽患者中,CPA檢測的敏感度為93.8%,特異度為34.6%,陽性預測值為94.4%,陰性預測值為32.1%;在涂陰患者中,CPA檢測的敏感度為81.8%,特異度為90.0%,陽性預測值為70.4%,陰性預測值為94.5%,見表1。
在對所有研究對象檢測中,CPA檢測的陽性率為47.6%(485/1019),高于固體(液體)培養的陽性率[45.3%(462/1020)],差異有統計學意義(χ2=604.36,P<0.05);CPA檢測法與固體(液體)培養方法一致性檢驗,Kappa=0.769,一致性較好。在涂陽患者中,CPA檢測的陽性率為91.6%(306/334),固體(液體)培養陽性率為92.2%(308/334),差異有統計學意義(χ2=21.69,P<0.05);在涂陰患者中,CPA檢測的陽性率為26.1%(179/685),高于固體(液體)培養陽性率[22.5%(154/685)],差異有統計學意義(χ2=319.15,P<0.05)。
三、CPA檢測操作者滿意度調查結果
共調查22個操作者,發放問卷22份,全部收回。68.2%(15/22)的操作者認為可以在1 d之內達到獨立、熟練開展操作;45.5%(10/22)的操作者認為對于一個完全沒有分子生物學檢測經驗的技術人員,需要培訓1~2 d就能夠達到獨立、熟練開展操作。81.8%(18/22)的操作者認為CPA技術與傳統的細菌學檢測(涂片和培養)相比操作更加容易、便捷;95.5%(21/22)的操作者認為其較普通的PCR檢測方法操作容易和便捷。所有操作者均認為CPA技術與傳統的細菌學檢測比較,生物安全性更好,室內質控的可靠性和可操作性更強。關于CPA檢測最大的優勢,操作者認為在于檢測過程時間短[86.4%(19/22)],操作簡單[72.7%(16/22)],對操作人員安全[68.2%(15/22)]。
討 論
早期診斷對于結核病預防控制至關重要。隨著分子生物學的發展,出現了很多結核病快速診斷的方法。恒溫擴增技術是繼PCR技術后發展起來的一種新型的核酸擴增技術,目前主要的恒溫擴增技術有滾環核酸擴增、環介導等溫擴增等。其中的幾種恒溫擴增技術已經商業化,例如環介導等溫擴增(LAMP)技術。LAMP技術為目前較成熟的結核分枝桿菌分子診斷方法,在結核分枝桿菌檢測方面也應用較多。有系統綜述研究中表明,LAMP技術的合并敏感度為91%,合并特異度為97%。但LAMP技術無論是儀器或是試劑盒都十分昂貴,不適合發展中國家的使用[9]。本研究中的CPA檢測的敏感度和特異度都接近了LAMP技術[10],產品價格也相對低廉。
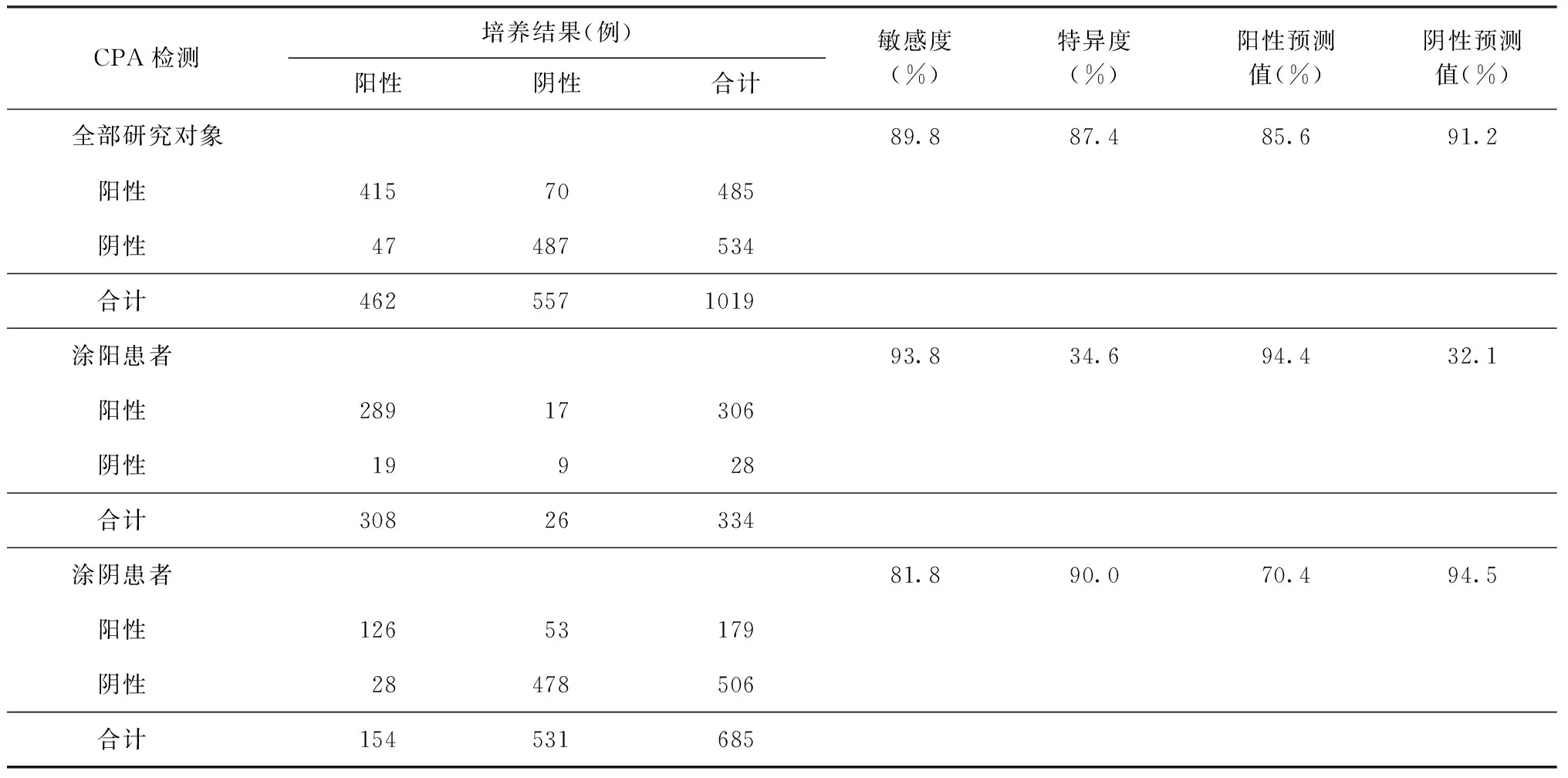
表1 CPA檢測以培養結果為參照的檢測效能
CPA技術是我國科研人員獨立開發的一種新的恒溫擴增技術,在反應系統和檢測方法上都有了很大的改進和創新。主要原理是將痰液或支氣管沖洗液等臨床標本,經液化處理、離心法提取DNA模板,用交叉引物擴增技術在63 ℃恒溫下完成結核分枝桿菌DNA的擴增和雜交,然后在密閉的一次性核酸檢測裝置中用免疫層析乳膠標記試紙條定性檢測擴增產物。CPA試驗只需要一臺簡單的加熱器,不需要特殊的儀器,對設備要求非常低;結果判斷只需借助肉眼進行,不需要操作者有很高的專業水平;且整個檢測過程均在全封閉式核酸檢測裝置內進行,可避免因交叉污染造成的假陽性反應[11]。CPA技術曾應用在細菌和病毒的早期診斷研究中,例如諾如病毒、輪狀病毒、腸道腺病毒、星狀病毒[12]、葡萄球菌、家禽腺病毒、轉基因生物、大腸桿菌、瘧疾、H1N1病毒[13-18]的檢測中,也曾應用在結核病診斷研究[19-20]中,均取得了較好的評價結果。本研究應用CPA方法的二代產品EasyNATTMTB-CPA不但在初診涂陽肺結核患者中顯示了較好的敏感度、特異度,以及陽性預測值和陰性預測值,同樣在涂陰患者中顯示了較好的檢測效能,與既往文獻報道一致[19-20]。
CPA方法檢測從標本處理到獲得檢測結果整個操作可以在4 h內完成;固體培養試驗從痰標本處理接種到結果報告所需平均時間為40 d,與固體培養相比,CPA檢測明顯縮短了結果報告時間。CPA技術操作不需要昂貴的核酸擴增儀器,安全性好;能單個獨立擴增;密閉空間可以減少試驗間交叉污染及對實驗者的傳染;試紙條顯示結果比較明確,結果判讀簡單。同樣,目前的CPA檢測也有其自身的缺點,即功能單一,不能做耐藥檢測;黏液性痰取樣時比較困難;操作中需要反復洗滌離心,核酸提取比較繁瑣、自動化程度低,前處理步驟過多且耗時長;批量檢測慢;結果保存不方便。
目前肺結核病原學診斷以羅氏固體培養和液體培養兩種方法作為金標準。但因為結核分枝桿菌生長緩慢,診斷時間較長,目前肺結核的快速診斷在國際上都是一個難題。通過本研究我們可以看到,CPA方法能夠明顯縮短患者的診斷時間,具有較高的敏感度、特異度及陽性預測值,有助于早期、快速發現結核病患者,在結核病診斷中具有推廣應用的前景。
志謝 感謝為本研究進行實驗室操作的所有工作人員!
[1] 朱巖昆, 王宇, 靳曉偉, 等. 交叉引物核酸恒溫擴增技術在基層實驗室診斷肺結核的應用價值. 中國防癆雜志, 2016,38(10):813-817.
[2] Small PM, Pai M. Tuberculosis diagnosis-time for a game change. N Engl J Med, 2010, 363(11): 1070-1071.
[3] Pai M, Kalantri S, Dheda K. New tools and emerging technolo-gies for the diagnosis of tuberculosis: part Ⅱ. Active tuberculosis and drug resistance. Expert Rev Mol Diagn, 2006, 6(3): 423-432.
[4] Roetzer A, Diel R, Kohl TA, et al. Whole genome sequencing versus traditional genotyping for investigation of aMycobacte-riumtuberculosisoutbreak: a longitudinal molecular epidemiolo-gical study. PLoS Med, 2013, 10(2): e1001387.
[5] 黃曙海, 譚慧媚, 戴廣明, 等. LAMP技術檢測結核分枝桿菌試驗性研究. 應用預防醫學, 2011, 17(1): 1-4.
[6] 趙雁林, 姜廣路. 痰涂片鏡檢標準化操作及質量保證手冊. 北京:中國協和醫科大學出版社,2009.
[7] 趙雁林, 逄宇. 結核病實驗室檢驗規程. 北京:人民衛生出版社, 2015.
[8] 詹思延. 流行病學.7版. 北京:人民衛生出版社, 2012.
[9] 楊睿, 王孝友, 趙獻芝, 等. 恒溫擴增技術在動物疫病檢測中的應用. 中國動物檢疫, 2010, 27(2): 45-48.
[10] 于霞, 馬異峰, 付育紅, 等. 環介導等溫擴增法檢測臨床標本中結核分枝桿菌的系統評價. 中國防癆雜志, 2014, 36(4): 260-266.
[11] Xu G, Hu L, Zhong H, et al. Cross priming amplification: mechanism and optimization for isothermal DNA amplification. Sci Rep, 2012, 2: 246.
[12] Bai Z, Xie H, You Q, et al. Isothermal cross-priming amplification implementation study. Lett Appl Microbiol, 2015, 60(3): 205-209.
[13] Qiao B, Cui JY, Sun L, et al.Cross-priming amplification targeting the coagulase gene for rapid detection of coagulase-positive Staphylococci.J Appl Microbiol, 2015, 119(1): 188-195.
[14] Niczyporuk JS, Woz'niakowski G, Samorek-Salamonowicz E.Application of cross-priming amplification (CPA) for detection of fowl adenovirus (FAdV) strains. Arch Virol, 2015, 160(4): 1005-1013.
[15] Zhang F, Wang L, Fan K, et al.The detection of T-Nos, a genetic element present in GMOs, by cross-priming isothermal amplification with real-time fluorescence. Anal Bioanal Chem, 2014, 406(13): 3069-3078.
[16] 祁軍, 詹曦菁, 李智慧, 等.交叉引物等溫擴增技術在腸出血性大腸桿菌O157:H7快速檢測中的應用. 口岸衛生控制,2016, 21(1):11-16.
[17] 祁軍,于 智睿, 詹曦菁, 等.交叉引物等溫擴增技術在惡性瘧疾快速檢測中的應用. 中國媒介生物學及控制雜志,2013, 24(3): 204-207.
[18] 白志軍, 胡林, 李魁彪, 等. 交叉引物恒溫擴增法檢測甲型H1N1流感病毒及臨床應用. 中國人獸共患病學報, 2015, 31(3): 208-211, 215.
[19] Ou X, Song Y, Zhao B, et al. A multicenter study of cross-priming amplification for tuberculosis diagnosis at peripheral level in China. Tuberculosis (Edinb), 2014, 94(4): 428-433.
[20] Fang R, Li X, Hu L, et al. Cross-priming amplification for rapid detection ofMycobacteriumtuberculosisin sputum specimens. J Clin Microbiol, 2009, 47(3): 845-847.
(本文編輯:李敬文)
Multi-center study of cross priming amplication test for pulmonary tuberculosis diagnosis in China
JIANG Xiao-ying*, YIN Shao-hua, HUANG Hai-rong, DAI Guang-ming, ZHANG Zhi-guo, ZHANG Li, ZHANG Li-xia, YANG Yong-hui, MAO Xiu-jun, WANG Yu-ling, BAI Guang-hong, LIANG Xuan, HUANG Yu-ping, DENG Yun, ZHAO Yan-xu, ZHU Min, GONG Yu-hua, CHEN Su-fang, ZHU Fan, TAN Yao-ju, REN Yi, LIU Yu-qin, JI Bin-ying, TAN Lei, LIU Wen, LIU Yu-hong, LI Liang.
*Beijing Chest Hospital, Capital Medical University & Beijing Tuberculosis and Thoracic Tumor Research Institute & Clinical Center on TB, Chinese Center for Disease Control and Prevention, Beijing 101149, China
s: LIU Yu-hong, Email: liuyuhong0516@126.com; LI Liang, Email: liliang69@hotmail.com
Objective To evaluate the efficiency and reliability of the cross priming amplication (CPA) test for pulmonary tuberculosis (PTB) in China. Methods A total of 1020 patients with suspected PTB from Feb. to Dec. 2015 were continuously enrolled from the outpatient departments of 21 medical institutions, such as Beijing Chest Hospital affiliated to Capital Medical University, Changping Tuberculosis Dispensary and Tianjin Haihe Hospital. Three sputum samples were collected from each recruited patient. Detection ofMycobacteriumtuberculosis(MTB) by CPA was compared to a reference standard (roche solid culture method in 17 institutions for 819 patients; in the other 4 institutions, BACTEC MGIT 960 culture system for 151 cases and liquid culture system for 50 cases). Satisfaction survey of CPA Test was conducted after CPA test. Results Among the recruited 1020 PTB suspects, 334 were smear positive, whereas 685 were smear negative. Culture positive rate was 45.3% (462/1020),while CPA positive rate was 47.6% (485/1019). The results showed that the sensitivity and specificity of the CPA test based on spot sputum for MTB detection were 89.8% (415/462) and 87.4% (487/557). The sensitivity and specificity of the CPA test in smear positive patients were 93.8% (289/308) and 34.6% (9/26), while those in smear negative patients were 81.8% (126/154) and 90.0% (478/531), respectively. The CPA test showed high consistency with solid (liquid) culture method (Kappa=0.769). According to the results of acceptability questionnaire survey, 81.8% (18/22) of the manipulators believed that CPA test was easier and more convenient to operate and had lower infection risk for laboratory staff, compared with culture method. Conclusion CPA test had high sensitivity and specificity and also had a good consistency with culture. It'll contribute to find out TB patients early and fast. CPA test has a good prospect for application in China.
Mycobacteriumtuberculosis; Nucleic acid amplification techniques; Evaluation studies; Multicenter study
10.3969/j.issn.1000-6621.2017.07.015
101149 首都醫科大學附屬北京胸科醫院 北京市結核病胸部腫瘤研究所 中國疾病預防控制中心結核病防治臨床中心(姜曉穎、黃海榮、戴廣明、劉宇紅、李亮);內蒙古醫科大學(尹韶華);北京市昌平區結核病防治所(張治國);天津市海河醫院(張立、張麗霞);河北省胸科醫院(楊永輝);唐山市第四醫院(毛秀君);石家莊市第五醫院(王瑜玲);陜西省結核病防治院(白廣紅);沈陽市胸科醫院(梁煊);開封市結核病防治所(黃玉平);山東省胸科醫院(鄧云);青島市胸科醫院(趙延旭);杭州市紅十字會醫院(朱敏);鎮江市第三人民醫院(龔玉華);蘇州市第五人民醫院(陳蘇芳);成都市傳染病醫院(朱帆);廣州市胸科醫院(譚耀駒);武漢市肺科醫院(任易);黑龍江省傳染病防治院(劉玉琴);哈爾濱市胸科醫院(紀濱英);四平市結核病醫院(譚雷);棗莊市王開結核病防治院(劉文)
劉宇紅,Email:liuyuhong0516@126.com;李亮,Email:liliang69@hotmail.com
2016-12-13)

