對“鐵與鹽酸、硫酸溶液的反應”實驗藥品選擇的建議
曾華+陳勇+秦澤龍+沈光云
摘要:鐵與非氧化性酸發生反應生成Fe2+,但淺綠色現象在課堂實驗中難以快速實現。為解決此問題,在材料的選擇上進行了實驗探究,并對出現的諸多副反應現象進行了理論分析。發現用還原性鐵粉與8 mol/L鹽酸溶液反應能快速出現淺綠色現象,適宜做課堂教學實驗。
關鍵詞:鐵;鹽酸溶液;稀硫酸;實驗探究
文章編號:1005–6629(2016)12–0067–04 中圖分類號:G633.8 文獻標識碼:B
“金屬與酸的反應”首次出現在人教版義務教育教科書九年級《化學》[1]下冊第八單元課題2。其次在人教版普通高中課程標準實驗教科書《化學1》第四章第四節中,介紹了關于Fe在常溫下在濃硫酸中的鈍化反應[2]。單質鐵與非氧化性酸發生反應生成Fe2+,這是毋須置疑的客觀事實。但在實際的實驗教學中發現:用含鐵金屬與稀鹽酸或稀硫酸的反應速率過于緩慢,課堂實驗中難以快速觀測到溶液由無色變為淺綠色的現象,且常伴隨著副反應的發生。眾多教師在對該實驗現象的解釋中選擇了回避,造成學生對實驗結論的接受度不高。
為此,我們設計了常見的含鐵金屬與不同濃度的硫酸、鹽酸溶液反應的研究實驗,并對實驗過程中出現的現象進行理論分析,以期得到在課堂實驗中快速出現淺綠色現象的實驗方案。
1 材料與方法
1.1 實驗材料
普通鐵釘(規格:2寸、長50mm,1.5寸、長38mm;天津金利華源釘業有限公司)、A3鐵板(經切割機處理為鐵屑,下文簡稱“鐵屑”)、201不銹鋼(經切割機處理為屑,下文簡稱“不銹鋼屑”)、還原性鐵粉(分析純,廣東省化學試劑工程技術研究開發中心)、酸(選取中學實驗室常用濃度的酸:3 mol/L硫酸溶液、4 mol/L硫酸溶液、6 mol/L鹽酸溶液、8 mol/L鹽酸溶液)
1.2 實驗方法
在多次重復性實驗基礎上,選擇鐵釘(1.5寸、2寸)、鐵屑、不銹鋼屑、鐵粉分別與6 mol/L鹽酸溶液、8 mol/L鹽酸溶液、3 mol/L硫酸溶液、4 mol/L硫酸溶液各6mL于試管中進行實驗,并滴加植物油液封防止氧化,觀察、記錄實驗現象,記錄反應時間。
2 結果與分析
2.1 普通鐵釘反應實驗
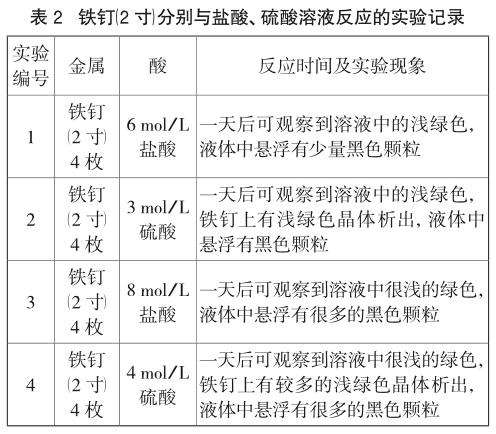
由表1,表2可知,用不同規格的普通鐵釘與不同濃度酸溶液進行反應,淺綠色現象明顯,但所需時間較長,1d后能觀察到明顯現象,且普通鐵釘中含碳量較高,均會出現黑色懸浮顆粒。且隨酸的濃度增大,黑色顆粒增多。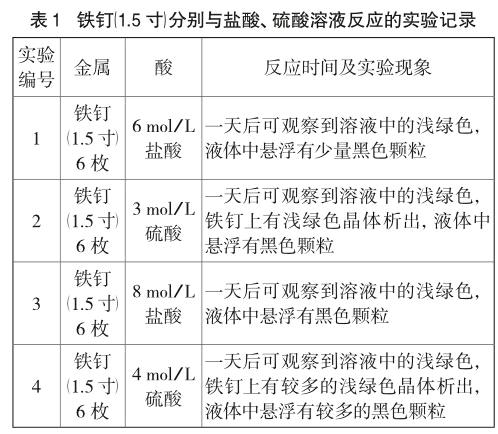
2.2 鐵屑反應實驗
由表3可知,鐵屑與酸溶液反應出現淺綠色現象較鐵釘顏色更淺,但所需時間仍然很長,1d后能觀察到明顯現象,且鐵屑中含碳量較高,同樣出現黑色懸浮顆粒,其中硫酸溶液中出現的黑色顆粒較鹽酸溶液更多。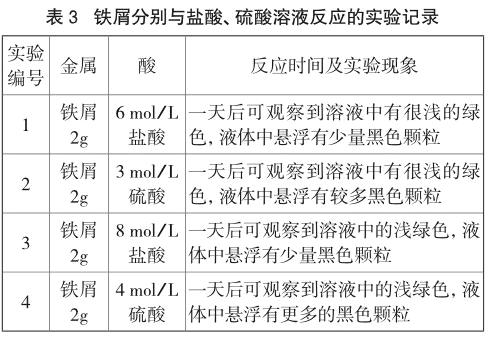
2.3 不銹鋼屑反應實驗
由表4可知,以不銹鋼屑為實驗材料進行實驗,綠色現象出現較快,尤其是第4組實驗,在5min內出現淺綠色現象,但不銹鋼片整體出現較多復雜實驗現象,雖未觀察到黑色顆粒懸浮物,但出現諸多如黃綠色、藍綠色等副反應的顏色現象。
2.4 鐵粉反應實驗
由表5可知,利用還原性鐵粉與稀鹽酸或稀硫酸反應,淺綠色溶液現象明顯,且實驗時間短,等濃度的鹽酸反應的現象較稀硫酸更快[3,4]。在筆者的實驗范圍內,選用8 mol/L的鹽酸實驗效果最佳。在此基礎上,若用酒精燈加熱試管,將會在30s內觀察到明顯的淺綠色現象。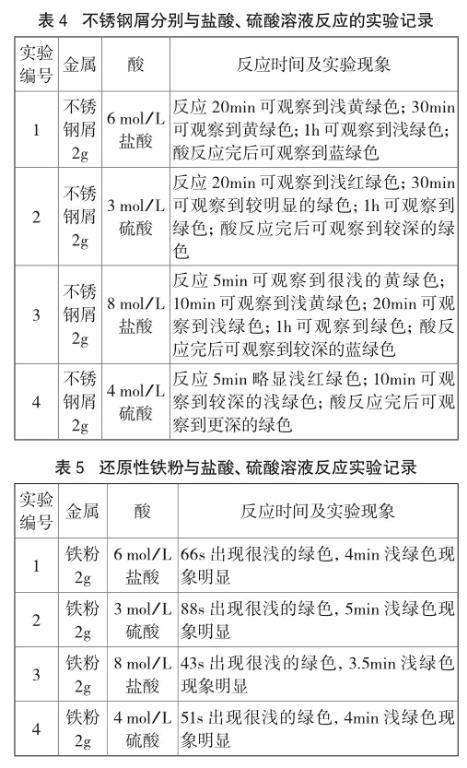
3 注意事項
(1)含Fe2+的鹽溶液在酸性介質中較穩定,但隨著反應進行,仍易被氧化,故在保存含Fe2+的鹽溶液中應加入適量H+濃度為0.01 mol/L的相應酸,同時添加適量(1g) 鐵粉以防止氧化。
(2)若選用鐵屑或鐵釘與酸溶液進行實驗,需預先用酸洗除去鐵屑表面的鐵銹。
(3)經多次實驗證明:鹽酸、硫酸的濃度應適中,濃度太小反應速率太慢,濃度太大反應速率太快或鈍化,且反應時液體會沖出試管造成危險。建議使用筆者推薦的濃度進行實驗。
4 討論
4.1 酸的濃度不宜過大
根據文獻報道,常溫下Al、Fe、Cr等金屬在大于98%的硫酸(18.4 mol/L)中發生鈍化反應,由此可用鐵制容器盛裝冷硫酸[5]。因此,取常用濃度為3 mol/L或4 mol/L的H2SO4溶液,而不能選取濃度過大的濃硫酸。為理論上控制相應的H+濃度,故選擇2倍濃度的鹽酸溶液。
4.2 以嚴謹的科學態度選擇含鐵金屬
含鐵金屬種類眾多,筆者選用市面上常見含鐵金屬為實驗材料。生鐵釘為常見家用鐵釘,即常用生鐵(GBT-718-2005),除鐵外,還含有碳、硅、錳、磷和硫等元素對性質試驗造成影響。國標顯示生鐵與A3鐵板的含鐵量低于不銹鋼,此外就其晶體結構而言,不利于與酸溶液發生置換反應。因此,鑒于Fe2+能被空氣中O2氧化原因,鐵釘與鐵屑均不宜于演示實驗。經過多次實驗證明,選擇鐵釘分別與6 mol/L鹽酸、3 mol/L硫酸提前一天進行實驗,雖可觀察到溶液中的淺綠色,但也證明了鐵釘中含有碳的黑色顆粒。此外,生鐵中含錳,在酸性介質中以+2價的粉紅色[Mn(H2O)6]2+水合離子存在,Mn(Ⅱ)為四面體配合物,在四面體中,其晶體分裂能較八面體場低,所以高自旋四面體型配合物顏色較深,呈黃綠色[6]。此外,鐵釘與稀硫酸發生反應,久置溶液,會有FeSO4·7H2O綠色晶體的析出。FeSO4·7H2O晶體在空氣中易氧化為黃褐色的堿式硫酸鐵(Ⅲ)Fe(OH)SO4,因此,在酸的選擇上,宜使用鹽酸。若選擇鐵屑與8 mol/L鹽酸提前一天進行實驗,可觀察到溶液中的淺綠色;若選擇4 mol/L的硫酸提前一天進行實驗,則液體中懸浮有較多的黑色顆粒會影響淺綠色的觀察。
4.3 杜絕實驗材料選擇中的“想當然”
有的教師認為不銹鋼含鐵量高于生鐵,于是在課堂實驗中選擇不銹鋼為實驗材料,其實不然。查閱資料得知,201不銹鋼其含碳量(%)≤0.15,硅:≤0.75,錳:5.5~7.50,鉻:16.0~18.0,氮:≤0.25,磷:≤0.060,硫:≤0.030,鎳:3.50~5.50,銅:半銅0.8,高銅1.5 [GB/T20878-2007]。不銹鋼屑與鹽酸或硫酸溶液反應,呈現諸多顏色變化,原因在于首先不銹鋼中鉻含量至少大于12%,且鉻的價電子層結構為3d54s1,6個價電子均可成鍵,具多種氧化態;在酸性介質中,非鈍化的鉻十分活躍,易將不銹鋼中銅、鎳等從其溶液中置換出來;在與鹽酸溶液反應中,鉻會先生成藍色的CrCl2溶液,進一步被空氣氧化為綠色的CrCl3溶液,由于Cr3+離子配位能力極強,在鹽酸溶液中以紫色的[Cr(H2O)6]3+、藍綠色的[Cr(H2O)6Cl]Cl2·H2O和綠色的[Cr(H2O)4Cl2]Cl·2H2O形式存在;鉻與硫酸溶液反應生成Cr2(SO4)3與冷硫酸以紫色的 Cr2(SO4)3·18H2O、綠色的Cr2(SO4)3·6H2O與桃紅色的Cr2(SO4)3無水形式存在。其次Ni能溶于稀酸中,如與硫酸反應生成NiSO4,在溶液中能以綠色晶體NiSO4·7H2O形式存在。同理,Ni也能與鹽酸反應,其生成物以NiCl2·7H2O、NiCl2·6H2O、NiCl2·4H2O和NiCl2·2H2O等一系列綠色晶體形式存在[7]。因此,在表4所顯示的實驗現象中,觀察到的淺綠色并非完全為[Fe(H2O)6]2+所呈現的顏色。不銹鋼與硫酸發生反應,局部出現桃紅色Cr2(SO4)3、紫色的Cr2(SO4)3·18H2O、綠色Cr2(SO4)3·6H2O,故反應起初呈現淺紅綠色現象,隨著反應進行,鐵與鎳更多地參與反應,呈現深綠色現象。不銹鋼與鹽酸反應,現象較硫酸更復雜,反應起初,由于[Cr(H2O)6]3+、[Cr(H2O)6Cl]Cl2·H2O、[Cr(H2O)4Cl2]Cl·2H2O和[Fe(H2O)6]2+的綜合配色影響,而顯淺黃綠色;隨著反應的進行,較多綠色晶體NiCl2·7H2O、NiCl2·6H2O、NiCl2·4H2O和NiCl2·2H2O的生成,將黃綠色掩蓋,因此可在1h后觀察到深綠色現象。由于不銹鋼中鉻含量很高,最終由于[Cr(H2O)6Cl]Cl2·H2O的影響,使溶液呈現青色現象。由此,筆者認為不銹鋼與鹽酸或硫酸溶液反應,不宜用于金屬Fe與非氧化性酸的演示實驗或學生實驗。
結合實驗結果與分析,我們建議,在中學階段的演示實驗或學生實驗中,為提高課堂效率,宜使用還原性鐵粉(分析純或優級純)與8M的鹽酸溶液反應,能快速出現淺綠色現象。此外,可采用加熱法提高反應速率、滴加植物油液封以及添加過量鐵粉以防止氧化。
正是由于化學物質種類的多樣性與性質上的差異性,才讓世界五彩斑斕,吸引人們去探究發現其規律。中學教師應具備扎實的專業知識,格物致知,本著科學的實驗態度來研究實驗教學中出現的問題,不能單憑“想當然”而不借助理論知識,即便是看似簡單的中學實驗,也應以嚴謹的科學態度認真對待,并以實驗優化證實。
參考文獻:
[1]王晶等.義務教育課程標準實驗教科書·化學(下冊)[M].北京:人民教育出版社,2012:9~11.
[2]宋心琦等.普通高中課程標準實驗教科書·化學1[M].北京:人民教育出版社,2012:100~102.
[3]王程杰.關注氯離子效應在實驗中的應用[J].化學教學,2015,(12):53~56.
[4]談小強.關于鋼鐵腐蝕的理論探討和實驗分析[J].化學教學,2012,(5):47~49.
[5]劉懷樂.理性解讀濃硫酸的吸水性、脫水性和氧化性[J].教學儀器與實驗,2010,26(3):29~31.
[6][7]北京師范大學,華中師范大學,南京師范大學無機化學教研室.無機化學(下冊)(第四版)[M].北京:高等教育出版社,2003:760~784.

