氟離子與碳酸根共存廢水中氟離子的去除研究
胡巧開 余中山
湖北師范大學城市與環境學院 (中國黃石 435002)
科研開發
氟離子與碳酸根共存廢水中氟離子的去除研究
胡巧開 余中山
湖北師范大學城市與環境學院 (中國黃石 435002)
以氯化鈣(CaCl2)為沉淀劑,對模擬廢水進行處理。通過單因素實驗,探討了無水CaCl2用量、攪拌時間、攪拌速率以及靜置時間對氟離子去除率的影響。在單因素實驗的基礎上,進行四因素三水平的正交試驗,其結果表明,去除氟離子的最佳工藝條件如下:無水CaCl2用量為0.85 g/100mL、攪拌速率為125 r/min、攪拌反應時間為20 min、靜置時間為2.25 h。在該條件下,氟離子質量濃度由1000 mg/L降至7.9455 mg/L,去除率達到99.21%,殘留的氟離子質量濃度小于《污水綜合排放標準》(GB 8978—1996)中氟離子質量濃度的一級標準限值。因氟化鈣溶解度比碳酸鈣溶解度大,如靜置時間和反應時間過長,則微小的氟化鈣晶體逐漸溶解,促使碳酸鈣生成,即發生沉淀的轉移,會使氟離子質量濃度增大,氟離子去除率減小。
氟離子 碳酸根 共存 去除率 CaCl2靜置時間
氟是人體必需的微量元素之一,飲用水中適宜的質量濃度為0.5~1.0 mg/L。長期飲用氟質量濃度高于3 mg/L的水,會引起氟骨病。隨著現代工業的發展,氟及其化合物的生產日益增加。含氟礦石的開采加工、金屬冶煉、鋁電解、焦炭等行業排放出大量的高濃度含氟廢水,造成了環境污染,危害人類健康。因此含氟廢水必須處理達標后才能向外排放。《污水綜合排放標準》(GB 8978—1996)規定:排放污水中氟離子質量濃度的一級標準最高限值為10 mg/L[1]。
目前,國內處理含氟工業廢水的常用方法主要有吸附法和沉淀法兩大類,此外還有反滲透法、離子交換樹脂法、電凝聚法、電滲析法等[2-3]。普遍使用的鈣鹽沉淀法對于氟離子(F-)有很好的去除效果,而且處理成本比較低廉,便于各種類型的工廠使用[4]。
本文探討了氟離子與碳酸根共存廢水中氟離子與鈣離子的沉淀條件,研究了不同因素對氟離子去除率的影響。
1 實驗部分
1.1 儀器
PF-1氟離子選擇電極、232飽和甘汞電極,上海羅素科技有限公司;PHS-3C pH計,上海虹益儀器儀表有限公司;85-2磁力攪拌器,余姚市肖東儀表廠;AB204-N電子天平,賽多利斯儀器(北京)有限公司;JJ-4六聯同步電動攪拌器,常州市金壇區中大儀器廠;SKFO-01電熱恒溫鼓風干燥箱,黃石市恒豐醫療器械有限公司;其他常規儀器。
1.2 試劑
實驗所用的無水碳酸鈉、硝酸鈉、檸檬酸鉀、鹽酸、乙酸、乙酸鈉、氟化鈉均為分析純;氟化鈉為基準試劑;無水氯化鈣為工業級。
1.3 分析方法
用氟離子選擇電極法測定氟離子的質量濃度。
1.4 實驗方法
(1)單因素實驗:稱取一定量的無水CaCl2分別加入5個燒杯中,再加入100 mL模擬廢水,以一定的攪拌速率攪拌一定時間,靜置一定時間后,用定性濾紙過濾,所得濾液稀釋后測定氟離子質量濃度。
(2)正交試驗:在單因素實驗的基礎上對無水CaCl2用量、攪拌速率、攪拌反應時間、靜置時間做四因素三水平的正交試驗,步驟同單因素實驗。
2 結果與討論
2.1 單因素實驗
2.1.1 氯化鈣用量的選擇
5個燒杯中各加入100 mL模擬廢水,并分別加入0.70,0.80,0.90,1.00,1.10 g無水CaCl2,在150 r/min的攪拌速率下同時攪拌反應30 min后過濾。取濾液測定其中剩余氟離子質量濃度,結果見圖1。

圖1 CaCl2用量對除氟效率的影響
圖1表明,在攪拌速率為150 r/min、攪拌時間為30 min時,投加0.80 g無水CaCl2能使100 mL混合溶液中的氟離子質量濃度降到9.75 mg/L,去除率達99.0%。
理論上,在100 mL混合溶液中投加0.477 g無水CaCl2就能使氟離子和碳酸根離子全部生成沉淀;但實際上使用0.80 g無水CaCl2才能使氟離子質量濃度降到10 mg/L以下。從動力學角度分析,由于同離子效應,加入過量的無水CaCl2才能使反應向生成氟化鈣(CaF2)和碳酸鈣(CaCO3)沉淀方向移動,使游離的氟離子和碳酸根離子質量濃度進一步降低。隨著無水CaCl2用量的增加,鈣離子質量濃度升高,沉淀反應的活化能逐漸降低,CaF2沉淀生成的反應速率加快,同時,碳酸根離子與鈣離子結合生成CaCO3,剩余氟離子質量濃度不斷下降,去除率不斷上升[5]。但當CaCl2用量超過0.80 g后,剩余氟離子質量濃度降低的速率也逐漸減緩,這是由于CaF2沉淀顆粒細小,導致出現沉淀速率緩慢、沉降周期較長等現象[6]。說明CaCl2投加量超過一定值之后,混合溶液內的氟離子不會無限減少,考慮到成本問題,無水CaCl2適當過量即可。
2.1.2 攪拌速率的選擇
5個燒杯中各放入100 mL模擬廢水及0.80 g無水CaCl2,分別以100,150,200,250,300 r/min的攪拌速率攪拌反應30 min后過濾,測定濾液中剩余氟離子的質量濃度,結果見圖2。
圖2表明,在無水CaCl2用量為0.80 g、攪拌時間為30 min時,最適宜的攪拌速率是150 r/min,可使100 mL混合溶液中的氟離子質量濃度降到9.750 3 mg/L,去除率達到99.02%。
氟離子和碳酸根離子分別與鈣離子結合,離子間通過相互碰撞積聚成微小的晶核,溶液中的構晶離子向晶核表面擴散并沉積在晶核上,晶核就逐漸長大成沉淀微粒[7]。攪拌速率小于150 r/min時,攪拌速率越快,剩余氟離子質量濃度越低,沉淀形成效果越好;攪拌速率超過150 r/min后,溶液中游離的氟離子難以與晶核緊密接觸形成穩定的沉淀,剩余氟離子質量濃度隨攪拌速率的加快而升高,去除率下降。在同樣的熱力學平衡條件下,顆粒粒徑越小,活度積常數越大,平衡時總氟質量濃度越高[8]。即:攪拌速率在150 r/min附近時能夠達到氟離子最大去除率,攪拌速率過快,反而不容易形成CaF2沉淀。
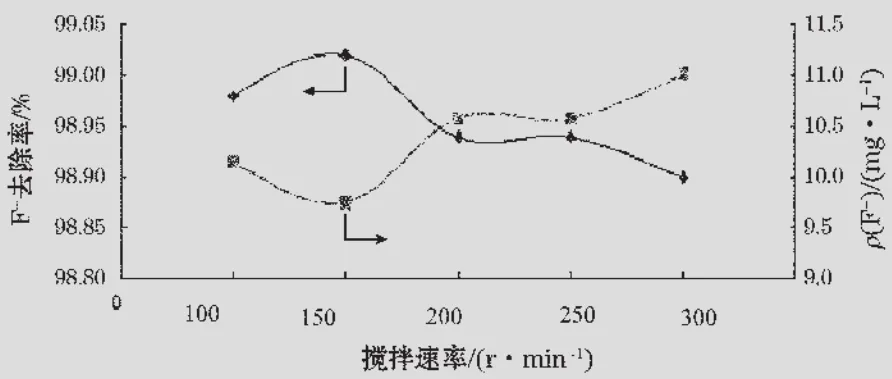
圖2 攪拌速度對除氟效率的影響
2.1.3 攪拌反應時間的選擇
5個燒杯中各放入100 mL模擬廢水,并分別加入0.80 g無水CaCl2,以150 r/min的攪拌速率分別攪拌反應10,20,30,40,50 min后過濾,取濾液測定剩余氟離子質量濃度,結果見表1。
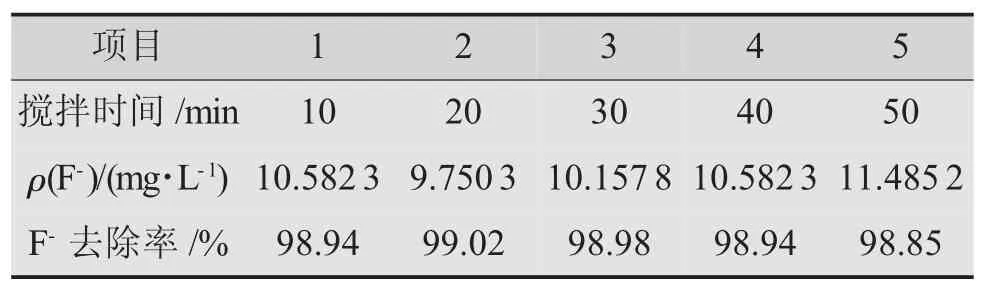
表1 攪拌時間對除氟效率的影響
由表1可看出,在攪拌過程中,剩余氟離子質量濃度先降低后升高。延展上述實驗,增加攪拌時間為60,70,80,90,100 min的實驗,其他條件相同,合并實驗結果詳見圖3。
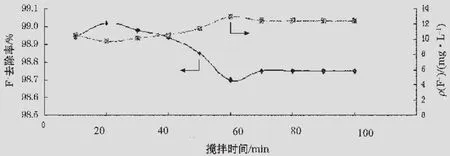
圖3 攪拌時間對除氟效率的影響
圖3表明,攪拌反應至20 min時,混合溶液中的氟離子質量濃度降到9.750 3 mg/L,去除率達99.02%。反應時間超過20 min后,剩余氟離子質量濃度逐漸升高,并在攪拌60 min后趨于平穩。
常溫下,CaF2的溶度積為3.4×10-11,CaCO3的溶度積為8.7×10-9,所以在反應過程中,CaF2的形式先于CaCO3,氟離子質量濃度會逐漸降低,去除率提高。利用溶度積規則解釋沉淀的溶解,關鍵是使難溶電解質在水溶液中電離生成的陽離子或陰離子的質量濃度降低,使離子積小于溶度積,則平衡向沉淀溶解的方向移動[9]。因為CaF2的溶解度為2.04× 10-4,CaCO3的溶解度為9.33×10-5,所以隨著攪拌時間的延長,剩余氟離子質量濃度逐漸降低,但超過一定時間后,CaF2向溶解方向移動,游離氟離子和鈣離子增加,鈣離子繼續與溶液中游離的碳酸根離子結合形成CaCO3。相比較而言CaCO3的溶解程度比CaF2小,所以總體上呈現出氟離子質量濃度上升,去除率下降的現象。攪拌60 min后達到平衡,CaF2和CaCO3沉淀基本不再發生轉移,剩余氟離子質量濃度也基本不變。
2.1.4 靜置時間的選擇
在5個燒杯中各放100 mL模擬廢水,加入0.80 g無水CaCl2,以150 r/min的攪拌速率同時攪拌20 min,再分別放置1,1.5,2,2.5,3 h后過濾。取濾液測定剩余氟離子質量濃度,結果見圖4。

圖4 靜置時間對除氟效率的影響
圖4表明,以150 r/min的攪拌速率攪拌20 min、靜置2 h時氟離子的去除效率最高,剩余氟離子質量濃度降至8.6234 mg/L,達到國家排放標準。
靜置過程中,溶液中微小晶體的溶解度大于大晶體,大晶體溶解已經達到飽和,而微小晶體并沒有達到飽和,因而微小晶體逐漸溶解,構晶離子在大晶體上沉積[8]。因為CaF2溶解度比CaCO3溶解度大,所以沉淀時間小于2 h時,溶度積小的CaF2沉淀不斷生成,游離的氟離子不斷與鈣離子結合并在CaF2晶體上沉積,剩余氟離子質量濃度不斷下降,去除率上升;靜置時間超過2 h后,溶解度大的CaF2沉淀反應向溶解方向偏移,小的CaF2晶體溶解出氟離子和鈣離子,鈣離子與碳酸根離子結合生成CaCO3沉淀,即沉淀發生了轉移,所以剩余氟離子質量濃度逐漸上升,去除率開始下降。
2.2 正交試驗
在單因素實驗的基礎上,設計無水CaCl2用量、攪拌速率、攪拌時間和靜置時間的四因素三水平正交試驗。實驗的設計和結果分別見表2和表3。
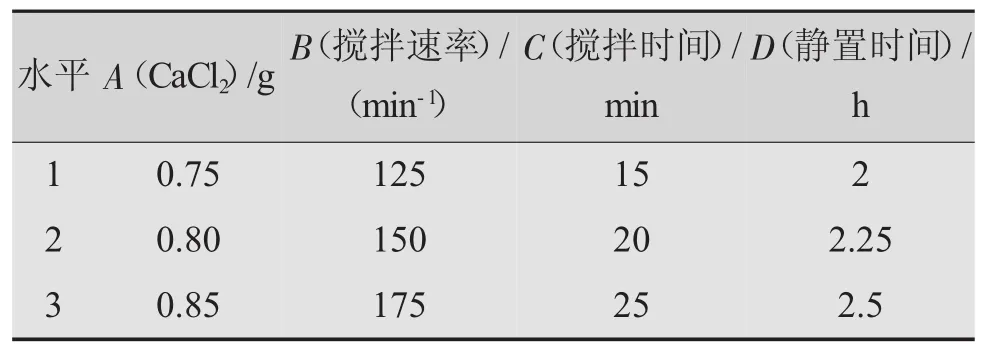
表2 正交試驗水平設計表
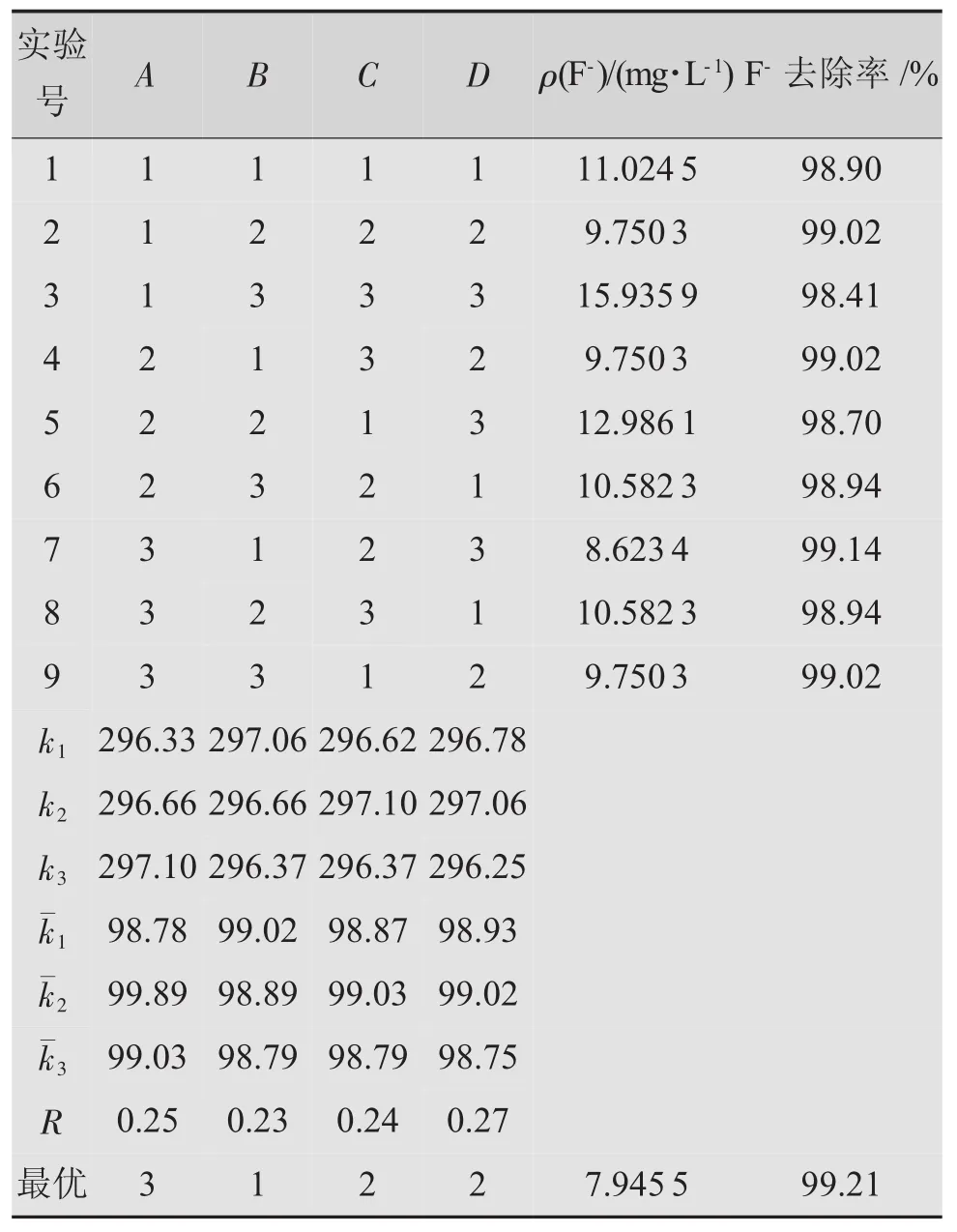
表3 正交試驗表
正交試驗結果表明,各因素的影響程度順序依次為:靜置時間>無水CaCl2用量>攪拌時間>攪拌速率,其中靜置時間和CaCl2用量是主要的影響因素。去除氟離子的最佳工藝條件是A3B1C2D2,即無水CaCl2用量為0.85 g、攪拌速率為125 r/min、攪拌時間為20 min、靜置時間為2.25 h。在該條件下,氟離子去除率達到99.21%,剩余氟離子質量濃度為7.9455 mg/L,符合GB8978—1996的規定。
3 結論
(1)單因素實驗結果表明,在氟離子、碳酸根初始質量濃度均為1000 mg/L的100 mL模擬廢水中,加入0.80 g無水CaCl2、攪拌速率為150 r/min、攪拌時間為20 min、靜置2.0 h后,氟離子的去除率達到99.14%,剩余氟離子質量濃度為8.6234 mg/L。
(2)正交試驗結果表明,去除氟離子的最佳工藝條件為:每100 mL模擬廢水的CaCl2用量為0.85 g、攪拌速率為125 r/min、攪拌時間為20 min、靜置時間為2.25 h。在此條件下,氟離子的去除率為99.21%,剩余氟離子質量濃度僅為7.9455 mg/L,小于GB8978—1996中氟離子質量濃度的一級標準限值。
(3)雖然CaF2的溶度積小于CaCO3,反應時先形成CaF2沉淀,但其溶解度大于CaCO3,攪拌反應時間超過20 min后,CaF2的溶解速率大于生成速率,導致剩余氟離子質量濃度升高,去除率下降;靜置時間超過2.25 h后,溶解度大的CaF2沉淀向溶解方向移動,溶解出的鈣離子與碳酸根離子結合,生成CaCO3沉淀,發生沉淀轉移,導致剩余氟離子質量濃度逐漸上升,去除率下降。
(4)在類似廢水的處理中,應控制好攪拌反應時間和靜置時間,以避免因CaF2沉淀的轉移使氟離子質量濃度升高而不能達到排放標準的現象。
[1]劉宏江,李鵬,賀軍四,等.含氟廢水處理的機理和工藝流程的研究[J].銅業工程,2012(6):81-84.
[2]雷紹民,郭振華.氟污染的危害及含氟廢水處理技術研究進展[J].金屬礦山,2012(4):152-155,159.
[3]鄭丹陽,耿存珍.水體除氟方法的最新研究進展[J].環境科學與管理,2014,39(11):31-34.
[4]李寧,王樹軒,王壽江,等.氯化鈣的生產和應用綜述[J].鹽業與化工,2009,38(6):42-43.
[5]王而力,錢鳳國,李唯錦.含氟廢水處理中氟衰減的化學動力學研究[J].遼寧城鄉環境科技,2000,20(3):44-48, 60.
[6]高海生.化學沉淀法處理含氟廢水的研究 [D].太原:太原理工大學,2014.
[7]華東理工大學分析化學教研組,四川大學工科化學基礎課程教學基地.分析化學 [M].6版.北京:高等教育出版社,2009:175-184.
[8]姜科,周康根,李程文.粒徑對CaF2沉淀溶解平衡的影響[J].中國有色金屬學報.2011,21(12):3195-3201.
[9]董玉琳.沉淀反應的熱力學及動力學初探[J].貴州化工. 2001,26(3):32-33,44.
Study on Removal of Fluoride Ions in the Wastewater Containing Fluoride and Carbonate
Hu QiaokaiYu Zhongshan
The simulated wastewater was treated with calcium chloride as precipitant.The effects of the anhydrous CaCl2dosage,stirring time,stirring speed and standing time on the removal rate of fluoride ions were investigated by single factor test.Based on the single factor test,the orthogonal tests of four factors and three levels were carried out.The results showed that the optimum conditions for removal of fluoride ions were listed as follows∶the anhydrous CaCl2dosage was 0.85 g/100 mL,the stirring speed was 125 r/min,the stirring time was 20 min,and the standing time was 2.25 h.Under the above conditions,the concentration of fluoride ions decreased from 1 000 mg/L to 7.945 5 mg/L,and the removal rate reached 99.21%.The residual fluorine ions concentration was less than the primary standard limit in the"Integrated wastewater discharge standard" (GB 8978—1996).The solubility of calcium fluoride was higher than that of calcium carbonate,if the standing time or the reaction time was too long,then the tiny calcium fluoride crystal gradually dissolved and promoted the formation of calcium carbonate,resulting in the precipitation transfer,the mass concentration of fluorine ions increased and the removal rate of fluorine ions decreased.
Fluoride Ion;Carbonate;Coexistence;Removal rate;CaCl2;Standing time
X505
2017年4月
胡巧開 女 1965年生 本科 副教授 主要從事環境工程的教學及水污染控制研究工作

