PD-1/PD-L1阻斷劑免疫治療不良反應及其處理原則
黃樂富,邸 巖,徐小寒,孫元元,王苗苗,賀子軒,景 句,周心娜,王小利,任 軍
(首都醫科大學附屬北京世紀壇醫院腫瘤內科,腫瘤治療性疫苗北京市重點實驗室,北京 100038)
·藥學進展·
PD-1/PD-L1阻斷劑免疫治療不良反應及其處理原則
黃樂富,邸 巖,徐小寒,孫元元,王苗苗,賀子軒,景 句,周心娜,王小利,任 軍
(首都醫科大學附屬北京世紀壇醫院腫瘤內科,腫瘤治療性疫苗北京市重點實驗室,北京 100038)
免疫治療成為繼手術、放療、化療后又一種重要的抗腫瘤手段。其中抗程序細胞死亡蛋白1(programmed death-1,PD-1)及配體(PD-1 ligand,PD-L1)免疫檢查點阻斷劑,在腫瘤治療中取得了突破性進展,已被美國食品藥品管理局(FDA)批準用于惡性黑色素瘤、轉移性鱗狀非小細胞肺癌、晚期腎癌、頭頸鱗狀細胞癌、尿路上皮癌等治療,但隨著PD-1/PD-L1阻斷劑在臨床上逐步推廣,越來越多的免疫相關副反應(immune-related adverse events,irAEs)引起關注。本文對PD-1/PD-L1阻斷劑治療引起的各器官的免疫相關不良反應以及對應臨床處理方法進行綜述,有助于臨床醫護工作者診斷、預防及治療其相關不良反應。[關鍵詞] 免疫檢查點;PD-1;PD -L1;不良反應;免疫治療
隨著腫瘤學、免疫學等相關學科的迅速發展和交叉滲透,腫瘤免疫治療取得了突飛猛進的發展,成為繼手術、放療、化療后又一種重要的抗腫瘤手段。其中抗程序細胞死亡蛋白1(programmed death-1,PD-1)及配體(PD-1 ligand,PD-L1)免疫檢查點抑制劑,在腫瘤治療中取得了突破性進展。美國食品藥品管理局(FDA)已批準nivolumab和pembrolizumab用于治療惡性黑色素瘤、轉移性鱗狀非小細胞肺癌、晚期腎癌、頭頸鱗狀細胞癌、霍奇金淋巴瘤、尿路上皮癌,且針對胃癌、結腸癌、肝癌的臨床研究也在進行中。
但隨著PD-1/PD-L1阻斷劑在國內外臨床試驗和應用的逐步推廣,越來越多的不良反應引起關注。PD-1受體抑制劑阻斷T細胞負性調控信號解除免疫抑制,增強T細胞抗腫瘤效應的同時,也可能異常增強自身正常的免疫反應,導致免疫耐受失衡,累積到正常組織時表現出自身免疫樣的炎癥反應,稱為免疫相關副反應(immune-related adverse events,irAEs),涉及皮膚、消化道、肝臟、內分泌、肺部等在內的多個器官。但目前仍沒有針對irAEs的特定分級標準,其分類及分級,仍遵循美國國立癌癥研究所常規不良事件評價標準(CTCAE)第4版。
本文綜述了應用PD-1/PD-L1阻斷劑引起各器官的irAEs及對應臨床處理方法,有助于臨床醫護工作者診斷、預防及治療相關不良反應。
1 皮膚毒性
最常見也是最早發生的的irAEs是皮膚毒性,高峰期出現在PD-1/PD-L1阻斷劑治療兩個周期后,包括濾泡性皮炎、紅斑性皮炎、丘疹性皮炎等。以輕度皮膚毒性最為常見,有28% ~ 50%患者出現不同程度的皮膚瘙癢,皮疹和濕疹[1-4],通常見于軀干與四肢。嚴重的皮膚毒性有苔蘚樣皮膚反應、Sweet綜合征、大皰性類天皰瘡等[1],且文獻報道苔蘚樣皮膚反應及濕疹可誘發白癜風[5],機制可能與阻斷在腫瘤及皮膚均表達某種抗原有關[7]。此外,PD-1阻斷劑增加放療敏感性,因此兩者聯合可能誘發急性皮膚反應[6]。
輕度皮膚毒性可不進行治療或局部外用糖皮質激素、口服止癢劑(例如抗組胺藥物,NK-1受體抑制劑等);而干預后不改善、口腔粘膜受累或發生3級及以上皮膚毒性的患者,應暫停PD-1抑制劑,并請皮膚科會診行皮膚病學評估,包括臨床評估、皮膚活檢等[8],治療上口服潑尼松(1 mg·kg-1·d-1),必要時靜脈給藥治療,直到毒性嚴重程度≤1級。如果48 h內惡化,考慮加用免疫抑制劑(如英夫利昔單抗,環磷酰胺,霉酚酸酯)。
1級皮膚不良反應可持續免疫治療;2級皮膚不良反應可在改善后恢復免疫治療,但若連續治療12周后病情仍無改善,則應停止免疫治療。對于嚴重皮膚不良反應的患者,干預治療好轉后是否繼續PD-1阻斷劑治療,目前仍有爭議。
2 腹瀉與結腸炎
腸道不良反應多發生于PD-1抑制劑應用后的5 ~10周[9-10]。以腹瀉及結腸炎為主。
中學生接受時事政治的場所有家庭、學校和社區等,其中中學政治課堂是學生了解時事政治的主要途徑和場所。接受的途徑也較為單一,主要有電視新聞、報刊閱讀、上網獲取和教師宣講、學生傳播等。課堂上時事政治的宣講只有政治、語文兩課的老師進行,其余學科幾乎不涉及。認識不到位是影響時事教學實施和政治課堂教學效果的一個重要原因。
腹瀉發生率為8% ~ 19%,以輕中度為主,3/4級的重度腹瀉多發生于聯合伊匹單抗治療,且為劑量依賴性[11],在Ⅱ期研究中顯示10 mg·kg-1組的重度腹瀉發生率(10%)顯著高于3 mg·kg-1組(1%)[12]。
結腸炎是指腹瀉的同時伴有腹痛,或伴有直腸出血或分泌粘液增多,或內窺鏡下取病理檢查明確有結腸炎改變,發生率為1.3%,聯合用藥時上升至11.8%[13]。早發現及時干預對減少中重度胃腸道不良事件、改善癥狀尤為重要。
腹瀉或結腸炎相關癥狀持續超過3 d,排除感染因素后根據腹瀉程度及時評估病情予以應用糖皮質激素。輕微癥狀的1級(每天< 4次)對癥予以結腸炎飲食和胃腸動力抑制劑(洛派丁胺或復方地芬諾酯)。調整飲食并應用止瀉藥2 ~ 3 d后癥狀仍持續但無加重時可應用布地奈德。2級中度腹瀉(每天4 ~ 6次)時結腸鏡有助于明確診斷,一旦鏡下明確結腸炎應暫停PD-1抗體,立即予以糖皮質激素1 ~ 2 mg·kg-1·d-1治療。對嚴重甚至危及生命的結腸炎(3或4級,每天7次及以上或伴有并發癥)的患者永久停用免疫檢查點抑制劑治療,并予以大劑量糖皮質激素(2 ~ 4 mg·kg-1·d-1)。如果應用糖皮質激素3 d后癥狀仍無改善者,推薦每2周加用一次英夫利昔單抗[14-16]。英夫利昔單抗的劑量和周期參照炎癥性腸病中的治療原則[17]。對英夫利昔單抗耐藥的患者可應用麥考酚酯。
根據隨機雙盲對照試驗的結果,長效糖皮質激素不能降低腹瀉發生率或減輕癥狀[18],因此,不推薦應用長效糖皮質激素如布地奈德預防腹瀉。
3 肝臟毒性
PD-1阻斷劑引起的免疫介導性肝炎也稱自身免疫性肝毒性,其發生率< 5%[19-20],多發生于用藥8 ~13周。有報道其延遲副反應可持續至服藥后1年至數年,醫生隨訪時應重視[1,21-22]。
每次用藥期間均應行肝功能監測(liver function tests),irAEs相關肝毒性的癥狀可表現為黃疸、上腹痛、嘔吐等,也可表現為無癥狀或其他非特異性癥狀,如發熱、乏力、消化不良等。一旦肝功能有惡化趨勢應及時評估,排除感染、非感染性疾病以及腫瘤進展引起的肝功能異常。推薦的實驗室檢查有:抗核抗體(ANA)、平滑肌抗體(SMA)、全代謝分析、膽紅素、r-谷氨酰轉肽酶(GGT)、乳酸脫氫酶(LDH)、抗線粒體抗體、乙丙型病毒性肝炎等抗體。irAEs肝毒性患者血清學檢查ANAs、抗平滑肌抗體、抗肝細胞胞質抗體通常是陰性的。肝功能異常升高至正常范圍的3倍以上時需引起重視,需每天復查監測肝功能動態變化,可行CT掃描或肝活檢,與其他自身免疫性肝炎相鑒別[21,23]。irAEs肝毒性影像學表現不典型,在嚴重的情況下,CT掃描示輕度肝腫大、門靜脈周圍淋巴結腫大。IrAEs病理表現為[24-25]匯管區水腫、肝竇內外或膽小管口周邊淋巴細胞浸潤。肝毒性具體分級及治療見表1(ULN為正常值上限)[8,26]。
大多數病例經糖皮質激素治療均獲得緩解。即使癥狀很快改善,長期激素維持逐漸減量是必要的步驟。如果類固醇激素治療后4 ~ 7 d無緩解,需加用英夫利昔單抗治療。激素難治性病例,依據自身免疫性肝炎的處理原則可給予硫唑嘌呤或霉酚酸酯[27]。
4 免疫治療相關性肺炎
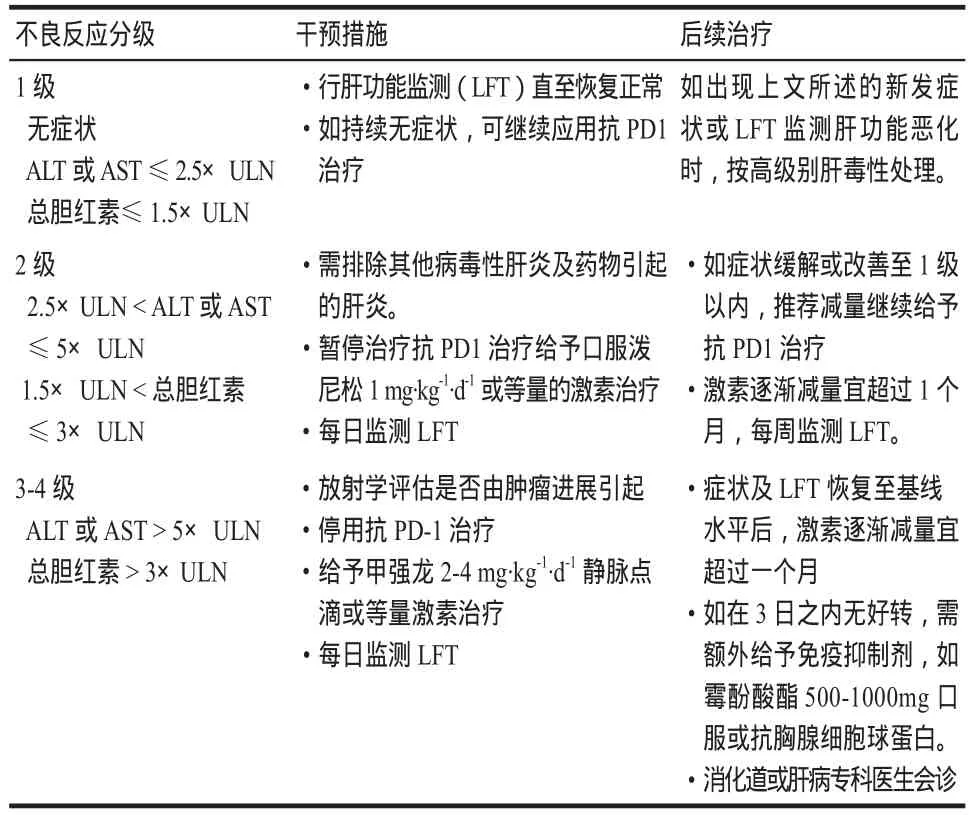
表1 irAEs肝毒性具體分級及治療原則Tab 1 Grading and treatment of immune-related hepatotoxicity
使用PD-1/PD-L1阻斷劑時,早期試驗發生irAEs肺炎約為10%,且偶有危及生命報道[30-32]。一項nivolumab治療晚期實體瘤的臨床試驗出現了3例(入組296例)免疫相關性肺炎導致的死亡[33]。也有報道肺癌患者或既往存在肺氣腫、哮喘、肺纖維化、肺部放療病史的患者發生免疫相關性肺炎的可能越大、程度更重[34]。
irAEs肺炎的表現為干咳、進行性呼吸困難、發熱、胸痛等癥狀。當懷疑患者出現irAEs肺炎時,需行肺CT檢查,最常見為機化性肺炎的影像學表現,呈雙肺內多發病灶,如磨玻璃樣改變、網格狀改變、肺實變等[35],而其他免疫檢查點抑制劑導致的irEAs肺炎病灶多位于下肺[36-37]。
對于irAEs肺炎的治療,醫生需根據副反應嚴重程度的分級,采取不同的治療方案。輕度irAEs肺炎采取對癥藥物治療,如口服強的松1 ~ 2 mg·kg-1·d-1或甲潑尼龍0.5 ~ 1 mg·kg-1·d-1。對于中度及以上的患者應首先停用PD-1受體抑制劑,嚴重的永久終止免疫治療,并行支氣管鏡檢查,請呼吸科醫生會診,以除外肺部感染和惡性腫瘤肺轉移可能。中度患者給予口服或靜脈注射激素治療,病情不緩解或重度免疫相關性肺炎的患者需住院持續應用大劑量的皮質激素,如甲潑尼龍2 ~ 4 mg·kg-1·d-1,必要時還需聯合應用免疫抑制劑,如霉酚酸酯、環磷酰胺、英夫利昔單抗[38]。
5 內分泌系統
接受PD-1抑制劑治療的患者中,10%被觀察到出現了不同級別免疫相關內分泌病癥。較為常見的是甲狀腺功能異常及下垂體炎,1型糖尿病也有相關報道。
由自身免疫介導的內分泌毒性主要影響甲狀腺,導致1 ~ 2級甲狀腺功能減退(4% ~ 8%)和甲狀腺功能亢進(2% ~ 3%),以及少見的急性甲狀腺炎(1%)。在臨床上,如果出現TSH降低(< 0.5×正常值下限)或升高(> 2×正常值上限),或既往甲狀腺功能障礙,在應用PD-1抗體期間應監測游離三碘甲腺原氨酸(fT3)和游離甲狀腺素(fT4)[39]。對于2級甲減,可應用L-甲狀腺素替代治療。有癥狀的2級甲亢應優先使用甲巰咪唑治療,必要時應用β受體阻滯劑。3級甲狀腺功能障礙,可給予潑尼松龍1 ~ 2 mg·kg-1。如果發生4級的甲狀腺功能障礙則需要緊急停止PD-1抗體治療并給予潑尼松龍1 ~ 2 mg·kg-1[40-41]。由于大多數甲狀腺毒性可以通過激素替代治療得到妥善處理,PD-1抑制劑通常無需中斷。對于激素替代治療無法控制的甲狀腺功能障礙,應考慮甲狀腺切除術。
下垂體炎的發生率為1% ~ 6%,通常發生在6和13周之間[8,40-41],包括垂體功能減退及腎上腺皮質功能不全,癥狀可表現為模糊,伴有輕微疲勞,關節痛,行為改變和由于激素不足而導致的性欲喪失,也可能是嚴重的頭痛和視覺變化,癥狀多不典型,難以診斷[42-43]。因此,需要定期監測TSH,fT3和fT4,因為低TSH可能是癥狀出現前先兆指標。
下垂體炎是少數幾乎不可逆的irAEs之一,通常需要長期激素替代[41]。臨床表現為疲乏或化驗提示皮質醇減少,如果已排除原發性下垂體炎和由此引起的垂體功能減退或自身免疫性腎上腺炎引起的皮質醇減少,可考慮診斷免疫相關性下垂體炎。對于無癥狀的1級的下垂體炎,行MRI垂體掃描并與內分泌專家共同評估是否開始激素替代治療;對于2級及以上的下垂體炎,應考慮停用PD-1抗體免疫治療,潑尼松龍(或等效物)應立即以1 mg·kg-1開始使用并逐周減少10 mg·d-1。潑尼松龍達到10 mg·d-1后,必須用氫化可的松替代,通常推薦劑量為25 ~ 40 mg·d-1。在極少數情況下,垂體后葉可能會受到影響,導致出現尿崩癥,出現多飲和尿量增多,目前推薦使用人工合成抗利尿激素(ADH)。
最近有報道PD-1抗體后可誘發1型糖尿病[44-45]。一名沒有任何個人或家族糖尿病史的癌癥患者,使用PD-1抗體治療7周后,出現自身免疫性1型糖尿病、糖尿病酮癥酸中毒[46]。1型糖尿病作為嚴重胰島素缺乏癥,血糖極易波動難控制,甚至危及生命。一經確診,應立即終止PD-1抗體治療,并積極胰島素替代治療。但由于潛在危險性,醫生應加強警惕。
6 PD-1/PD-L1阻斷劑其它罕見毒性
6.1 腎臟毒性
腎毒性報道較少,發病率約1%[47-48],主要表現為免疫介導相關腎炎及腎功能不全。在PD-1抗體聯合ipilimumab(CTLA-4單抗)治療晚期黑色素瘤的臨床試驗,可見腎小管間質性腎炎的報道,病理活檢示肉芽腫型急性間質性腎炎等,嚴重者可至腎臟衰竭。單用PD-1抑制劑引起腎功能不全的病例中,多以血肌酐升高為主,間質性腎炎少見。治療上,均對類固醇激素治療反應較好,早發現早診斷及時予以激素為主的治療,可使血肌酐迅速下降避免透析治療。
6.2 胰腺毒性
約1% ~ 2%的應用PD-1抑制劑的患者可出現免疫相關胰酶水平的升高[1,19]。但確診胰腺炎的病例極少[19]。也有合并2型糖尿病的患者治療后出現胰腺β細胞功能衰竭,需要胰島素替代治療[1]。
PD-1單抗治療期間,不推薦常規監測胰酶水平[3];若發現單純胰酶水平的升高而沒有其他癥狀懷疑胰腺炎時,可以監測指標變化并注意觀察臨床癥狀;必要時行MRI檢查有助于早期診斷。如果有腹痛等臨床癥狀且酶升高水平較明顯時,建議先停用PD-1抑制劑,并給予靜脈激素治療(甲強龍1.0 ~ 2.0 mg·kg-1·d-1)。必要時請專科醫師協助診治。
6.3 眼部毒性
眼色素層炎在單用PD-1抑制劑或聯合治療中均有報道。癥狀為眼睛發紅,畏光,疼痛,視力改變等[47-48]。出現上述癥狀時應請眼科醫師完善專科檢查,外用類固醇滴眼可緩解癥狀。較重的眼科炎癥推薦使用口服類固醇。
6.4 關節炎
PD-1抑制劑的患者中小部分可出現關節痛,且既往有關節炎病史者癥狀加劇[7,49]。抗核抗體(ANA)、抗環瓜氨酸肽的檢測有助于免疫相關性關節炎發作時的診斷,低劑量口服類固醇(0.5 mg·kg-1·d-1)可有效控制癥狀[12]。
6.5 神經系統疾病
在PD-1/PD-L1抗體聯合ipilimumab(CTLA-4單抗)治療肺癌的報道中,有散在出現重癥肌無力、免疫介導性腦炎等神經系統毒性出現[11,17,50],單用PD-1/ PD-L1抑制劑暫時未見相關神經系統毒性報道。使用糖皮質激素可有效緩解毒副反應,并及時請神經科醫師協助診治。另外,也有推薦靜脈應用免疫球蛋白或血漿置換[8]。
其他irAEs還包括疲乏、心肌炎、胃炎、結節病、葡萄膜炎,風濕性多肌痛,脫髓鞘、血管炎、粒細胞減少等造血系統綜合征等。輕中度可行保守對癥治療,3/4級或遷延不愈的2級不良反應需停用PD-1抗體,并應用糖皮質激素治療改善癥狀。
綜上,PD-1/PD-L1阻斷劑因對常規療法無效的晚期腫瘤具有確切療效而備受矚目[51]。盡管其耐受性良好,3-4級嚴重不良反應少見,但因其阻斷免疫抑制通路的同時,可累及絕大多數正常組織,引起免疫相關不良反應多且復雜,對于臨床醫師而言應該提供高警惕,不僅僅關注抗腫瘤療效,對不良反應,也要予以重視,掌握常見種類、分級、診斷及治療管理方法,做到早診斷早治療,將不良反應控制在低級別,降低危險,改善預后。大多數irAEs早期足量激素治療是可逆的,有效控制病情后可逐漸減量至完全停用。如果類固醇激素治療后無緩解,需聯用英夫利昔單抗治療。
此外,臨床試驗時自身免疫性疾病人群多被排除在外,因此免疫檢查點抑制劑治療具有潛在的自身免疫性疾病患者的安全性尚不可知。而且免疫治療與其他療法聯合,以達到最佳的臨床療效是未來腫瘤綜合治療的發展方向,因此是否會增加不良反應的發生及嚴重程度,或出現新的irAE,都值得臨床密切關注,可進行分層研究,深入探討其發生機理,以便進一步提高腫瘤綜合治療水平,提高晚期腫瘤患者的生活質量。
致謝:在此特別感謝杜克大學(Duke University)H. Kim Lyerly教授對本文給予的支持與指導。
[1] Hofmann L, Forschner A, Loquai C, et al. Cutaneous, gastrointestinal, hepatic, endocrine, and renal side-effects of anti-PD-1 therapy[J]. Eur J Cancer, 2016, 60: 190-209.
[2] Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma[J]. N Engl J Med, 2011, 364(26): 2517-2526.
[3] Postow MA. Managing immune checkpoint-blocking antibody side effects[J]. Am Soc Clin Oncol Educ Book, 2015, 35: 76-83.
[4] Weber JS, Yang JC, Atkins MB, et al. Toxicities of immunotherapy for the practitioner[J]. J Clin Oncol, 2015, 33(18): 2092-2099.
[5] Hwang SJ, Carlos G, Wakade D, et al. Cutaneous adverse events (AEs) of anti-programmed cell death (PD)-1 therapy in patients with metastatic melanoma: A single-institution cohort[J]. J Am Acad Dermatol, 2016, 74(3): 455-461.
[6] Sibaud V, David I, Lamant L, et al. Acute skin reaction suggestive of pembrolizumab-induced radiosensitization[J]. Melanoma Res, 2015, 25(6): 555-558.
[7] Topalian SL, Sznol M, Mcdermott DF, et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab[J]. J Clin Oncol, 2014, 32(10): 1020-1030.
[8] Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies[J]. Ann Oncol, 2015,26(12): 2375-2391.
[9] Weber JS, K?hler KC, Hauschild A. Management of immune-related adverse events and kinetics of response with ipilimumab[J]. J Clin Oncol, 2012, 30(21): 2691-2697.
[10] Weber JS, Dummer R, de Pril V, et al. Patterns of onset and resolution of immune-related adverse events of special interest with ipilimumab[J]. Cancer, 2013, 119(9): 1675-1682.
[11] Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma[J]. N Engl J Med, 2015, 373(1): 23-34.
[12] Wolchok JD, Neyns B, Linette G, et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study[J]. Lancet Oncol, 2010, 11(2): 155-164.
[13] K?hler KC, Hassel JC, Heinzerling L, et al. Management of side effects of immune checkpoint blockade by anti-CTLA-4 and anti-PD-1 antibodies in metastatic melanoma[J]. J Dtsch Dermatol Ges, 2016, 14(7): 662-681.
[14] Pagès C, Gornet JM, Monsel G, et al. Ipilimumab-induced acute severe colitis treated by infliximab[J]. Melanoma Res, 2013, 23(3): 227-230.
[15] Minor DR, Chin K, Kashani-Sabet M. Inf l iximab in the treatment of anti-CTLA4 antibody (ipilimumab) induced immune-related colitis[J]. Cancer Biother Radiopharm, 2009, 24(3): 321-325.
[16] Merrill SP, Reynolds P, Kalra A, et al. Early administration of inf l iximab for severe ipilimumab-related diarrhea in a critically ill patient[J]. Ann Pharmacother, 2014, 48(6): 806-810.
[17] Stidham RW, Lee TC, Higgins PD, et al. Systematic review with network meta-analysis: the efficacy of anti-TNF agents for the treatment of Crohn's disease[J]. Aliment Pharmacol Ther, 2014, 39(12): 1349-1362.
[18] Weber J, Thompson JA, Hamid O, et al. A randomized, doubleblind, placebo-controlled, phaseⅡstudy comparing the tolerability and efficacy of ipilimumab administered with or without prophylactic budesonide in patients with unresectable stage Ⅲ or Ⅳ melanoma[J]. Clin Cancer Res, 2009, 15(17): 5591-5598.
[19] Robert C, Ribas A, Wolchok JD, et al. Anti-programmeddeath-receptor-1 treatment with pembrolizumab in ipilimumabrefractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial[J]. Lancet, 2014, 384(9948): 1109-1117.
[20] Hamid O, Robert C, Daud A, et al. Safety and Tumor Responses with lambrolizumab (anti–PD-1) in melanoma[J]. N Engl J Med, 2013, 369(2):134-44.
[21] Linardou H, Gogas H. Toxicity management of immunotherapy for patients with metastatic melanoma[J]. Ann Transl Med, 2016, 4(14): 272.
[22] Michot JM, Bigenwald C, Champiat S, et al. Immunerelated adverse events with immune checkpoint blockade: a comprehensive review[J]. Eur J Cancer, 2016, 54: 139-148.
[23] Rizvi NA, Mazières J, Planchard D, et al. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial[J]. Lancet Oncol, 2015, 16(3): 257-265.
[24] Johncilla M, Misdraji J, Pratt DS, et al. Ipilimumab-associated hepatitis: clinicopathologic characterization in a series of 11 cases[J]. Am J Surg Pathol, 2015, 39(8): 1075-1084.
[25] Kim KW, Ramaiya NH; Krajewski KM, et al. Ipilimumab associated hepatitis: imaging and clnicopathologic findings[J]. Invest New Drugs, 2013, 31(4): 1071-1077.
[26] Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies[J]. Ann Oncol, 2015, 26(12): 2375-2391.
[27] Abdel-Wahab N, Shah M, Suarez-Almazor ME. Adverse events associated with immune checkpoint blockade in patients with cancer: a systematic review of case reports[J]. PLoS One, 2016, 11(7): e0160221.
[28] Nishino M, Sholl LM, Hodi FS, et al. Anti-PD-1-related pneumonitis during cancer immunotherapy[J]. N Engl J Med, 2015, 373(3): 288-290.
[29] Nishino M, Giobbie-Hurder A, Hatabu H, et al. Incidence of programmed cell death 1 inhibitor-related pneumonitis in patients with advanced cancer: a systematic review and meta-analysis[J]. JAMA Oncol, 2016, 2(12): 1607-1616.
[30] Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(17): 1627-1639.
[31] Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(21): 2018-2028.
[32] Gettinger SN, Horn L, Gandhi L, et al. Overall survival and longterm safety of nivolumab (anti-programmed death 1 antibody, bms-936558, ono-4538) in patients with previously treated advanced non-small-cell lung cancer[J]. J Clin Oncol, 2015, 33(18): 2004-2012.
[33] Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med, 2012, 366(26): 2443-2454.
[34] Gulley JL, Rajan A, Spigel DR, et al. Avelumab for patients with previously treated metastatic or recurrent non-small-cell lung cancer (JAVELIN Solid Tumor): dose-expansion cohort of a multicentre, open-label, phase 1b trial[J]. Lancet Oncol, 2017, pii: S1470-2045(17)30240-1.
[35] Nishino M, Chambers ES, Chong CR, et al. Anti-PD-1 inhibitorrelated pneumonitis in non-small cell lung cancer[J]. Cancer Immunol Res, 2016, 4(4): 289-293.
[36] Nishino M, Brais LK, Brooks NV, et al. Drug-related pneumonitis during mammalian target of rapamycin inhibitor therapy in patients with neuroendocrine tumors: a radiographic pattern-based approach[J]. Eur J Cancer, 2016, 53: 163-170.
[37] Nishino M, Boswell EN, Hatabu H, et al. Drug-relatedpneumonitis during mammalian target of rapamycin inhibitor therapy: radiographic pattern-based approach in waldenstr?m macroglobulinemia as a paradigm[J]. Oncologist, 2015, 20(9): 1077-1083.
[38] Postow MA, Chesney J, Pavlick AC, et al. Nivolumab and ipilimumab versus ipilimumab in untreated melanoma[J]. N Engl J Med, 2015, 372(21): 2006-2017.
[39] Eigentler TK, Hassel JC, Berking C, et al. Diagnosis, monitoring and management of immune-related adverse drug reactions of anti-PD-1 antibody therapy[J]. Cancer Treat Rev, 2016, 45: 7-18.
[40] Corsello SM, Barnabei A, Marchetti P, et al. Endocrine side effects induced by immune checkpoint inhibitors[J]. J Clin Endocrinol Metab, 2013, 98(4): 1361-1375.
[41] Spain L, Diem S, Larkin J. Management of toxicities of immune checkpoint inhibitors[J]. Cancer Treat Rev, 2016, 44: 51-60.
[42] Ryder M, Callahan M, Postow MA, et al. Endocrine-related adverse events following ipilimumab in patients with advanced melanoma: a comprehensive retrospective review from a single institution[J]. Endocr Relat Cancer, 2014, 21(2): 371-381.
[43] Torino F, Barnabei A, Paragliola RM, et al. Endocrine side-effects of anti-cancer drugs: mAbs and pituitary dysfunction: clinical evidence and pathogenic hypotheses[J]. Eur J Endocrinol, 2013, 169(6): R153-164.
[44] Jing H, Vudattu N, Sznol M, et al. Precipitation of autoimmune diabetes with anti-pd-1 immunotherapy[J]. Diabetes Care, 2015, 38(4): e55.
[45] Martin-Liberal J, Furness AJ, Joshi K. Anti-programmed cell death-1 therapy and insulin-dependent diabetes: a case report[J]. Cancer Immunol, 2015, 64(6): 765-767.
[46] Mellati M, Eaton KD, Brooksworrell BM, et al. Anti-PD-1 and Anti-PDL-1 monoclonal antibodies causing type 1 diabetes[J]. Diabetes Care, 2015, 38(9): e137.
[47] Robert C, Schachter J, Long GV, et al. Pembrolizumab versus ipilimumab in advanced melanoma[J]. N Engl J Med, 2015, 372(26): 2521-2532.
[48] Wolchok JD, Kluger H, Callahan MK, et al. Nivolumab plus ipilimumab in advanced melanoma[J]. N Engl J Med, 2013, 369(2): 122-133.
[49] Powles T, Eder JP, Fine GD, et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer[J]. Nature, 2014, 515(7528): 558-562.
[50] Loochtan AI, Nickolich MS, Hobson-Webb LD. Myasthenia gravis associated with ipilimumab and nivolumab in the treatment of small cell lung cancer[J]. Muscle Nerve, 2015, 52(2): 307.
[51] 胡毅,陶海濤.晚期非小細胞肺癌的藥物治療進展[J].中國藥物應用與監測,2014,11(6):329-333.
Optimal management of immune-related adverse events associated with PD-1/PD-L1 inhibitors immunotherapy
HUANG Le-fu, DI Yan, XU Xiao-han, SUN Yuan-yuan, WANG Miao-miao, HE Zi-xuan, JING Ju, ZHOU Xin-na, WANG Xiao-li, REN Jun
(Cancer Center, Beijing Shijitan Hospital Aff l iated to Capital Medical University; Beijing Key Laboratory of Cancer Therapeutic Vaccine, Beijing 100038, China)
Immunotherapy has become an important anti-tumor means following surgery, radiotherapy and chemotherapy. (PD-1) and PD-1 (PD-L1) immune checkpoint blockers have made a breakthrough, the US Food and Drugs Administration (FDA) has approved the use of nivolumab and pembrolizumab for the treatment of malignant melanoma and nivolumab for squamous non-small cell lung cancer, urothelium carcinoma, etc. However, as PD-1/PD-L1 blockers become more widely used clinically, the inevitable more immune-related adverse events (irAEs) should be addressed. In this paper, immune-related adverse effects of PD-1/ PD-L1 blockers in various organs and the corresponding clinical treatment methods are reviewed, which will help clinicians to diagnose, prevent and treat their related adverse reactions.
Immune checkpoint; PD-1; PD-L1; Adverse event; Immunotherapy
R969.3
A
1672 – 8157(2017)03 – 0177 – 06
2017-03-03
2017-05-01)
北京市醫院管理局臨床技術創新項目揚帆計劃項目資助(XMLX201413)
任軍,男,主任醫師,教授,研究方向:腫瘤學、免疫學。E-mail:renjun9688@yahoo.com
黃樂富,男,醫學博士研究生,研究方向:腫瘤免疫治療。E-mail:aile0921@163.com

