黑曲霉果糖基水解酶的重組表達及酶學特征分析
董自星,肖 華,王靜培,張志萌,王 君,路福平,*
(1.天津科技大學化工與材料學院生物化工系,天津 300457;2.天津科技大學生物工程學院與工業發酵微生物教育部重點實驗室,天津 300457)
?
黑曲霉果糖基水解酶的重組表達及酶學特征分析
董自星1,2,肖 華2,王靜培2,張志萌2,王 君2,路福平2,*
(1.天津科技大學化工與材料學院生物化工系,天津 300457;2.天津科技大學生物工程學院與工業發酵微生物教育部重點實驗室,天津 300457)
目的:果糖基轉移酶在新型果糖基衍生品的制備過程中具有重要作用,獲得酶活高、性能優良的果糖基水解酶是關鍵。方法:利用MEGA 4.0以及Clustal X2等軟件對黑曲霉的基因組進行分析,遴選了5個果糖基水解酶基因,接著將它們在畢赤酵母中進行了克隆表達,并研究了重組酶的酶學性質。結果:在搖瓶水平上,重組酶Fru1和Fru5的酶活分別為1360和1560 U/mL,遠高于目前已報道的果糖基水解酶的酶活。重組酶Fru1的最適反應溫度和pH分別為45 ℃和5.5,EDTA對它有微弱的促進作用,Fe2+、Na+、Co2+、Cu2+和Ca2+會輕微地抑制酶活,該酶對蔗糖既有水解作用,又有轉苷活性,還可以水解菊粉中的二糖到五糖;重組酶Fru5的最適反應溫度和pH分別為50 ℃和5.0,Li+、Na+和EDTA對其酶活有促進作用,但Fe2+則強烈抑制酶的活性,它還可以水解蔗糖以及菊粉中幾乎所有的大分子糖。結論:本研究為果糖基水解酶的工業化生產及其在新型果糖基衍生品制備過程中的應用提供了可能途徑。
果糖基水解酶,新型果糖基衍生品,黑曲霉,重組表達,酶學性質
在自然界中,果糖以單體形式大量存在于水果和蜂蜜中;果糖和葡萄糖通過糖苷鍵連接形成蔗糖,其廣泛分布于甘蔗和甜菜中;以果聚糖形式(菊粉)存在于細菌、真菌和高等植物中[1]。果糖及其果糖基衍生物(如高果糖漿、果葡糖漿、結晶果糖和低聚果糖等)因其具有獨特的甜度與生理保健功能,在醫藥、食品、乳制品、保健品以及飼料行業具有良好的應用前景。
果糖基水解酶在新型果糖基衍生品的制備過程中起著重要作用。它們包括細菌、真菌和植物來源的蔗糖酶(invertase)、菊粉酶(inulinase)、果聚糖酶(levanase)以及果聚糖蔗糖酶(levansucrase)等[2]。其中蔗糖酶(EC 3.2.1.26)可以將蔗糖水解為果糖和葡萄糖,用于果葡糖漿的生產。與傳統酸水解法相比,酶法具有精制工序簡單、產品品質好等優點,有利于果葡糖漿的工業化生產[3]。此外,蔗糖酶還具有果糖基轉移活性,可以產生低聚果糖(fructooligosaccharides)[4]和低聚乳果糖(lactosucrose)[5]等。利用菊粉外切酶(EC 3.2.1.80)生產高果糖漿(high fructose corn syrup)是目前最好的方法。該法對設備要求低,可直接將菊粉轉化成95%(w/v)以上的果糖,易于分離純化[6]。可以替代以淀粉為原料,經α-淀粉酶、葡萄糖淀粉酶和葡萄糖異構酶酶解生產高果糖漿的方法[7]。菊粉內切酶則可以用來生產低聚果糖等[8]。

表1 引物列表Table 1 Primers used in this study
注:下劃線部分為限制性酶切位點。長期以來,作用于果糖或果糖基的酶系一直沒有得到深入研究。雖然國內外專家也對菊粉酶等進行了許多研究,但是基本上都停留在實驗室水平,工業應用規模很少[9]。其主要原因是微生物產酶量低,酶制劑生產成本高。因此,篩選高表達的新菌種或構建高表達的重組菌是解決這個問題的主要方法。
本文采用生物信息學的方法從黑曲霉基因組中遴選到5個可能的果糖基水解酶基因。并以黑曲霉CICIM F0510為出發菌株,提取其總RNA,反轉錄得到cDNA。以此為模板,并將其果糖基水解酶基因在畢赤酵母中進行克隆與表達,進而研究重組酶的酶學性質,為后續果糖基水解酶的工業化生產、基因水平的改造及其在新型果糖基衍生品制備過程中的應用提供可能途徑。
1 材料與方法
1.1 材料與儀器
大腸桿菌(EscherichiacoliJM109) 由本實驗室保藏;黑曲霉(AspergillusnigerCICIM F0510) 從自然樣本分離保藏的野生菌株,由江南大學中國高校工業微生物資源與信息中心(http://cicim-cu.jiangnan.edu.cn)提供;畢赤酵母(PichiapastorisGS115)和質粒pPIC9K 購于Invitrogen公司;大腸桿菌的培養采用LB培養基;黑曲霉采用PDA培養基進行培養;畢赤酵母及其重組菌的培養基及其培養方法按照Invitrogen公司的畢赤酵母操作手冊進行;本研究中用到的引物根據美國國立生物技術信息中心的網站(NCBI,http://www.ncbi.nlm.nih.gov/guide/)上公布的序列進行設計,由生工生物工程(上海)股份有限公司合成,具體見表1;限制性內切酶、LA Taq DNA聚合酶、連接酶和RNA反轉錄試劑 均購于TaKaRa公司;TRNzol總RNA提取試劑 由康為世紀生物科技有限公司提供;Plasmid Mini Kit I和小量DNA產物純化回收試劑盒 購自OMEGA Bio-Tek公司;胰蛋白胨(Tryptone)和酵母提取物(Yeast Extract) 英國OXOID公司產品;其它試劑 均為國產分析純。
PTC-200型PCR儀 MJ Research Inc.;DYY-III-6B型穩壓穩流電泳儀 北京六一儀器廠;全自動凝膠成像儀 美國SYNGENE公司;Gene Pulser Xcell電轉儀 美國BIO-RAD公司;HW SY21-K電熱恒溫水浴鍋 北京市長風儀器儀表公司;SP-2012UV型分光光度計 上海光譜儀器有限公司;Agilent HP 1100高效液相色譜儀 美國惠普公司。
1.2 實驗方法
1.2.1 果糖基水解酶的生物信息學分析 利用NCBI查詢不同來源的果糖基水解酶的氨基酸序列。通過軟件MEGA 4.0以鄰近法(Neighbour-joining)構建進化樹[10],分析它們親緣關系的遠近,并通過軟件Clustal X2和BioEdit對這些酶的氨基酸序列進行比對和分析。
1.2.2 黑曲霉果糖基水解酶基因的克隆 采用TRNzol總RNA提取試劑提取黑曲霉的總RNA。以總RNA為模板,以Oligo(dT)為引物逆轉錄合成第一鏈cDNA,然后分別以第1鏈cDNA為模板進行PCR,擴增出5個果糖基水解酶基因(引物見表1)。基因的測序由生工生物工程(上海)股份有限公司完成。分別將PCR產物與質粒pPIC9K用SnaB I和EcoR I進行酶切,再將它們純化后進行連接,轉化E.coliJM109感受態細胞。篩選陽性轉化子,并提取其質粒進行酶切驗證。
1.2.3 陽性重組菌的篩選和表達 將構建成功的5個重組質粒以及對照空質粒pPIC9K均用Sal I進行線性化。酶切產物經純化回收后電轉化[11]P.pastorisGS115,均勻涂布于MD平板,30 ℃恒溫培養至單菌落形成。挑取多個單克隆重組酵母分別接種于終濃度為0.5、2 mg/mL的YPD/G418平板上進行篩選,于30 ℃培養箱培養至長出單菌落,挑取生長情況好的重組酵母菌株保存。
將構建成功的畢赤酵母重組菌GS115(pPIC9K-fru1)、GS115(pPIC9K-fru2)、GS115(pPIC9K-fru3)、GS115(pPIC9K-fru4)和GS115(pPIC9K-fru5)在YPD平板上進行純化,挑取單菌落接種于YPD液體培養基中,30 ℃、220 r/min振蕩培養至對數生長期(OD600=2~6,約18~20 h)。按1%(v/v)接種量接入25 mL BMGY培養基中,30 ℃、220 r/min振蕩培養至對數生長期。室溫下5000 r/min離心5 min收集酵母細胞,棄上清,將細胞重懸于50 mL BMMY培養基中至OD600=1.0,30 ℃繼續培養并開始誘導。每隔24 h補加0.5%的甲醇以維持誘導,同時取樣進行酶活測定。發酵結束后,12000 r/min離心10 min收集發酵上清液,即為粗酶液,-20 ℃保存備用。
1.2.4 果糖基水解酶的酶活測定 以蔗糖為底物,采用DNS法[12]進行酶活測定。取9 mL含有10%(w/v)蔗糖的0.1 mol/L的檸檬酸-磷酸氫二鈉緩沖液(pH6.0)于三角瓶中,加入1 mL酶液,充分混勻后,于50 ℃、200 r/min水浴搖床反應60 min。然后取上清液進行適當稀釋,使糖的濃度為0.1~0.8 mg/mL。取稀釋后的糖液0.5 mL于15 mL刻度試管中,加DNS試劑1.5 mL,沸水煮沸15 min,冷卻后加入10.5 mL去離子水,在540 nm波長下測定吸光度。用葡萄糖繪制標準曲線,獲得的標準曲線方程為y=0.648x-0.0143,R2=0.9975。
酶活單位定義:在最適條件下,每分鐘水解蔗糖產生1 μmol的葡萄糖所需的酶量即為1個酶活力單位。
1.2.5 最適反應溫度和熱穩定性的測定 在不同溫度(30、40、45、50、55、60、65 ℃)和pH6.0的緩沖液條件下,測定酶活,將酶活最高者定為100%,其它溫度下的酶活與最高酶活的比值即為待測酶液在該溫度下的相對酶活;將酶分別置于上述溫度的恒溫水浴中保溫60 min,迅速取出測定殘余酶活力。以未經水浴處理的酶活為100%,以殘余酶活力對溫度作圖。
1.2.6 最適作用pH和pH穩定性的測定 用不同pH的0.1 mol/L磷酸氫二鈉-檸檬酸緩沖液(3.0、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)和50 ℃條件下測定酶活,酶活數值最大者計為100%;在上述不同pH的緩沖液里和50 ℃的條件下保溫60 min,迅速取出進行酶活反應,測定重組酶的活力。酶活數值最大者計為100%。
1.2.7 金屬離子和螯合劑對酶活的影響 在果糖基水解酶與其底物進行反應的體系中,加入終濃度為5 mmol/L的K+、Zn2+、Mg2+、Fe2+、Na+、Co2+、Cu2+、Ca2+、Ni2+、Mn2+、Li+和EDTA,在最適反應pH和溫度下測定(Fru1,pH5.5、45 ℃;Fru5,pH5.0、50 ℃)果糖基水解酶的酶活。以不加金屬離子和螯合劑的反應體系的酶活為100%。
1.2.8 底物催化特征分析 按照酶活測定的方法,分別以10%(w/v)的蔗糖和菊粉為底物,將酶與底物在50 ℃反應60 min后,沸水浴10 min,冷卻至室溫后8500 r/min離心4 min,取上清液經0.45 μm濾膜過濾后,進行高效液相色譜分析。色譜條件:高效液相色譜儀(蒸發光散射檢測器)進行檢測,色譜柱為PrevailTMCarbohydrate ES 5 μ糖柱(5 μm,4.6 mm×250 mm);檢測器為蒸發光散射檢測器,其漂移管的溫度為90 ℃,氣體流速為2.2 L/min;流動相為乙腈與水的混合液(體積比為65∶35);柱溫30 ℃,流速1.0 mL/min。
1.3 數據處理
相關實驗均設置三個平行實驗,數據分析借助Origin 8.0軟件處理完成;采用SAS軟件進行ANOVA分析。
2 結果與討論
2.1 不同來源果糖基水解酶的生物信息特征比較
雖然黑曲霉CBS 513.88的基因組信息(EMBL AM270980~AM270998)已經被解析[13],但是其果糖基水解酶系的具體功能及性質的差異還沒有確定。為了研究這些酶的結構、功能及其潛在的應用價值,利用BLAST等軟件從NCBI中共查到5個來源于黑曲霉的果糖基水解酶基因,分別命名為fru1、fru2、fru3、fru4和fru5。它們編碼的酶分子AngFru1、AngFru4和AngFru5分別具有蔗糖酶、內切菊粉酶和外切菊粉酶活性,而AngFru2和AngFru3具有假定的蔗糖酶活性。
2.1.1 不同來源果糖基水解酶的親緣關系分析 利用軟件MEGA 4.0將5個黑曲霉來源的果糖基水解酶與已報道的果糖基水解酶的氨基酸序列進行系統進化樹的構建,其結果如圖1所示。由圖1可知,這些果糖基水解酶可以分為五類:內切菊粉酶、細菌蔗糖酶或菊粉酶、外切菊粉酶、酵母菌蔗糖酶或菊粉酶、絲狀真菌蔗糖酶。其中,AngFru1、AngFru2和AngFru3屬于絲狀真菌蔗糖酶,而AngFru4和AngFru5分別屬于內切菊粉酶和外切菊粉酶。
2.1.2 果糖基水解酶的氨基酸序列比對 氨基酸序列比對的結果表明,這些序列之間的相似度為10.27%~98.45%,平均值為27.65%。這些酶都具有果糖基水解酶的8個比較保守的結構域,包括A、B、B1、C、D、E、F和G(圖2)[14]。其中結構域A、D和E中還包含3個高度保守的酸性氨基酸殘基(圖2中灰色標出的氨基酸殘基),它們位于糖苷水解酶32(GH32)家族蛋白的活性位點[14]。
通過對不同來源的果糖基水解酶進行親緣關系遠近的分析以及氨基酸序列比對,發現A.nigerCBS 513.88來源的5個酶具有果糖基水解酶的高度保守的結構域。因此,它們均屬于果糖基水解酶家族。
2.2 重組表達載體的構建
進一步制備黑曲霉CICIM F0510的cDNA,以此為模板,對上述5個目標基因進行PCR擴增,并成功克隆入pPIC9K的SnaB I和EcoR I位點,獲得重組質粒。每個重組質粒的雙酶切結果見圖3。含fru1的重組質粒酶切出1.9 kb和9.3 kb兩條帶,與基因fru1和質粒pPIC9K的大小之和一致;其它四個質粒的酶切驗證結果也是正確的。這表明五個重組質粒構建成功,并將它們分別命名為pPIC9K-fru1、pPIC9K-fru2、pPIC9K-fru3、pPIC9K-fru4和pPIC9K-fru5。

表2 黑曲霉果糖基水解酶的基本特征Table 2 Properties of fructosyl hydrolases from A. niger

圖2 不同來源的果糖基水解酶的氨基酸序列比對Fig.2 Multiple sequence alignment of fructosyl hydrolases from different microorganisms注:(*),保守的氨基酸;(:),保守的替換;(.),半保守的替換;虛線表示的是空格。保守的酸性氨基酸殘基用灰色標出,8個保守的結構域(A,B,B1,C,D,E,F和G)在上方標出。
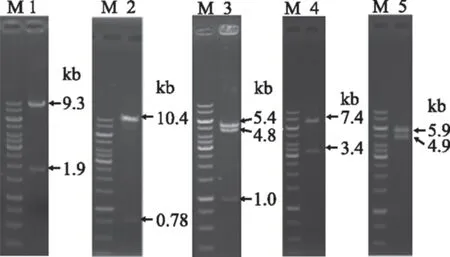
圖3 重組質粒的雙酶切鑒定Fig.3 Identification of the recombinant plasmids by double enzyme digestion注:M:1kb DNA ladder;1:fru1;2:fru2;3:fru3;4:fru4;5:fru5。
通過測序結果可知,除了有少數堿基和氨基酸的差異,fru2、fru4和fru5的測序結果與原始序列基本一致;而fru1和fru3的測序結果與原始序列完全一致(表2)。
2.3 重組果糖基水解酶的誘導表達
將上述構建獲得的5個重組質粒線性化后,轉化畢赤酵母GS115,獲得重組菌GS115(pPIC9K-fru1)、GS115(pPIC9K-fru2)、GS115(pPIC9K-fru3)、GS115(pPIC9K-fru4)和GS115(pPIC9K-fru5)。采用含有50 mL培養基的搖瓶進行發酵實驗,在甲醇的誘導下進行酶液制備。發酵持續120 h,離心收集獲得重組果糖基水解酶Fru1、Fru2、Fru3、Fru4和Fru5的粗酶液。通過酶活測定發現,重組酶Fru1和Fru5的酶活分別為1360和1560 U/mL(表3),遠遠高于目前報道的菊粉酶[15]和蔗糖酶[12,16]的酶活,具有潛在的工業化前景;Fru2表達水平很低,檢測不到酶活,與文獻報道一致[2];而Fru3和Fru4的酶活幾乎檢測不到,后續會將這三個基因在其它表達系統中進行表達。同步以pPIC9K質粒轉化畢赤酵母GS115獲得含有空白質粒的重組菌,其發酵液檢測不到果糖基水解酶酶活。

表3 重組果糖基水解酶的酶活Table 3 Activity of recombinant fructosyl hydrolases
注:“-”表示未檢測到酶活。
2.4 重組果糖基酶的酶學特征的研究
2.4.1 酶的最適反應溫度和熱穩定性 進一步對重組酶Fru1和Fru5的酶學性質進行研究。在不同溫度下測定Fru1和Fru5的酶活,結果見圖4(a)。重組酶Fru1的最適反應溫度為45 ℃,低于黑曲霉TH-2來源的蔗糖酶的最適反應溫度(65 ℃)[12];而重組酶Fru5的最適作用溫度為50 ℃,高于細菌來源菊粉酶的最適反應溫度(30~37 ℃),但低于鏈霉菌及青霉菌菊粉酶的最適反應溫度(60~70 ℃)[8]。溫度過高或過低,酶活均會迅速下降,溫度的變化對二種酶活都有較大的影響。熱穩定性的研究表明,重組酶Fru1和Fru5分別在30~45 ℃和40~55 ℃內較穩定(殘留的酶活在80%以上);而且在50~65 ℃內,Fru5的熱穩定性優于Fru1(圖4b)。此外,殘留酶活小于40%的溫度范圍分別為55 ℃以上和65 ℃以上。

圖4 Fru1和Fru5的最適作用溫度和熱穩定性 Fig.4 The optimal temperature and thermostability of Fru1 and Fru5注:a:最適作用溫度;b:熱穩定性。
2.4.2 酶的最適反應pH和pH穩定性 在不同pH反應條件下測定重組酶Fru1和Fru5的酶活,結果如圖5(a)所示。重組酶Fru1與Fru5的最適作用pH分別為5.5和5.0,而且它們均具有相對寬泛的pH作用范圍(pH4.5~6.0和pH4.0~5.5),在該pH范圍內相對酶活在80%以上。Fru1的最適作用pH高于黑曲霉TH-2的蔗糖酶的最適反應pH(4.4)[12];而Fru5的最適反應pH與已報道的黑曲霉來源菊粉酶的最適反應pH(4.0~5.0)[8,15]接近,也與已報道的絲狀真菌和酵母菌來源菊粉酶的最適pH(4.5~6.0)接近[8]。由pH穩定性的研究結果可知,在不同pH的0.1 mol/L磷酸氫二鈉-檸檬酸緩沖液中孵育1 h后,重組酶Fru1和Fru5分別在pH3.0~7.0和pH5.0~6.5的偏酸性條件下穩定性較好,殘留酶活在80%以上(圖5b)。與Fru5和來源于黑曲霉TH-2的蔗糖酶[12]相比,Fru1在較寬泛的pH范圍內相對酶活穩定。

圖5 Fru1和Fru5的最適作用pH及pH穩定性 Fig.5 The optimum pH and pH stability of Fru1 and Fru5 注:a:最適作用pH;b:pH穩定性。
2.4.3 離子和金屬螯合劑對酶的影響 各種金屬離子和螯合劑對重組酶酶活的影響見表4。由表4可知,K+、Zn2+和Mg2+對重組酶Fru1的酶活有微弱的抑制作用,而Fe2+、Na+、Co2+、Cu2+和Ca2+對其酶活有抑制作用,其中Ca2+的抑制作用比較顯著;Li+和Na+對Fru5的酶促反應有促進作用,而且Na+的促進作用比較明顯;Fe2+能顯著地抑制其酶活,而Zn2+、Mg2+、Ni2+、Mn2+和Co2+對其酶活有微弱的抑制作用。此外,EDTA對重組酶Fru1和Fru5的酶活均有微弱的促進作用,表明它們不是金屬酶[8]。

表4 金屬離子和螯合劑對Fru1和Fru5酶活的影響Table 4 Effects of metal ions and chelating agents on the activity of Fru1 and Fru5

圖6 重組酶Fru1和Fru5作用于蔗糖的產物分析 Fig.6 HPLC profile of sucrose catalyzed by recombinant Fru1 and Fru5注:a:蔗糖空白對照;b:Fru1;c:Fru5;峰1、2、3分別代表蔗糖、葡萄糖和果糖;峰4、5為高聚合度物質。
注:“-”表示未進行酶活測定;*表示有顯著性差異(p<0.05)。2.4.4 重組酶的底物催化特征分析 不同來源的蔗糖酶和菊粉酶與蔗糖和菊粉的結合及作用方式有差異,從而生成的產物也不同。為了考察重組酶Fru1和Fru5對蔗糖和菊粉作用產物聚合度的分布,對反應產物進行了HPLC分析。當以蔗糖為底物時,重組酶Fru1既可以將蔗糖水解為葡萄糖和果糖,也可以將其轉化為高聚合度的產物(圖6b)。因此,它既有水解作用,又有合成作用。而Fru5只能將蔗糖水解,并無合成作用(圖6c)。后續可以利用重組酶Fru1和Fru5對蔗糖的水解作用制備果葡糖漿[8],而Fru1對蔗糖的合成作用在低聚果糖、低聚乳果糖等新型果糖基衍生品的制備過程中具有潛在的應用價值[4-5]。
由圖7(a)可知,菊粉由13種物質混合組成。當以菊粉為底物時,重組酶Fru1能水解掉二糖、三糖、四糖和部分五糖,對六糖以上的多糖沒有作用(圖7b),它是否對菊粉有合成作用,還有待進一步分析。而Fru5能將不同聚合度的菊粉全部水解為單糖(圖7c),因此它對菊粉只有水解作用,沒有合成作用。因此,Fru5具有典型的外切菊粉酶的底物催化特征[17],可以用于高果糖漿及結晶果糖的生產過程中。此外,菊粉經過外切菊粉酶水解后產生的果糖可以作為發酵碳源,用于生產生物乙醇、生物油脂、乳酸、檸檬酸和單細胞蛋白等[8,18]。
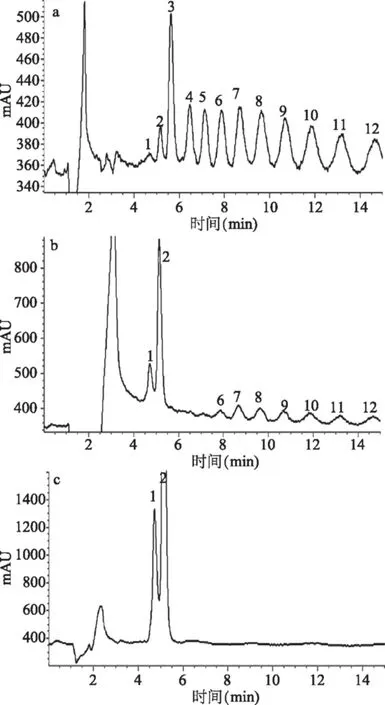
圖7 重組酶Fru1和Fru5作用于菊粉的產物分析 Fig.7 HPLC profile of inulin catalyzed by recombinant Fru1 and Fru5注:a:菊粉空白對照;b:Fru1;c:Fru5;峰1、2、3、4、5、6、7…12分別代表G(F)、GF(F2)、GF2(F3)、GF3(F4)、GF4(F5)、GF5(F6)、GF6(F7)…,其中,G和F分別為葡萄糖和果糖。
3 結論
本研究通過分子克隆與遺傳重組技術克隆及表達了黑曲霉來源的全部果糖基轉移酶,獲得的重組酶Fru1和Fru5的酶活分別為1360和1560 U/mL,遠遠高于目前已報道的蔗糖酶和菊粉酶的活性,為其大規模工業化生產奠定了良好的基礎。此外,酶學性質的研究表明,重組酶Fru1對蔗糖具有水解和合成活性,這為其用于果葡糖漿、低聚果糖以及低聚乳果糖的生產提供了可能。Fru5對蔗糖和菊粉都具有明顯的水解作用,為其在高果糖漿和結晶果糖的制造以及發酵碳源的制備等方面提供了重要的指導意義。
[1]高振鵬.于蘋果汁的液態果糖生產技術研究[D].西安:西北農林科技大學,2008.
[2]Yuan X L,Goosen C,Kools H,et al.Database mining and transcriptional analysis of genes encoding inulin-modifying enzymes ofAspergillusniger[J].Microbiology,2006,152(Pt 10):3061-3073.
[3]黃菁,張寧,張永韜,等.酶解大蒜渣制備果葡糖漿[J].食品與發酵工業,2010,36(12):89-93.
[4]Lafraya A,Sanz-Aparicio J,Polaina J,et al.Fructo-oligosaccharide synthesis by mutant versions ofSaccharomycescerevisiaeinvertase[J].Appllied and Environmental Microbiology,2011,77(17):6148-6157.
[5]Mu W M,Chen Q M,Wang X,et al.Current studies on physiological functions and biological production of lactosucrose[J].Appllied Microbiology and Biotechnology,2013,97(16):7073-7080.
[6]孔濤,吳祥云.菊芋中菊糖提取及果糖制備研究進展[J]. 食品工業科技,2013,34(18):375-378,382.
[7]張樂興.高果糖漿的性質與應用[J].廣州食品工業科技,2003,19(1):44-45.
[8]Neagu C,Bahrim G.Inulinases-a versatile tool for biotechnology[J].Innovative Romanian Food Biotechnology,2011,9:1-11.
[9]張麗娟.菊粉酶基因克隆及在畢赤酵母中表達[D].濟南:山東大學,2012.
[10]Tamura K,Dudley J,Nei M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J]. Molecular Biology and Evolution,2007,24(8):1596-1599.
[11]Ling Z,Ma T,Li J,et al.Functional expression of trypsin fromStreptomycesgriseusbyPichiapastoris[J].Journal of Industrial Microbiology and Biotechnology,2012,39(11):1651-1662.
[12]黃潔,梁建榮,蘇茉,等.黑曲霉TH-2蔗糖酶的分離純化及部分性質研究[J].西南大學學報:自然科學版,2011,33(2):70-75.
[13]Pel H J,de Winde J H,Archer D B,et al.Genome sequencing and analysis of the versatile cell factoryAspergillusnigerCBS 513.88[J].Nature Biotechnology,2007,25(2):221-231.
[14]Parrent J L,James T Y,Vasaitis R,et al.Friend or foe? Evolutionary history of glycoside hydrolase family 32 genes encoding for sucrolytic activity in fungi and its implications for plant-fungal symbioses[J].BMC Evolutionary Biology,2009,9:148.
[15]Kango N,Jain S C.Production and properties of microbial inulinases:recent advances[J].Food Biotechnology,2011,25:165-212.
[16]李陽.菊粉內切酶和蔗糖酶基因的高效重組表達及其在水解菊粉中的應用[D].青島:中國海洋大學,2014.
[17]Kango N,Jain S C.Production and properties of microbial inulinases:recent advances[J].Food Biotechnology,2011,25(3):165-212.
[18]Paix?o S M,Teixeira P D,Silva T P,et al.Screening of novel yeast inulinases and further application to bioprocesses[J].New Biotechnology,2013,30(6):598-606.
Recombinant expression and biochemical characterization of fructosyl hydrolases fromAspergillusniger
DONG Zi-xing1,2,XIAO Hua2,WANG Jing-pei2,ZHANG Zhi-meng2,WANG Jun2,LU Fu-ping2,*
(1.Department of Biochemical Engineering,College of Chemical Engineering and Materials Science,Tianjin University of Science & Technology,Tianjin 300457,China;2.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Objective:Fructosyl hydrolase plays a significant role in the preparation of novel fructose derivatives. It is important to obtain an efficient fructosyl hydrolase with high activity.Methods:Five fructosyl hydrolase-encoding genes in theAspergillusnigergenome were selected and analyzed by MEGA 4.0,Clustal X2 and other softwares. Subsequently,these genes were successfully cloned and expressed inPichiapastorisfollowed by comprehensive investigation of their biochemical properties. Results:At the shake-flask fermentation level,the activities of recombinant Fru1 and Fru5 were determined to be 1360 and 1560 U/mL,respectively,which were much higher than those of the fructosyl hydrolases ever reported. The optimum temperature and pH of recombinant enzyme Fru1 were 45 ℃ and 5.5,respectively. Its enzymatic activity was slightly enhanced by EDTA and inhibited by Na+,Co2+,Cu2+and Ca2+. Interestingly,this enzyme showed both hydrolytic and transglycosylation activities toward sucrose,and hydrolyzed short-chain inulin with degree of polymerization of 2~5. The temperature and pH optima of recombinant Fru5 were 50 ℃ and 5.0,respectively. It was remarkably enhanced by Li+,Na+and EDTA,and strongly inhibited by Fe2+. Fru5 could also hydrolyze sucrose and almost all polysaccharides in inulin. Conclusions:Our results have paved the way for the industrial manufacturing of fructosyl hydrolases and their applications in the production of novel fructose derivatives.
fructosyl hydrolases;novel fructose derivatives;Aspergillusniger;recombinant expression;enzymatic properties
2016-10-11
董自星(1986-),男,博士,助理研究員,研究方向:酶工程與技術,E-mail:dzx@tust.edu.cn。
*通訊作者:路福平(1967-),男,博士,教授,研究方向:應用微生物與酶工程,E-mail:lfp@tust.edu.cn。
TS201.2
A
1002-0306(2017)10-0178-07
10.13386/j.issn1002-0306.2017.10.026

