2型糖尿病抑郁患者自發腦活動靜息態功能磁共振特點
王 雪,武晉曉,焦秀敏,王 曄,周玉玲,張星光,呂肖鋒
?
2型糖尿病抑郁患者自發腦活動靜息態功能磁共振特點
王 雪1,武晉曉1,焦秀敏1,王 曄2,周玉玲1,張星光1,呂肖鋒1
目的 探討合并抑郁狀態的2型糖尿病患者自發性腦活動的靜息態功能磁共振特點。方法 應用患者健康自評量表(patient health questionnaire-9, PHQ-9)篩查糖尿病伴抑郁狀態(DM-D)患者29例,選取與之年齡、性別、受教育年限匹配的單純糖尿病(DM)患者25例。受試者均接受MRI掃描,應用分數低頻振幅(fractional amplitude of low-frequency fluctuation fALFF)分析方法比較兩組自發性腦區活動性異常的改變。結果 相對于DM組,DM-D組在右小腦后葉2區,右顳葉上、下角回,右額葉上、下回,右邊緣葉前扣帶回,右頂葉緣上回,左頂葉中央后回,左楔前葉,左角回等腦區fALFF值減低[P<0.05,多重比較校正(GRF校正)];在左殼核、左枕葉距狀回、右枕中回、右頂葉中央后回fALFF值增高(P<0.05,GRF校正)。相關性分析顯示DM-D組降低的角回及前扣帶回與PHQ-9自評量表評分成負相關。結論 應用靜息態功能磁共振技術顯示糖尿病合并抑郁狀態的患者存在多個腦區活動性異常的改變,且這些改變的腦區有助于進一步了解糖尿病共病抑郁患者的病理生理機制。
2型糖尿病;抑郁狀態;功能磁共振;分數低頻振幅
抑郁是由各種病因引起的以持久性情緒低落為臨床表現的一種常見的精神疾病,是身心疾病及早期死亡的重要危險因素[1],其臨床表現有多種類型。糖尿病[2]等慢性病(如心腦血管疾病[3]、癌癥[4]、卒中[5]、風濕[6]、骨質疏松[7])給患者帶來的軀體上不適也可促進抑郁情緒的發生。關于糖尿病與抑郁之間雙重相關性有Mate分析顯示,抑郁會使糖尿病的發病風險增加60%,而2型糖尿病患者有15%的風險患有抑郁[8]。加拿大糖尿病協會專家委員會臨床實踐指南(Canadian Diabetes Association Clinical Practice Guidelines Expert Committee)指出,糖尿病患者在精神疾病,特別是嚴重的抑郁癥、廣泛性焦慮癥及飲食失調等方面較一般人群更為普遍[9]。目前,兩者共病的病因探索尚沒有明確機制,而隨著影像學不斷深入研究,對于共病現象的局部腦區異常活動的研究為臨床及科研帶來更為有效的指導及應用。
1 對象與方法
1.1 對象 按照WHO診斷標準選取自2015-10至2016-09在陸軍總醫院內分泌科住院的2型糖尿病患者并進行PHQ-9自評量表[10]篩查。入選標準:年齡40~70歲;均為右利手;無神經系統癥狀及體征。排除標準:有明確精神病史及(或)神經系統疾病家族史;嚴重頭部外傷史;量表評估及臨床資料不完整及靜息態腦功能分析結果顯示頭動位移≥2 mm,角度>2°者。最終符合標準的糖尿病合并抑郁狀態29例(DM-D組)。另外選擇與之年齡、性別、受教育程度相匹配,且PHQ-9自評量表評分≤9分的2型糖尿病25例(DM組)。DM-D組中男12例,女17例;DM組中男11例,女14例。所有參與者均進行頭顱MRI掃描且簽訂知情同意書。兩組在年齡、性別、病程、糖化血紅蛋白水平等方面比較,差異無統計學意義(P>0.05,表1、2)。
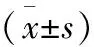

指標DM?D組(n=29)DM組(n=25)tP年齡(歲)53.689±8.68154.200±9.2060.2090.835病程(年)12.000±5.57710.462±5.201-1.7260.090糖化血紅蛋白(%)8.934±2.2318.848±1.900-0.0650.948空腹血糖(mmol/L)8.635±2.7688.353±2.0340.4220.675餐后2小時血糖(mmol/L)16.109±4.03517.520±4.4951.2150.230三酰甘油(mmol/L)2.178±1.9882.514±1.6390.6640.510高密度脂蛋白膽固醇(mmol/L)1.012±0.2490.967±0.212-0.7050.484低密度脂蛋白膽固醇(mmol/L)2.486±1.2372.718±1.9880.7950.430體重指數(kg/m2)28.379±3.60826.651±3.739-1.6830.104收縮壓(mmHg)148.000±14.944149.313±16.671-0.7240.419舒張壓(mmHg)77.138±13.69880.240±14.8560.7980.432
注:DM-D組指糖尿病合并抑郁狀態組,DM組為單純糖尿病組

表2 兩組2型糖尿病患者一般資料中計數資料的比較 (n;%)
注:DM-D組指糖尿病合并抑郁狀態組,DM組為單純糖尿病組
1.2 MRI數據采集 采用美國 GE 3.0T MRI掃描儀及頭部8通道線圈進行掃描,囑受試者保持清醒,閉眼、平靜呼吸,在掃描過程中盡量保持頭部固定。掃描參數按照美國 GE 3.0 T MRI標準參數設定,進行全腦3D-T1結構像掃描及靜息態-功能磁共振成像數據掃描。靜息態功能磁共振技術通過利用血氧信號的改變來間接反映局部腦區神經元活動的異常,為進一步定位腦區異常改變提供客觀依據;fALFF技術作為ALFF(amplitude of low frequency fluctuation)全頻段進行標準化后的分數值,對于腦脊液、腦室等非特性信號具有較好的抑制作用,提高了探測腦區自發性活動異常的敏感性和特異性[11]。
1.3 統計學處理 在基于Matlab 14.0的操作平臺上采用SPM12.0 (SPM12 - http://www.fil.ion.ucl.ac.uk/spm/)及數據處理助手(DPABI_V2.1,http://rfmri.org/dpabi)軟件對原始數據進行預處理。計算fALFF圖:應用DPABI_V2.1軟件中DPARSF小助手對頻段在0.01~0.08 Hz信號的功率譜行開方計算,得到低頻振幅ALFF值,相加得總和后,再除以全頻段振幅總和值,對全腦體素進行標準化處理,最后得到fALFF值。兩組分別進行單樣本t檢驗,得到關于fALFF值t圖,再將兩者進行獨立樣本t檢驗,得出兩組具有差異性的fALFF圖。最終結果應用DPABI_V2.1軟件進行GRF多重比較校正(P<0.05,體素數>10),GRF多重比較將T、F值均轉換為Z值。臨床數據資料采用SPSS 17.0軟件分析,均采用雙側檢驗,以P<0.05為差異有統計學意義。
2 結 果
兩組受試者fALFF值增高的腦區包括扣帶回/楔前葉、額葉皮質、雙側下頂葉等(圖1)。相對于DM組,DM-D組在右小腦后葉2區、右顳葉上、下角回,右額葉上、下回,右邊緣葉前扣帶回,右頂葉緣上回,左頂葉中央后回,左楔前葉,左角回等腦區fALFF值減低;在左殼核、左枕葉距狀回、右枕中回、右頂葉中央后回fALFF值增高(圖1,表3、4)。提取DM-D組減低的腦區與PHQ9評分進行相關性分析,顯示隨著評分的升高,減低腦區活動性逐漸減低,兩者呈負相關(圖2)。

圖1 兩組2型糖尿病患者靜息態功能磁共振顯示的fALFF圖(GRF校正,P<0.05,體素數>10)

腦區MNIXYZBA腦區體素數tP右小腦后葉42-72-51-33-5.23470.000右顳上回//顳下回63-21-212025-4.75130.000右額上回//額下回5427-34729-4.59230.000右角回48-75303936-4.16920.000右邊緣葉//前扣帶回333273212-4.87140.000右頂葉//緣上回57-5436-49-5.14690.000右頂下小葉-42-69393938-5.52040.000左頂葉//楔前葉-18-7245721-4.08970.000左頂下小葉//角回-42-69393938-5.52040.000
注:DM-D組指糖尿病合并抑郁狀態組,DM組為單純糖尿病組。MNI為蒙特利爾神經研究所標準頭解剖模版;T值為體素簇峰值的大小

表4 DM-D組較DM組fALFF值增強的腦區
注:DM-D組指糖尿病合并抑郁狀態組,DM組為單純糖尿病組。MNI為蒙特利爾神經研究所標準頭解剖模版。T值為體素簇峰值的大小

圖2 DM-D組右前扣帶回及右角回與PHQ-9得分相關分析
A.右角回,R=-0.409,P=0.028;B.右前扣帶回,R=-0.504,P=0.005
3 討 論
糖尿病與抑郁之間的關聯已成為公認的事實。有研究發現,老年抑郁癥與糖尿病大血管病變及認知功能的下降相關,且這種相關是相互的,可以隨著生命的進展而進一步發展[12]。但對兩者之間相互作用的具體機制目前尚不清楚。靜息態腦功能技術因無創性、空間分辨率高、對腦區定位準確等廣泛應用于多種疾病腦功能異常的研究。有不少研究應用靜息態腦功能發現,2型糖尿病患者及抑郁癥患者均存在異常活動的腦區,糖尿病患者以在扣帶回、顳中回、舌回、梭狀回、距狀回、枕中回等出現異常活動為主[13];抑郁患者以在丘腦、楔前葉、島葉、中央前回、前扣帶回等出現活動性異常信號為主[14],且有研究顯示,這些異常的腦區與抑郁量表評分及認知功能障礙有一定的相關性。本研究就兩者共病現象進行腦區異常活動的定位,為更好地理解其病理生理機制提供客觀依據。
有學者認為,抑郁情緒的調控網絡中,前額葉-杏仁核-紋狀體-丘腦中部是大腦內重要的情感調節回路,主要參與情感處理的過程[15]。Tekin和Cummings[16]曾對額葉皮質環路進行闡述,指出背外側前額葉病變可導致多種形式的情感改變。顳葉的邊緣系統與情感性功能活動相關,前扣帶回作為邊緣系統一部分,在情緒整合加工中起著極其重要的作用。關于抑郁患者腦功能連接的報道中發現,抑郁患者前扣帶回與顳中、下回,島回、舌回、小腦功能連接出現中斷,且功能連接強度與漢密爾頓抑郁量表評分呈負相關[17]。本研究發現,DM-D組患者在右側額葉、顳葉、前扣帶回、殼核區出現活動性異常的情況,從而可能出現上述環路異常的情況,導致患者出現心境及情緒調節紊亂。提取活動性降低的腦區,經量化后進行相關性分析,同樣得出隨著抑郁評分量表的升高,活動性降低的腦區也更為顯著。
楔葉作為參與高級認知功能整合的特殊腦區,同樣參與情節記憶及自我相關的信息處理過程;枕葉距狀回是中樞視覺處理及加工腦區;中央后回為軀體感覺的初級感受區,在研究糖尿病腦功能異常的研究中指出上述腦區均出現活動性降低的情況,且楔葉、距狀回等腦區與認知功能中執行能力呈負相關[18];本研究發現,上述腦區活動性增強的情況可能是患者出現代償功能的表現。因腦內有大量皮質神經元及豐富的傳導信號通路,形成的多模態形式可使某一部位的病變可能引起的功能缺失臨床表現上不太明顯。在對于抑郁患者研究中尚未出現此區活動異常的改變,這也可能是糖尿病患者所特有的腦區改變。本研究還發現,DM-D組出現緣上回及角回活動性降低的情況,角回及緣上回分別是對軀體定位、聽覺、視覺信息整合的多模式聯絡區,能特異性從事口語及非口語的聽覺激活,在臨床表現上患者均尚未出現聽覺障礙的現象,這也暗示此類患者應盡早進行聽力篩查,以早期得到有效診治。針對于上述特異性腦區的改變,本研究中患者因尚未進行抗抑郁治療,因此,針對于此類患者出現的特異性改變尚不能充分得到肯定,還需要大量樣本進一步深入研究。
綜上所述,本研究顯示糖尿病合并抑郁狀態的患者,經靜息態腦功能研究顯示多個腦區出現異常改變,這種異常改變為處于抑郁狀態的患者進行腦區功能定位提供基礎依據。
[1] Meier S M, Mattheisen M, Mors O,etal. Increased mortality among people with anxiety disorders: total population study [J]. Br J Psychiatry, 2016, 209(3): 216-221.
[2] Gafvels C, Hagerstrom M, Rane K,etal. Depression and anxiety after 2 years of follow-up in patients diagnosed with diabetes or rheumatoid arthritis [J]. Health Psychol Open, 2016, 3(2):1-12.
[3] Tully P J, Harrison N J, Cheung P,etal. Anxiety and cardiovascular disease risk: a review [J]. Curr Cardiol Rep, 2016, 18(12): 120.
[4] Liu Z, Zhang L, Shi S,etal. Objectively assessed exercise behavior in Chinese patients with early-stage cancer: a predictor of perceived benefits, communication with doctors, medical coping modes, depression and quality of life [J]. PloS One, 2017, 12(1): 1-9.
[5] Limampai P, Wongsrithep W, Kuptniratsaikul V. Depression after stroke at 12-month follow-up: a multicenter study [J]. Int J Neurosci, 2017, 20(1): 1-6.
[6] Abu-Shakra M. Quality of life, coping and depression in systemic lupus erythematosus [J]. Isr Med Assoc J, 2016, 18(3-4): 144-145.
[7] Bener A, Saleh N M, Bhugra D. Depressive symptoms and bone mineral density in menopause and postmenopausal women: a still increasing and neglected problem [J]. J Family Med Prim Care, 2016, 5(1): 143-149.
[8] Mezuk B, Eaton W W, Albrecht S,etal. Depression and type 2 diabetes over the lifespan: a meta-analysis [J]. Diabetes Care, 2008, 31(12): 2383-2390.
[9] Robinson D J, Luthra M, Vallis M. Diabetes and mental health [J]. Can J Diabetes, 2013, 37( Suppl 1): S87-92.
[10] Kroenke K, Spitzer R L, Williams J B. The PHQ-9: validity of a brief depression severity measure [J]. J Gen Intern Med, 2001, 16(9): 606-613.
[11] Zou Q H, Zhu C Z, Yang Y,etal. An improved approach to detection of amplitude of low-frequency fluctuation (ALFF) for resting-state fMRI: fractional ALFF [J]. J Neurosci Methods, 2008, 172(1): 137-141.
[12] Camus V, Kraehenbühl H, Preisig M,etal. Geriatric depression and vascular diseases: what are the links? [J]. J Affect Disord, 2004, 81(1): 1-16.
[13] Peng J, Qu H, Peng J,etal. Abnormal spontaneous brain activity in type 2 diabetes with and without microangiopathy revealed by regional homogeneity [J]. Eur J Radiol, 2016, 85(3): 607-615.
[14] Dutta A, McKie S, Deakin J F. Resting state networks in major depressive disorder [J]. Psychiatry Res, 2014, 224(3): 139-151.
[15] Marchand W R, Lee J N, Suchy Y,etal. Aberrant functional connectivity of cortico-basal ganglia circuits in major depression [J]. Neurosci Lett, 2012, 514(1): 86-90.
[16] Tekin S, Cummings J L. Frontal-subcortical neuronal circuits and clinical neuropsychiatry: an update [J]. J Psychosom Res, 2002, 53(2): 647-654.
[17] Wu H, Sun H, Xu J,etal. Changed hub and corresponding functional connectivity of subgenual anterior cingulate cortex in major depressive disorder [J]. Front Neuroanat, 2016, 10(120): 1-7.
[18] Cui Y, Jiao Y, Chen Y C,etal. Altered spontaneous brain activity in type 2 diabetes: a resting-state functional MRI study [J]. Diabetes, 2014, 63(2): 749-760.
(2016-12-10收稿 2017-02-15修回)
(責任編輯 武建虎)
Resting-state functional magnetic resonance imaging for patients with type 2 diabetes complicated with depressive state
WANG Xue1, WU Jinxiao1, JIAO Xiumin1, WANG Ye2, ZHOU Yuling1, ZHANG Xingguan1,and LV Xiaofeng1.
1.Department of Endocrinology, Beijing Army General Hospital, Beijing 100700, China; 2.The Second Military Medical University, Shanghai 200433, China
Objective To investigate the spontaneous brain activity in patients of diabetes complicated with depressive state using resting-state fMRI.Methods Twenty-nine cases were screened by PHQ-9 as diabetic patients complicated with depressive state (DM-D),while another 25 patients with diabetes mellitus(DM)alone who matched the DMD patients in gender, age, and education were selected as the control group. All the subjects were examined by resting-state fMRI. Fractional amplitude of low-frequency fluctuation (fALFF)was used to compare the changes of spontaneous abnormal brain activity in both groups.Results Compared with the DM group, DM-D group displayed decreased fALFF values in right cerebellum posterior crus2, the right temporal superior, right inferior gyrus, right angular gyrus, right frontal superior,middle, inferior gyrus, right limbic Lobe, right anterior cingulate, right parietal supramarginal gyrus, left parietal precuneus, and in left angular gyrus. However, in the left putamen, left occipital calcarine, left middle occipital gyrus, and left parietal postcentral gyrus, fALFF values were increased. Bivariate correlation analyses indicated that the decreased fALFF values and PHQ-9 self-rating scale scores were negatively correlated in DM-D group.Conclusions This resting-state fMRI study suggests that diabetic patients with depression have more than one abnormal brain activity, which helps to understand the pathophysiological mechanism of diabetic patients with depression.
type 2 diabetes; depressive state; resting-state fMRI; fractional amplitude of low-frequency fluctuation
王 雪,碩士研究生。
1.100700,北京陸軍總醫院內分泌科;2.200433,第二軍醫大學
呂肖鋒,E-mail:neifenmike@126.com
R587.1

