硅羥基磁珠的制備及全基因組DNA提取優化
李海洋王飛雷紅濤張璇2,陳珂
(1. 西南科技大學生命科學與工程學院,綿陽 621000;2. 廣東順德創新設計研究院,佛山 528000;3. 廣東省食品質量安全重點實驗室 農業部農產品貯藏保鮮質量安全風險評價實驗室 華南農業大學食品學院,廣州 510642)
硅羥基磁珠的制備及全基因組DNA提取優化
李海洋1王飛1雷紅濤3張璇2,3陳珂1
(1. 西南科技大學生命科學與工程學院,綿陽 621000;2. 廣東順德創新設計研究院,佛山 528000;3. 廣東省食品質量安全重點實驗室 農業部農產品貯藏保鮮質量安全風險評價實驗室 華南農業大學食品學院,廣州 510642)
旨在制備硅羥基功能化納米磁珠與核酸提取試劑,并對提取過程進行優化。采用溶劑熱法制備硅羥基功能化納米磁珠,并用表面化學修飾法在磁珠表面包裹SiO2;在自制磁珠提取過程中分別對比緩沖液濃度、裂解液濃度、磁珠量以及洗脫溫度等因素對DNA提取效率的影響,使用紫外分光光度計定量測定和瓊脂糖凝膠電泳定性驗證,并與商品化磁珠試劑盒提取效果進行對比。結果顯示,通過水熱法成功合成了粒徑在200 nm左右的Fe3O4@SiO2磁珠,當磁珠量為1.5 mg,裂解液為含5 mol/L的鹽酸胍溶液(pH4.9),緩沖液體系為含60%無水乙醇的60 mmol/L鹽酸胍緩沖液(pH7.5),洗脫溫度為65℃時,所提取的核酸效果達到最優,且4個因素對濃度的影響均存在統計學差異(P<0.05)。利用自制磁珠和試劑體系可高效的完成全血中全基因組DNA的提取,且優于商業化試劑盒。
納米磁珠;表面修飾;全基因組DNA提取
隨著分子生物學的快速發展,基因組水平研究已經成為熱點。無論是基因組學分析還是基因文庫的建立都需要提取出血液中的全基因組DNA[1]。而提取得到的DNA的濃度、純度以及一級結構的完整性會影響到后續分子生物學的研究。傳統的核酸提取方法大多利用離心、沉淀和色譜等方法,這些方法普遍存在操作時間長、過程復雜和用到有毒試劑等缺點[2]。故建立快速、高效、穩定且安全的DNA提取方法是分子生物學研究迫切需要的。
表面修飾的磁性納米粒子作為新型的功能材料,具有磁響應性和生物安全性[3]。在生物醫藥方面已得到廣泛應用。磁珠法提取核酸是利用磁性納米粒子與核酸結合,在外磁場的作用下達到分離純化核酸的目的[4]。
本研究通過對自制的硅羥基磁珠提取全基因組DNA的影響因素考察。優化Fe3O4@SiO2納米粒子提取全血DNA過程,采用核酸提取濃度、OD260/280及OD260/230三參數進行評價,探討磁珠量、裂解液、緩沖液及洗脫溫度對DNA提取效果的影響。同時,本試劑盒與商業化試劑盒進行性能比對,旨為快速提取基因組DNA方法提供最優方案。
1 材料與方法
1.1 材料
新鮮冷凍的血液樣品保存于-80℃超低溫冰箱;自制試劑盒;商業化磁珠法基因組DNA提取試劑盒購于廣州飛揚生物科技有限公司;蛋白酶K購于美國Merck公司;鹽酸胍購于上海賽百盛基因技術有限公司;Tris-base購于Biosharp公司;EDTA-Na2,TESO,NaAc,PEG4000購于健陽生物科技有限公司;其他試劑均為國產分析純。TENSOR27 紅外光譜儀(美國布魯克光譜儀器公司);VSM振動樣品磁強計(美國Quantum Design公司);NanoDrop2000超微量分光光度計(美國THERMO公司)。納米粒度分析儀Zetasizer Nano ZS(英國Malvern公司)。
1.2 方法
1.2.1 硅羥基磁珠的制備與表征 根據Geng等[5]的研究和預實驗最終確定制備過程為將5 mmol FeCl3·6H2O溶于40 mL乙二醇中,隨后加入3.6 g NaAc和1.0 g PEG4000,劇烈攪拌至完全溶解。將混合溶劑轉移至100 mL反應釜中,在200℃反應8 h,所得沉淀分別用去離子水和乙醇交替洗滌3次。40℃真空干燥12 h,即得到磁性Fe3O4納米粒子。取部分樣品用滅菌超純水制備成100 mg/mL的溶液,備用。
稱取300 mg水熱合成法的磁性Fe3O4納米粒子溶于150 mL 0.1mol/L的HCl中,超聲分散10 min,去離子水洗滌兩次后,加入240 mL乙酸,超聲分散10 min,隨后轉入三口燒瓶中,緩慢滴加3 mL 28%的濃氨水,稱取112 g的TESO置于其中,常溫下劇烈攪拌8 h。靜置后倒去上層液體所得沉淀分別用去離子水和乙醇交替洗滌3次。40℃真空干燥12 h,即得到磁性Fe3O4@SiO2粒子納米粒子。取部分樣品用滅菌超純水制備成100 mg/mL的溶液,備用。
磁珠的表征采用紅外光譜測試:采用KBr 壓片法,掃描范圍;磁學性能測試:采用振動樣品磁強計在298K條件下測定樣品的磁學性能。
1.2.2 DNA提取實驗步驟 取250 μL血液樣品到2 mL EP管中,加入25 μL蛋白酶K溶液和適量自制裂解液震蕩混勻,65℃孵育15 min;放冷至室溫后,沿管壁加入350 μL無水異丙醇立即混勻,然后加入適量體積100 mg/mL磁珠溶液充分振蕩,置于磁力架上磁分離,吸除廢液;加入適量自制緩沖液混勻,磁分離吸除液;加入800 μL 80%乙醇漂洗,磁分離吸除液體重復漂洗1次,室溫晾干后加入50 μL ddH2O洗脫,一定溫度條件下水浴10 min,置于磁力架吸附吸出液體得到DNA提純液體。
1.2.3 核酸提取實驗的條件優化 通過單因素實驗,先后優化磁珠量、裂解液中胍鹽濃度、緩沖液體系及洗脫溫度,這4個工作條件。采用核酸提取濃度、OD260/280及OD260/230三參數進行評價,當OD260/230在1.8-1.9,OD260/230大于2.0,同時核酸提取濃度越大,說明所提取的核酸純度高,濃度大,提取效果好。
1.2.3.1 磁珠量的優化 自制磁珠粒徑大約200 nm,濃度為100 mg/mL,為了考察磁珠用量對全基因組DNA提取效果的影響,實驗分別考察5、10、15、20、25和30 μL自制磁珠對核酸提取的效率進行優化。使磁珠用量分別為0.5、1.0、1.5、2.0、2.5和3.0 mg六組,每組設置3個平行對照。
1.2.3.2 緩沖液的優化 緩沖液在提取磁珠中是分離和分散磁珠和絮狀沉淀的重要一步,本實驗采用60 mmol/L鹽酸胍緩沖液(pH7.5)與一定體積無水乙醇配比作為緩沖液,并對緩沖液進行制備和優化配制,實驗分別考察含無水乙醇體積比為30%、40%、50%、60%、70%和80%的緩沖液液對核酸提取的效率進行優化。每組實驗設置3個平行對照。
1.2.3.3 裂解液的優化 本實驗采用高濃度低pH鹽酸胍溶液(pH4.9)來充分裂解血液細胞,為了考察裂解液對全基因組DNA提取效果的影響,在實驗其他步驟保持不變的情況下,實驗分別考察含3、3.5、4、4.5和5 mol/L的鹽酸胍裂解液對核酸提取的效率進行優化。每組實驗設置3個平行對照。
1.2.3.4 洗脫溫度的優化 對于磁珠法提取DNA在加入洗脫液洗脫核酸并將EP管放入恒溫水浴鍋分別以應用溫度分別為35℃、50℃、65℃和80℃,對其進行洗脫前的溫度處理,應用nanodrop2000測得核酸提取效率判斷溫度對核酸提取的影響。每組實驗設置3個平行對照。
2 結果
2.1 硅羥基基功能化磁性復合顆粒的表征
對自制磁珠和硅羥基磁珠同時采用KBr壓片法紅外光譜測試,結果(圖1-A)顯示,上方波形為裸磁珠紅外光譜,下方的波形為硅羥基修飾的磁珠,相比兩個波形在586 cm-1和1 224 cm-1均有很明顯的吸收峰。對自制裸磁珠和硅羥基磁珠分別通過振動樣品磁強計(VSM)測得數據(圖1-B)顯示,Fe3O4和Fe3O4@SiO2空心微球的飽和磁化強度分別為88.90 emμ/g和75.95 emμ/g。應用馬爾文粒度儀檢測,結果(圖1-C)顯示,硅羥基磁珠光強峰值在527 nm,粒徑主要分布在450-550 nm,平均粒徑為574 nm。
2.2 納米磁珠提取DNA的試劑優化結果
2.2.1 磁珠量優化結果 自制羧基功能化磁珠的濃度為100 mg/mL,在充分混勻的情況分別加入5、10、15、20、25和30 μL得到結果如圖2-A,其中在5-15 μL區間,核酸濃度隨加入磁珠的量增加而增大,但在15-30 μL范圍內,濃度差異并不明顯,幾乎趨于平穩,對于OD260/280和OD260/230在磁珠量低于15 μL時趨于穩定,分別保持在1.90-1.91和2.10-2.20之間,而當磁珠量大于15 μL后,OD260/280和OD260/230急劇下降。同時,對提取的樣品進行瓊脂糖凝膠電泳檢測,結果如圖2-B所示。
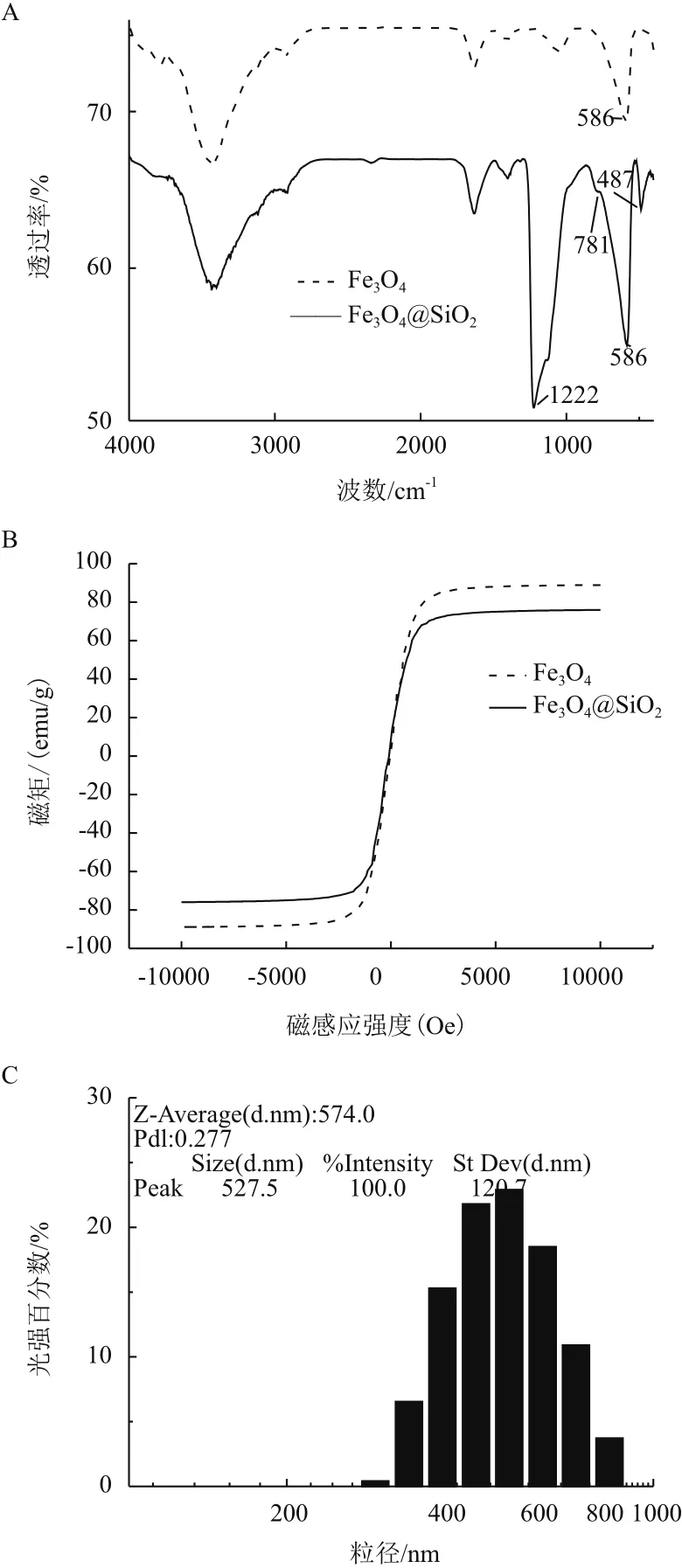
圖1 羧基功能化納米磁珠的表征
2.2.2 緩沖液優化結果 對自制核酸提取試劑盒的緩沖液進行優化,對鹽酸胍緩沖液與乙醇混合比例30%-80% 等差遞增條件進行了實驗,采用平均核酸濃度、OD260/280及OD260/230三參數進行評價。所得各項數據如圖3-A所示,當乙醇在緩沖液中占60%時,樣本的平均核酸提取濃度最高,且OD260/280為1.90,OD260/230為1.93。同時,對提取的樣品進行瓊脂糖凝膠電泳檢測,結果如圖3-B所示。
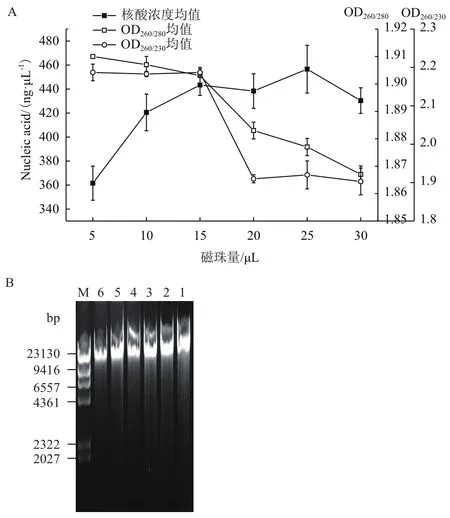
圖2 試劑盒磁珠量優化

圖3 試劑盒緩沖液乙醇含量優化
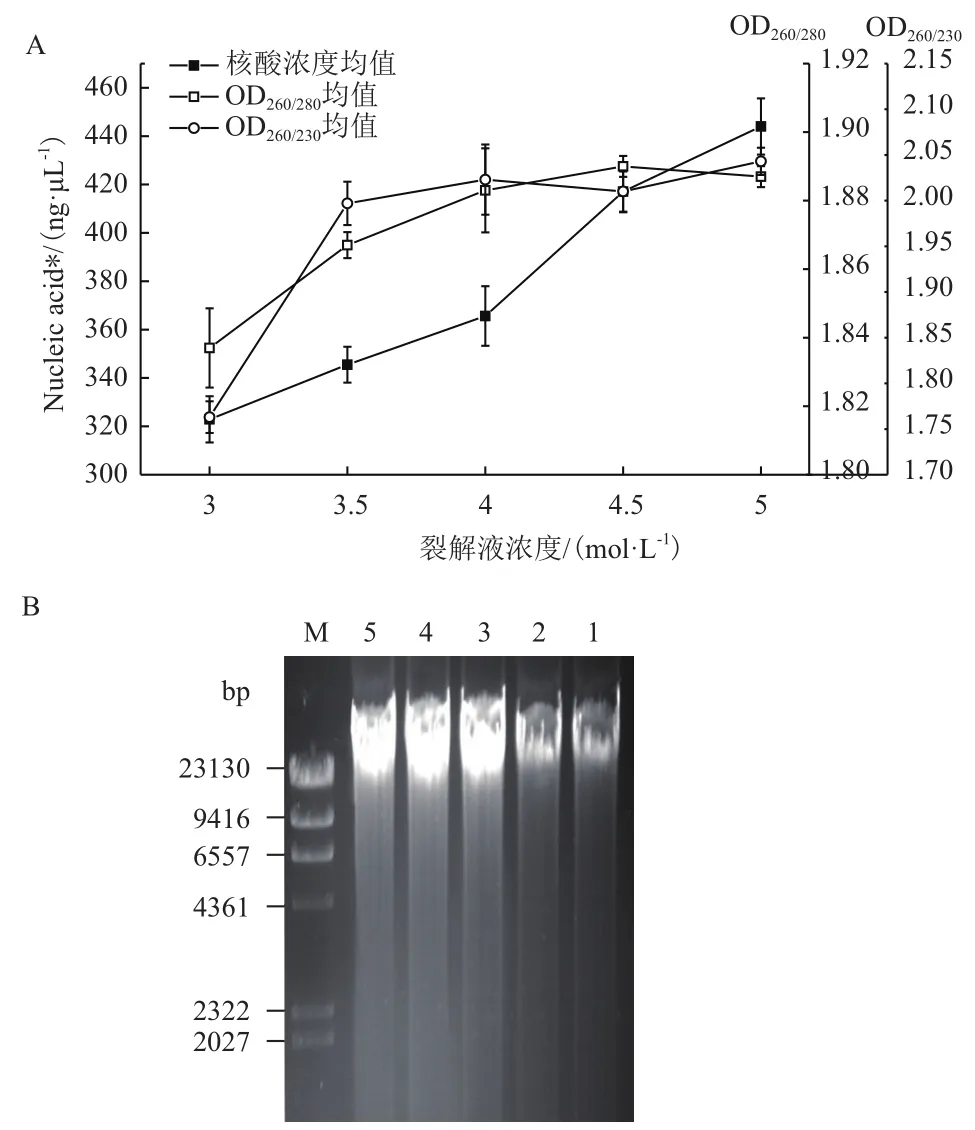
圖4 試劑盒裂解液濃度優化
2.2.3 裂解液優化結果 實驗分別考察含3、3.5、4、4.5和5 mol/L的鹽酸胍裂解液對血液進行裂解并提取核酸,結果如圖4所示,其中核酸濃度隨裂解液中鹽酸胍濃度的增加而增大,其濃度最大值表現在鹽酸胍濃度為5 mol/L時,對于核酸純度值OD260/280和OD260/230在鹽酸胍濃度高于4 mol/L后趨于穩定,分別保持在1.89-1.90和2.00-2.05之間(圖4-A)。同時,對提取的樣品進行瓊脂糖凝膠電泳檢測,結果如圖4-B所示。
2.2.4 洗脫溫度優化結果 在核酸提取的最后一步,加入洗脫液后我們對其進行水浴處理,應用溫度分別為35℃、50℃、65℃和80℃,結果(圖5)顯示,核酸濃度在洗脫溫度為65℃是的值最大,而在80℃的值最小,而對于核酸純度OD260/280數值穩定在1.90左右,OD260/230在溫度升高時有明顯的降低趨勢,但其數值均保持在2.15-2.25之間(圖5-A)。同時,對提取的樣品進行瓊脂糖凝膠電泳檢測,結果如圖5-B所示。

圖5 試劑盒核酸洗脫溫度優化
2.2.5 試劑盒對比結果 整合上述單因素實驗結果的最優工作條件,即磁珠量為1.5 mg,裂解液為含5 mol/L的鹽酸胍溶液(pH4.9),緩沖液體系為含60%無水乙醇的60 mmol/L鹽酸胍緩沖液(pH7.5),洗脫溫度為65℃,作為自制試劑盒的最優提取方案,當提取血量為250 μL時,DNA提取得率為20 μg左右。并與商業化試劑盒比較,結果如表1所示,其數據差異均滿足統計學差異(P<0.05),并對樣品進行瓊脂糖凝膠電泳(圖6)。
2.2.6 富集率實驗 綜合上述自制試劑盒的最優提取方案,取20 μg的全基因組DNA,采用本試劑盒提取方案,進行3組平行實驗,最后所得核酸產量為 19.04±0.13,OD260/280為 1.82,OD260/230為 2.03,最終所得樣品富集效率為88.7%-95.9%。
3 討論
在堿性條件下(pH值為9-10),在水介質中使用氯化鐵和尿素,可合成Fe2O3納米粒子[6]。與之相近應用溶劑熱法也可以很高效率的制備Fe3O4納米微粒[7]。本研究中應用水熱法制備Fe3O4納米微粒,并對其表面進行硅羥基修飾,得到可應用于核酸提取的硅羥基納米磁珠。
細胞核酸的提取是分子生物學重要的一步。傳統的幾種提取DNA的方法包括:煮沸法、鹽析法、酚-氯仿法、異丙醇沉淀方法、濾膜離心柱法[8,9]。Qie等[10]應用聚酰胺-胺型樹枝狀高分子PAMAM對DNA的結合效應將其修飾在鐵磁性納米粒子表面,應用修飾后的粒子提取DNA,此方法較為新穎。對各種傳統方法進行比較證明磁珠修飾法的提取效率高及過程較為便捷[11]。本實驗應用自制的納米磁珠表面修飾硅羥基進行核酸提取,并對裂解液濃度、緩沖液體系、磁珠量、洗脫溫度進行優化。實驗結果表示4個因素均對核酸的提取效率有影響。對于實驗結果用紫外分光光度計進行定量檢測,純DNA的OD260/280比值約為1.8,正常值為1.8-2.0。該比值小于1.6時表示樣品有蛋白質污染,同時當比值大于2.0時,則有RNA污染。而OD260/230表示DNA中的雜質鹽離子,正常的比值應大于1.8[12]。

表1 自制試劑盒與omega試劑盒對比結果
3.1 硅羥基磁珠的表征
由圖1-A可知,1 224 cm-1是O-Si-O的伸縮振動峰,其中3 426.0 cm-1是Fe3O4及SiO2表面的-OH峰和Fe-O的特征吸收峰發生重疊,同時586 cm-1和1 224 cm-1處的峰也說明Si和Fe3O4表面的-OH發生反應,從而證實包覆過程已發生[13]。對于振動樣品磁強計的測量結果(圖1-B)可看出在硅羥基包裹下磁珠磁力為75.95 emμ/g相比裸磁珠88.90 emμ/g有明顯的減弱,且均具有超順磁性[14]。Fe3O4@SiO2空心微球在磁場條件下由良好的磁響應性,這一性質對磁性離子在生物分離等領域中的應用非常重要。

圖6 omega試劑盒與自制試劑盒對比
3.2 磁珠量優化
在對于全血提取DNA的優化試驗中,Ling等[15]對提取磁珠量進行優化實驗,但實驗中僅僅取了TOYOBO公司的試劑盒磁珠40 μL和80 μL兩個樣本,對于實驗優化沒有一個較長的梯度現象。對于我們自制的硅羥基磁珠的濃度為100 mg/mL,在加入磁珠從5 μL到15 μL的過程中可以明顯看到核酸濃度呈上升的趨勢,且純度比值趨于平衡,15 μL以后磁珠濃度有少量的增加,而OD260/280和OD260/230有明顯的下降,表示不一定磁珠越多提取效率越高,過量的磁珠會影響后面的緩沖和漂洗過程,阻礙了對鹽離子的漂洗,造成樣品有鹽離子污染,同時也對蛋白酶K溶解蛋白質有一定的影響,故OD260/280出現走低趨勢。由此提取中出于核酸純度和經濟效益的關系,磁珠量選優結果為15 μL的磁珠。
3.3 緩沖液優化
在核酸提取的過程中,在加入磁珠除廢后加入緩沖液,主要是起到分散磁珠和純化DNA的作用,并有效的分散絮狀沉淀[16]。并且這個步驟在實驗中需重復兩次,對磁珠法提取核酸的效率有很大的影響,從圖3-A中乙醇比例在60%時達到了峰值,且OD260/280均值為1.907±0.006和OD260/230均值為1.933±0.015也幾乎位于最高點,圖3-A中泳道1,2,3,6均有拖帶現象,證明核酸純度不夠。對于OD260/230僅在乙醇比例為60%比值大于1.8,其他位置均存在鹽離子污染,所以緩沖液乙醇比例為60%時提取效率最優。
3.4 裂解液優化
Shan等[17]在優化實驗中得出裂解液中鹽酸胍濃度對核酸提取效率的影響較大,圖4-B中裂解液濃度較低時核酸濃度也較低,且樣品OD260/230低于1.8有鹽離子污染,并且OD260/280的比值也較低,隨裂解液濃度的增加明顯可見核酸濃度和純度比值均隨其增加而增大,在鹽酸胍濃度為4 mol/L時,純度比值OD260/280為1.883±0.023、OD260/230為2.023±0.078,且隨鹽酸胍濃度增加趨于穩定,均在正常純度范圍之內。而核酸濃度在4.5 mol/L時為417.10±8.32,在5 mol/L時為444.00±11.62其差異并不大,在圖4-B的電泳圖中345泳道的亮度明顯高于12,出于高效率而言5 mol/L是實驗的最優條件,而出于經濟考慮,采用4.5 mol/L的鹽酸胍溶液性價比更高。
3.5 洗脫溫度優化
從圖5-B結果可看出洗脫溫度較其他因素對核酸的提取效率影響較小,隨著溫度增加,核酸提取效率有一定的提高,但核酸純度值OD260/280和OD260/230均趨于平衡,且在較好的純度值范圍內,洗脫溫度在80℃時核酸濃度有些許的降低,表明溫度過高會破壞樣品中的核酸。故如需要短時間完成提取則不需要在洗脫過程中加熱,以便于節省時間且對核酸濃度影響不大,如需要更高的提取濃度,則在洗脫過程中需要在65℃水浴10 min,以得到最好的核酸提取效率。
3.6 試劑盒對比
根據實驗數據表明自制的試劑盒核酸濃度為438.63±18.28提取效率優于商業化的試劑盒提取的核酸濃度324.90±13.11。并且OD260/230為1.87,OD260/230達到2.203,即提取純度很高,所有數據均滿足統計學差異(P<0.05)。
4 結論
對磁珠法提取DNA的過程,對裂解液、緩沖液、磁珠量、洗脫溫度進行大量實驗,得到當裂解液濃度為5 mol/L,緩沖液乙醇含量為60%,磁珠量為15 μL,洗脫溫度為65℃時,自制硅羥基納米磁珠的提取效率最高,且優于商業化試劑盒,當提取血量為250 μL時,DNA提取得率為20 μg左右,樣品富集效率為88.7%-95.9%。
[1]Ormond KE, Wheeler MT, Hudgins L, et al. Challenges in the clinical application of whole-genome sequencing[J]. Lancet, 2010, 375(9727):1749-1751.
[2]LI XX, Zhao HY, Yang YT, et al. Comparing the three methods to extract human genomic DNA from whole blood[J]. Progress in Modern Biomedicine, 2013, 13(27):5221-5225.
[3]Sadeghi S. Surface modified magnetic Fe3O4nanoparticles as a selective sorbent for solid phase extraction of uranyl ions from water samples[J]. Journal of Hazardous Materials, 2012, 215-216(2):208-216.
[4]Xiao Y, Wang CH, Li X, et al. Research on magnetic separation methods for the extraction of nucleic acids[J]. Advanced Materials Research, 2013, 662(2):343-347.
[5]Geng MX, Liu FT. Preparation of Fe3O4nanoparticles by hydrothermal method[J]. Journal of University of Jinan, 2009, 8(4):401-404.
[6]Rahman M, Jamal A, Khan S, et al. Characterization and applications of as-grown -Fe2O3nanoparticles prepared by hydrothermal method[J]. Journal of Nanoparticle Research, 2011, 13(9):3789-3799.
[7]Li G, Shen B, He N, et al. Synthesis and characterization of Fe3O4@ SiO2core-shell magnetic microspheres for extraction of genomic DNA from human whole blood[J]. Journal of Nanoscience & Nanotechnology, 2011, 11(12):10295-10301.
[8]Tang JN, Zeng ZG, Wang HN, et al. An effective method for isolation of DNA from pig faeces and comparison of five different methods[J]. Journal of Microbiological Methods, 2008, 75(3):432-436.
[9]Mu?oz-Cadavid C, Rudd S, Zaki SR, et al. Improving molecular detection of fungal DNA in formalin-fixed paraffin-embedded tissues:comparison of five tissue DNA extraction methods using panfungal PCR[J]. Journal of Clinical Microbiology, 2010, 48(6):2147-2153.
[10]Qie F, Zhang G, Hou J, et al. Extracting genomic DNA of foodstuff by polyamidoamine(PAMAM)-magnetite nanoparticles[J]. Talanta, 2012, 93(2):166-171.
[11]Witt S, Neumann J, Zierdt H, et al. Establishing a novel automated magnetic bead-based method for the extraction of DNA from a variety of forensic samples[J]. Forensic Science International Genetics, 2012, 6(5):539-547.
[12]Wilfinger WW, Mackey K, Chomczynski P. Interpretation of nucleic acid OD260/280ratios[J]. Protocols and Product Manuals, 2012, 123(1):1-13.
[13]Sun J, Yu G, Liu L, et al. Core-shell structured Fe3O4@SiO2supported cobalt(II)or copper(II)acetylacetonate complexes:magnetically recoverable nanocatalysts for aerobic epoxidation of styrene[J]. Catalysis Science & Technology, 2014, 4(5):2496-2499.
[14]Mikhaylova M, Kim DK, Bobrysheva N, et al. Superparamagnetism of magnetite nanoparticles:dependence on surface modification[J]. Langmuir, 2004, 20(6):2472-2477.
[15]Ling J, Wang H, Zhang S, et al. Optimization of genomic DNA extraction with magnetic bead- based semi-automatic system[J]. Journal of Zhejiang University Medical Sciences, 2012, 41(3):320-326.
[16]Li G, Shen B, He N, et al. Synthesis and characterization of Fe3O4@ SiO2core-shell magnetic microspheres for extraction of genomic DNA from human whole blood[J]. Journal of Nanoscience & Nanotechnology, 2011, 11(12):10295-10301.
[17]Shan Z, Wu Q, Wang X, et al. Bacteria capture, lysate clearance, and plasmid DNA extraction using pH-sensitive multifunctional magnetic nanoparticles[J]. Analytical Biochemistry, 2010, 398(1):120-122.
(責任編輯 馬鑫)
Optimization of Genomic DNA Extraction with Silica Hydroxyl Magnetic Beads
LI Hai-yang1WANG Fei1LEI Hong-tao3ZHANG Xuan2,3CHEN Ke1
(1. School of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621000;2. Guangdong Shunde Innovative Design Institute,Foshan 528000;3. Guangdong Provincial Key Laboratory of Food Quality and Safety,Key Risk Assessment Laboratory of Agricultural Product Preservation,Ministry of Agriculture,College of Food Sciences,South China Agricultural University,Guangzhou 510642)
This study aims to prepare silicon hydroxyl functionalized magnetic nano magnetic beads and nucleic acid extraction reagents,and to optimize the extraction process. Solvent thermal method was employed to prepare the silicon hydroxyl functionalized nano magnetic beads,then coating SiO2on the surface of magnetic beads by surface chemical modification method. The effects of buffer concentration,lysate concentration,dose of magnetic beads and elution temperature on the efficiency of DNA extraction were analyzed by self-made magnetic beads extraction kit,respectively. All the experimental results,quantitatively by ultraviolet spectrophotometer,and qualitatively by agarose gel electrophoresis,were validated;meanwhile,the extraction results were compared with commercial kit. Results showed that we successfully synthesized the Fe3O4@SiO2magnetic beads of approximate 200 nm. The extraction efficiency of nucleic acid achieved the best on the conditions of magnetic beads was 1.5 mg,lysate contained 5 mol/L guanidine hydrochloride buffer(pH4.9),the buffer system was 60 mmol/L guanidine hydrochloride(pH7.5)with 60% ethanol,and elution temperature was 65℃. Moreover,there were statistical differences on the effects by the four factors(P < 0.05). In conclusion,using self-made magnetic beads and reagent system may efficiently carry out the complete genomic DNA extraction of whole blood,even it is better than the commercial kit.
magnetic nanoparticle;surface modification;genomic DNA extraction
10.13560/j.cnki.biotech.bull.1985.2016-1045
2016-11-18
國家自然科學基金項目(U1301214),廣東省自然科學基金項目(S2013030013338),四川省教育廳重點項目(15zd1117),四川省科技廳應用基礎項目(2015JY0015),四川省生物質改性重點實驗室項目(14tdgc02)
李海洋,男,碩士,研究方向:生物分析應用;E-mail:oceanlee2008@163.com
張璇,女,碩士,研究方向:生物分析化學,E-mail:zhang_xuan_2009@163.com;陳珂,男,博士,副教授,研究方向:污染環境生物修復研究,E-mail:chenke@swust.edu.cn

