1株野鳥源重組H3N2亞型禽流感病毒的遺傳進化分析
高見勛 , 黃廷賀 , 葛伯洋 , 樊兆斌
(1.遼寧益康生物股份有限公司 , 遼寧遼陽111000 ; 2.菏澤學院藥物科學與技術系 , 山東菏澤274000)
1株野鳥源重組H3N2亞型禽流感病毒的遺傳進化分析
高見勛1, 黃廷賀1, 葛伯洋1, 樊兆斌2
(1.遼寧益康生物股份有限公司 , 遼寧遼陽111000 ; 2.菏澤學院藥物科學與技術系 , 山東菏澤274000)
2014年4月-6月期間,在遼寧盤錦濕地采集野鴨泄殖腔拭子98份,分離到1株H3N2亞型禽流感病毒。作者對其進行了全基因組測序及HA和NA基因遺傳進化分析。HA基因遺傳進化樹分為4個分支,分離株屬于Avian分支,與Canine分支有較近的遺傳關系,共同聚到一個大分支,與Equine分支遺傳距離最遠。NA基因遺傳演化表明,分離株屬于亞洲分支。
H3N2亞型 ; 分子特征 ; 遺傳進化
H3N2禽流感病毒是A型流感病毒中的一個重要亞型。1968年7月中旬暴發的 “香港流感”,8至9月間經香港迅速傳播,引發全球大流行,導致近達到100萬人死亡,經查證此次流感大流行的“元兇”為H3N2流感病毒[1]。近些年該亞型病毒在全球大多數國家人流感流行病學監測結果中顯示為優勢毒株。該亞型流感病毒在豬群中主要為類人和基因重排H3N2兩種流行株[2]。近年,在自然及人為選擇雙重壓力下,該亞型病毒跨越種間傳播的機率也在逐步的加大,如2007年韓國和2010年中國廣東都報道了H3N2禽流感感染犬的病例,而且韓國出現了犬源H3N2病毒感染家貓的跨種間傳播[3-4]。野鳥作為禽流感病毒的天然宿主,為流感病毒的抗原變異提供了良好條件,作者對遼寧盤錦濕地1株野鳥源H3N2病毒全基因組進行了分析,旨在為禽流感病毒的疾病預測提供流行病學資料。
1 材料與方法
1.1 病毒 2014年4月-6月,遼寧盤錦濕地采集野鴨泄殖腔拭子98份,分離到1株H3N2禽流感病毒,命名為:A/Mallard/Liaoning/1/2014(H3N2),簡稱MD/LN/1/14。
1.2 病毒的分離及鑒定 病毒的分離與純化采用SPF雞胚系統,具有參考文獻[5]方法。參照禽流感診斷標準的HA-HI方法,使用H1~H16亞型禽流感及新城疫的標準血清初步判定病毒的亞型。以上病毒的分離都在遼寧益康生物股份有限公司P2實驗室完成。
1.3 病毒全基因組序列測定及遺傳進化分析 用TRIZol LS試劑盒從陽性雞胚尿囊液中提取病毒RNA,反轉錄合成cDNA后進行RT-PCR擴增,之后將純化的PCR產物后克隆到pGEMT-EASY載體上,陽性質粒送寶生物工程(大連)有限公司進行測序。用DNA STAR中的SeqMan對測序結果進行拼接,用BLAST工具進行同源序列搜索,用MEGA5.0軟件進行多序列比對分析以及系統進化樹的構建。
2 結果與分析
2.1 同源性比較 利用NCBI中的BLAST軟件搜索發現,分離株的8個基因片段與8株不同亞型的禽流感病毒同源性最高,屬于新的重組病毒。結果見表1。
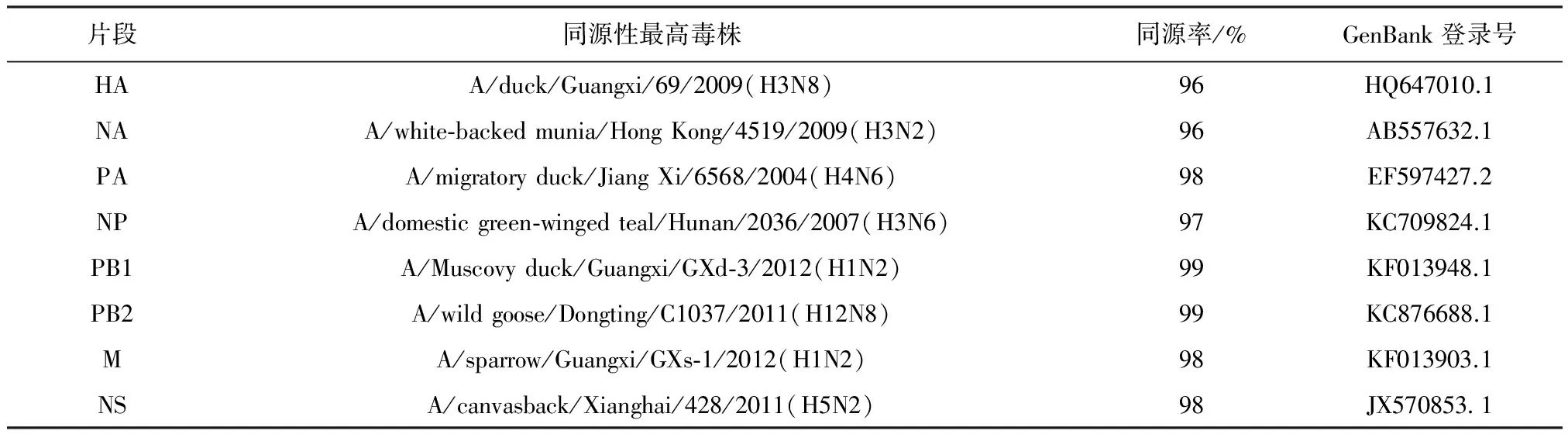
表1 MD/LN/1/14基因片段同源性分析
2.2 分子特征分析
2.2.1 HA分子特征分析 分離株HA蛋白序列分析表明,HA蛋白裂解位點為PEKQTR*GLF,具有低致病性禽流感的特征。分離株HA蛋白有6個潛在的糖基化位點,其與SW/GD/01/98、Moscow/10/99毒株的差異見表2。影響流感病毒受體結合特異性的關鍵位點為226,228[6],分離株兩個位點的氨基酸分別為Gln,Gly,仍保持優先結合SA-α-2,3-Gal受體的特性,不具備跨種傳播的能力。結果見表4。
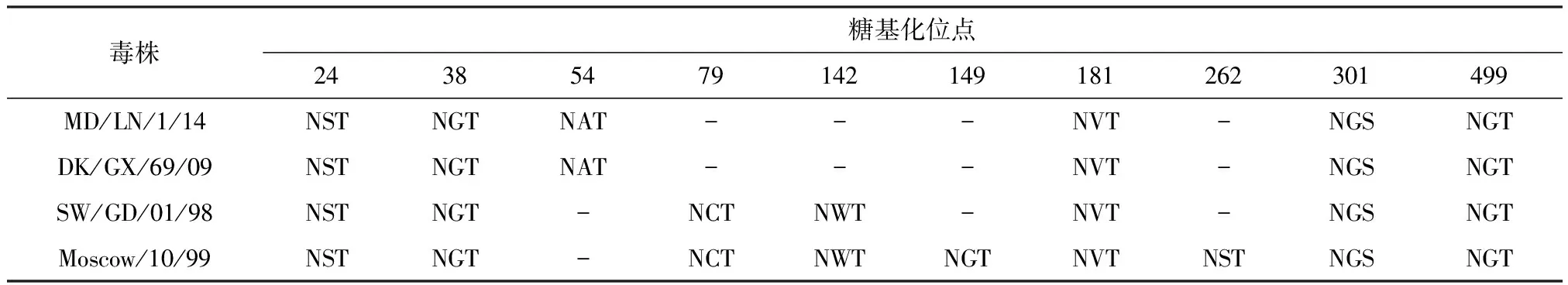
表2 HA蛋白潛在糖基化位點分析
DK/GX/69/09:A/duck/Guangxi/69/2009(H3N8);SW/GD/01/98:A/swine/Guangdong/01/1998(H3N2);Moscow/10/99:A/Moscow/10/1999(H3N2)
2.2.2 NA分子特征分析 野鴨源MD/LN/1/14有6個糖基化位點,與DK/China/92/09、Moscow/10/99,SW/GD/01/98毒株比較結果見表3。分離株NA分子中與流感病毒抗達菲類藥物相關的275(H-Y)氨基酸位點沒有發現突變[7]。結果見表4。
表3 NA蛋白潛在糖基化位點分析
2.2.3 其他基因分子特征分析 PB2分子的627位點和701位點被認為在流感病毒跨種間傳播中起關鍵性作用[8-9],分離株兩個位點均末發生突變。分離株M2分子與抗金剛烷胺類藥物相關氨基酸位點沒有突變[9]。NS1分子的92位點氨基酸由Asp突變為Glu,可以導致流感病毒對干擾素產生抗性[10],分離株末檢測到突變。結果見表4。
2.3 HA和NA基因分子進化分析 將分離的MD/LN/1/14毒株,與不同宿主來源、不同區域的代表株及GenBank中搜索的同源性較高的毒株進行分析,構建了HA和NA基因遺傳進化樹。從圖1-A可知,HA基因分為4個分支,MD/LN/1/14分離株聚類到Avian分支。此分支與Canine分支具有較近的遺傳距離,共同聚到同一個大分支,與Equine分支的遺傳距離則最遠。從圖1-B可知,NA基因遺傳進化樹劃分成亞洲和歐洲兩大分支,MD/LN/1/14分離株聚類到亞洲分支,該分支核苷酸同源率在87%~96%范圍內。
表4 關鍵位點的突變分析
圖1 基于HA基因(A)和NA(B)基因開放閱讀框構建的遺傳進化樹
3 討論
流感病毒HA分子的可裂解性在禽流感病毒組織嗜性及致病性方面起著關鍵作用[11]。MD/LN/1/14病毒HA蛋白裂解位點為PEKQTR*GLF,與禽源、人源及豬源相同。馬流感則為PEKQIR*GLF,其與Crawford等在2005年分離到的犬源H3N2流感病毒相同,而2009-2010年分離的H3N2亞型犬流感病毒則為PERQTR*GLF,我國廣東分離的1株犬流感卻與禽源H3亞型流感病毒裂解位點相同[12]。因此,HA蛋白裂解位點T328R和K326R的突變在H3亞型流感病毒宿主特異性方面需進一步研究證實。
MD/LN/1/14毒株HA分子有6個潛在糖基化位點,而SW/GD/01/98 和Moscow/10/99分別有7個和9個。謝劍鋒對1996-2011年福建省H3N2亞型流感病毒分子特征分析中發現,HA蛋白糖基化位點有隨著時間的推移逐漸增加的趨勢,這可能是病毒為了逃逸宿主免疫屏障的壓力而發生的抗原漂移[13]。野鳥由于其特殊的行為和生活習性,以及不存在接種疫苗的原因,這可能是導致其糖基化位點較少的一個重要原因。NA蛋白中與流感病毒抗達菲類藥物相關的氨基酸位點的突變在分離株中均未檢測到,這可能與野鳥不接觸抗病毒類藥物有關。
HA基因系統進化分析發現,分離株劃歸于Avian分支,主要為分離于水禽的H3亞型禽流感病毒,分布于東亞,歐洲及西伯利亞等地域。Avian分支與Canine分支遺傳關系較近,與Equine分支遺傳關系較遠。分析我國廣東分離的犬源H3N2亞型HA氨基酸序列,發現其耐藥性,關鍵性受體結合位點及與致病性相關的位點同禽源保持較高度一致,卻與豬源、馬源及人源表現出較大的不同,這表明我國2010-2011年間流行的H3N2亞型犬流感,可能是犬與家禽接觸過程中或者食用生禽肉次感染了該病毒,此與Song等研究的韓國犬貓源H3N2亞型病毒可能來自于鳥類的分析結果一致。因此,我們需要加大我國野鳥、家禽及犬H3亞型禽流感病毒的監察力度,及時掌握禽流感病毒的遺傳變異規律,為進一步加強防控H3亞型禽流感病毒跨越種間傳播提供充足的數據基礎。
[1] 杜寧,楊霄星,藍雨,等.1968 年香港流感(H3N2)病原學概述[J].病毒學報,2009,25(5):17-20.
[2] Olsen C W,Karasin A I,Carman S,etal. Triple reassortant H3N2 influenza A viruses,Canada,2005[J].Emerging infectious diseases,2006,12(7):1132.
[3] Song D,Kang B,Lee C,etal. Transmission of avian influenza virus (H3N2) to dogs[J]. Emerging infectious diseases,2008,14(5):741.
[4] Lin Y,Zhao Y,Zeng X,etal. Genetic and pathobiologic characterization of H3N2 canine influenza viruses isolated in the Jiangsu Province of China in 2009-2010[J]. Veterinary microbiology,2012,158(3):247-258.
[5] 郭元吉,程小雯.流行性感冒病毒及其試驗技術[M]. 北京:中國三峽出版社,1997:87-90.
[6] Yamada S,Suzuki,Y,Suzuki T,etal. Haemagglutinin mutations responsible for the binding of H5N1 influenza A viruses to human-type receptors[J]. Nature,2006,444,378-382.
[7] Brookes S M,Irvine R M,Nunez A,etal. Influenza A (H1N1) infection in pigs[J]. Veterinary Record,2009,164(24): 760-761.
[8] Katz J M,Lu X,Tumpey T M,etal. Molecular correlates of influenza A H5N1 virus pathogenesis in mice[J]. Journal of virology,2000,74(22):10807-10810.
[9] Li Z,Chen H,Jiao P,etal.Molecular basis of replication of duck H5N1 influenza viruses in a mammalian mouse model[J]. Journal of virology,2005,79(18):12058-12064.
[10] Li S,Shi Z,Jiao P,etal. Avian-origin H3N2 canine influenza A viruses in Southern China[J]. Infection,Genetics and Evolution,2010,10(8): 1286-1288.
[11] 曹梅,田夫林,莊文忠.禽流感病毒血凝素分子生物學研究進展[J].動物醫學進展,2004,25(2): 35-37.
[12] 余利旋,熊永忠,遠立國,等.H3N2亞型犬流感病毒的分離鑒定[J].中國預防獸醫學報,2011,33(001):15-18.
[13] 謝劍鋒.福建省H3N2亞型流感病毒分子流行病學特征分析[D].福州:福建醫科大學,2012.
Phylogenetic Analyses of a Novel H3N2 Avian Influenza Virus Isolated from a Mallard
GAO Jian-xun1, HUANG Ting-he1, GE Bo-yang1, FAN Zhao-bin2
(1.Yi Kang Biotechnology co., LTD of Liao Ning, Liaoyang 111000, China; 2.Department of Pharmaceutical Science and Technology, Heze 274000, China)
From April to June 2014,98 cloaca samples were collected from mallard in wetland of Panjin,Liaoning province,and a novel H3N2 strain AIV was isolated. The complete gene sequences and phylogenetic analyses were performed. The HA Phylogenetic tree was divided into four lineages and the isolate belonged to Avian lineage. This lineage had the shortest genetic distance from canine lineage,but a further distance from equine lineage. The isolate fell into Asian lineage in the NA phylogenetic tree.
H3N2 subtype ; molecular characterization ; genetic evolution
FAN Zhao-bin
2016-08-30
國家自然科學基金青年基金項目(31402170);遼寧科技廳自然科學基金項目(2014022045)
高見勛(1985-),男,本科生,就讀于動物病毒分子生物學專業,E-mail:438321212@qq.com
樊兆斌,E-mail:18724591358@163.com
S858.31
A
0529-6005(2017)05-0012-03

