野外采集和人工飼養胭脂魚耳石微結構特征分析
雷毅, 周宇, 楊坤, 武佳韻, 張修月, 宋昭彬, 3*
(1. 四川大學生命科學學院,四川省瀕危野生動物保護生物學重點實驗室,成都610064; 2. 四川農業大學生命科學學院,四川雅安625014; 3. 四川大學生命科學學院,生物資源與生態環境教育部重點實驗室,成都610064)
野外采集和人工飼養胭脂魚耳石微結構特征分析
雷毅1, 周宇1, 楊坤1, 武佳韻2, 張修月1, 宋昭彬1, 3*
(1. 四川大學生命科學學院,四川省瀕危野生動物保護生物學重點實驗室,成都610064; 2. 四川農業大學生命科學學院,四川雅安625014; 3. 四川大學生命科學學院,生物資源與生態環境教育部重點實驗室,成都610064)
分別檢測了人工飼養和野外采集胭脂魚Myxocyprinusasiaticus耳石微結構特征。根據透明性的差異,可將耳石劃分出暗區和亮區兩部分,63.16%人工飼養胭脂魚的耳石具有明顯的亮暗區界限,暗區大小為0.17 mm±0.03 mm;14.81%野外采集胭脂魚的耳石亮暗區界限清晰,大部分亮暗區界限模糊或沒有亮暗區差異,暗區大小為0.14 mm±0.06 mm。人工飼養和野外采集胭脂魚耳石中心核直徑分別為13.10 μm±1.87 μm和11.14 μm±1.74 μm,原基個數分別為1個和1~2個。人工飼養胭脂魚耳石標記輪1~3條,生長輪寬度為2.14 μm±0.59 μm,寬度均勻,波動幅度小;野外采集個體耳石標記輪1~7條,生長輪寬度為2.54 μm±1.12 μm,波動幅度相對較大。生長輪寬度聚類分析表明,在歐氏距離為2.5處可將94.59%的人工飼養胭脂魚耳石聚在一起,聚類結果與微結構特征檢測結果基本吻合。人工飼養與野外采集胭脂魚耳石的亮暗區、生長輪寬度、標記輪等微結構特征差異明顯,可用于兩者的識別。
胭脂魚; 野外采集; 人工飼養; 耳石微結構; 群體識別
胭脂魚Myxocyprinusasiaticus(Bleeker)屬鯉形目Cypriniformes亞口魚科Catostostomidae胭脂魚屬Myxocyprinus(丁瑞華,1994),其生長快、個體大、肉味鮮美,且具有較高的觀賞價值,是我國傳統的名貴經濟魚類之一(祝東梅等,2013;Chuetal.,2016)。該物種曾在長江和閩江廣泛分布,且產量較大(陳春娜,2008;Chengetal.,2013)。受水利工程修建、過度捕撈、水體污染等影響,閩江的胭脂魚已幾近絕跡,長江中的分布區也逐漸縮小,已被列為國家Ⅱ級重點保護水生野生動物(張春光等,2000;Lietal.,2013)。胭脂魚自然種群數量銳減,人工增殖放流是保護和恢復其資源的重要途徑(武佳韻等,2014)。然而,胭脂魚放流時大多數個體未被標記,無法準確識別放流和野生個體,勢必影響胭脂魚放流效果的評估。因此,建立準確、有效的個體識別方法尤為重要。
在魚體的各種器官組織中,耳石的結構與組成成分相當穩定,能記錄魚類生長和發育中所經歷的一些重要事件,如初次攝食、變態、定居、棲息地改變及生存環境的突然變化等(Johetal.,2011;黎雨軒等,2013;李鳳瑩等,2014)。自Pannella(1971)首次報道魚類耳石日輪后,耳石微結構的研究引起了國內外學者的濃厚興趣并不斷發展起來,耳石日輪已在海、淡水硬骨魚類中得到普遍證實(Dingetal.,2015;Cardosoetal.,2016)。如今,耳石微結構的檢測與分析已成為魚類生態學及漁業生物學研究中一項重要而公認的技術,為準確研究魚類的種群生態學特征提供了新途徑,同時還有助于建立識別魚類種群的新方法。有研究表明,生存環境條件的差異,如食物、晝夜溫差、競爭壓力等,可能影響耳石微結構的式型,使魚類耳石微結構表現出一定的差異,可用于群體的鑒別(Johetal.,2011;Pecketal.,2015)。許多研究通過對耳石微結構的檢測和分析,也都實現了對魚類不同群體的識別(Paragamianetal.,1992;Hendricks & Torsello,1994;宋昭彬等,2003a;Yamadaetal.,2009)。然而,人工飼養和野生胭脂魚耳石微結構是否存在可用于兩者識別的差異,尚未見報道。
本研究對野外采集和人工飼養胭脂魚耳石微結構進行檢測和分析,旨在找出人工飼養和野生胭脂魚耳石微結構的穩定差異,從而有效地區分人工飼養和野生胭脂魚,為人工放流群體的識別、放流效果的評估等提供依據。
1 材料與方法
1.1 材料采集
野外胭脂魚樣本分別采自重慶市萬州長江江段(2007—2013年,體長5.57~17.55 cm,體質量2.8~89.8 g)、木洞長江江段(2013年,體長5.1~15.1 cm,體質量2.0~53.4 g)、瀘州-合江長江江段(2012年,體長11.2~31.9 cm,體質量31.2~682.3 g)和宜賓市長江江段(2013—2015年,體長4.4~6.2 cm,體質量1.76~5.76 g)。人工飼養胭脂魚樣本分別采自四川省農業科學院水產研究所(2012年,體長6.12~13.12 cm,體質量5.0~36.1 g)、重慶市萬州水產研究所(2013年,體長11.4~16.2 cm,體質量30~85.6 g)和宜賓珍稀水陸生動物研究所(2013年,體長11.8~19.9 cm,體質量26.4~146.2 g)。
1.2 耳石的摘取和磨片制備
用剪刀剪開胭脂魚腦顱骨,將左、右耳石取出,經無水乙醇清洗后晾干,分別保存于1.5 mL離心管中。選取左耳石,用Krazy glue固定于載玻片上,依次用800#、1200#和1500#水磨砂紙沿耳石矢切面打磨,打磨過程中不斷在顯微鏡下檢查,直至打磨到生長中心。然后將耳石翻面,用同樣的方法打磨另一面。打磨完成后,加熱使Krazy glue熔化,取下耳石用無水乙醇清洗、二甲苯透明后,中性樹脂封片保存,以備耳石微結構檢測。
1.3 檢測、拍照
在NIKON YZ2光學顯微鏡下鏡檢耳石微結構特征,統計原基個數和標記輪條數。用CANON US 60B數碼相機和OLYMPUS BX43顯微鏡組成的照相系統對耳石磨片拍照。使用計算機輔助圖像分析系統(宋昭彬,2000)測量耳石中心核大小,當耳石形狀呈圓形時,測量直徑,否則測量長徑;測量耳石原基至標記輪的距離;測量沿耳石短徑方向的暗區半徑和從距耳石原基100 μm處開始的20個連續生長輪寬度(圖1)。
1.4 數據處理與分析
用Excel 10.0和Graph Pad Prism 5.0進行數據統計和分析。以20個連續生長輪寬度為指標,用SPSS 19.0進行聚類分析。借助Adobe Photoshop CS6對圖片進行編輯處理。
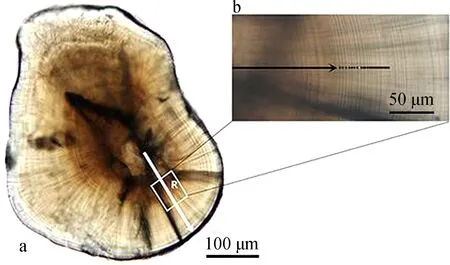
圖1 胭脂魚耳石生長輪的測量
a. 矢狀面全貌(R. 生長輪測量方向), b. 生長輪寬度的測量。
a. whole section of the sagittal plane (R. the direction of the measurement), b. measurement of the daily increments.
2 結果
2.1 人工飼養胭脂魚耳石微結構特征
根據耳石矢切面上透明度和光密度的差異,可將人工飼養胭脂魚耳石大致劃分出暗區和亮區。入射光下,暗區顏色深,亮區顏色較淺;反射光下,暗區不透明,亮區透明度較高(圖版Ⅰ:1,2)。耳石亮暗區透明度差異較大,兩區交替處可觀察出明顯的顏色差異,63.16%的耳石(n=57)能夠看出兩區分界(圖版Ⅰ:1,2,6),暗區大小為0.17 mm±0.03 mm。
胭脂魚耳石磨片上具有一圓形或橢圓形的生長中心,為耳石中心核(圖版Ⅰ:1,3),人工飼養胭脂魚耳石中心核直徑為13.10 μm±1.87 μm (n=83);其內深黑色的圓形、卵圓形或橢圓形結構為耳石原基,所檢測的人工飼養胭脂魚耳石(n=64)均表現為1中心核1原基。耳石中心核周圍明暗相間的環紋構成生長輪。人工飼養胭脂魚耳石生長輪較均勻(圖版Ⅰ:6,9),寬度為2.14 μm±0.59 μm,波動幅度為0.49~4.74 μm(n=43)(圖2)。少數生長輪顏色很深、寬度較寬,顯著區別于其他生長輪,為標記輪(圖版Ⅰ:10)。人工飼養胭脂魚耳石上通常具有1條、2條或3條標記輪,所占比例分別為48.98%、35.71%和6.12%(n=98),各標記輪在耳石上的位置較穩定,分別為10.57~13.48 μm、25.49~38.07 μm、36.74~56.83 μm。
2.2 野外采集胭脂魚耳石微結構特征
野外采集胭脂魚耳石同樣可以劃分出亮區和暗區(圖版Ⅰ:3,4),但僅14.81%耳石(n=81)的亮暗區分界明顯,耳石暗區大小為0.14 mm±0.06 mm;56.79%的耳石除具有明顯的中央暗區和外部亮區外,兩者之間有一個過渡區域(圖版Ⅰ:4,10);28.39%的耳石無明顯的亮暗區差別(圖版Ⅰ:5)。
野外采集胭脂魚耳石中心核直徑為11.14 μm ±1.74 μm(n=85),大多數耳石(86.42%)為1中心核1原基,少數耳石為1中心核2原基。生長輪寬度為2.54 μm±1.12 μm,波動較大(圖版Ⅰ:7,8),幅度為0.51~12.13 μm(n=23)(圖2)。標記輪數量為1~7條,所占比例依次為4.65%、8.14%、27.91%、25.58%、16.28%、5.81%和3.49%(n=86),標記輪在耳石上的位置不固定。
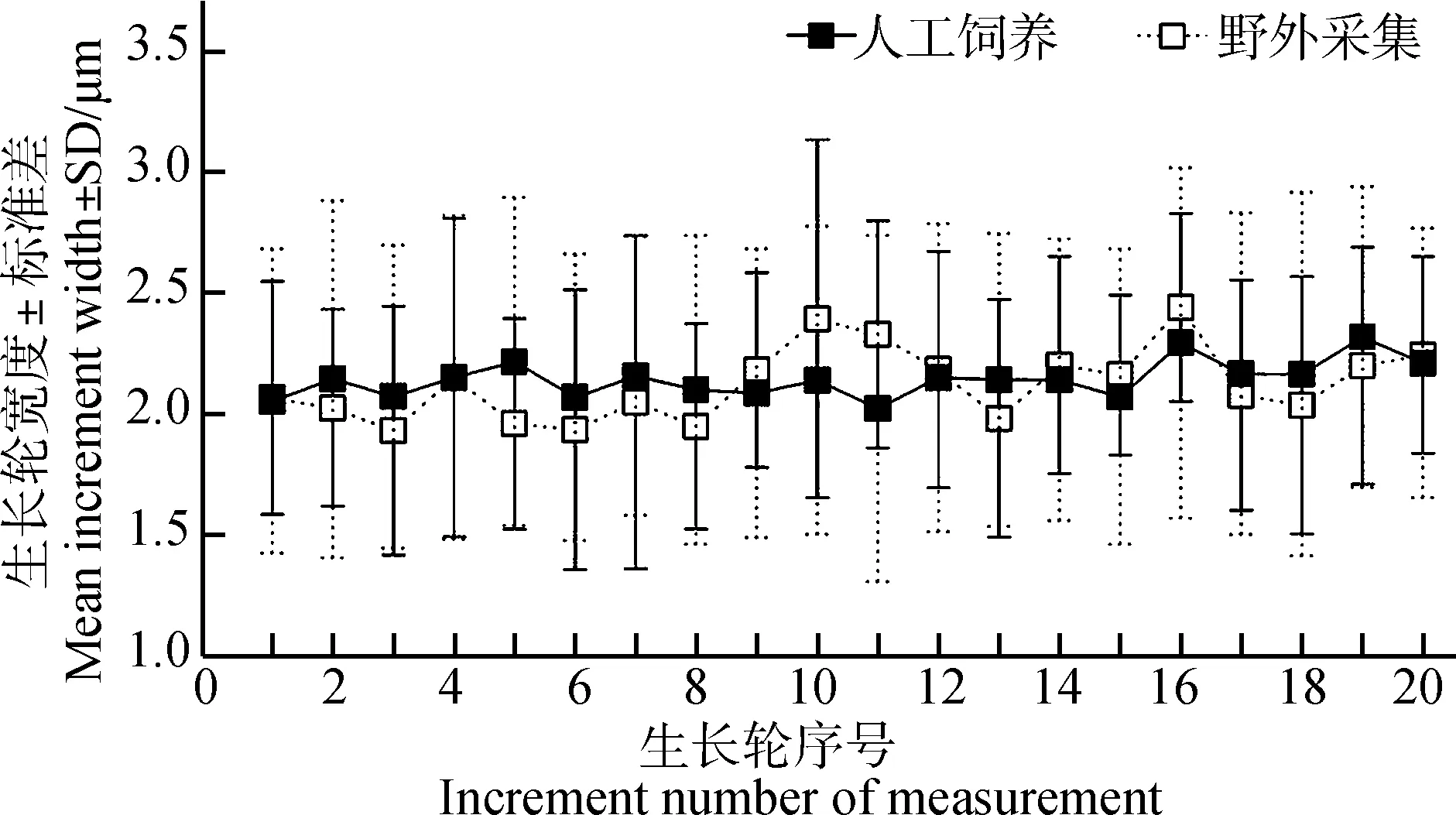
圖2 人工飼養和野外采集胭脂魚耳石上部分生長輪寬度比較
對野外采集胭脂魚耳石微結構的檢測發現,23.45%的耳石(n=81)中間部分微結構特征更多地與人工飼養胭脂魚耳石微結構特征相符,耳石的亮暗區分界明顯,暗區大小為0.15 mm±0.02 mm(圖3:a);耳石中心為1中心核1原基,中心核大小為12.81 μm±1.04 μm(圖3:b);生長輪均勻,寬度為2.09 μm±0.96 μm,波動幅度0.57~6.74 μm,耳石中間部分的生長輪相對清晰,耳石外緣部分則相對模糊(圖3:c)。這些個體可能是被誤捕的人工放流胭脂魚。
2.3 歐氏聚類
以20個連續生長輪寬度為指標進行聚類分析,結果表明,在歐氏距離為2.5處可將94.59%的人工飼養胭脂魚耳石(n=37)聚在一起(類群Ⅰ),同時,類群Ⅰ中還包含42.11%的野外采集胭脂魚耳石(n=57)(圖4),依據人工飼養和野生胭脂魚耳石微結構特征的差別,對此部分耳石的微結構特征進行復核,有9顆耳石的微結構特征與野生胭脂魚耳石微結構特征相符,余下耳石均檢測到人工飼養胭脂魚耳石的典型特征,包含了78.95%的通過耳石微結構特征檢測被判定為人工放流胭脂魚的耳石。對未能聚到類群Ⅰ中的人工飼養胭脂魚耳石(MR-17和MR-14)的輪紋寬度、亮暗區、標記輪等耳石微結構特征進行檢測,其多數結構特征與人工飼養胭脂魚耳石微結構特征相吻合,可能為聚類誤差。
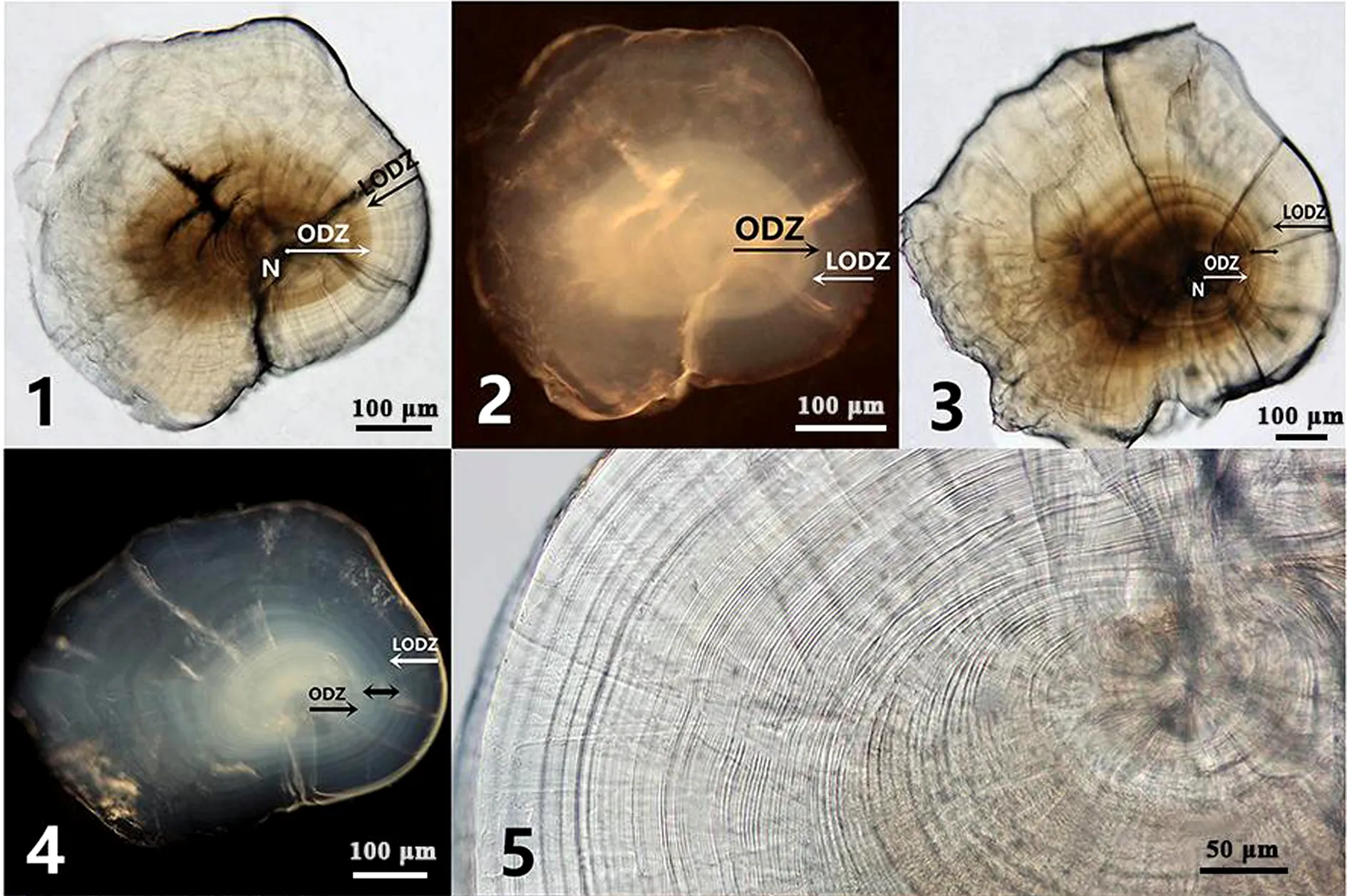

圖版Ⅰ 胭脂魚耳石矢切面磨片
1, 2, 6, 9. 人工飼養胭脂魚耳石; 3, 4, 5, 8, 10. 野外采集胭脂魚耳石; 1~4. 解剖鏡; 5~10. 顯微鏡; 1, 3. 入射光; 2, 4. 反射光; N. 中心核, ODZ. 暗區, LODZ. 亮區; ?. 標記輪。
1, 2, 6, 9. sagittal section of otoliths from hatchery-breedingM.asiaticus; 3, 4, 5, 8, 10. sagittal section of otoliths from wild-caughtM.asiaticus; 1-4. dissecting microscope; 5-10. compound microscope; 1, 3. incident light; 2, 4. reflected light; N. nucleus, ODZ. optically dense zone, LODZ. low optically dense zone; ?. check.
圖3 野外采集胭脂魚中可能為放流胭脂魚的耳石
Fig. 3Myxocyprinusasiaticusconfirmed to be originated from stocking enhancement
ODZ. 暗區, LODZ. 亮區, N. 中心核, P. 耳石原基。
ODZ. optically dense zone, LODZ. low optically dense zone; N. nucleus; P. primordium.
3 討論
魚類的耳石隨著魚體的生長而不斷生長,生長輪的形態也會發生相應的改變,由最初正圓形的同心圓輪到最后穩定變成一端稍尖的心梨形或長圓形,其圓心位于偏近圓的一端,形成長、短徑,通常短徑生長輪排列緊密,長徑生長輪較稀疏。不同魚類耳石長、短徑的生長輪清晰度不一,故生長輪計數、間距測量應根據不同魚類的實際情況而定(Campanaetal.,1994;解玉浩,1995)。魚類耳石在長徑和短徑方向上,沉積速率較為穩定,都能反映耳石的生長輪特性(管興華,曹文宣,2007)。對胭脂魚耳石生長輪的檢測發現,長徑上生長輪稀疏且多有混亂不清區段,短徑上生長輪密集且清晰,多數耳石靠近耳石中心的生長輪清晰度較弱,可能由以下原因引起:第一,耳石自身發育使生長輪比較微弱。晝夜溫差可以影響生長輪的清晰度和對比度,而在溫度恒定或晝夜溫差不大的條件下,沉積的生長輪通常不清晰,且分界線不明顯(Campana,1984;Neilson & Geen,1985;Bestgen & Bundy,1998;宋昭彬等,2003)。第二,顯微聚焦觀察、拍照時,耳石上的生長輪難以在全視野下清晰觀察。這種情況在稍大耳石的觀察中尤為明顯,因為焦平面上微小的差異,可使靠近耳石邊緣的增量變得重疊或完全消失;或可使生長輪一部分清晰,一部分模糊;還可使輪紋有明顯移動(王菲等,2010)。第三,耳石打磨過程中,部分生長輪被磨損。在本研究中,野外采集胭脂魚群體可能存在放流個體,為了能夠盡可能保證對放流胭脂魚群體進行識別,作者認為,對生長輪寬度的測量,應從距耳石中心核最近且生長輪清晰的區域開始。

圖4 胭脂魚耳石生長輪寬度的聚類分析
Fig. 4 Clustering analysis based on the otolith ofMyxocyprinusasiaticus
MR. 人工飼養胭脂魚, MW. 野外采集胭脂魚。
MR. hatchery-breedingM.asiaticus, MW. wild-caughtM.asiaticus.
魚類耳石生長輪具有日沉積現象,可用于年齡的估計、推算孵化日期和生長率等(Chenetal.,2011;Liuetal.,2013)。同時,魚類在生活史中所經歷的特殊事件也會通過影響生長輪的沉積規律等方式被記錄(史方等,2006;劉偉等,2013)。水溫和食物是影響魚類耳石生長輪沉積規律的2個主要因素,不同生長條件下,耳石生長輪寬度和規則性表現出較大差異(Yukamietal.,2008;Parkinsonetal.,2012)。付自東(2006)和Song等(2009)的研究表明,飼養水溫越高,胭脂魚的耳石生長輪越寬;饑餓組和攝食組仔魚間耳石生長輪寬度存在明顯差異。Hendricks和Torsello(1994)對美洲西鯡Alosasapidissima的研究表明,受生長慢及孵化場飼養條件穩定的影響,孵化場飼養的個體耳石生長輪窄,放流到野外后,生長輪寬度增加。當魚類從一個棲息地向另一個棲息地遷移時,由于不同環境中水溫和食物豐度的差異,耳石生長輪寬度也會隨之發生變化(Andrewsetal.,2012;Takahashietal.,2014)。本研究發現,胭脂魚在人工飼養和野外條件下耳石生長輪寬度存在差異,人工飼養胭脂魚耳石生長輪較窄且均勻,波動幅度較小,而野生個體生長輪寬度波動幅度較大,差異的形成可能也與生長期總體的水溫和食物有關。飼養條件下,胭脂魚一般在3月—4月初進行人工催產,而野外的繁殖時間為3—4月,且多數個體在4月繁殖。人工飼養胭脂魚對應的水溫相對偏低,導致其耳石生長輪寬度比野生個體窄。值得注意的是,在飼養條件下,水溫的波動相對于野外環境中的小,可能是造成野生個體的耳石生長輪波動幅度較大的原因;同時,飼養條件下,食物充足且穩定,而野外條件下的營養條件可能不穩定,也可能是影響耳石生長輪寬度及其規則性的另一因素。
本研究發現,胭脂魚耳石上表現出透明性的差異,即亮區和暗區的存在,這與管興華和曹文宣(2007)、陸化杰等(2012)、劉必林等(2016)在其他魚類中的研究結果相似。Morris和Aldrich(1985)研究認為,耳石透明性的差異主要受溫度和食物影響,春、夏季魚類活動力較強,新陳代謝旺盛,沉積鈣離子的速率快且沉積量較多,在光學顯微鏡下呈現亮帶;而秋、冬季魚類新陳代謝率降低,沉積在耳石中的碳酸鈣含量相應減少,有機質所占比例提高,在光學顯微鏡下呈現暗帶。宋昭彬等(2003b)對草魚Ctenopharyngodonidellus的研究表明,受不同月份平均水溫的影響,耳石上表現出顯著的透明性差異。Volk等(1990)也認為,突然降低水溫,可使大麻哈魚Oncorhynchusketa的耳石上形成暗帶,饑餓則使大鱗大麻哈魚O.tschawytscha的耳石上形成透明性相對較高的環帶。胭脂魚耳石上出現透明性的差異可能也與生活環境中的平均水溫有關,即四季平均水溫的差異導致了耳石上亮區和暗區的差異。同時,人工飼養胭脂魚相比于野生胭脂魚更早進行繁殖,由于水深和人為因素的影響,飼養環境下水溫的波動較野外條件下的相對小;而長江水溫在2—4月一般會以一個基本穩定的速率開始逐步回升,但總體水溫都維持在較低水平,5月開始,長江水溫上升較快,由20 ℃左右上升至年均最高水溫28~33 ℃(宋昭彬,2000;孫大明等,2010)。因此,人工飼養條件下的胭脂魚一般會經歷更長時間的較低溫生長,這也與本研究所得出的人工飼養胭脂魚耳石暗區大于野生胭脂魚的結果相符。
有研究表明,人工飼養條件下的個體攝食條件好且環境條件穩定,而野生個體要忍受食物量的變化及生存條件的波動,兩者在耳石微結構上表現出一些特有的差異,通過對耳石微結構的分析,可以對飼養和野生種群進行區分(Zhangetal.,1995;Wilson & McCormick,1999;Morales-Ninetal.,2005)。宋昭彬等(2003a)對人工飼養和野生草魚耳石微結構的研究也指出,由于飼養和天然條件下食物和溫度等差異,兩者的亮暗區特征,生長輪的清晰度、寬度和對比度等耳石微結構特征存在明顯差異,可用于不同群體的識別。本研究發現,人工飼養和野生胭脂魚耳石微結構特征也存在同樣較為穩定的差異。通過對野外誤捕、人工飼養胭脂魚耳石微結構特征的系統檢測與分析,利用飼養和野生胭脂魚種群的耳石微結構特征差異,可以識別人工飼養、野生和人工放流胭脂魚。進行識別時,可以參考以下特征:(1)亮暗區的表現形式;(2)生長輪寬度及波動幅度;(3)標記輪的數量及在耳石上形成位置的穩定性;(4)中心核的大小及原基個數。但僅通過觀察耳石微結構特征進行群體識別又具有一定局限性,只能做出經驗性總結和判斷。依據耳石生長輪寬度對耳石進行聚類分析,得出了同檢測耳石微結構特征較為一致的分類結果,經檢驗,聚類分析具備一定的可信度。因此,將耳石微結構特征與生長輪寬度歐式聚類分析相結合,可更加客觀、準確識別人工飼養和野生胭脂魚群體。
致謝:本研究得到了四川省農業科學院水產研究所、重慶市萬州水產研究所、宜賓珍稀水陸生動物研究所和何學福教授在胭脂魚樣本收集中給予的幫助,在此表示感謝。同時,感謝四川大學生命科學學院林玉成老師在耳石照片的拍攝過程中給予的指導和幫助。
陳春娜. 2008. 我國胭脂魚的研究進展[J]. 水產科技情報, 5(4): 160-164.
丁瑞華. 1994. 四川魚類志[M]. 成都: 四川科學技術出版社.
付自東. 2006. 胭脂魚仔、稚魚耳石微結構及標記研究[D]. 成都: 四川大學.
管興華, 曹文宣. 2007. 利用耳石日輪技術研究長江中游草魚幼魚的孵化期及生長[J]. 水生生物學報, 31(1): 18-23.
黎雨軒, 湯建華, 徐獻明, 等. 2013. 三門灣和呂四近岸小黃魚仔稚魚耳石微結構特征比較[J]. 海洋漁業, 35(4): 423-431.
李鳳瑩, 朱國平, 許柳雄. 2014. 西南大西洋拉式南美南極魚耳石外型特征[J]. 生態科學, 1: 7-11.
劉必林, 陳新軍, 李建華. 2016. 東太平洋莖柔魚的耳石微結構[J]. 水產學報, 40(8): 1211-1217.
劉偉, 戰培榮, 王繼龍, 等. 2013. 大麻哈魚胚胎耳石微結構及其群體環境標記[J]. 水生生物學報, 37(5): 929-937.
陸化杰, 陳新軍, 方舟, 等. 2012. 西南大西洋阿根廷滑柔魚耳石微結構及生長特性[J]. 漁業科學進展, 33(3): 15-25.
史方, 孫軍, 林小濤, 等. 2006. 唐魚仔魚耳石的形態發育及日輪[J]. 動物學雜志, 41(4): 10-16.
宋昭彬, 常劍波, 曹文宣, 等. 2003a. 人工飼養和野生草魚幼魚耳石微結構的比較研究[J]. 水生生物學報, 27(1): 7-12.
宋昭彬, 常劍波, 曹文宣. 2003b. 草魚仔魚耳石的自然標記和生長輪的清晰度[J]. 動物學報, 49(4): 508-513.
宋昭彬. 2000. 四大家魚仔幼魚耳石微結構的特征及其應用研究[D]. 武漢: 中國科學院水生生物研究所.
孫大明, 田慧峰, 張歡, 等. 2010. 長江上游水溫監測及水溫和氣溫關系研究[J]. 建筑節能, 12(38): 74-77.
王菲, 程家驊, 羅海忠. 2010. 東海條石鯛仔魚耳石日輪與生長的關系[J]. 中國水產科學, 17(2): 320-328.
武佳韻, 吳波, 楊坤, 等. 2014. 野外采集和人工繁育胭脂魚形態差異研究[J]. 淡水漁業, 44(6): 74-80.
解玉浩. 1995. 魚類耳石日輪[J]. 生物學通報, 30(11): 22-23.
張春光, 趙亞輝, 康景貴. 2000. 我國胭脂魚資源現狀及其資源恢復途徑的探討[J]. 自然資源學報, 15(2): 155-159.
祝東梅, 楊坤, 王衛民, 等. 2013. 中國胭脂魚的細胞遺傳學分析[J]. 中國水產科學, 20(3): 682-668.
Andrews AH, DeMartini EE, Brodziak J,etal. 2012. A long-lived life history for a tropical, deepwater snapper (Pristipomoidesfilamentosus): bomb radiocarbon and lead-radium dating as extensions of daily increment analyses in otoliths[J]. Canadian Journal of Fisheries and Aquatic Sciences, 69(11): 1850-1869.
Bestgen KR, Bundy JM. 1998. Environmental factors affect daily increment deposition and otolith growth in young Colorado squawfish[ J]. Transactions of the American Fisheries Society, 127: 105-117.
Campana SE, Fowler AJ, Jones CM. 1994. Otolith elemental fingerprinting for stock identification of Atantic cod (Gadusmorhua) using laser ablation ICPMS[J]. Canadian Journal of Fisheries and Aquatic Sciences, 55: 1942-1950.
Campana SE. 1984. Microstructural growth patterns in the otoliths of larval and juvenile starry flounder,Platichthysstellatus[J]. Canadian Journal of Zoology, 62: 1507-1512.
Cardoso JFMF, Freitas V, de Paoli H,etal. 2016. Growth conditions of 0-group plaicePleuronectesplatessain the western Wadden Sea as revealed by otolith microstructure analysis[J]. Journal of Sea Research, 111: 88-96.
Chen X, Lu H, Liu B,etal. 2011. Age, growth and population structure of jumbo flying squid,Dosidicusgigas, based on statolith microstructure off the exclusive economic zone of Chilean waters[J]. Journal of the Marine Biological Association of the United Kingdom, 91(1): 229-235.
Cheng WW, Wang DQ, Du H,etal. 2013. Isolation and characterization of 23 microsatellite loci in the Chinese sucker (Myxocyprinusasiaticus)[J]. Conservation Genetics Resources, 5(2): 375-377.
Chu ZJ, Yu DH, Dong GF. 2016. Partial replacement of fish meal by soybean meal with or without methionine and phytase supplement in diets for juvenile Chinese sucker,Myxocyprinusasiaticus[J]. Aquaculture Nutrition, 22(5): 989-996.
Ding CZ, Chen YF, He DK,etal. 2015. Validation of daily increment formation in otoliths forGymnocyprisselincuoensisin the Tibetan Plateau, China[J]. Ecology and Evolution, 5(16): 3243-3249.
Hendricks ML, Torsello DL. 1994. Use of otolith microstructure to distinguish wild from hatchery-reared American shad in the Susquehanna River[J]. North American Journal of Fisheries Management, 14: 151-161.
Joh M, Matsuda T, Satoh N,etal. 2011. Otolith microstructure of brown solePseudopleuronectesherzensteini: validation of daily ring formation and the occurrence of microstructure denoting metamorphosis[J]. Fisheries Science, 77(5): 773-783.
Li P, Zhang YG, Peng ZG. 2013. Development of 34 new microsatellite markers for the endangered Chinese sucker (Myxocyprinusasiaticus) using 454 sequencing[J]. Conservation Genetics Resources, 5(2): 441-444.
Liu BL, Chen XJ, Chen Y,etal. 2013. Age, maturation, and population structure of the Humboldt squidDosidicusgigasoff the Peruvian Exclusive Economic Zones[J]. Chinese Journal of Oceanology and Limnology, 31(1): 81-91.
Morales-Nin B, Bjelland RM, Moksness E. 2005. Otolith microstructure of a hatchery reared European hake (Merlucciusmerluccius)[J]. Fisheries Research, 74(1): 300-305.
Morris CC, Aldrich FA. 1985. Statolith length and increment number for age determination in squidIllexillecebrosus(Cephalopode: Ommastrephidae)[J]. NAFO Scientific Council Studies, 9: 101-106.
Neilson JD, Geen GH. 1985. Effects of feeding regimes and diel temperature cycles on otolith increment formation in juvenile chinook salmon,Oncorhynchustshawytscha[J]. Fishery Bulletin, 83(1): 91-101.
Pannella G. 1971. Fish otoliths: daily growth layers and periodical patterns[J]. Science, 173: 1124-1127.
Paragamian V, Bowles E, Hoelsher B. 1992. Use of daily growth increments on otoliths to assess stockings of hatchery-reared kokanees[J]. Transactions of the American Fisheries Society, 121: 785-791.
Parkinson KL, Booth DJ, Lee JE. 2012. Validation of otolith daily increment formation for two temperate syngnathid fishes: the pipefishesStigmatoporaargusandStigmatoporanigra[J]. Journal of Fish Biology, 80(3): 698-704.
Peck MA, Baumann H, Clemmesen C,etal. 2015. Calibrating and comparing somatic-, nucleic acid-, and otolith-based indicators of growth and condition in young juvenile European sprat (Sprattussprattus)[J]. Journal of Experimental Marine Biology and Ecology, 471: 217-225.
Song ZB, Fu ZD, He CL,etal. 2009. Effects of temperature, structure and photoperiod on otolith increments in larval Chinese sucker,Myxocyprinusasiaticus[J]. Environmental Biology of Fishes, 84: 159-171.
Takahashi M, Yoneda M, Kitano H,etal. 2014. Growth of juvenile chub mackerelScomberjaponicusin the western North Pacific Ocean: with application and validation of otolith daily increment formation[J]. Fisheries Science, 80(2): 293-300.
Volk EC, Schroder SL, Fresh KL. 1990. Inducement of unique otolith banding patterns as a practical means to mass-mark juvenile Pacific salmon[J]. American Fisheries Society Symposium, 7: 203-215.
Wilson DT, McCormick MI. 1999. Microstructure of settlement-marks in the otoliths of tropical reef fishes[J]. Marine Biology, 134: 29-41.
Yamada H, Chimura M, Asami K,etal. 2009. Otolith development and daily increment formation in laboratory-reared larval and juvenile black-spot tuskfishChoerodonschoenleinii[J]. Fisheries Science, 75(5): 1141-1146.
Yukami R, Aoki I, Mitani I. 2008. Daily age of adult Japanese anchovyEngraulisjaponicusoff eastern Honshu, Japan by otolith daily increment[J]. Fisheries Science, 74(6): 1348-1350.
Zhang Z, Beamish RJ, Riddell BE. 1995. Differences in otolith microstructure between hatchery-reared and wild Chinook salmon (Oncorhynchustshawytscha)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 52: 344-352.
Otolith Microstructure Character Analysis between Wild-caught and Hatchery-breedingMyxocyprinusasiaticus
LEI Yi1, ZHOU Yu1, YANG Kun1, WU Jiayun2, ZHANG Xiuyue1, SONG Zhaobin1, 3*
(1. Sichuan Key Laboratory of Conservation Biology on Endangered Wildlife, College of Life Sciences, Sichuan University,Chengdu 610064, China; 2. College of Life Sciences, Sichuan Agricultural University, Ya’an, Sichuan Province 625014, China;3. Key Laboratory of Bio-Resources and Eco-Environment of Ministry of Education, College of Life Sciences,Sichuan University, Chengdu 610064, China)
The otolith microstructure of hatchery-breeding and wild-caughtMyxocyprinusasiaticuswere examined and analyzed. The otoliths ofM.asiaticuscould be divided into optically dense and low optically dense zones based on the difference of transparence. The otoliths, which had distinct boundary between the optically dense and low optically dense zones, accounted for 63.16% in hatchery-breeding population and 14.81% in wild-caught. The size of optically dense zones in otolith of wild and captiveM.asiaticuswas 0.14 mm±0.06 mm and 0.17 mm±0.03 mm, respectively. Otolith nucleus diameter of hatchery-breeding and wild-caught was13.10 μm±1.87 μm and 11.14 μm±1.74 μm, respectively, and the primordium was 1 and 1-2, respectively. The number of checks was 1-3, and the width of daily increment was 2.14 μm±0.59 μm in the otolith of hatchery-breedingM.asiaticus. However, otoliths of wild-caughtM.asiaticusshaped 1-7 checks and the width of daily increment was 2.54 μm±1.12 μm. Otoliths of hatchery-breedingM.asiaticushad more regular and smaller fluctuant width of daily increment compared with that of wild-caught individuals. The result of clustering analysis based on daily increment suggested that, 94.59% of otoliths from hatchery-breedingM.asiaticuswere clustered together at the Euclidean distance of 2.5, and this was consistent with the result of microstructure examination. In conclusion, the otolith microstructure of hatchery-breeding and wild-caughtM.asiaticuswere remarkably differed such as the optically dense and low optically dense zones, the width of the daily increment and the number of the checks, and these differences could be used to determine the source ofM.asiaticus.
Myxocyprinusasiaticus; wild-caught; hatchery-breeding; otolith microstructure; stock discrimination
2017-01-16 接受日期:2017-03-14
中國長江三峽集團有限公司科研項目(0799531)
雷毅(1989—), 男, 碩士研究生, 研究方向:動物分子生物學, E-mail:leiyi_scu@126.com
*通信作者Corresponding author, 教授, 博士生導師, E-mail:zbsong@scu.edu.cn
10.11984/j.issn.1000-7083.20170018
Q959.4
A
1000-7083(2017)03-0285-08

