南瓜SCoT-PCR反應(yīng)體系的優(yōu)化與引物篩選
王豐豐,王萍,石磊,楊靜,楊琴
(內(nèi)蒙古野生特有蔬菜種質(zhì)資源與種質(zhì)創(chuàng)新重點(diǎn)實(shí)驗(yàn)室·內(nèi)蒙古農(nóng)業(yè)大學(xué)農(nóng)學(xué)院呼和浩特010019)
南瓜SCoT-PCR反應(yīng)體系的優(yōu)化與引物篩選
王豐豐,王萍,石磊,楊靜,楊琴
(內(nèi)蒙古野生特有蔬菜種質(zhì)資源與種質(zhì)創(chuàng)新重點(diǎn)實(shí)驗(yàn)室·內(nèi)蒙古農(nóng)業(yè)大學(xué)農(nóng)學(xué)院呼和浩特010019)
為了構(gòu)建適合南瓜SCoT-PCR反應(yīng)的最佳體系,筆者對(duì)需要控制的5個(gè)變量使用L25(56)正交試驗(yàn)設(shè)計(jì)。結(jié)果表明,最佳優(yōu)化體系為:2.5 mmol·L-1Mg2+、0.40 mmol·L-1dNTPs、0.5 U Taq酶、1.00 μmol·L-1引物、30 ng模板DNA,共20 μL。然后從51個(gè)SCoT引物中篩選出多態(tài)性明顯的引物20個(gè),并優(yōu)化最適退火溫度。最后,對(duì)所得優(yōu)化體系進(jìn)行可行性驗(yàn)證。該體系有利于SCoT標(biāo)記在南瓜材料上的應(yīng)用,構(gòu)建的優(yōu)化體系及篩選出的引物可為南瓜分子遺傳育種奠定基礎(chǔ)。
南瓜;SCoT-PCR;體系優(yōu)化;正交設(shè)計(jì);引物篩選
南瓜,葫蘆科南瓜屬[1],按經(jīng)濟(jì)栽培種可分為5大類(lèi):美洲南瓜、印度南瓜、中國(guó)南瓜、黑籽南瓜和灰籽南瓜。美洲南瓜的嫩瓜味道可口、耐貯藏,在果實(shí)成熟早期收獲炒食或作餡均可[2],是不可或缺的淡季蔬菜;印度南瓜和中國(guó)南瓜的老熟果實(shí)淀粉含量較高,營(yíng)養(yǎng)價(jià)值豐富,可作為飼料或雜糧食用,取其果實(shí)可熬制南瓜粥,味道甘甜,而南瓜籽可作瓜子食用;黑籽南瓜以作砧木為主;灰籽南瓜的作用還有待研究。所以,對(duì)于南瓜新品種的選育是十分必要的。在南瓜材料上,RAPD、SSR、ISSR等分子標(biāo)記方法都已經(jīng)被成功應(yīng)用[3-5],而新的分子標(biāo)記方法——目標(biāo)起始密碼子多態(tài)性(Start codon target? ed polymorphism,SCoT)分子標(biāo)記尚未見(jiàn)相關(guān)報(bào)道。
SCoT標(biāo)記是Collard和Mackill[6]在水稻上提出的一種基于單引物擴(kuò)增反應(yīng)(single primer amplifica?tion reaction,SPAR)的新型分子標(biāo)記。該標(biāo)記根據(jù)植物基因中的ATG翻譯起始位點(diǎn)側(cè)翼保守序列來(lái)設(shè)計(jì)單引物,擴(kuò)增產(chǎn)生偏向候選功能基因區(qū)顯性多態(tài)性標(biāo)記,具有成本低、操作簡(jiǎn)單、引物通用性更強(qiáng)、遺傳信息完整[7]等優(yōu)點(diǎn),在柑橘、葡萄、鐵皮石斛、籽用西瓜等植物上得到迅速應(yīng)用[8-11]。本試驗(yàn)擬構(gòu)建南瓜SCoT-PCR優(yōu)化體系并篩選合適的引物,為SCoT分子標(biāo)記在南瓜分子遺傳方面的研究奠定基礎(chǔ)。
1 材料與方法
1.1 材料
體系優(yōu)化所用材料為南瓜‘特豐一號(hào)’,引物篩選所用材料為4個(gè)南瓜地方品種,品種編號(hào)為2、7、14、21,驗(yàn)證材料為來(lái)自不同地區(qū)的20個(gè)南瓜地方品種,品種編號(hào)為2~21(詳見(jiàn)表1)。DNA模板提取自南瓜幼嫩真葉。SCoT引物序列來(lái)自于Collard等[6]的報(bào)道,由上海生工生物工程有限公司合成。基因組DNA提取試劑盒購(gòu)于天根生化科技有限公司,dNTPs、Taq DNA聚合酶、10× Buffer、DL2000 Marker等均從全式金生物工程有限公司采購(gòu)。
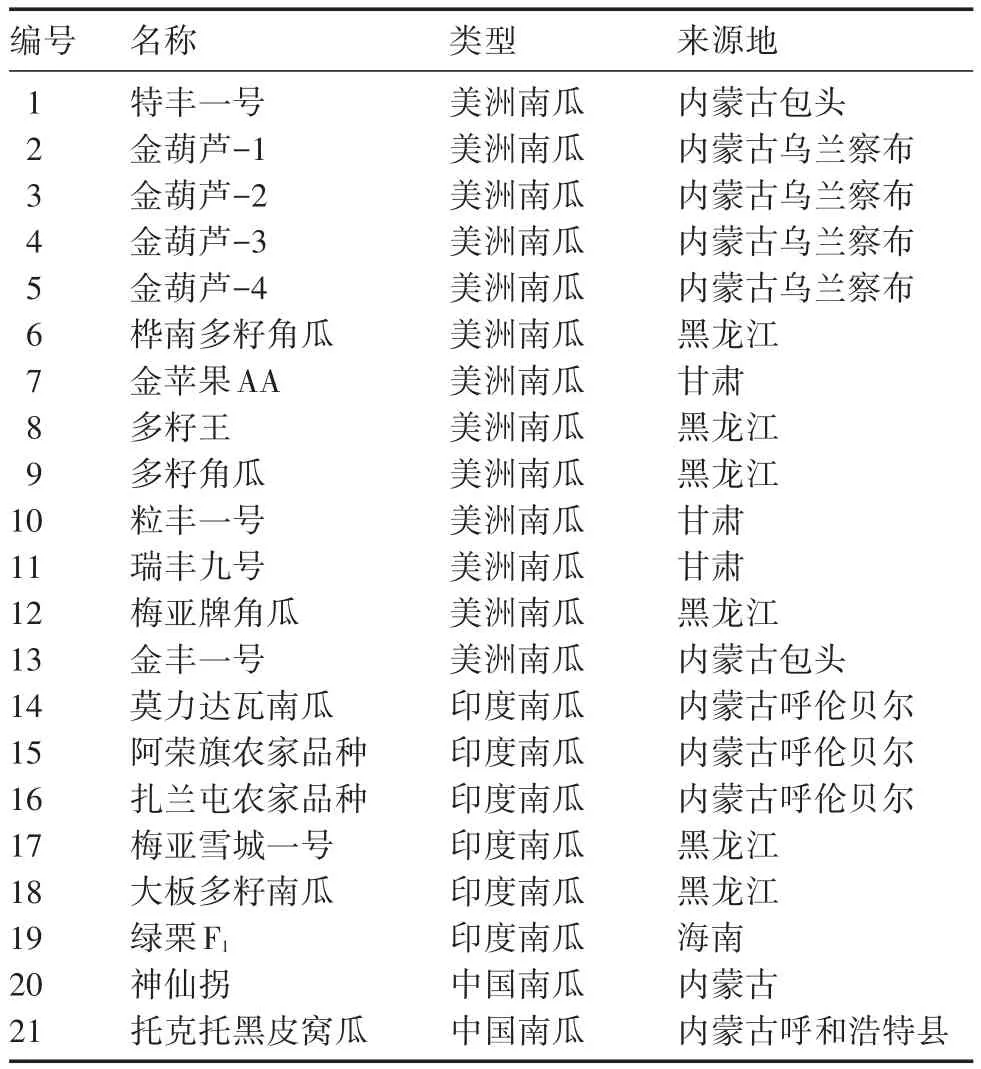
表1 供試材料
1.2 基因組DNA的提取與檢測(cè)
南瓜種子溫湯浸種后放到裝有雙層濾紙的培養(yǎng)皿中保持濕潤(rùn),長(zhǎng)至2~3片真葉時(shí),摘下幼嫩真葉清洗,迅速放到研缽中,加入液氮研磨至粉末并裝至2 mL PCR管中,置于-20℃冰箱保存?zhèn)溆谩L崛NA樣品,1%瓊脂糖凝膠電泳[12],電壓120 V,時(shí)間1 h,使用紫外分光光度法檢測(cè),置于-20℃條件下保存?zhèn)溆谩?/p>
1.3 SCoT-PCR反應(yīng)體系正交設(shè)計(jì)
SCoT引物使用的是SC25,正交試驗(yàn)設(shè)計(jì)采用L25(56)正交表(表2),設(shè)計(jì)出25組正交組合,對(duì)影響PCR反應(yīng)體系的5大主要因素Mg2+濃度、dNTPs濃度、引物濃度、Taq酶和DNA模板用量進(jìn)行優(yōu)化,每個(gè)影響因素有5個(gè)水平(表3)。SCoT-PCR反應(yīng)體系共20 μL,包括5個(gè)因素的不同水平,每個(gè)體系添加2.0 μL的10×Buffer,加ddH2O至終體積。正交設(shè)計(jì)表共25個(gè)處理,每個(gè)處理3次重復(fù)。

表2 SCoT-PCR反應(yīng)體系L25(56)正交設(shè)計(jì)及直觀分析

表3 L25(56)正交試驗(yàn)的因素及水平
1.4 SCoT-PCR擴(kuò)增及檢測(cè)
PCR擴(kuò)增程序?yàn)椋?4℃預(yù)變性4 min,94℃變性30 s,47.7℃復(fù)性退火30 s,72℃延伸1 min,循環(huán)35次;72℃延伸5 min。得到擴(kuò)增產(chǎn)物于4℃下保存。取4 μL的擴(kuò)增產(chǎn)物與2 μL的6×Load?ing buffer混勻,在經(jīng)Gelview核酸染料染色后的1%(ω,下同)瓊脂糖凝膠上進(jìn)行電泳,電極緩沖液為0.5×TBE,電壓120 V,時(shí)間1 h,最后在紫外凝膠成像系統(tǒng)上拍照保存。
1.5 數(shù)據(jù)統(tǒng)計(jì)與處理
對(duì)凝膠圖片采用姜小鳳等[13]和何正文等[14]的方法進(jìn)行綜合打分。設(shè)定打分范圍1~25,依次從條帶清晰度、數(shù)目多少及多態(tài)性高低來(lái)比較分析,條帶好的記為25,差的記為1,按此比較排序。根據(jù)3個(gè)重復(fù)打分結(jié)果進(jìn)行直觀分析,然后假設(shè)不存在交互作用的情況下,計(jì)算出試驗(yàn)每個(gè)因素下各水平的平均值,該值能夠反映因素各水平對(duì)反應(yīng)體系影響程度的大小。Ti為每個(gè)因素在同一水平下的試驗(yàn)值之和,Ki為每個(gè)因素在同一水平下的數(shù)據(jù)平均值,R為同一因素不同水平間平均值的極差。這些數(shù)值的大小同樣反映了該因素對(duì)試驗(yàn)結(jié)果影響的大小[15]。直觀分析后,利用SPSS 18.0軟件對(duì)所得結(jié)果進(jìn)行方差分析,估計(jì)試驗(yàn)誤差。最后,綜合比較2種分析方法,得出最優(yōu)反應(yīng)體系。
1.6 多態(tài)性SCoT引物篩選和退火溫度的確定
采用1.5中得出的最優(yōu)反應(yīng)體系,以各因素確定濃度為基礎(chǔ)進(jìn)行適合引物的篩選及引物最佳退火溫度的試驗(yàn)(表4)。

表4 ScoT引物篩選及最適退火溫度
1.7 反應(yīng)體系的穩(wěn)定性和可行性檢測(cè)
選取多個(gè)引物對(duì)20份南瓜材料進(jìn)行PCR擴(kuò)增,在經(jīng)Gelview核酸染料染色后的1%瓊脂糖凝膠上電泳,然后在紫外成像系統(tǒng)上拍照檢測(cè),以驗(yàn)證反應(yīng)體系的穩(wěn)定性和可行性。
2 結(jié)果與分析
2.1 正交試驗(yàn)結(jié)果分析
2.1.1 直觀分析對(duì)凝膠照片進(jìn)行直觀分析(圖1),處理19和25條帶是最清晰、多態(tài)性最明顯的。據(jù)此對(duì)3個(gè)重復(fù)進(jìn)行3次獨(dú)立打分統(tǒng)計(jì),得到的平均分依次為:1.00,2.33,15.67,18.33,21.00,8.33,20.67,22.33,3.67,3.00,15.00,6.00,20.67,10.00,19.33,5.67,12.00,12.67,24.67,7.00,11.00,18.00,10.33,12.33,24.33。平均分的大小可看作每一水平對(duì)試驗(yàn)影響程度的數(shù)值表達(dá),將此數(shù)值通過(guò)計(jì)算轉(zhuǎn)變?yōu)槊總€(gè)因素對(duì)應(yīng)的影響效果。依次算出Ti、Ki以及對(duì)應(yīng)的R值(表5)。根據(jù)直觀分析的結(jié)果,各因素極差R大小依次為引物濃度>dNTPs濃度>Taq酶量>Mg2+濃度>模板DNA質(zhì)量,表明各因素對(duì)反應(yīng)體系的影響程度大小與此順序相同,其中引物濃度對(duì)PCR反應(yīng)體系影響最大,為主要因素;模板DNA質(zhì)量影響最小。通過(guò)對(duì)比直觀分析中各因素各水平的平均值可以選出最適水平,這些最適水平結(jié)合起來(lái)就是最佳組合。
2.1.2 方差分析為了彌補(bǔ)直觀分析不能估計(jì)試驗(yàn)誤差大小的缺點(diǎn),筆者利用SPSS 18.0軟件對(duì)統(tǒng)計(jì)結(jié)果進(jìn)行方差分析(表6):從方差分析表中可以看出,各因素對(duì)PCR反應(yīng)體系的影響與直觀分析結(jié)果一致,其中引物濃度對(duì)試驗(yàn)結(jié)果影響顯著,其他各個(gè)因素影響主次也與直觀分析一致。總體表明試驗(yàn)誤差對(duì)試驗(yàn)結(jié)果影響較小,因此結(jié)果較可靠,可供參考。
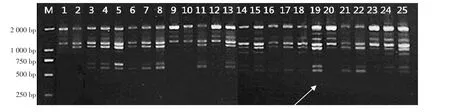
圖1 SCoT-PCR正交試驗(yàn)擴(kuò)增產(chǎn)物電泳
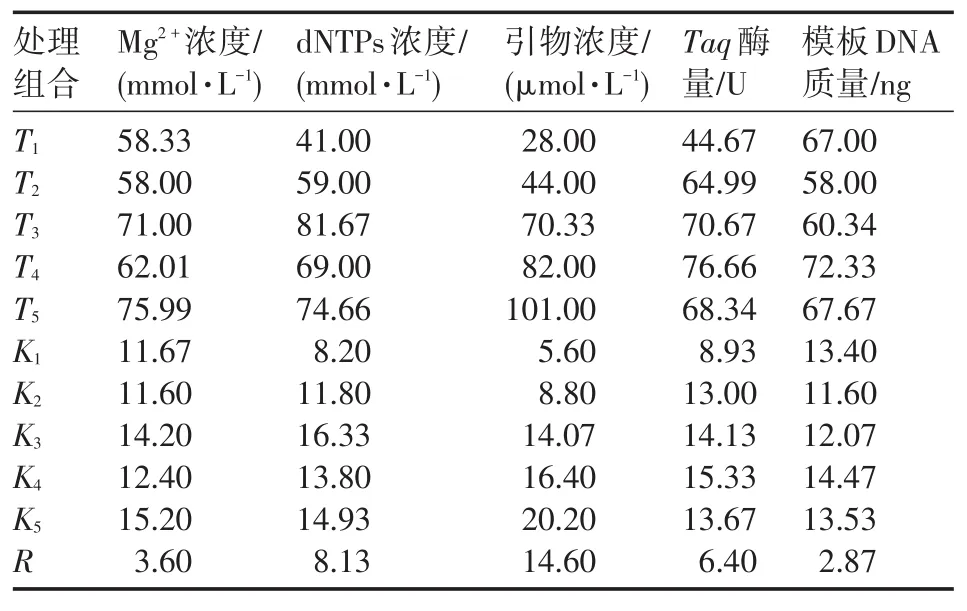
表5 正交設(shè)計(jì)直觀分析結(jié)果
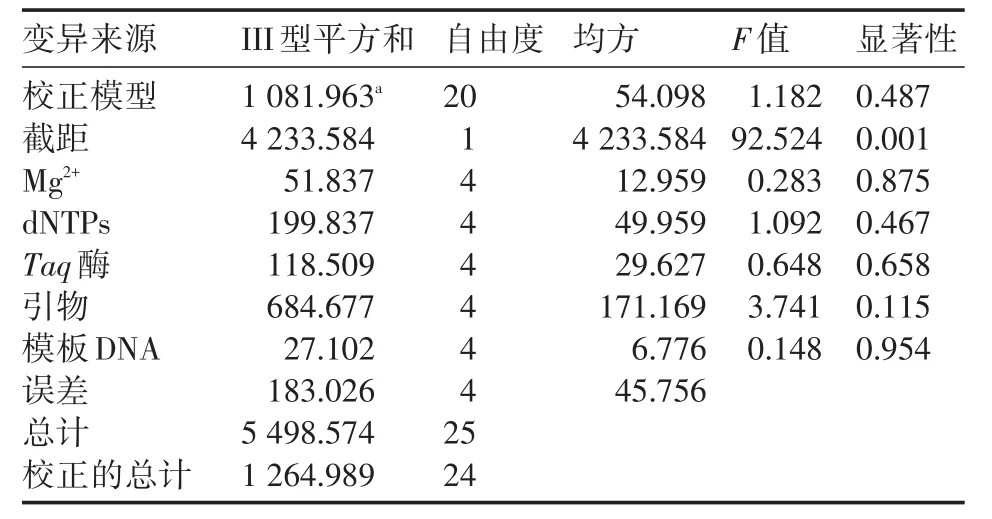
表6 SPSS18.0方差分析結(jié)果
2.1.3 綜合分析在2種分析方法綜合考慮下,5種因素的最佳水平分別為Mg2+濃度3.0 mmol·L-1、dNTPs濃度0.30 mmol·L-1、Taq酶量1.5 U、引物濃度1.00 μmol·L-1、模板DNA質(zhì)量40 ng。將SCoT-PCR正交組合對(duì)比分析發(fā)現(xiàn),25個(gè)組合中并沒(méi)有出現(xiàn)包含這5種因素最佳水平的組合,但其中分值較高的組合在各方面都與最佳水平較接近,整體符合要求。在綜合考量體系中各因素的影響、經(jīng)濟(jì)費(fèi)用及試驗(yàn)質(zhì)量的前提下,最終確定最優(yōu)組合為19號(hào)組合:2.50 mmol·L-1Mg2+、0.40 mmol·L-1dNTPs、 0.50 U Taq酶、1.00 μmol·L-1引物、30 ng模板DNA,反應(yīng)總體積20 μL。
2.2 引物篩選
根據(jù)綜合分析確定的南瓜SCoT-PCR最佳反應(yīng)體系,以4份地方品種南瓜DNA為模板,對(duì)51個(gè)引物各自電泳出的4條條帶進(jìn)行多態(tài)性分析,篩選出條帶清晰、多態(tài)性明顯的引物共20個(gè),分別為SC3、SC5、SC7、SC9、SC11、SC12、SC13、SC14、SC15、SC16、SC18、SC19、SC20、SC21、SC25、SC29、SC35、SC38、SC54和SC62。部分引物擴(kuò)增效果見(jiàn)圖2,其中引物SC8多態(tài)性不明顯,不符合引物篩選的要求。

圖2 引物SC6、SC8、SC9和SC25多態(tài)性的篩選
2.3 引物最佳退火溫度選擇
退火溫度是除了控制變量的5個(gè)因素外對(duì)試驗(yàn)結(jié)果影響最大的一個(gè)因素。對(duì)篩選出的20個(gè)引物逐一進(jìn)行退火溫度的篩選,采用45~58℃溫度范圍設(shè)置12個(gè)溫度梯度,分別為45.0、46.1、47.2、48.4、49.6、50.9、52.0、53.1、54.2、55.5、56.8、58.0℃。對(duì)于每個(gè)引物凝膠電泳出的12條條帶進(jìn)行分析,可得到該引物的最適退火溫度。部分引物的退火溫度篩選見(jiàn)圖3。篩選出的20個(gè)引物的最適退火溫度如表4所示。

圖3 引物SC3(左)、SC16(右)退火溫度的優(yōu)化
體系優(yōu)化時(shí)所采用的SC25退火溫度篩選結(jié)果見(jiàn)圖4,該引物退火溫度變化不規(guī)律,但符合整體趨勢(shì)。12個(gè)退火溫度中,在45.0、47.2、50.9℃時(shí),擴(kuò)增條帶少,背景也弱;在46.1、49.6℃時(shí),擴(kuò)增條帶清晰但擴(kuò)增條帶數(shù)較48.4℃少;當(dāng)退火溫度上升到55.5、56.8和58.0℃時(shí),擴(kuò)增條帶較少且不清晰。因此,以條帶清晰、背景強(qiáng)、條帶無(wú)雜質(zhì)作為劃分依據(jù),確定本試驗(yàn)中引物SC25的最佳退火溫度為48.4℃,此退火溫度可以應(yīng)用在整個(gè)體系優(yōu)化的過(guò)程中(其他引物退火溫度的篩選過(guò)程與此引物相同)。

圖4 引物SC25退火溫度的優(yōu)化
2.4 SCoT-PCR反應(yīng)體系穩(wěn)定性和可行性檢測(cè)
雖然已建立起了南瓜SCoT-PCR最佳反應(yīng)體系,但需要在多基因型條件下進(jìn)行驗(yàn)證。對(duì)反應(yīng)體系可靠性進(jìn)行驗(yàn)證采用的是20份南瓜材料(表1),反應(yīng)體系采用19號(hào)組合,唯一變量是20個(gè)不同的模板DNA,最后對(duì)凝膠照片進(jìn)行分析,結(jié)果發(fā)現(xiàn)該體系擴(kuò)增出清晰的、多態(tài)性明顯的條帶,證實(shí)了該體系的穩(wěn)定性和可行性。在驗(yàn)證過(guò)程中,用多個(gè)引物配合20份南瓜品種材料才能最大程度減少試驗(yàn)誤差,得到最穩(wěn)定的反應(yīng)體系。圖5是引物SC25對(duì)20份南瓜材料進(jìn)行PCR擴(kuò)增驗(yàn)證的凝膠電泳圖,說(shuō)明該優(yōu)化反應(yīng)體系是可靠的,可以進(jìn)一步應(yīng)用于南瓜的分子遺傳學(xué)研究。

圖5 引物SC25對(duì)2~21號(hào)樣品擴(kuò)增結(jié)果
3 討論
分子標(biāo)記的諸多優(yōu)越性使得學(xué)者們熱衷于分子方面的研究,而目標(biāo)起始密碼子多態(tài)性標(biāo)記也成為了一種頗受歡迎的分子標(biāo)記方法。所有基于PCR反應(yīng)技術(shù)的分子標(biāo)記方法都一樣,反應(yīng)體系要受到很多因素的影響,比如Mg2+、dNTPs、Taq酶、引物和模板DNA等的濃度,還有退火溫度,都會(huì)影響PCR反應(yīng)的結(jié)果[16]。因此,在對(duì)試驗(yàn)材料采用SCoT分子標(biāo)記方法進(jìn)行分析時(shí),應(yīng)首先對(duì)其反應(yīng)體系進(jìn)行各因素水平的優(yōu)化,先確定各因素的最優(yōu)水平,選出最佳的反應(yīng)體系,再進(jìn)行后續(xù)試驗(yàn)。
退火溫度也是影響試驗(yàn)結(jié)果的一個(gè)關(guān)鍵因素,溫度過(guò)高條帶清晰但少,溫度過(guò)低有雜帶但條帶多[17]。在PCR反應(yīng)體系優(yōu)化過(guò)程中有很多可采用的設(shè)計(jì)方法,而正交試驗(yàn)設(shè)計(jì)方法是各種分子標(biāo)記反應(yīng)體系優(yōu)化中應(yīng)用最為廣泛的。該方法不僅綜合考慮到了PCR反應(yīng)體系中各因素間的交互作用,還能避免單因素試驗(yàn)過(guò)程中所產(chǎn)生的誤差[18],最終可以快速獲得滿(mǎn)意的試驗(yàn)結(jié)果。當(dāng)然,該種打分方法也存在一些缺陷,因?yàn)樵趯?duì)擴(kuò)增條帶進(jìn)行打分的過(guò)程中,不同的人對(duì)條帶的清晰度、多態(tài)性等的判斷標(biāo)準(zhǔn)有差異,受個(gè)人主觀性影響較大,故評(píng)分結(jié)果則會(huì)產(chǎn)生較大差異[19]。因此,在對(duì)條帶評(píng)分的時(shí)候,要多重復(fù)、全方面的進(jìn)行,最大程度地減少主觀誤差。在對(duì)瓊脂糖凝膠紫外成像拍照時(shí),注意調(diào)整背景亮度、對(duì)比度等各種參數(shù),盡量得到最佳的凝膠圖片,方便對(duì)試驗(yàn)結(jié)果的觀察分析。
近些年,DNA分子標(biāo)記技術(shù)的應(yīng)用越來(lái)越普遍,各類(lèi)標(biāo)記如RAPD、ISSR、SRAP等[3-5]都在南瓜遺傳多樣性研究中有了初步的應(yīng)用。肖祖梅[20]將RAPD和ISSR標(biāo)記相結(jié)合,對(duì)28份觀賞南瓜材料的遺傳多樣性進(jìn)行了研究。盧麗芳等[21]利用SRAP分子標(biāo)記技術(shù)對(duì)所收集的85份南瓜資源進(jìn)行親緣關(guān)系分析,從100對(duì)引物中挑出17對(duì)引物對(duì)其進(jìn)行條帶擴(kuò)增。向成鋼等[22]利用SSR標(biāo)記對(duì)20份分屬10個(gè)品種群的中國(guó)南瓜、印度南瓜和美洲南瓜材料及1份印度南瓜和中國(guó)南瓜的種間雜交種進(jìn)行了多態(tài)性及親緣關(guān)系分析。與這些標(biāo)記相比,SCoT分子標(biāo)記操作更加簡(jiǎn)單,有利于各種物種SCoT標(biāo)記技術(shù)體系的建立;比ISSR標(biāo)記更有效地產(chǎn)生和性狀連鎖的標(biāo)記,易于分子標(biāo)記輔助育種;比RAPD標(biāo)記使用的引物長(zhǎng)度更長(zhǎng),重復(fù)性好;引物設(shè)計(jì)趨于簡(jiǎn)單,在原有引物序列基礎(chǔ)上做少許改動(dòng)來(lái)設(shè)計(jì)更多的新引物,設(shè)計(jì)好的SCoT標(biāo)記引物可以在物種間通用。該標(biāo)記可作為RAPD、ISSR標(biāo)記技術(shù)的有效補(bǔ)充;今后,SCoT標(biāo)記作為一種新型的目的基因標(biāo)記,為我們提供了除SRAP、TRAP等標(biāo)記方法外一種能跟蹤性狀的新的分子標(biāo)記技術(shù)。
4 結(jié)論
筆者采用正交設(shè)計(jì)方法成功構(gòu)建了適用于南瓜的SCoT-PCR最佳反應(yīng)體系:2.5 mmol·L-1Mg2+、0.40 mmol·L-1dNTPs、0.5 U Taq酶、1.00 μmol·L-1引物、30 ng模板DNA,總體積20 μL。采用20個(gè)不同品種的南瓜材料對(duì)優(yōu)化的反應(yīng)體系進(jìn)行驗(yàn)證,結(jié)果表明所有引物均能擴(kuò)增出特異性豐富的條帶,證明了優(yōu)化的SCoT-PCR反應(yīng)體系在多基因型條件下的可用性。SCoT分子標(biāo)記可進(jìn)一步為南瓜的遺傳研究提供標(biāo)記資源。
[1] 李新崢,孫麗,萬(wàn)國(guó)葉.26份南瓜雜交組合(F1)主要農(nóng)藝性狀的分析[J].中國(guó)瓜菜,2013,26(1):13-16.
[2] 李錫香,朱德蔚.南瓜種質(zhì)資源描述規(guī)范和數(shù)據(jù)標(biāo)準(zhǔn)[M].北京:中國(guó)林業(yè)出版社,2007.
[3] NONTUTHUKO R N,PANGIRAYI B T,ALPHEUS M Z.Genetic diversity in Cucurbita pepo landraces revealed by RAPD and SSR markers[J].Scientia Horticulturae,2015,189:192-200.
[4] 朱海生,盧麗芳,溫慶放,等.南瓜ISSR-PCR反應(yīng)體系的建立與優(yōu)化[J].分子植物育種,2014,12(4):802-809.
[5] M FERRIOL,B PICó,F(xiàn) NUEZ.Genetic diversity of a germ?plasm collection of Cucurbita pepo using SRAP and AFLP mark?ers[J].Theoretical and Applied Genetics,2003,107(2):271-282.
[6] COLLARD B C Y,MACKILL D J.Start Codon Targeted (SCoT)Polymorphism:A simple,novel DNA marker technique for generating gene-targeted markers in plants[J].Plant Molec?ular Biology Reporter,2009,27(1):86-93.
[7] 熊發(fā)前,唐榮華,陳忠良,等.目標(biāo)起始密碼子多態(tài)性(SCoT):一種基于翻譯起始位點(diǎn)的目的基因標(biāo)記新技術(shù)[J].分子植物育種,2009,7(3):635-638.
[8] 韓國(guó)輝,向素瓊,汪衛(wèi)星,等.柑橘SCoT分子標(biāo)記技術(shù)體系的建立及其在遺傳分析中的應(yīng)用[J].園藝學(xué)報(bào),2011,38(7):1243-1250.
[9] 張君玉,郭大龍,龔瑩,等.葡萄目標(biāo)起始密碼子多態(tài)性反應(yīng)體系的優(yōu)化[J].果樹(shù)學(xué)報(bào),2011,28(2):209-214.
[10] 趙瑞強(qiáng),高燕會(huì),章曉玲,等.鐵皮石斛SCoT-PCR反應(yīng)體系構(gòu)建及優(yōu)化[J].核農(nóng)學(xué)報(bào),2012,26(4):648-655.
[11] 楊靜,王萍,石磊.籽用西瓜SCoT-PCR反應(yīng)體系優(yōu)化及引物篩選[J].西北農(nóng)業(yè)學(xué)報(bào),2016,25(6):1-8.
[12] 黃永蓮.瓊脂糖凝膠電泳實(shí)驗(yàn)技術(shù)研究[J].湛江師范學(xué)院學(xué)報(bào),2009,30(6):83-85.
[13] 姜小鳳,高燕會(huì),童再康,等.石蒜屬植物SCoT-PCR反應(yīng)體系構(gòu)建及優(yōu)化[J].浙江農(nóng)林大學(xué)學(xué)報(bào),2013,30(3):444-452.
[14] 何正文,劉運(yùn)生,陳立華,等.正交設(shè)計(jì)直觀分析法優(yōu)化PCR條件[J].湖南醫(yī)科大學(xué)學(xué)報(bào),1998,23(7):403-404.
[15] 任羽,王得元,張銀東,等.辣椒SRAP-PCR反應(yīng)體系的建立與優(yōu)化[J].分子植物育種,2004,2(5):689-693.
[16] 李勇,朱永春.基于瓊脂糖凝膠電泳的小麥SSR擴(kuò)增體系優(yōu)化[J].華北農(nóng)學(xué)報(bào),2009,24(6):174-177.
[17] 周鵬,王萍,石磊,等.籽用西瓜SSR體系的建立與優(yōu)化[J].內(nèi)蒙古農(nóng)業(yè)大學(xué)學(xué)報(bào),2015,36(4):38-43.
[18] AHMAD M G,PETER P,ZSOLT P,et al.Efficiency of arbi?trarily amplifieddominant markers(SCoT,ISSR,RAPD)for di?agnostic fingerprinting in tetraploid potato[J].American Journal of Potato Research,2011,88(3):226-237.
[19] 何仁鋒,馮尚國(guó),陳喆,等.藥用菊花SCoT-PCR反應(yīng)體系的正交優(yōu)化[J].核農(nóng)學(xué)報(bào),2014,28(10):1781-1789.
[20] 肖祖梅.觀賞南瓜種質(zhì)資源遺傳多樣性的RAPD和ISSR分析[D].重慶:西南大學(xué),2008.
[21] 盧麗芳,朱海生,溫慶放,等.南瓜種質(zhì)資源遺傳多樣性的SRAP分析[J].熱帶作物學(xué)報(bào),2015,36(12):2142-2148.
[22] 向成鋼,王艷玲,張雪梅,等.SSR標(biāo)記在南瓜親緣關(guān)系分析中的應(yīng)用[J].北方園藝,2013(15):104-108.
本刊聲明
本刊刊登的稿件,視為作者同意本刊對(duì)該文稿、圖片擁有復(fù)制、匯編、發(fā)行及在網(wǎng)絡(luò)、光盤(pán)等數(shù)字傳媒上進(jìn)行傳播宣傳的使用權(quán)。所付稿酬已包含上述使用費(fèi)。如有異議,請(qǐng)?jiān)趤?lái)稿時(shí)說(shuō)明。
《中國(guó)瓜菜》編輯部
Orthogonal optimization of SCoT-PCR system and primer screening in pumpkin
WANG Fengfeng,WANG Ping,SHI Lei,YANG Jing,YANG Qin
(Key Laboratory of Wild Vegetable Germplasm Resources and Innovation,College of Agronomy,Inner Mongolia Agricultural University, Huhhot 010019,Inner Mongolia,China)
A L25(56)of orthogonal design was used to optimize SCoT-PCR(Scodon Targeted Polymorphism Amplification System)of pumpkin in 5 factors such as Taq DNA polymerase,Mg2+,DNA template,dNTPs and primer concentrations. The result showed that the optimized system was as follows:a total volume of 20 μL including 2.50 mmol·L-1Mg2+, 0.40 mmol·L-1dNTPs,0.50 U Taq polymerase,1.00 μmol·L-1primer and 30 ng DNA template.20 primers were selected from the 51 primer combinations test with clear band patterns and abundant polymorphisms.The most suitable annealing temperature of primers were selected.The SCoT-PCR reaction system for SCoT markers of pumpkin could be applied in pumpkin molecular genetics research.
Pumpkin;SCoT-PCR;System optimization;Orthogonal design;Primers screening
2016-09-10;
2016-11-10
內(nèi)蒙古科技計(jì)劃項(xiàng)目(20090707,2010704,20110711,20120212);內(nèi)蒙古高寒地區(qū)高產(chǎn)安全蔬菜生產(chǎn)的研究與創(chuàng)新項(xiàng)目(NDPYTD2013-3)
王豐豐,男,在讀碩士研究生,從事蔬菜種質(zhì)資源與種質(zhì)創(chuàng)新研究。E-mail:980853124@qq.com
王萍,女,副教授,碩士生導(dǎo)師,主要從事種質(zhì)資源與種質(zhì)創(chuàng)新研究。E-mail:wangping@imau.edu.cn

