脂聯素對低氧條件下大鼠肺微動脈內皮細胞NO生成的促進作用及其機制
徐海軍,張存娟,周寧娟,蘇 慧,孫 新(第四軍醫大學西京醫院兒科,西安 700;楊凌示范區醫院兒科;第四軍醫大學西京醫院老年病科;通訊作者,E-mail:sunxin6@fmmu.edu.cn)
脂聯素對低氧條件下大鼠肺微動脈內皮細胞NO生成的促進作用及其機制
徐海軍1,2,張存娟1,周寧娟1,蘇 慧3,孫 新1*
(1第四軍醫大學西京醫院兒科,西安 710032;2楊凌示范區醫院兒科;3第四軍醫大學西京醫院老年病科;*通訊作者,E-mail:sunxin6@fmmu.edu.cn)
目的 重組人球狀脂聯素(APN)促進低氧條件下大鼠肺微血管內皮細胞(PMVECs)NO的生成,探討其潛在的分子機制研究。 方法 原代培養SD大鼠PMVECs,傳至第3代經免疫組化法鑒定細胞傳至第3代鑒定細胞;PMVECs分4組,常氧組(210 ml/L O2,37 ℃);低氧組(20 ml/L O2);低氧+APN組(20 ml/L O2+APN 1 μg/ml),低氧+APN+L-NAME組(20 ml/L O2,+APN 1 μg/ml+L-NAME 1 μg/ml)處理,各組細胞同時處理(加藥)后,培養12 h收集上清,硝酸還原法測NO濃度,RT-PCR測定eNOS mRNA的基因表達Western blot檢測AMPK/p-AMPK、PI3K/p-PI3K、Akt/p-Akt、eNOS/p-eNOS蛋白表達。 結果 鑒定細胞為PMVECs。與常氧組比較,低氧組NO濃度、eNOS mRNA表達水平顯著下降(P<0.01);與低氧組比較,低氧+APN組低氧誘導的NO濃度、eNOS mRNA表達水平顯著增加(P<0.01);L-NAME可阻斷NO的產生和eNOS mRNA的表達。各組AMPK、PI3K、Akt、eNOS總蛋白表達量無差異;與常氧組比較,低氧組中AMPK、PI3K、Akt、eNOS磷酸化表達水平下降(P<0.05);與低氧組比較,低氧+APN組AMPK、PI3K、Akt、eNOS磷酸化表達水平增加(P<0.05);與低氧+APN組比較,低氧+APN+L-NAME組AMPK、PI3K、Akt磷酸化表達水平沒有變化(P>0.05);L-NAME可阻斷eNOS磷酸化的表達(P<0.01)。 結論 低氧條件下APN可促進PMVECs生成NO,其可能機制是AMPK/PI3K/Akt/eNOS/NO信號通路的激活。
脂聯素; 肺微動脈內皮細胞; 信號通路; 一氧化氮
肺動脈高壓(pulmonary arterial hypertension,PAH)是起源于肺動脈、最終影響心臟的微小血管疾病[1],主要表現為肺動脈阻力持續性升高、平滑肌增生、原位血栓形成,損害肺細小動脈和肺動脈壓力持續上升的惡性肺血管疾病[2],最終死于右心室容量超負荷導致的右心衰竭。低氧性肺動脈高壓(hypoxia pulmonary hypertension,HPH)是PAH中最常見類型,低氧引起PMVECs的功能障礙,主要表現為PMVECs生成一氧化氮(NO)減少,后者目前被認為是最重要的舒血管因子[1]。所以,增加PMVECs NO的生成,促進和改善低氧誘導PMVECs功能障礙是治療低氧性肺動脈高壓的關鍵。
脂聯素(APN)是脂肪細胞分泌的一種重要的脂肪因子,研究已經證實,低脂聯素血癥是心血管疾病的一個獨立的危險因素,動物研究表明增加APN濃度能夠改善肥胖誘導的內皮細胞功能障礙,降低血壓[3]。APN能夠改善血管內皮細胞eNOS功能障礙和提高血管對NO的生物利用度[4]。
目前,APN研究的重點主要集中在高血壓和心肌疾病上,是否對肺動脈高壓有作用還不清楚。本課題組前期通過SD大鼠低氧性肺動脈高壓模型,證實了APN對大鼠肺動脈PMVECs具有獨立的保護作用[5]。本實驗在細胞水平上進一步研究APN通過促進低氧誘導的PMVECs NO生成,降低血管緊張度,達到降低肺動脈高壓的作用,并探討其潛在的分子機制。
1 材料和方法
1.1 實驗動物及主要試劑
SPF級6-8周齡SD雄性大鼠,生產許可證編號:SCXK(軍)2012-0007,體質量150-180 g,由解放軍第四軍醫大學實驗動物中心提供。澳洲胎牛血清(賽奧美細胞技術有限公司,血清產地:澳大利亞),DMEM高糖培養基(美國Gibcro公司),內皮細胞生長因子(50×)(美國Gibcro公司),10%胰蛋白酶(美國Gibcro公司),APN(Recombinant Human gAcrp30/Adipolean)(美國Peprotech公司),CD31抗體(美國Abcam公司),FITC標記的IgG(美國Abbkine公司),DAPI(上海碧云天生物技術研究所),NO檢測試劑盒(南京建成生物工程研究所),PVDF膜(美國Biosharp公司),p-AMPK/AMPK抗體、p-PI3K/PI3K抗體、p-Akt/Akt抗體(美國Cell Sinaling 公司),p-eNOS/eNOS抗體(美國BD公司),辣根過氧化物酶(HRP)標記羊抗兔IgG(武漢博士德生物工程有限公司)。
1.2 SD大鼠PMVECs的鑒定和實驗分組
取大鼠肺邊緣剪成1 mm×1 mm小塊組織,制備PMVECs單細胞懸液,原代培養至第3代,玻片上細胞匯合至70%以上進行鑒定。免疫組化檢測PMVECs表面標志物(CD31)抗原。PMVECs經CD31抗體(一抗),4 ℃孵化過夜,異硫酸熒光標記植物凝集素(FITC)標記的羊抗兔IgG抗體(二抗)孵育,DAPI核復染,免疫熒光顯微鏡下鑒定。將第3代PMVECs經10%胰蛋白酶消化后的細胞懸液,細胞濃度調整至(2.5-5.0)×105/ml,以5.0×104/cm2密度接種至4個培養瓶內繼續培養,待鋪滿>60%瓶底時,分為常氧組(210 ml/L O2,37 ℃);低氧組(20 ml/L O2);低氧+APN(1 μg/ml)組,低氧+APN(1 μg/ml)+L-NAME(1 μg/ml)組處理,同時培養12 h。
1.3 各組細胞培養液上清NO測定
將試劑和待檢測樣品按照NO試劑盒說明書要求分別加入各管混勻,靜置10 min,波長550 min,光徑0.5 cm,雙蒸水調零,測各管OD值,根據公式計算各組細胞上清NO濃度。
1.4 RT-PCR測定eNOS mRNA基因表達
棄去上清的PMVECs瓶內加入1 ml Trizol提細胞總RNA,RT-PCR法檢測eNOS mRNA表達,以β-actin作為內參。設計引物為:Forward:5′-CAAGACCGATTACACGACATTGAGA-3′;Reverse:5′-TGAGGACTTGTCCAAACACTCCAC-3′。反轉錄:37 ℃,15 min;85 ℃,5 s;PCR擴增條件:95 ℃,30 s;變性95 ℃,5 s;退火60 ℃,30 s;共40個循環。以相對數形式表示(2-ΔΔCt),ΔCt=Ct目的基因-Ctβ-actin;ΔΔCt=ΔCt處理組-ΔCt對照組。
1.5 PMVECs的AMPK/p-AMPK、PI3K/p-PI3K、Akt/p-Akt、eNOS/p-eNOS蛋白表達的Western blot檢測
棄去上清的PMVECs加入裂解液濃度為1 mmol/L,冰上使細胞充分裂解,采用BCA法測蛋白質濃度,取等量蛋白加入5×SDS-PAGE蛋白上樣緩沖液混合并煮沸10 min,SDS-PAGE電泳,轉膜PVDF后分別加入一抗p-AMPK/AMPK、p-PI3K/PI3K、p-Akt/Akt、p-eNOS/eNOS單克隆抗體,濃度均為1 ∶1 000,4 ℃過夜,羊抗兔IgG抗體(二抗)孵育,清洗3遍,經凝膠成像系統曝光Western blot條帶,Image J軟件計算和分析各組目的條帶灰度值比值。
1.6 統計學分析
2 結果
2.1 PMVECs鑒定
倒置相差顯微鏡下PMVECs細胞邊界清楚,呈典型的“鵝卵石” 樣形態或“鋪路石”樣排列,胞質豐富;CD31表達呈陽性,細胞膜表面發紅熒光,經DAPI復染細胞核發藍色熒光(見圖1)。
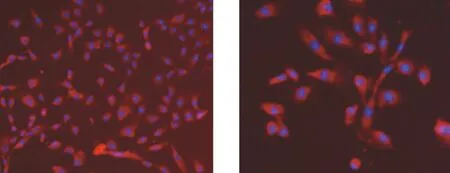
A.×200 B.×400圖1 PMVECs免疫組織化學鑒定Figure 1 Identification of PMVECs by immunohistochemical method
2.2 培養液上清NO的測定
與常氧組比較,低氧組NO濃度顯著下降(P<0.01);與低氧組比較,低氧+APN組NO濃度顯著增加(P<0.01);與常氧組、低氧組、低氧+APN組比較,低氧+APN+L-NAME組NO濃度顯著下降(P<0.01,見圖2)。
2.3 eNOS mRNA基因的的表達水平
與常氧組比較,低氧組eNOS mRNA基因表達水平顯著下降(P<0.01);與低氧組比較,低氧+APN組eNOS mRNA基因表達水平顯著增加(P<0.01);與常氧組、低氧組、低氧+APN組比較,低氧+APN+L-NAME組eNOS mRNA基因表達水平顯著下降(P<0.01,見圖3)。
2.4 AMPK/p-AMPK、PI3K/p-PI3K、Akt/p-Akt、eNOS/p-eNOS的的表達水平水平
四組AMPK、PI3K、Akt、eNOS總蛋白表達不變;與常氧組比較,低氧誘導的AMPK、PI3K、Akt、eNOS磷酸化表達水平下降(P<0.05);與低氧組比較,低氧+APN組增加低氧誘導的AMPK、PI3K、Akt、eNOS磷酸化表達水平(P<0.05);L-NAME可阻斷eNOS磷酸化的表達(見圖4)。
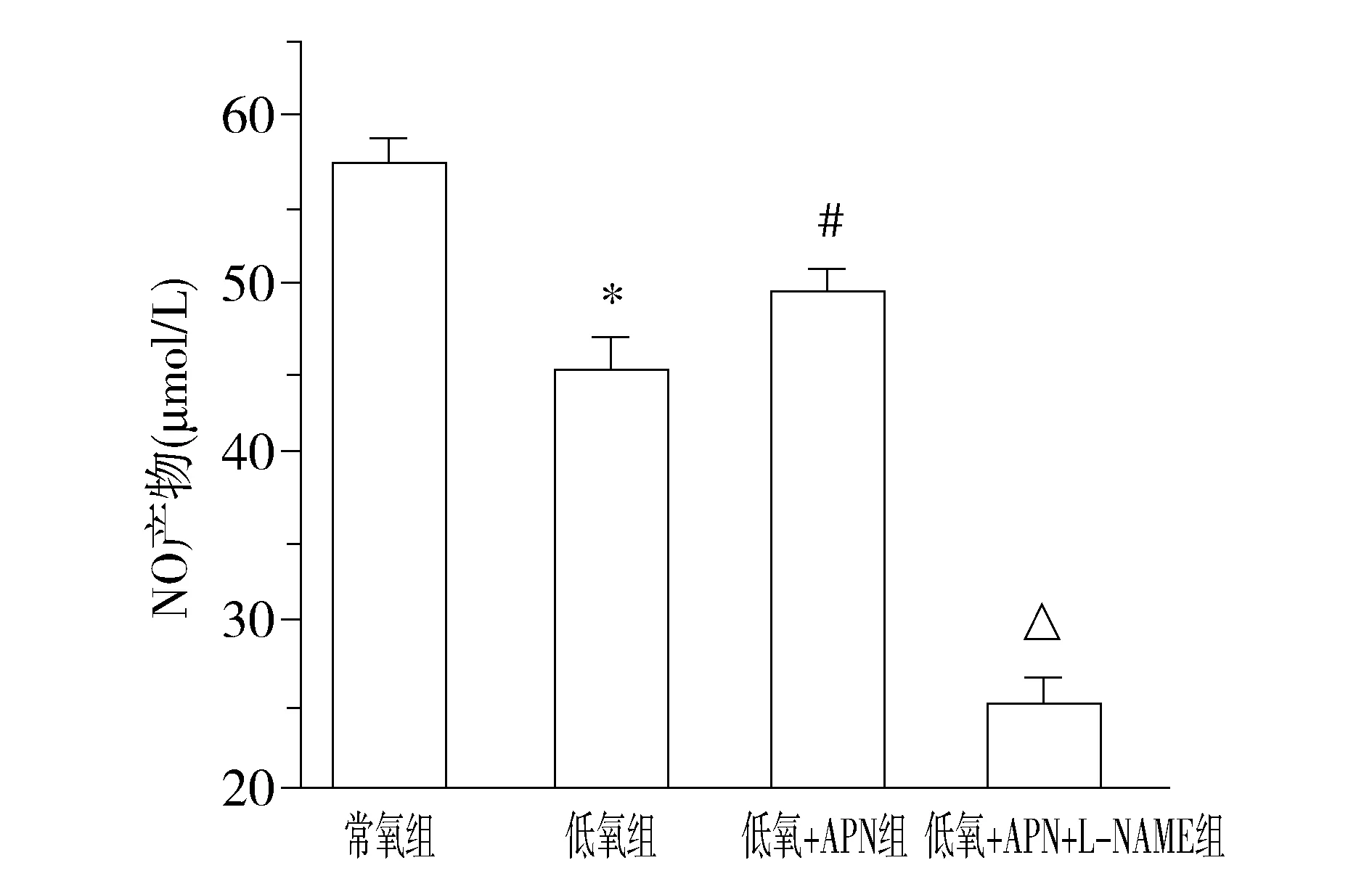
與常氧組比較,*P<0.01;與低氧組比較,#P<0.01;與其他三組比較,△P<0.01圖2 各組細胞培養液上清NO濃度檢測(n=7)Figure 2 Concentration of NO in supernatant determined by nitrate reductive enzymatic method(n=7)
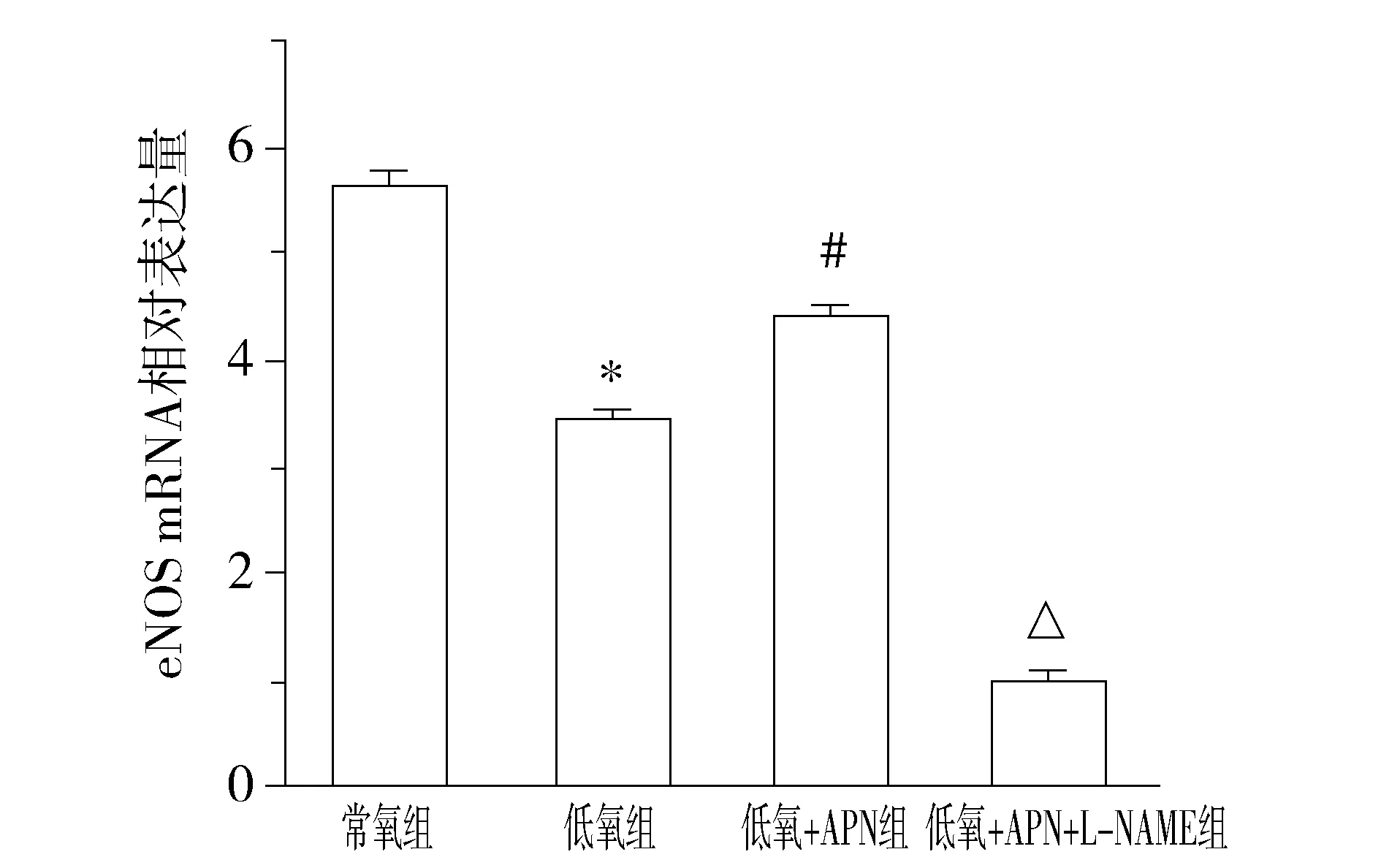
與常氧組比較,*P<0.01;與低氧組比較,#P<0.01;與其他三組比較,△P<0.01圖3 用RT-PCR測定各組細胞eNOS mRNA基因相對表達量(n=7)Figure 3 Expression of eNOS mRNA by RT-PCR(n=7)
3 討論
目前認為[7]早期低氧性肺動脈收縮反應(HPV)和后期合并肺動脈結構重建(PVR)是HPH最主要的兩個發病環節。長期低氧PMVECs功能障礙,最主要表現NO生成減少引起血管舒縮失衡。因此,從源頭上保護血管內皮細胞,增加NO生成;延緩肺動脈血管的重建成為治療HPH的關鍵。APN是一種內源性胰島素增敏劑[8],具有保護血管內皮細胞、調節代謝、 抗炎及保護心肌細胞等多種生物學作用,成為國內外研究的熱點。苗蘭等[9]在2%O2條件下,大鼠PMVECs經體外培養12 h后,細胞存活率降低,生化指標改變,細胞骨架基本完整,PMVECs功能障礙。本實驗在低氧條件下誘導內皮細胞生成NO濃度,給予APN后NO明顯增加;在細胞水平上證實了APN可能通過APMK/PI3K/Akt/eNOS/NO通路的激活發揮對肺動脈內皮細胞的作用,達到治療肺動脈高壓的作用。
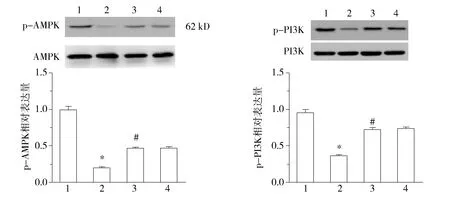
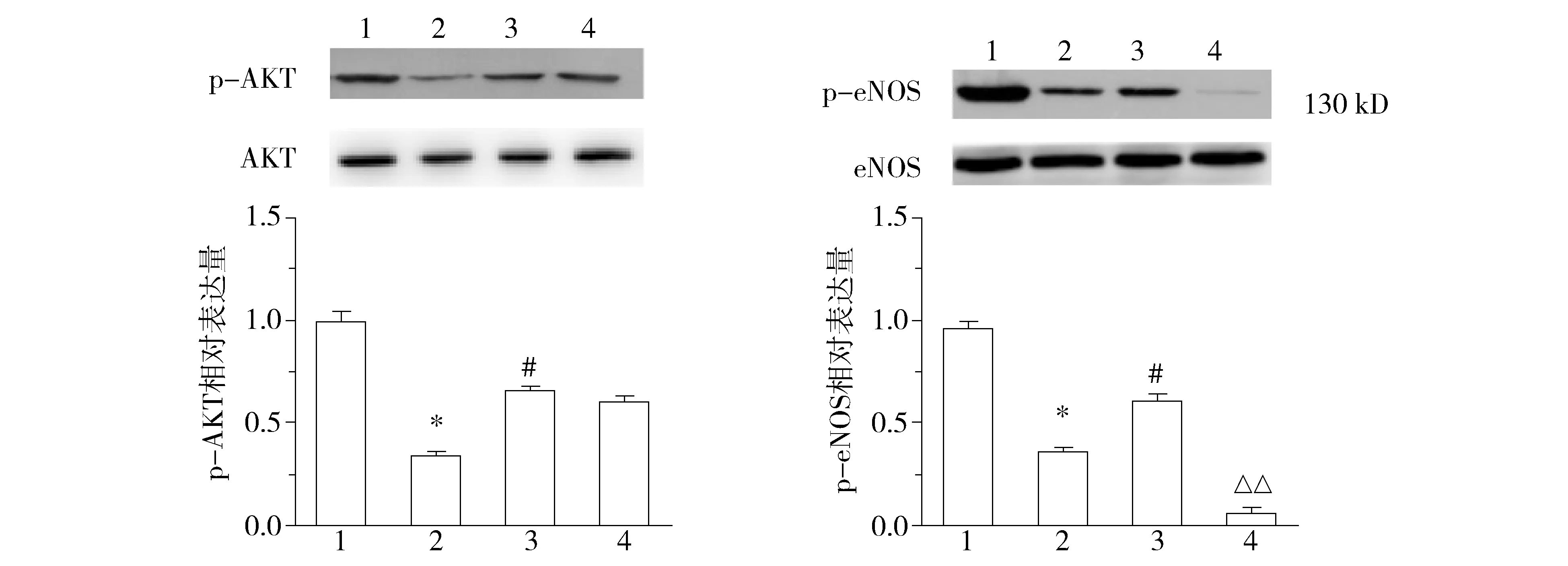
1.常氧組; 2.低氧組; 3.低氧+APN組; 4.低氧+APN+L-NAME組;與常氧組比較,*P<0.05;與低氧組比較,#P<0.05;與低氧+APN組比較,△△P<0.01圖4 各組細胞總AMPK、Akt、PI3K、eNOS水平和磷酸化表達的表達的水平 (n=7)Figure 4 Protein levels of AMPK/p-AMPK,PI3K/p-PI3K,Akt/p-Akt and eNOS/p-eNOS detected by Western blot (n=7)
Kajimoto等[10]認為,內皮細胞呈現典型的“鵝卵石”樣形態,內皮細胞膜表面特異性CD31高表達。我們的實驗顯示所培養的細胞為PMVECs呈典型的“鵝卵石”樣,細胞膜表面特異性CD31高表達。內皮細胞合成和分泌多種生物活性物質,包括細胞因子、趨化因子、生長因子等調節血管穩態[11]。內皮細胞通過L-Arg-NO途徑由一氧化氮合酶(NOS)催化L-精氨酸生成NO[12],NO單純擴散進入血管平滑肌,平滑肌舒張,緊張度下降使血管舒張。研究[13]表明,低氧減少內皮細胞依賴的eNOS基因表達和誘發內皮細胞功能障礙,最主要表現為NO生成減少[14]和生物活性下降[15]導致的內皮細胞依賴的平滑肌舒張降低。我們的實驗表明,與常氧組比較,低氧組NO濃度顯著下降(P<0.01),eNOS mRNA基因表達水平顯著下降(P<0.01),表明低氧誘導內皮細胞功能障礙;與低氧組比較,低氧+APN組NO濃度顯著增加(P<0.01),eNOS mRNA基因表達水平顯著增加(P<0.01),表明APN能夠改善低氧誘導內皮細胞功能障礙,增加NO生成;與常氧、低氧、低氧+APN組比較,低氧+APN+L-NAME組NO濃度顯著下降(P<0.01),eNOS mRNA基因表達水平顯著下降(P<0.01),APN改善低氧誘導內皮細胞功能障礙可被 eNOS 抑制劑 L-NAME 阻斷。Chen等[16]認為APN通過AMPK通路激活eNOS,使其磷酸化,增加NO舒張血管。 Western blot結果顯示,各組AMPK、PI3K、Akt、eNOS總蛋白表達不變;與常氧組比較,低氧組AMPK、PI3K、Akt、eNOS磷酸化水平下降(P<0.05);與低氧組比較,低氧+APN組AMPK、PI3K、Akt、eNOS磷酸化水平增加(P<0.05);與低氧+APN組比較,低氧+APN+L-NAME組AMPK、PI3K、Akt磷酸化水平沒有變化(P>0.05);L-NAME可阻斷eNOS磷酸化水平(P<0.01),說明APN對低氧誘導的內皮細胞保護作用可能是通過AMPK/PI3K/Akt/eNOS/NO通路實現。
生理情況下,內皮細胞通過AMPK/PI3K/Akt/eNOS通路生成NO維持血管的舒張作用;低氧可誘導PMVECs功能障礙,主要表現為NO生成減少,血管舒張功能降低,緊張度增加形成肺動脈高壓。本實驗證實了,APN能夠通過AMPK/PI3K/Akt/eNOS/NO通路糾正低氧誘導PMVECs功能障礙,增加eNOS mRNA基因表達和NO生成,血管舒張功能,降低肺動脈高壓。
本研究表明,本研究結果表明,在細胞水平上,APN具有獨立地降低低氧性肺動脈高壓的作用,其可能的機制為AMPK/PI3K/Akt/eNOS/NO通路的激活,APN可能成為潛在用于治療低氧性肺動脈高壓的輔助藥物。
[1] Cheng KK,Lam KS,Wang Y,etal.Adiponectin-induced endothelial nitric oxide synthase activation and nitric oxide production are mediated by APPL1 in endothelial cells[J].Diabetes,2007,56(5):1387-1394.
[2] Gladwin MT.Cardiovascular complications and risk of death in sickle-cell disease[J].Lancet,2016,387(10037):2565-2574.
[3] Ebrahimi-Mamaeghani M,Mohammadi S,Arefhosseini SR,etal.Adiponectin as a potential biomarker of vascular disease[J].Vasc Health Risk Manag,2015,11:55-70.
[4] Nosalski R,Guzik TJ.Perivascular adipose tissue inflammation in vascular disease[J].Br J Pharmacol,2017:Epub ahead of print.
[5] 張存娟,楊瑞,邢文娟,等.脂聯素改善間歇性低氧性肺動脈高壓大鼠離體肺動脈舒張功能及其機制[J].心臟雜志,2016,28(3):273-278.
[6] Hoeper MM,Humbert M,Souza R,etal.A global view of pulmonary hypertension[J].Lancet Respir Med,2016,4(4):306-322.
[7] Ma C,Li Y,Ma J,etal.Key role of 15-lipoxygenase/15-hydroxyeicosatetraenoic acid in pulmonary vascular remodeling and vascular angiogenesis associated with hypoxic pulmonary hypertension[J].Hypertension,2011,58(4):679-688.
[8] Markaki A,Psylinakis E,Spyridaki A.Adiponectin and end-stage renal disease[J].Hormones (Athens),2016,15(3):345-354.
[9] 苗蘭英,林大勇,白劍,等.低氧條件下大鼠血管內皮細胞的形態觀察[J].生物學雜志,2011,28(4):18-20.
[10] Kajimoto K,Hossen MN,Hida K,etal.Isolation and culture of microvascular endothelial cells from murine inguinal and epididymal adipose tissues[J].J Immunol Methods,2010,357(1-2):43-50.
[11] Rafii S,Butler JM,Ding BS.Angiocrine functions of organ-specific endothelial cells[J].Nature,2016,,529(7586):316-325.
[12] Shan L,Wang B,Gao G,etal.L-Arginine supplementation improves antioxidant defenses through L-arginine/nitric oxide pathways in exercised rats[J].J Appl Physiol (1985),2013,115(8):1146-1155.
[13] Fish JE,Yan MS,Matouk CC,etal.Hypoxic repression of endothelial nitric-oxide synthase transcription is coupled with eviction of promoter histones[J].J Biol Chem,2010,285(2):810-826.
[14] Giuliano F.New horizons in erectile and endothelial dysfunction research and therapies[J].Int J Impot Res,2008,20(Suppl 2):S2-S8.
[15] Chalupsky K,Kracun D,Kanchev I,etal.Folic acid promotes recycling of tetrahydrobiopterin and protects against hypoxia-induced pulmonary hypertension by recoupling endothelial nitric oxide synthase[J].Antioxid Redox Signal,2015,23(14):1076-1091.
[16] Chen H,Montagnani M,Funahashi T,etal.Adiponectin stimulates production of nitric oxide in vascular endothelial cells[J].J Biol Chem,2003,278(45):45021-45026.
Effect of diponectinon on hypoxia-induced pulmonary microvascular endothelial cells and its mechanism
XU Haijun1,2,ZHANG Cunjuan1,ZHOU Ningjuan1,SU Hui3,SUN Xin1*
(1DepartmentofPediatrics,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China;2DepartmentofPediatrics,HospitalofYanglingDemonstrationDistrict;3DepartmentofGeriatrics,XijingHospital,FourthMilitaryMedicalUniversity;*Correspondingauthor,E-mail:sunxin6@fmmu.edu.cn)
ObjectiveTo investigate the production of NO in rat pulmonary microvascular endothelial cells(PMVECs) under hypoxia,and to explore the underlying molecular mechanisms.MethodsThe third passage of primary culture PMVECs from SD rat were identified by immunohistochemical method and divided into four groups.The PMVECs in four groups were cultured respectively under normoxia condition(210 ml/L O2,37 ℃),hypoxia condition(20 ml/L O2),hypoxia condition(20 ml/L O2)+APN (1 μg/ml),hypoxia condition(20 ml/L O2)+APN (1 μg/ml)+L-NAME (1 μg/ml).Supernatant and cell lysate were collected after culture for 12 h.The concentration of NO in supernatant was determined by nitrate reductive enzymatic method,the expression of eNOS mRNA was detected by RT-PCR,and protein levels of AMPK/p-AMPK,PI3K/p-PI3K,Akt/p-Akt and eNOS/p-eNOS were detected by Western blot in each group.ResultsPrimary culture PMVECs were successfully identified.NO production and expression of eNOS mRNA in hypoxia group decreased significantly compared with normoxia group(P<0.01).NO production and eNOS mRNA expression in hypoxia+ANP group were significantly higher than those in hypoxia group(P<0.01).L-NAME deceased the production of NO and the expression of eNOS mRNA(P<0.01).There was no significant difference in total protein levels of AMPK,PI3K,Akt and eNOS among the four groups.Phosphorylated AMPK,PI3K,Akt and eNOS decreased significantly in hypoxia group compared with normoxia group(P<0.05).Phosphorylated AMPK,PI3K,Akt and eNOS increased significantly in hypoxia+ANP group compared with hypoxia group(P<0.05).Phosphorylated AMPK,PI3K and Akt showed no significant difference between hypoxia+ANP+L-NAME group and hypoxia+ANP group(P<0.05).L-NAME deceased the expression of eNOS phosphorylation(P<0.01).ConclusionAPN can promote the production of NO from PMVECs under hypoxic conditions at the cellular level by the activation of AMPK/PI3K/Akt/eNOS/NO signaling pathway.
adiponectin; pulmonary artery endothelial cell; signaling pathway; nitric oxide
國家自然基金資助項目(81270330,30700345,31371151,31271219);陜西省科技廳國際合作課題資助項目(2013KW30-02);陜西省科學技術研究發展計劃資助項目(2013Kkjxx-89)
徐海軍,男,1980-05生,碩士,E-mail:navy800628@163.com
2017-02-10
R544.1
A
1007-6611(2017)05-0415-05
10.13753/j.issn.1007-6611.2017.05.003

