miR-204對乳腺癌MDA-MB-231細胞生物學特性的影響*
吳劉成,杜利莉,王 靜,殷海琳,馬 超,蔣茂榮,邵義祥△
(1 南通大學杏林學院,江蘇南通 226009;2 南通大學實驗動物中心,江蘇南通 226001)
miR-204對乳腺癌MDA-MB-231細胞生物學特性的影響*
吳劉成1,2,杜利莉1,王 靜1,殷海琳1,馬 超1,蔣茂榮2,邵義祥2△
(1 南通大學杏林學院,江蘇南通 226009;2 南通大學實驗動物中心,江蘇南通 226001)
目的 研究microRNA-204(miR-204)對乳腺癌細胞生物學特性的影響。方法 在人乳腺癌細胞MDA-MB-231中轉染miR-204模擬物和抑制劑后48 h,實時熒光PCR(Real-time PCR)檢測細胞中miR-204表達變化。流式細胞儀分析miR-204對MDA-MB-231細胞增殖、凋亡的影響。采用Transwell遷移小室分析法檢測miR-204對MDA-MB-231細胞遷移的影響。結果 實時熒光PCR分析:miR-204模擬物和抑制劑效果顯著,與正常對照比較差異有統計學意義(P<0.01);流式細胞儀分析:與正常對照相比,miR-204 模擬物組G1期細胞數目明顯減少(P<0.01),G2/M期細胞數目明顯增多(P<0.01),而miR-204 抑制劑的作用則相反,G1期細胞數目明顯增多(P<0.01),G2/M期細胞數目明顯減少(P<0.01);miR-204模擬物組明顯促進細胞凋亡(P<0.01),而抑制劑組明顯抑制細胞凋亡(P<0.01)。Transwell遷移小室分析:miR-204 模擬物組穿過Transwell遷移小室的細胞明顯減少(P<0.01),而抑制劑組則相反,細胞數目明顯增多(P<0.01)。結論 miR-204對乳腺癌MDA-MB-231細胞具有負調控作用,能夠抑制乳腺癌細胞增殖和遷移,促進癌細胞凋亡。
乳腺腫瘤;細胞凋亡;微RNAs;miR-204;MDA-MB-231;細胞生物學特性
乳腺癌是嚴重危害生命健康的惡性腫瘤之一,是女性第2位最常見的惡性腫瘤[1],且乳腺癌的發病率和病死率呈逐年增長趨勢[2]。目前,已經有開發相關的靶向藥物用于臨床治療,但療效并不樂觀,分子靶向治療被認為是一種有效途徑[3]。微小RNA(miRNA)的出現為研究乳腺癌的發病機制提供了新的策略和思路。有研究發現miRNA-204(miR-204)過表達則可抑制膠質瘤細胞的增殖和遷移能力[4]。顯然miR-204對腫瘤細胞具有抑制作用,而在乳腺癌中研究的還比較少。因此,本試驗構建miR-204的模擬物及抑制劑,并轉染作用于乳腺癌MDA-MB-231細胞,研究對該細胞的行為學變化,以期為乳腺癌的靶向治療提供新的思路。
1 材料與方法
1.1 材料
1.1.1 細胞 使用人乳腺癌MDA-MB-231細胞系,由南通大學實驗動物中心提供。
1.1.2 主要儀器與試劑 CO2培養箱(Thermo公司,美國);超凈工作臺(蘇州安泰空氣技術有限公司,中國);倒置顯微鏡(Olympus公司,日本);流式細胞儀(BD公司,美國);ABI stepone 實時熒光PCR (Real-Time PCR) System (ABI公司,美國);低溫冷凍離心機 (Eppendorf公司,德國)。1640培養基,胎牛血清(HyClone公司,美國);Trizol (Invitrogen公司,美國);細胞周期與細胞凋亡檢測試劑盒,Annexin V-FITC Apoptosis Detection Kit(碧云天生物科技公司,中國);riboFECTTMCP 轉染試劑盒(廣州銳博生物科技有限公司,中國);SYBR?PrimeScriptTMRT-PCR(Roch公司,瑞士);Omniscript?Reverse Transcription kit (Qiagen公司,德國)。
1.2 方法
1.2.1 細胞復蘇及培養 按照常規的細胞凍融方法操作,以緩凍速溶為原則,將凍存細胞從-80 ℃冰箱中取出,迅速放入37 ℃的水浴,使其快速融化,之后加入完全培養基。放入CO2培養箱,第2天更換培養基,每隔1~2天或者培養基變為黃色時更換培養基。
1.2.2 miR-204轉染細胞方法 轉染前1 d細胞接種至6孔板中,密度為1×105,采用含有10%胎牛血清(FBS)的1640培養基培養細胞,使轉染時的細胞密度能夠達到50%~80%。細胞轉染按照riboFECTTMCP 轉染試劑盒說明書進行操作。試驗設置4個組:正常對照組加入500 μL的磷酸鹽緩沖液(PBS);陰性對照組加入陰性對照mimic及riboFECTTMCP Reagent;抑制劑組加入miR-204抑制劑及riboFECTTMCP Reagent;模擬物組加入miR-204 mimic及riboFECTTMCP Reagent。之后將6孔板放入CO2培養箱中培養48 h。
1.2.3 Real-time PCR檢測miR-204表達水平 本試驗檢測miR-204采用U6作為內參,其中RT反應中的頸環引物和Real-time PCR反應中的頸環引物,均由廣州銳博生物有限公司設計并合成。細胞總RNA提取。轉染48 h,然后棄掉培養基,使用預冷PBS緩沖液洗2次;6孔板中加入1.0 mL Trizol,水平放置片刻;用槍頭吹打幾次,轉入1.5 mL EP管中,反復吹打至無明顯沉淀;室溫孵育5 min;加入0.2 mL三氯甲烷;渦旋振蕩器上震蕩15 s;室溫孵育5 min;4 ℃,12 000 r/min,15 min;吸取大約0.5 mL上清液;加入0.5 mL異丙醇,上下顛倒混勻;室溫孵育10 min;4 ℃,12 000 r/min,10 min;棄去上清液;加入1.0 mL 75%乙醇;輕微混勻,4 ℃,7 500g,5 min,棄去上清液;重復上一步驟;靜置5~10 min,晾干;用RNase-free水重懸;55~60 ℃水浴10~15 min,超微量分光光度計測定核酸濃度。PCR反應體系及條件:RNA template (2 μg),Bulge-LoopTMmiRNA RT Primer(62.5 nmol/L) 2.0 μL,加RNase-free water至14 μL,以上體系混勻后,瞬時離心,70 ℃放置10 min后,再加入以下試劑進行RT反應,10×Buffer RT 2 μL,dNTP Mix (5 mmol/L each dNTP) 2 μL,RNase 抑制劑 (10 U/μL) 1 μL,Omniscript Reverse Transcriptase 1 μL,total reaction volume 20 μL,瞬時離心,37 ℃ 60 min,70 ℃ 10 min,于-20 ℃保存。Real-time PCR反應體系及條件。20 μL 反應體系:2×SYBGreen Master Mix 10 μL,Bulge-LoopTMmiRNA Forward Primer (5 μmol/L) 2 μL,Bulge-LoopTMmiRNA Reverse Primer (5 μmol/L) 2 μL,cDNA 2 μL,加ddH2O 至20 μL。試劑混勻后短暫離心置于ABI stepone Real-time PCR 儀,程序如下:95 ℃ 5 min;(95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s收集熒光)×45;55.0~90.0 ℃每上升0.3 ℃讀熒光值生成熔解曲線。每個PCR反應設置3個復孔,擴增結束后,根據擴增曲線和熔解曲線分析擴增效率和特異性,并得到各反應管的循環閾值(Ct),miR-204的相對表達量采用2-△△Ct方程進行計算。
1.2.4 細胞增殖和凋亡檢測方法 分別在6孔板中轉染試劑48 h后,按照碧云天生物科技公司試劑盒說明書操作,并用流式細胞儀檢測。
1.2.5 細胞遷移檢測方法 在6孔板中細胞轉染試劑48 h后,更換為基礎培養基,饑餓24 h,收集細胞,PBS洗滌再重懸,向Transwell上室中加入200 μL細胞懸液(2×105),下室中加入500 μL完全培養基,參照文獻[5]操作。

2 結 果
2.1 miR-204 抑制劑和模擬物轉染效率的檢測 4組轉染效率比較差異有統計學意義(F=198.9,P=0.000)。與正常對照組相比,陰性對照組miR-204表達水平率略有上升,但比較差異無統計學意義(t=2.637,P=0.062);抑制劑組miR-204水平明顯下降(t=11.60,P=0.000);模擬物組miR-204水平明顯上升(t=14.10,P=0.0000),見圖1。
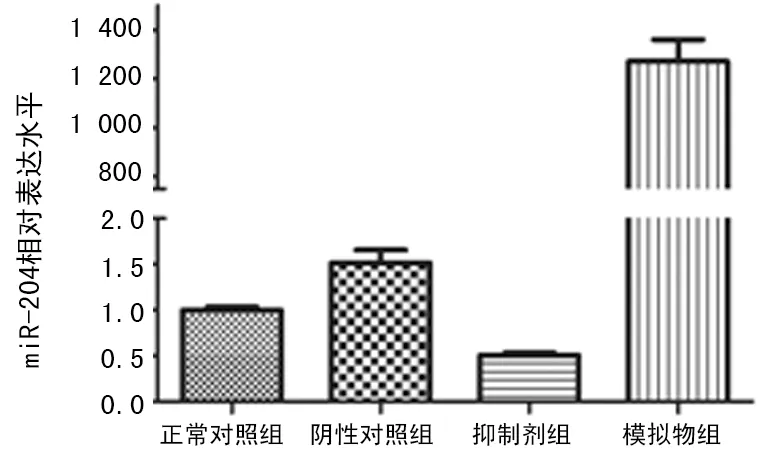
圖1 4組miR-204表達水平
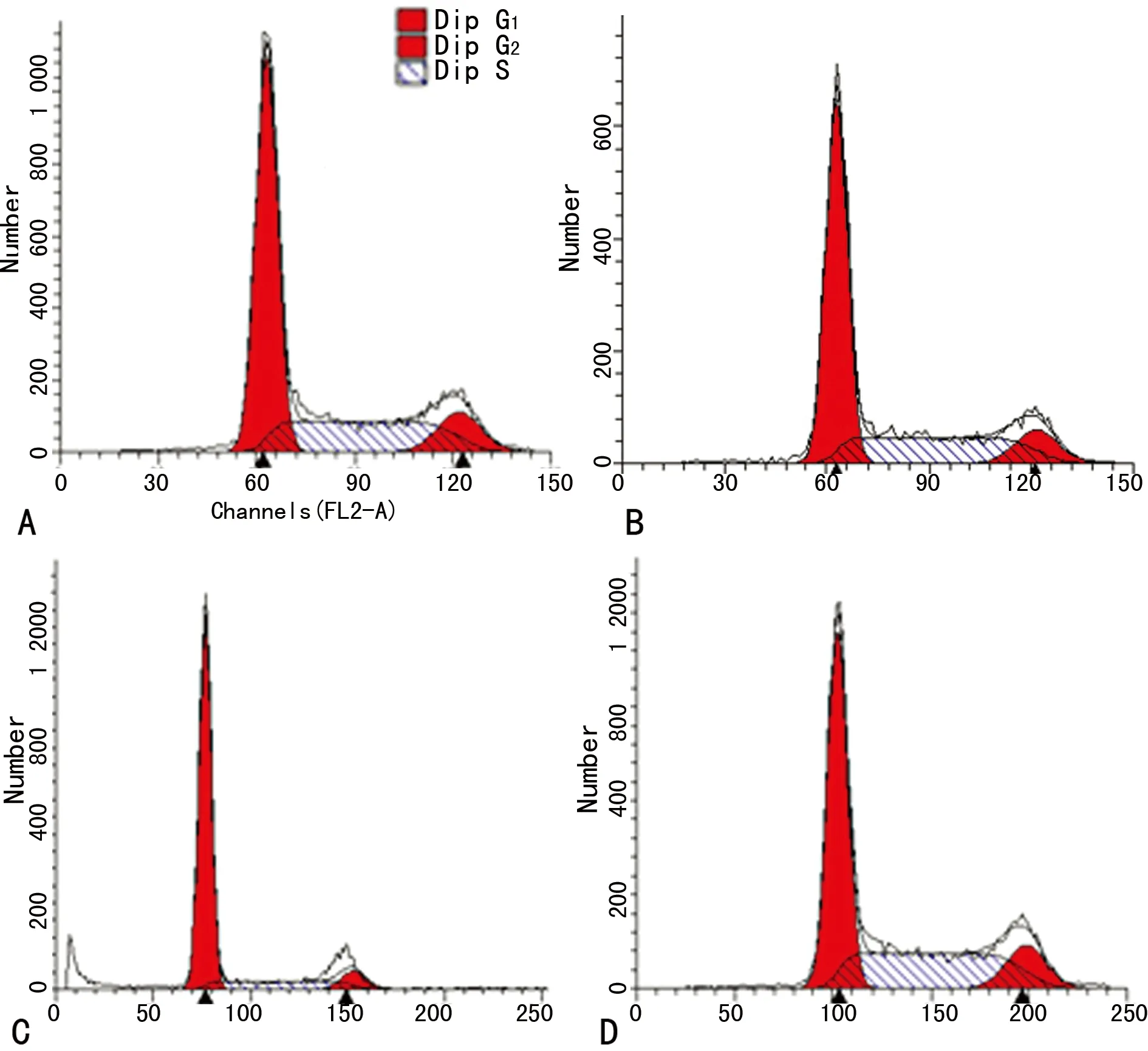
A:正常對照組;B:陰性對照組;C:抑制劑組;D:模擬物組。
圖2 細胞流式術檢測各組人乳腺癌MDA-MB-231細胞增殖
2.2 細胞流式術檢測人乳腺癌MDA-MB-231細胞增殖 G1期、S期及G2/M期,3個時期中的4組百分比細胞計數的均數差異有統計學意義(FG1期=106.98,FS期=25.80,FG2/M期=28.24,P<0.01)。G1期:與正常對照組相比,陰性對照組細胞數目增多,但比較差異無統計學意義(P>0.05),抑制劑組細胞數目明顯增多(P<0.01),模擬物組細胞數目明顯減少(P<0.01)。S期:與正常對照組相比,陰性對照組細胞數目減少,但比較差異無統計學意義(P>0.05),抑制劑組細胞數目明顯減少(P<0.01),模擬物組細胞數目略有增多,但比較差異無統計學意義(P>0.05)。G2/M期:與正常對照組相比,陰性對照組細胞數目增多,但比較差異無統計學意義(P>0.05),抑制劑組細胞數目明顯減少(P<0.01),模擬物組細胞數目明顯增多(P<0.01),見圖2、3。
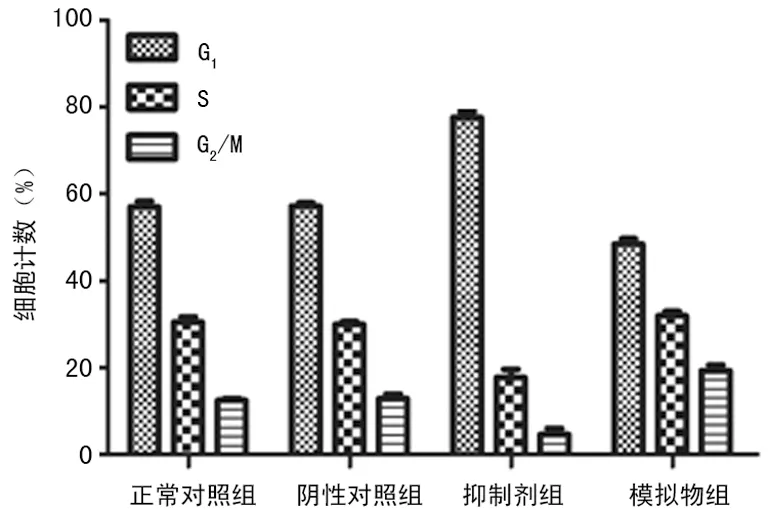
圖3 miR-204對各組人乳腺癌MDA-MB-231細胞周期的影響
2.3 細胞流式術檢測人乳腺癌MDA-MB-231細胞凋亡 4組百分比細胞凋亡計數的均數比較差異有統計學意義(F=118.3,P<0.01)。與正常對照組相比,陰性對照組細胞凋亡數目減少,但比較差異無統計學意義(t=2.267,P=0.086),抑制劑組細胞凋亡數目明顯減少(t=12.77,P<0.01),模擬物組細胞凋亡數目明顯增多(t=7.086,P<0.01),見圖4、5。
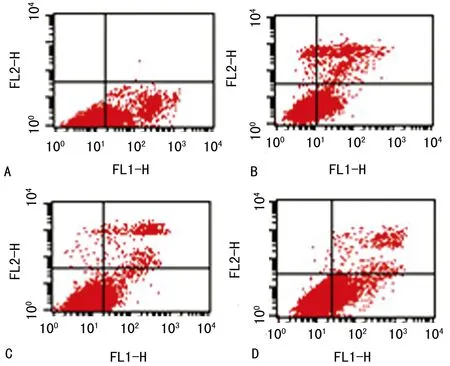
A:正常對照組;B:陰性對照組;C:抑制劑組;D:模擬物組。
圖4 細胞流式術檢測各組人乳腺癌MDA-MB-231細胞凋亡
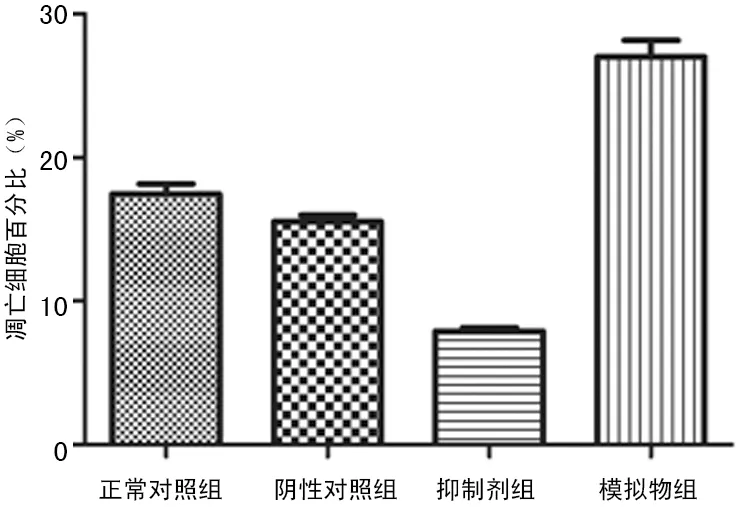
圖5 miR-204 對各組人乳腺癌MDA-MB-231細胞凋亡的影響
2.4 Transwell小室試驗檢測人乳腺癌MDA-MB-231細胞的遷移能力 4組遷移細胞數目的均數比較差異有統計學意義(F=60.77,P<0.01)。與正常對照組相比,陰性對照組細胞遷移數目增多,但比較差異無統計學意義(t=1.011,P=0.369),抑制劑組細胞遷移數目增多(t=6.411,P<0.01),模擬物組細胞遷移數目減少(t=7.115,P<0.01),見圖6、7。
A:正常對照組;B:陰性對照組;C:抑制劑組;D:模擬物組。
圖6 Transwell小室檢測各組人乳腺癌MDA-MB-231細胞遷移
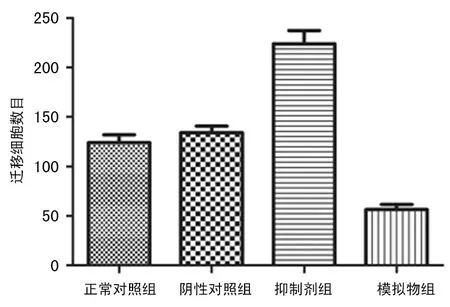
圖7 miR-204 對各組人乳腺癌MDA-MB-231細胞遷移的影響
3 討 論
miRNA是一種非編碼小RNA分子(約含22個核苷酸),存在于植物、動物和一些病毒中,功能主要是RNA沉默和轉錄后修飾調控基因表達[6]。成熟的miRNA是RNA誘導沉默復合體(RISC)的重要組成部分,該沉默復合體還包括核糖核酸酶和許多相關的蛋白質[7]。miR-204定位于人類第9號染色體73424891和73425000位之間。有研究表明miR-204在腫瘤組織中存在異常表達,并與腫瘤增殖[8]、侵襲轉移[9]、化療抵抗[10]及不良預后[11]密切相關。然而,miR-204在不同的腫瘤中起著不同的作用。比如,miR-204在急性淋巴白血病[12]和前列腺癌[13]腫瘤中高表達,起癌基因作用,促進腫瘤的增殖和轉移。而在鼻咽癌[9]和子宮內膜癌[10]等腫瘤中表達下調,起抑癌基因作用,抑制腫瘤的發展。
本研究結果顯示,miR-204促進乳腺癌細胞凋亡,與Wang 等[14]報道的結果一致,抑制細胞的增殖,這與Xiong等[15]報道的結果相似,抑制細胞的遷移能力,這與Imam等[16]等報道的結果相似。研究結果提示,miR-204在乳腺癌細胞中起抑癌基因的作用,能夠抑制乳腺癌細胞的增殖和遷移并促進其凋亡,具有作為診治乳腺癌分子靶標的潛能。但是miR-204調控乳腺癌增殖和轉移的具體機制還不是很清楚,還有待于更進一步的研究。總之,miR-204可能在乳腺癌的發生、發展及治療過程中發揮重要作用,靶向miR-204治療也可能為乳腺癌的治療提供新思路。
[1]張敏璐,黃哲宙,鄭瑩.中國2008年女性乳腺癌發病、死亡和患病情況的估計及預測[J].中華流行病學雜志,2012,33(10):1049-1051.
[2] Kantelhardt EJ,Cubasch H,Hanson C.Taking on breast cancer in East Africa:global challenges in breast cancer[J].Curr Opin Obstet Gynecol,2015,27(1):108-114.
[3]范雅文,張旭輝,張嶸,等.三陰乳腺癌的異質性及靶向治療[J].生物技術通訊,2015,26(3):442-445
[4]Ying Z,Li Y,Wu J,et al.loss of miR-204 expression enhances glioma migration and stem cell-like phenotype[J].Cancer Res,2013,73(2):990-999.
[5]Yi M,Li M,Long X,et al.miR-520e regulates cell proliferation,apoptosis and migration in breast cancer[J].Oncol Lett,2016,12(5):3543-3548.
[6]Ambros V.The functions of animal microRNAs[J].Nature,2004,431(7006):350-355
[7]Rana TM.Illuminating the silence:understanding the structure and function of small RNAs[J].Nat Rev Mol Cell Biol,2007,8(1):23-36.
[8]Mikhaylova O,Stratton Y,Hall D,et al.VHL-regulated MiR-204 suppresses tumor growth through inhibition of LC3B-mediated autophagy in renal clear cell carcinoma[J].Cancer Cell,2012,21(4):532-546.
[9]Vimalraj S,Miranda PJ,Ramyakrishna B,et al.Regulation of breast cancer and bone metastasis by microRNAs[J].Dis Markers,2013,35(5):369-387.
[10]Ryan J,Tivnan A,Fay J,et al.MicroRNA-204 increases sensitivity of neuroblastoma cells to cisplatin and is associated with a favourable clinical outcome[J].Br J Cancer,2012,107(6):967-976.
[11]Zeng L,Yu J,Huang T,et al.Differential combinatorial regulatory network analysis related to venous metastasis of hepatocellular carcinoma[J].BMC Genomics,2012,13 Suppl 8:S14.
[12]Kovaleva V,Mora R,Park YJ,et al.miRNA-130a targets ATG2B and DICER1 to inhibit autophagy and trigger killing of chronic lymphocytic leukemia cells[J].Cancer Res,2012,72(7):1763-1772.
[13]Boll K,Reiche K,Kasack K,et al.MiR-130a,miR-203 and miR-205 jointly repress key oncogenic pathways and are downregulated in prostate carcinoma[J].Oncogene,2013,32(3):277-285.
[14]Wang X,Qiu W,Zhang G,et al.MicroRNA-204 targets JAK2 in breast cancer and induces cell apoptosis through the STAT3/BCl-2/survivin pathway[J].Int J Clin Exp Pathol,2015,8(5):5017-5025.
[15]Xiong F,Liu K,Zhang F,et al.MiR-204 inhibits the proliferation and invasion of renal cell carcinoma by inhibiting RAB22A expression[J].Oncol Rep,2016,35(5):3000-3008.
[16]Imam JS,Plyler JR,Bansal H,et al.Genomic loss of tumor suppressor miRNA-204 promotes cancer cell migration and invasion by activating AKT/mTOR/Rac1 signaling and actin reorganization[J].PLoS One,2012,7(12):e52397.
Effect of miR-204 in cell biological characteristics of breast cancer MDA-MB-231 cell*
WuLiucheng1,2,DuLili1,WangJing1,YinHailin1,MaChao1,JiangMaorong2,ShaoYixiang2△
(1.XinglinCollege,NantongUniversity,Nantong,Jiangsu226009,China;2.LaboratoryAnimalsCentre,NantongUniversity,Nantong,Jiangsu226001,China)
Objective To study the effect of microRNA-204 (miR-204) on the biological characteristics of breast cancer cells.Methods Real-time PCR was used to detect the expression of miR-204 in human breast cancer cell MDA-MB-231 after transfection of miR-204 mimics and inhibitor for 48 h.Flow cytometry was used to analyse the effect of miR-204 on the proliferation and apoptosis of MDA-MB-231 cells.The effect of miR-204 on the migration of MDA-MB-231 cells was detected by Transwell migration assay.Results Real-time PCR analysis showed that miR-204 mimics and inhibitors had significant effect compared with normal control group(P<0.01).Flow cytometry analysis showed that compared with normal control group,the number of G1phase cells of miR-204 mimics group was significantly decreased(P<0.01),while the number of G2/M cells of miR-204 mimics group was significantly increased(P<0.01).In contrast,the number of G1phase cells of miR-204 inhibitor group was significantly increased(P<0.01),while the number of G2/M cells of miR-204 inhibitor group was significantly decreased(P<0.01).miR-204 mimics group significantly promoted apoptosis,while the inhibitor group significantly inhibited apoptosis(P<0.01).Transwell migration analysis showed that the number of cells of miR-204 mimics group were significantly reduced,while the number of cells was significantly increased in the inhibitor group(P<0.01).Conclusion We find miR-204,which can promote cell apoptosis and inhibit cell proliferation and migration,is a negative factor in the breast cancer cell line MDA-MB-231.
breast neoplasms;apoptosis;MicroRNAs;miR-204;MDA-MB-231;cell biological characteristics
10.3969/j.issn.1671-8348.2017.14.004
江蘇省高等學校大學生創新創業訓練計劃項目(201513993009Y)。 作者簡介:吳劉成(1980-),實驗師,碩士,主要從事人類疾病動物模型方面研究。△
,E-mail:shaoyx@ntu.edu.cn。
Q291
A
1671-8348(2017)14-1881-04
2016-11-23
2017-01-11)

