全反式維甲酸對川崎病患兒外周血Th17/Treg細胞平衡的影響研究
黎 萍,倪維華,潘 薇,田 婧,鄭百紅*
(1.吉林大學第二醫院 兒科,吉林 長春130041;2.吉林大學基礎醫學院 免疫學系)
全反式維甲酸對川崎病患兒外周血Th17/Treg細胞平衡的影響研究
黎 萍1,倪維華2,潘 薇1,田 婧1,鄭百紅1*
(1.吉林大學第二醫院 兒科,吉林 長春130041;2.吉林大學基礎醫學院 免疫學系)
目的 探討全反式維甲酸(ATRA)對川崎病患兒外周血Th17/Treg細胞平衡的影響。方法 研究納入10名川崎病患兒為病例組,選擇10名健康兒童作為對照組,采取外周靜脈血后,無菌分離、制備外周血單個核細胞(PBMC),給予不同濃度ATRA誘導培養PBMC72 h后,采用酶聯免疫吸附法(ELISA)檢測細胞上清液的細胞因子IL-10、IL-17A、TGF-β以及IL-6水平,實時PCR檢測RORγt mRNA和FOXP3 mRNA表達水平,流式細胞術檢測Th17/Treg占外周CD4+T細胞百分比。結果 未加ATRA作用下,病例組Th17細胞比例,轉錄因子RORγt的mRNA表達水平以及相關細胞因子IL-10、IL-17A均高于對照組(P均<0.01),而Treg細胞比例,FOXP3 mRNA表達水平以及相關細胞因子TGF-β、IL-6低于對照組(P均<0.01)。給予不同濃度ATRA作用后,病例組以及對照組Th17比例、IL-10、IL-17A、RORγt的mRNA均有所下降,而Treg細胞比例、FOXP3 mRNA表達水平、TGF-β、IL-6均有所上升(P均<0.01)。結論 ATRA在體外可促進川崎病患兒外周血Treg分化,同時抑制Th17分化,改變川崎病患兒外周血Th17/Treg失衡狀態,該研究為闡明川崎病的免疫學發病機制及探索新療法提供實驗依據以及思路。
川崎病;維甲酸;Th17細胞;Treg細胞;細胞因子
(ChinJLabDiagn,2017,21:0781)
川崎病(KD)是一種主要累及冠狀動脈等中小血管的全身性血管炎綜合征,多見于6個月至5歲兒童,其發病率有逐年增高趨勢[1]。川崎病所致冠狀動脈損傷是小兒最常見的獲得性心臟病之一,并且可能是成年后缺血性心臟病的危險因素之一[2]。川崎病的病因以及發病機制迄今尚未完全闡明,目前認為川崎病是感染等因素誘發的急性自身免疫性血管炎[3]。有研究表明,急性期KD患兒體內存在Th17淋巴細胞(Th17)和調節T淋巴細胞(Treg)失衡,Th17細胞過度活化、Treg細胞比例降低,這可能是導致KD患兒炎癥細胞因子異常增高、冠脈損傷、對靜脈注射免疫球蛋白(IVIG)無反應的原因之一[4]。
維甲酸是食物中維生素A在體內代謝后形成的衍生物,在體內發揮作用的維甲酸主要包括全反式維甲酸(ATRA)和9-順式維甲酸。新近研究表明,維甲酸在體內、外均可抑制Th17細胞的增殖,并促進T細胞轉化為Treg;其作用機制是通過直接減少RORγt[5],以及誘導FOXP3的表達[6];并且維甲酸在體外促進健康人群的Treg轉化[7]。然而,ATRA對川崎病影響的研究尚未見報道。本研究探討ATRA對川崎病患兒外周血Th17/Treg細胞平衡的影響,將為我們進一步研究川崎病的免疫學發病機制,及探索針對該環節的干預治療提供研究依據。
1 材料與方法
1.1 研究對象
研究納入10名臨床診斷為川崎病的患兒為病例組,選擇10名健康兒童作為健康對照組。所有對象均來自2013年6月-2016年6月在吉林大學第二醫院兒科門診或住院病例。記錄兩組研究對象的一般資料和臨床資料。本研究對象均為IVIG敏感型且無冠狀動脈損傷,病例組于確診當天早7:00至7:30空腹無菌抽取3 ml肘靜脈血,對照組以及病例組靜脈血均裝入無菌肝素抗凝管,充分抗凝后置4℃冰箱保存,2 h內處理。KD的診斷參照美國心臟病學會在2004年制定的診斷標準[2];IVIG無反應型及敏感型參照中國以及美國診斷標準[1,8];病例組在確診時、IVIG治療后1個月以及2個月分別行心臟超聲,排除冠狀動脈損傷[9]病例。本研究已由吉林大學第二醫院倫理委員會通過;研究方案已經告知研究對象家屬,并獲得簽字同意。
1.2 方法
1.2.1 無菌分離、制備外周血單個核細胞(PBMC) 將含有淋巴細胞分離液的離心管傾斜45°,在距液面約1 cm處,沿管壁緩慢滴入已用等體積RPMI-1640培養液稀釋混勻的抗凝血,稀釋血液將以2∶1比例懸浮于淋巴細胞分離液液面上,2 000 r/min室溫離心15 min。沿管壁吸盡位于第2層的PBMC,移至15 ml離心管中,用2倍體積的培養液稀釋混勻后,2 000 r/min離心10 min,可見單個核細胞沉于管底,棄上清,再加入2倍體積培養液稀釋混勻,2 000 r/min離心5 min,棄上清;加入培養液0.1 ml,混勻并計數PBMC。
1.2.2 ATRA誘導培養PBMC 全反式維甲酸R2625購于美國Sigma公司,將ATRA溶解于DMSO配成濃度為10 mmol/L的母液,保存于4℃冰箱中。用培養液調整為1×109/L的PBMC細胞懸液。取24孔培養板,設空白對照、低濃度組、中濃度組和高濃度組,各孔ATRA最終濃度為0 μmol/L、0.5 μmol/L、1 μmol/L、2 μmol/L,每組設4個復孔,取50 μl 10%植物血凝素和200 μl的PBMC懸液加入各孔,同時取ATRA制劑0 μl、50 μl、100 μl、200 μl,分別加入各組,用培養液調整各孔總容量為1 ml。細胞孵箱培養72 h后離心收集培養液上清,置于-80℃保存待測。收集細胞用于流式細胞儀檢測以及實時PCR。
1.2.3 培養上清液中IL-17、IL-10、TGF-β及IL-6含量檢測 IL-17、IL-10、TGF-β及IL-6的ELISA試劑盒為美國eBioscience公司產品,采用酶聯免疫吸附試驗(ELISA)法檢測上清中IL-17、IL-10和TGF-β及IL-6含量,以標準品濃度為橫坐標,以OD值為縱坐標,利用MPM軟件繪制標準曲線并獲取曲線方程,然后按曲線方程計算各樣本的濃度。
1.2.4 Treg細胞流式檢測 重懸、洗滌離心后按106個細胞加入CD4-FITC、CD25-APC流式抗體染色,4℃混勻、染色,洗滌細胞兩遍,離心棄上清;加入破膜液500 μl破膜與固定,4℃孵育30 min;然后加入終止液,離心,再用終止液重懸計數并洗滌一遍。重懸細胞沉淀并向其中按照106個細胞,加入FOXP3-PE流式抗體進行核內染色。4℃混勻1 h,然后用破膜終止液洗滌兩遍,終止液重懸細胞,過濾細胞,用流式細胞儀檢測CD25+FOXP3+T細胞在CD4+T細胞中所占比例。
1.2.5 Th17細胞流式檢測 細胞檢測前需向細胞培養液中加入細胞刺激混合液(加蛋白轉運抑制劑)進行刺激4.5 h-5 h,洗滌破膜同Treg細胞處理方式。破膜前只標記CD4-FITC流式抗體,破膜后加入IL-17A-PE和RoRγt-Alexa Fluor647進行胞內和核內標記;4℃混勻1 h,然后檢測RoRγt+IL-17A+T細胞在CD4+T細胞中所占比例。
1.2.6 實時PCR檢測mRNA表達水平 取上述培養細胞,分離總RNA,采用逆轉錄系統逆轉錄RNA,使用羅氏熒光定量儀檢測,應用軟件進行分析,結果以待測基因β-actin的比值表示。FOXP3引物為:5′-CACGCATGTTTGCCTTCTTCAGA-3′,5′- GTAGGGTTGGAACACCTGCTGGG-3′,RORγt引物為:F:5′-TCAGTCATGAGAACACAAATTGA-3′,R:5′-GCACCCCTCACAGGTGATAA-3′;β-actin 引物:5′- ATCTGGCACCACACCTTC -3′,5′ - AGCCAGGTCCAGACGCA -3′。逆轉錄和PCR試劑盒均購自TaKaRa公司。
1.3 統計分析
2 結果
2.1 一般資料
病例組10例川崎病患兒中男女比為7∶3,年齡范圍為2.24-5.87(4.37±1.01)歲;健康對照組10例,其中男女比為7∶3,年齡范圍為2.48-5.29(4.67±1.16)歲,兩組年齡、性別構成比無統計學差異。
2.2 ATRA對CD25+FOXP3+T/CD4+T百分比以及RORγt+IL-17A+T/CD4+T百分比的影響
流式細胞儀檢測結果顯示,未加ATRA作用下,病例組Th17(RORγt+IL-17A+T)細胞比例高于對照組,Treg(CD25+FOXP3+T)細胞比例低于對照組(P均<0.01)。病例組中,低、中和高濃度ATRA組PBMC培養Th17比例顯著低于空白對照組(P均<0.01),而中、高濃度組無顯著差異(P>0.05)。健康對照組中,不同濃度ATRA作用下,Th17細胞比例會下降,顯著低于空白對照組(P均<0.01)。健康對照組以及病例組中,低、中和高濃度ATRA組 PBMC培養Treg細胞,Treg細胞比例均有所上升(P均<0.01)。結果如表1所示。
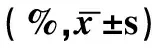
表1 ATRA干預后Th17、Treg細胞占外周血 CD4+T 細胞比例的比較
a:與空白對照組比,P<0.01;b:與低濃度組比,P<0.01;c:與中濃度組比,P<0.01。
2.3 ATRA對PBMC分泌IL-10、TGF-β、IL-17A和IL-6水平的影響
未加ATRA作用下,病例組PBMC分泌的IL-10、TGF-β低于對照組。經過低、中和高濃度ATRA作用后,病例組和健康對照組PBMC分泌的IL-10、TGF-β均顯著升高,IL-17A和IL-6水平高于對照組(P均<0.01)。結果如表2、3所示。
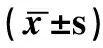
表2 ATRA干預后PBMC分泌IL-10和TGF-β水平
a:與空白對照組比,P<0.01;b:與低濃度組比,P<0.01;c:與中濃度組比,P<0.01。
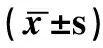
表3 ATRA干預后PBMC分泌IL-17A、IL-6水平
a:與空白對照組比,P<0.01;b:與低濃度組比,P<0.01;c:與中濃度組比,P<0.01。
2.4 ATRA對川崎病外周PBMC中FOXP3 mRNA、RORγt mRNA表達水平的影響
未加ATRA作用下,病例組RORγt mRNA表達水平高于對照組,FOXP3 mRNA低于對照組(P均<0.05)。病例組以及健康對照組中,低、中和高濃度ATRA組PBMC培養RORγt mRNA表達水平顯著低于空白對照組(P均<0.01),病例組中、高濃度組之間無顯著差異(P>0.05)。健康對照組中,中濃度組RORγt mRNA表達水平與低濃度組無統計學差異(P<0.05)。病例組不同濃度ATRA組之間,FOXP3 mRNA水平無統計學差異(P>0.05);而健康對照組中濃度組FOXP3 mRNA水平高于低濃度組以及高濃度組(P均<0.05)。如表4所示。
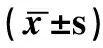
表4 外周PBMC中FOXP3、RORγt的mRNA表達水平
a:與空白對照組比,P<0.01;b:與低濃度組比,P<0.01;c:與中濃度組比,P<0.01。
3 討論
ATRA能通過細胞核上多種受體產生廣泛的生物學效應,如抑制外源性凝血、抑制細胞遷移、誘導細胞分化[10]。研究發現,ATRA參與天然T細胞轉化為Treg細胞的過程[11]。在維甲酸和TGF-β1共同培養體系中,T細胞表現出很強的免疫抑制功能,這可能與FOXP3表達的增加有關;而RA受體的抑制物能夠抑制FOXP3的表達,說明FOXP3的表達受到內源性維甲酸以及維甲酸受體的正調節[12]。研究表明[4],川崎病患兒Treg細胞表達水平和抑制功能明顯降低,而Th17細胞表達顯著升高。Th17細胞在自身免疫中發揮促炎作用,RORγt 是Th17分化的特異性轉錄因子,它能誘導編碼IL-17的基因轉錄,促使CD4+T分化為Th17細胞,并分泌IL-6、IL-17A等促炎因子[13]。本研究中,ATRA處理川崎病患兒外周有核細胞后,各組Treg表達和分泌細胞因子明顯增加,而Th17水平明顯下降;由于CD4+T細胞比例在對照組和處理組均無明顯變化,從而排除了CD4+T細胞比例改變對Treg和Th17細胞表達水平的影響。未加ATRA作用下,病例組Th17比例、RORγt的mRNA表達水平均高于對照組,而Treg細胞比例、FOXP3 mRNA表達水平低于對照組(P均<0.05)。給予不同濃度ATRA作用后,病例組以及對照組Th17比例均有所下降;低、中等和高濃度ATRA組 PBMC培養Treg細胞,Treg細胞比例均有所上升(P均<0.05)。本研究通過檢測ATRA對川崎病患兒Treg和Th17細胞數量和分泌細胞因子的影響,發現ATRA可上調Treg表達,同時降低Th17水平,有效改變川崎病Th17/Treg失衡狀態。但是,ATRA是否可通過作用于Treg和Th17細胞分化,影響Th17/Treg平衡,應用于川崎病的治療?尚需進一步動物實驗來觀察、驗證。
ATRA可改變Th17/Treg平衡失調,能夠恢復Th17/Treg平衡狀態,對川崎病的診治具有重要意義。因此,深入研究Th17/Treg失衡及其機制和ATRA對平衡的影響,為我們進一步研究川崎病的免疫學發病機制,及為開發治療川崎病藥物提供新的思路。
[1]《中華兒科雜志》編輯委員會,中華醫學會兒科學分會心血管學組,中華醫學會兒科學分會免疫學組.川崎病專題討論會紀要[J].中華兒科雜志,2007,45(11):826.
[2]Newburger JW,Takahashi M,Gerber MA,et al.Diagnosis,treatment,and long-term management of Kawasaki disease:A statement for health professionals from the committee on rheumatic fever,endocarditis,and Kawasaki disease,Council on Cardiovascular Disease in the Young,American Heart Association[J].Pediatrics,2004,114(6):1708.
[3]Zhu FH,Ang JY.The Clinical Diagnosis and Management of Kawasaki Disease:a Review and Update[J].Current Infectious Disease Reports,2016,18(10):32.
[4]Ichiyama K,Yoshida H,Wakabayashi Y,et al.Foxp3 inhibits ROR gamma t-mediated IL-17A mRNA transcription through direct interaction with ROR gamma t[J].Journal of Biological Chemistry,2008,283(25):17003.
[5]Kanamori M,Nakatsukasa H,Okada M,et al.Induced Regulatory T Cells:Their Development,Stability,and Applications[J].Trends in Immunology,2016,37(11):803.
[6]Liu ZM,Wang KP,Ma JL,et al.The role of all-trans retinoic acid in the biology of Foxp3(+) regulatory T cells[J].Cell Mol Immunol,2015,12(5):553.
[7]Golovina TN,Mikheeva T,Brusko TM,et al.Retinoic acid and rapamycin differentially affect and synergistically promote the ex vivo expansion of natural human T regulatory cells[J].PloS one,2011,6(1):e15868.
[8]Ogata S,Bando Y,Kimura S,et al.The strategy of immune globulin resistant Kawasaki disease:A comparative study of additional immune globulin and steroid pulse therapy[J].Journal of Cardiology,2009,53(1):15.
[9]Chen SJ,Dong Y,Kiuchi MG,et al.Coronary Artery Complication in Kawasaki Disease and the Importance of Early Intervention A Systematic Review and Meta-analysis[J].Jama Pediatrics,2016,170(12):1156.
[10]Das BC,Thapa P,Karki R,et al.Retinoic acid signaling pathways in development and diseases[J].Bioorganic & Medicinal Chemistry,2014,22(2):673.
[11]Bono MR,Tejon G,Flores-Santibanez F et al.Retinoic Acid as a Modulator of T Cell Immunity[J].Nutrients,2016,8(6):349.
[12]den Hartog G,van Altena C,Savelkoul HF,et al.The mucosal factors retinoic acid and TGF-beta1 induce phenotypically and functionally distinct dendritic cell types[J].International archives of allergy and immunology,2013,162(3):225.
[13]Fasching P,Stradner M,Graninger W,et al.Therapeutic Potential of Targeting the Th17/Treg Axis in Autoimmune Disorders[J].Molecules,2017,22(1):134.
The effect of all-trans-retinoic acid on the balance of Th17/Treg in the peripheral blood of patients with Kawasaki disease
LIPing,NIWei-hua,PANWei,etal.
(DepartmentofPediatrics,SecondHospitalofJilinUniversity,Changchun130041,China)
Objective To examine the effect of all-trans-retinoic acid(ATRA) on the balance of Th17/Treg in the peripheral blood of patients with Kawasaki disease.Methods Peripheral venous blood samples were obtained from 10 children with Kawasaki disease and 10 healthy children as control.The peripheral blood mononuclear cells (PBMC) were isolated aseptically,and the cells were cultured with different concentrations of ATRA for 72 hours.Plasma levels of Th17- and Treg-related cytokines including IL-17A,IL-10,IL-6,TGF-β in cell supernatant and mRNA expression levels of RORγt and FOXP3 were tested using ELISA and real time PCR,respectively.Flow cytometry was used to detect the percentage of Th17/Treg in CD4+ T cells.Results Without effect of ATRA,PBMC from patients with Kawasaki disease had higher levels of Th17 percentage,IL-17A,IL-10 and RORγt mRNA (P<0.01) when compared to the control group.ATRA resulted in a reduction in Th17 percentage,IL-17A,IL-10 and RORγt mRNA (P<0.01) and an increase of Treg percentage,IL-6,TGF-β and FOXP3 mRNA in PBMC from patients with Kawasaki disease and control group(P<0.01).Conclusion ATRA could promote Treg differentiation of peripheral blood in children with Kawasaki disease in vitro,and inhibit Th17 differentiation.The Th17/Treg imbalance in peripheral blood of children with Kawasaki disease was changed by ATRA in vitro.Our findings provide further evidence for the immune pathogenesis and therapy of Kawasaki disease.
Kawasaki disease;retinoic acid;T-helper 17 cells;regulatory T cells;cytokines
吉林省科技廳青年基金資助課題(20140520022JH)
*通訊作者
1007-4287(2017)05-0781-05
R725.4
A
2016-10-27)

