辣椒疫病罹病植株根際土壤細菌群落多樣性分析
周濤 羅路云 陳紅松 張卓 羅源華
摘要:【目的】分析辣椒疫病罹病植株根際土壤細菌群落多樣性,為辣椒疫病防控提供理論依據。【方法】采集湖南長沙、吉首及永州地區辣椒疫病罹病植株根際土壤,運用IlluminaMiSeq高通量測序技術對土壤樣品基因組DNA的16S rDNA-V4區進行測序分析,明確不同地區罹病辣椒植株根際土壤細菌群落多樣性。【結果】3個地區罹病辣椒根際土壤的細菌OTU數量存在差異,獨有OTU占總體比例各有差異,其中永州地區占其總數的30.18%、吉首地區占其總數的41.83%、長沙地區占其總數的24.07%,3個地區共有OTU占所有檢測到OTU的14.95%。α多樣性指標均表現為長沙地區最低,吉首地區最高。在門水平上,3個地區的罹病辣椒根際土壤微生物組成相似,優勢菌門為Acidobacteria(酸桿菌門)、Proteobacteria(變形菌門)、Actinobacteria(放線菌門)和Chloroflexi(綠彎菌門),但3個地區在相對豐度上表現一定差異。【結論】湖南永州、吉首和長沙地區辣椒疫病罹病植株根際土壤細菌多樣性存在差異,以吉首最高、長沙最低;3個地區的罹病辣椒根際土壤微生物組成相似,但相對豐度存在差異。
關鍵詞: 辣椒疫病;根際土壤;微生物群落;多樣性
中圖分類號: S436.3 文獻標志碼:A 文章編號:2095-1191(2017)06-1014-05
Comparison on bacterial community diversity in rhizosphere soil of peppers with phytophthora blight
Abstract:【Objective】In the present study, bacterial community diversity in rhizosphere soil of peppers with phytophthora blight was studied to provide reference for control of pepper phytophthora blight. 【Method】Rhizosphere soil of peppers dying from phytophthora blight was collected from Changsha, Jishou and Yongzhou in Hunan. 16S rDNA-V4 regions of sample genome DNA were sequenced by IlluminaMiSeq high-throughput sequencing to analyze bacterial community diversity in rhizosphere soil of peppers with phytophthora blight in different areas. 【Result】Bacteria OTU number and proportions of unique OTU of rhizosphere soil of peppers with phytophthora blight of three areas were different. The proportion of Yongzhou accounted for 30.18% of the total, and that of Jishou accounted for 41.83% of the total and that of Changsha accounted for 24.07% of the total. Shared OTU of the three areas accounted for 14.95% of all detected OTU. Alpha diversity index were the lowest in Changsha and the highest in Jishou. At phylum level, the microbial composition was similar in rhizosphere soil of peppers with phytophthora blight of three areas, the dominant bacteria were Acidobacteria, Proteobacteria, Actinobacteria and Chloroflexi, but relative abundance showed some differences. 【Conclusion】There is difference in bac-
terial community diversity in rhizosphere soil of peppers dying from phytophthora blight in Yongzhou, Jishou and Changsha, the diversity of Jishou is the highest while that of Changsha is the lowest. The microbial composition is similar in rhizosphere soil of peppers with phytophthora blight of the three areas, but the relative abundance is different.
Key words: pepper phytophthora blight; rhizosphere soil; microorganism community; diversity
0 引言
【研究意義】辣椒(Capsicum annuum L.)是一種重要的經濟作物,在我國常年種植面積超過130萬ha。辣椒疫病(Pepper phytophthora blight)是由辣椒疫霉菌引起的一種真菌病害,可造成辣椒嚴重減產甚至絕收。辣椒疫霉菌侵染辣椒后可引起其器官腐爛或整株死亡(Sanogo and Ji,2013;Cao et al.,2014;Wang et al.,2014);辣椒疫霉菌還可危害番茄、黃瓜、南瓜、茄子等多種茄科和葫蘆科作物,嚴重制約作物生產(Polo-López et al.,2013;伍善東等,2015)。近年來,隨著辣椒產業及辣椒種植區域的不斷擴大,辣椒疫病危害面積也逐年擴大,造成嚴重的經濟損失。土壤生態是農業生態系統的基礎,與農業生態系統的可持續發展直接相關(Maul et al.,2014)。因此,研究辣椒疫病罹病植株根際土壤微生物的組成和多樣性有助于進一步了解辣椒疫病的發生機制,對辣椒疫病的防治具有重要意義。【前人研究進展】土壤微生物、理化性質和酶是土壤生態系統的重要組分,是調節土壤微生態環境及功能的關鍵因子。土壤微生物能將土壤中的有機物和一些難分解的物質轉化為植物生長所需的營養成分(Yin et al.,2014)。每克土壤中一般含有104~106個真菌個體、106~1010個細菌個體和10~103個原生生物,而植物根際土壤微生物的數量較一般土壤多。植物根際土壤微生物是土壤生態系統中最活躍的部分,參與土壤中各種生物學和生物化學過程,對植物的生長發育和環境適應性產生重要影響。大量的土壤微生物聚集在植物根系周圍,與植物根系相互作用,形成微生態環境(Nadeem et al.,2014)。涂璇等(2007)對接種生防放線菌后土壤和辣椒根系微生物區系的變化進行研究,發現拮抗放線菌可通過影響辣椒根際微生物來控制辣椒疫霉的生長繁殖。Nadeem等(2014)研究表明,在辣椒植株根際接種外來菌,可以調節植株根區的微生物群落結構,有利于保持和促進土壤肥力和健康狀況,改變土壤理化性質和土壤酶活性,有可能從根本上控制辣椒疫病。Wang等(2014)發現蕓苔屬植物殘體作為土壤熏蒸材料與有拮抗作用的解淀粉芽孢桿菌結合,可通過影響辣椒根際土壤中微生物群落多樣性而達到防治辣椒疫病的目的。王秋君等(2015)進行了銅綠假單胞菌結合生物熏蒸防控辣椒疫病的效果研究,結果表明,生物熏蒸結合施用銅綠假單胞菌是一種環保的防控辣椒疫病方法。羅路云等(2017)研究表明,施用沼澤紅假單胞菌PSB06可改善土壤微生物結構,提高土壤微生物群落豐富性及土壤中放線菌所占的豐度,達到防治辣椒疫病的目的。【本研究切入點】目前,微生物多樣性的分析手段主要是基于傳統的可培養方法,但該方法僅針對群落中的可培養微生物。運用高通量測序技術可準確、全面地對樣品中細菌群落進行鑒定,但相關研究鮮見報道。【擬解決的關鍵問題】采集湖南長沙、吉首和永州地區辣椒疫病罹病植株根際土壤樣品,運用IlluminaMiSeq高通量測序技術分析根際土壤中細菌群落多樣性,以期為辣椒疫病防治提供理論依據。
1 材料與方法
1. 1 樣品采集
土壤樣品分別采集于湖南長沙(CS)、吉首(JS)和永州(YZ)3個地區,每個地區隨機選取5個辣椒疫病嚴重發生田塊,使用五點取樣法采集土樣,采集后將土樣混勻,分別裝入采樣袋,低溫保藏,運輸至實驗室后置于-80 ℃保存。3個采樣地均為常年種植同種辣椒品種,施肥條件一致,自然條件及土壤性質相似。
1. 2 DNA測序、擴增及測序
土壤DNA的提取采用FastDNA SPIN Kit for soil試劑盒(MP Biomedicals,美國),具體步驟參照試劑盒使用說明。取5.0 μL基因組DNA使用1%瓊脂糖凝膠電泳進行檢測,濃度和純度采用NanoDrop2000(Thermo Scientific,美國)測定,A260/A280在1.8~2.0,-20 ℃冰箱保存。以土壤DNA為模板,采用細菌16S rRNA基因V4區的引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)進行PCR擴增。PCR反應體系50.0 μL:5.0 μL 10×PCR Buffer(含20 mmol/L MgCl2),1.5 μL dNTP(10 mmol/L),1 U Taq DNA聚合酶,1.0 μL DNA模板,ddH2O補至50.0 μL。擴增程序:94 ℃預變性1 min;94 ℃ 20 s,57 ℃ 25 s,68 ℃ 45 s,進行35個循環;最后68 ℃延伸10 min,4 ℃保存。PCR擴增完成后產物用1%瓊脂糖凝膠進行電泳檢測。PCR回收產物送諾禾致源生物信息科技有限公司進行IlluminaMiSeq高通量測序。
1. 3 數據處理
先使用Barcode(標簽序列)將不同樣品原始數據區分開,去除引物,刪除低質量序列,然后使用FLASH程序(version 1.0.0)進行拼接,采用UCHIME(version USEARCH 5.2.32)去除嵌合序列。計算DNA矩陣,使用UPARSE程序在97%的序列相似度水平下對序列劃分操作分類單元(OTU)。RDP-Classifer分析設置置信度參數50%。對處理數據進行均一化處理,計算不同分類水平上的OTU數量和Chao1,繪制稀釋曲線。通過Chao1、香農指數(Shannon)和辛普森指數(Simpson)多樣性評估序列文庫的α多樣性。以上分析均在Galaxy網站平臺上(http://zhoulab5.rccc.ou.edu:8080/root)及R語言vegan程序包完成。
2 結果與分析
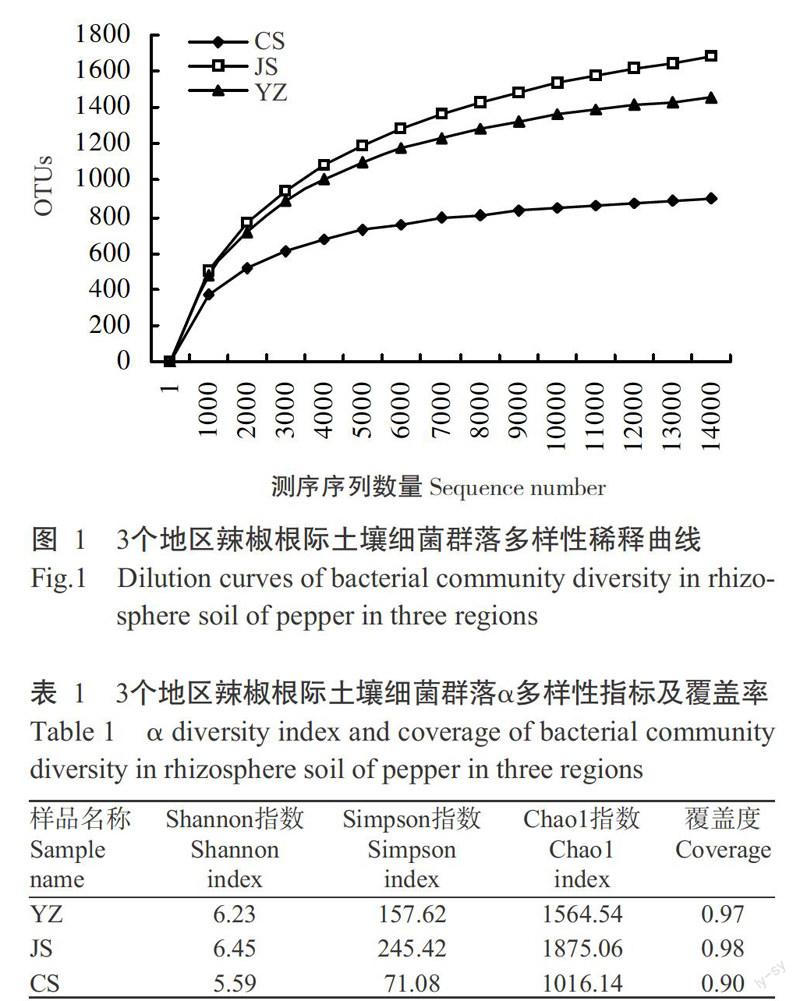
2. 1 3個地區辣椒根際土壤微生物群落OTU差異及多樣性比較
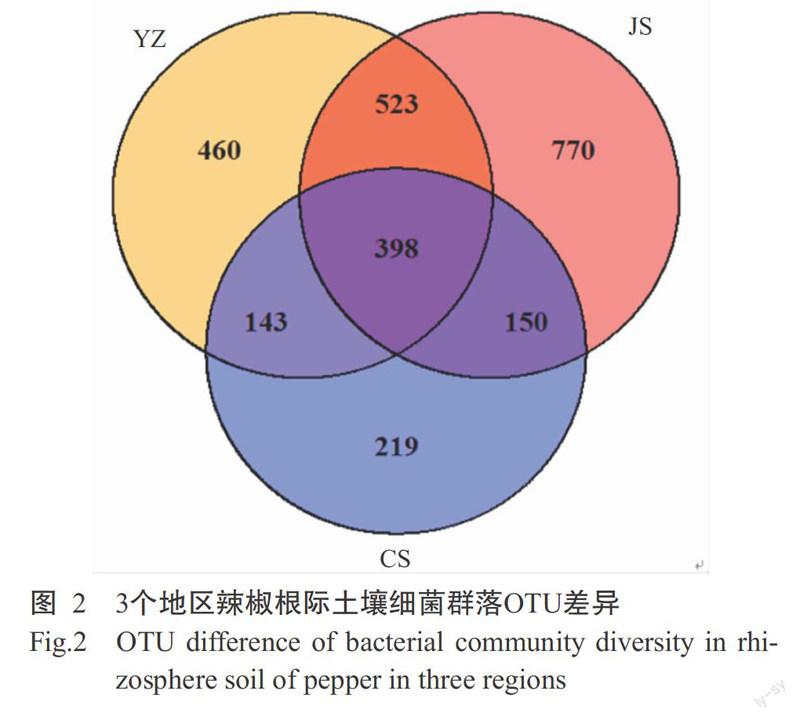
由圖1可看出,3個地區土壤樣品間細菌群落多樣性存在差異,各樣品的稀釋曲線趨于平緩,即認為測序深度已基本覆蓋樣品中所有的物種,測序數據量足以反映樣品中的物種多樣性,且測序達飽和時表現為α多樣性JS>YZ>CS。對長沙、吉首和永州3個地區辣椒根際土壤樣品細菌群落的α多樣性指標進行評估,其中Shanon指數變化范圍為5.59~6.45,Simpson指數變化范圍為71.08~245.42,Chao1變化范圍為1016.14~ 1875.06(表1),3組數據均表現為長沙地區最低,吉首地區最高。原始數據經質控后按97%的序列相似性可劃分為2662個OTUs,其中永州地區檢測到1524個OTUs、吉首地區檢測到1841個OTUs、長沙地區檢測到910個OTUs;3個地區獨有OTU所占比例各有差異,其中永州地區占其總數的30.18%、吉首地區占其總數的41.83%、長沙地區占其總數的24.07%,3個地區重合OTU占所有檢測到OTU的14.95%,說明土壤樣品雖然均來源于辣椒疫病死亡植株根際,但3個地區在OTU水平上存在明顯差異(圖2)。
2. 2 細菌群落結構比較
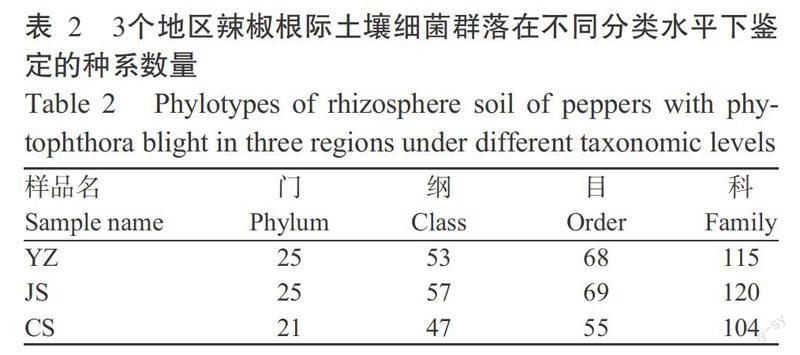
測得的細菌群落所有序列可被注釋到27個門、60個綱、75個目和147個科(表2)。從圖3可看出,在門的水平下,永州地區占優勢地位的門有Acidobacteria(酸桿菌門)、Proteobacteria(變形菌門)、Actinobacteria(放線菌門)和Chloroflexi(綠彎菌門);吉首地區占優勢地位的門有Acidobacteria、Proteobacteria、Actinobacteria、Chloroflexi和Planctomycetes(浮霉菌門);長沙地區占優勢地位的門有Proteobacteria、Actinobacteria、Chloroflexi、Firmicutes(厚壁菌門)和Thaumarchaeota(奇古菌門)。永州、吉首和長沙地區在門水平上微生物組成相似,但在相對豐度上表現出一定的差異,其中Actinobacteria的相對豐度分別為9.71%、25.07%和13.28%,Proteobacteria為30.38%、17.47%和17.31%,Chloroflexi為5.62%、9.12%和12.67%,Acidobacteria為22.18%、13.82%和2.96%。這4種優勢菌門在3個地區的相對豐度總和分別為67.89%、65.48%和46.22%。在不同分類水平下相對豐度分析結果表明,Proteobacteria是最優勢門,Gammaproteobacteria(γ-變形菌綱)為最優勢綱,Actinomycetales(放線菌目)為優勢目。
3 討論
前人主要通過分離培養對土壤微生物多樣性進行研究,隨著分子生物學技術的不斷發展,發現傳統的方法已不能全面鑒定土壤樣品中的微生物,只能鑒定其中可培養部分。馬云艷等(2015)對辣椒疫病病株和健株根際土壤中的可培養微生物進行鑒定并對其群落多樣性進行檢測,但由于技術的局限性未能對其中不可培養微生物進行多樣性分析。植物根際與其他生境一樣,根際微生物不僅具有豐富的多樣性,還含有大量未培養的微生物種群(Prosser,2002),因此有必要采用非培養手段對根際微生物進行研究。本研究運用高通量測序技術分析辣椒疫病罹病植株根際土壤細菌群落多樣性,有助于全面了解湖南長沙、吉首和永州地區辣椒疫病根際土壤中細菌多樣性情況,為采用微生態調控技術防治辣椒疫病提供理論基礎。
根據Fierer和Jackson(2006)的研究結果可知,Acidobacteria、Actinobacteria、Proteobacteria和Bacter-
oidetes在所有的生物群中均占優勢地位,且在細菌群落組成上差異不顯著。近年來,越來越多的研究表明在各種不同土壤生態系統中細菌群落的優勢門組成具有相似性(Fierer et al.,2011;Wang et al.,2011;Shen et al.,2013)。本研究中,在門水平上Acidobacteria、Actinobacteria和Proteobacteria在3個地區均占優勢地位,與前人的研究結果一致,但在相對豐度上3個地區的優勢門存在一定差異。
通常來說,健康植株根際土壤上比發病植株根際土壤擁有更多獨有的OTU,同時病株根際土壤細菌群落中更低的多樣性表明發病程度越高(Rosenzweig et al.,2012)。本研究比較了湖南永州、吉首和長沙3個地區辣椒疫病罹病植株根際土壤樣品的OTU差異,結果顯示3個地區獨有的OTU所占總體比例存在差異,其中永州地區占其總數的30.18%、吉首地區占其總數的41.83%、長沙地區占其總數的24.07%,表現為吉首>永州>長沙;同時,3個地區稀釋曲線及α多樣性結果也表現為吉首>永州>長沙,與OTU的結果一致。
4 結論
湖南永州、吉首和長沙3個地區辣椒疫病罹病植株根際土壤細菌群落多樣性分析結果表明,3個地區的辣椒疫病致死發病程度不同,吉首地區的辣椒疫病發病程度最重,長沙地區較低;3個地區的辣椒疫病罹病植株根際土壤微生物組成相似,優勢菌門均為Acidobacteria、Proteobacteria、Actinobacteria和Chloroflexi,但在相對豐度上存在一定差異。
參考文獻:
羅路云, 金德才, 左暉, 張卓, 譚新球, 張德詠, 盧向陽, 劉勇. 2017. 沼澤紅假單胞菌PSB06對辣椒根際微生物群落結構的影響[J]. 環境科學,38(2):735-742. [Luo L Y, Jin D C, Zuo H, Zhang Z, Tan X Q, Zhang D Y, Lu X Y, Liu Y. 2017. Effects of Rhodopseudomonas palustris PSB06 on pepper rhizosphere microbial community structure[J]. Environmental Science, 38(2):735-742.]
馬云艷, 王東勝, 李玉龍, 薛泉宏, 林雁冰. 2015. 辣椒疫病病株與健株根區土壤微生態研究[J]. 西北農業學報, 24(4):129-137. [Ma Y Y, Wang D S, Li Y L, Xue Q H, Lin Y B. 2015. Micro-ecology in the rhizosphere soil of the phytophthora blight infected plants and healthy plants[J]. Acta Agriculturae Boreali-occidentalis Sinica, 24(4):129- 137.]
涂璇, 薛泉宏, 張寧燕, 牛曉磊. 2007. 辣椒疫病生防放線菌篩選及其對辣椒根系微生物區系的影響[J]. 西北農林科技大學學報(自然科學版), 35(6):141-146. [Tu X, Xue Q H, Zhang N Y, Niu X L. 2007. Screening bio-control actinomycetes to control pepper phytophthora blight and the impact of microbial population of peppers rhizosphere[J]. Journal of Northwest A & F University(Natural Science Edition) , 35(6):141-146.]
王秋君,常志州,王光飛,馬艷. 2015. 銅綠假單胞菌結合生物熏蒸防控辣椒疫病的效果[J]. 江蘇農業學報,31(2):290-297. [Wang Q J,Chang Z Z,Wang G F,Ma Y. 2015. Integration of Pseudomonas aeruginosa with biofumigation to control phytophthorablight of pepper[J]. Jiangsu Journal of Agricultural Sciences,31(2):290-297.]
伍善東,劉冬華,郭照輝,單世平,程偉. 2015. 抑制黃瓜疫病生防菌株LY-38的發酵條件優化[J]. 貴州農業科學,43(2):53-56. [Wu S D,Liu D H,Guo Z H,Shan S P,Cheng W. 2015. Fermentation conditions optimization for LY-38,abiocontrol strain inhibiting cucumber blight[J]. Guizhou Agricultural Sciences,43(2):53-56.]
Cao Y, Chang Z Z, Wang J D, Ma Y, Yang H, Fu G Q. 2014. Potential use of anaerobically digested manure slurry to suppress Phytophthora root rot of chilli pepper[J]. Scientia Horticulturae, 168(3):124-131.
Fierer N, Jackson R B. 2006. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 103(3):626-631.
Fierer N, Mccain C M, Meir P, Zimmermann M, Rapp J M, Silman M R, Knight R. 2011. Microbes do not follow the elevational diversity patterns of plants and animals[J]. Ecology, 92(4):797-804.
Maul J E, Buyer J S, Lehman R M, Culman S, Blackwood C B, Rberts D P, Zasada I A, Teasdale J R. 2014. Microbial community structure and abundance in the rhizosphere and bulk soil of a tomato cropping system that includes cover crops[J]. Applied Soil Ecology, 77(5):42-50.
Nadeem S M, Ahmad M, Zahir Z A, Javaid A, Ashraf M. 2014. The role of mycorrhizae and plant growth promoting rhizobacteria(PGPR) in improving crop productivity under stressful environments[J]. Biotechnology Advances, 32(2):429-448.
Polo-López M I, Oller I, Fernández-Ibá?觡ez P. 2013. Benefits of photo-Fenton at low concentrations for solar disinfection of distilled water. A case study:Phytophthora capsici[J]. Catalysis Today, 209(209):181-187.
Prosser J I. 2002. Molecular and functional diversity in soil micro-organisms[J]. Plant and Soil, 244(1): 9-17.
Rosenzweig N, Tiedje J M, Iii J F Q, Hao J J. 2012. Microbial communities associated with potato common scab- suppressive soil determined by pyrosequencing analyses[J]. Plant Disease, 96(5):718-725.
Sanogo S, Ji P. 2013. Water management in relation to control of Phytophthora capsici, in vegetable crops[J]. Agricultural Water Management, 129:113-119.
Shen C C, Xiong J B, Zhang H Y, Chu H Y. 2013. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain[J]. Soil Biology & Biochemistry, 57:204-211.
Wang J J, Soininen J, Zhang Y, Wang B X, Yang X D, Shen J. 2011. Contrasting patterns in elevational diversity between microorganisms and macroorganisms[J]. Journal of Biogeography, 38(3):595-603.
Wang Q J, Ma Y, Wang G F, Gu Z G, Sun D, An X, Chang Z Z. 2014. Integration of biofumigation with antagonistic microorganism can control Phytophthora blight of pepper plants by regulating soil bacterial community structure[J]. European Journal of Soil Biology, 61(5):58-67.
Yin R, Deng H, Wang H L, Zhang B. 2014. Vegetation type affects soil enzyme activities and microbial functional diversity following re-vegetation of a severely eroded red soil in sub-tropical China[J]. Catena, 115(3):96-103.
(責任編輯 麻小燕)

