野生大麻居群遺傳多樣性ISSR分析的取樣策略
張慶瀅 郭蓉 陳璇 許艷萍 郭孟璧 郭鴻彥 楊明
摘要:【目的】分析野生大麻居群的合理取樣樣本量,為全面了解我國大麻資源的遺傳多樣性及制定野生大麻保護策略提供參考依據。【方法】隨機抽取96個遼寧科爾沁沙地野生大麻自然居群個體,采用計算機模擬方法從中隨機抽取不同樣本量(分別為5、10、15、20、25、30、35、40、50、60、70、80、90和96個個體)的抽樣群體各20次,利用ISSR分子標記對其遺傳多樣性進行分析,確定合理的取樣樣本量。【結果】利用從60條ISSR引物中篩選出的9條引物對隨機抽取的96個野生大麻個體進行PCR擴增,共獲得76個位點,其中多態位點48個,多態率達63.16%,觀測等位基因數(Na)為1.632,有效等位基因數(Ne)為1.250,Neis基因多樣性指數(H)為0.156,Shannons信息指數(I)為0.245。由各遺傳參數擬合曲線變化趨勢分析結果可知,初始的4種抽樣群體(分別為5、10、15和20個個體)遺傳多樣性水平呈急速增加趨勢,之后隨著樣本量的加大,遺傳多樣性水平增加趨勢明顯變緩。當抽樣群體樣本量超過25個個體時,Na、Ne、H和I均包含了野生大麻居群90%以上的遺傳變異。【結論】采用ISSR分子標記評估野生大麻群體遺傳多樣性時,群體取樣樣本量不宜小于25個個體才能較好地反映該居群總體的遺傳多樣性水平。
關鍵詞: 野生大麻;ISSR;遺傳多樣性;取樣策略
中圖分類號: S563.3 文獻標志碼:A 文章編號:2095-1191(2017)06-0973-06
Sampling strategy for genetic diversity ISSR analysis of wild
Cannabis sativa L. population
Abstract:【Objective】Reasonable sampling size for wild Cannabis sativa L. was analyzed and determined to provide reference for comprehensive understanding of genetic diversity of domestic C. sativa L. resources and formulating protection strategies for it. 【Method】Ninety-six representative individuals of wild C. sativa L. population from Horqin sandy land were randomly selected. Using computer simulation method, each sampling group with different individuals(5,10, 15,20,25,30,35,40,50,60,70,80,90,96) were randomly sampled 20 times. ISSR molecular marker method was carried out to estimate the genetic diversity and determine the proper sampling size. 【Result】PCR amplification was conducted on 96 sampled C. sativa L. individuals by 9 primers screened out of 60 ISSR primers. The results showed that 76 loci with 48 polymorphic loci were identified, and polymorphic rate was 63.16%. Observed average alleles(Na) number was 1.632, effective alleles(Ne) number was 1.250, Neis gene diversity index(H) was 0.156,and Shannons information index(I) was 0.245. Fitted curves of different genetic parameters indicated that the genetic diversity increased sharply for the first four sampling groups(5,10,15 and 20 individuals respectively). As sampling size enlarged, the increasing trend of genetic diversity was slowed. When the sampling size was over 25 individuals, Na,Ne,H and I contained over 90% of genetic diversity of wild C. sativa L population. 【Conclusion】The sampling size should be no less than 25 individuals when using ISSR molecular marker to evaluate genetic diversity of C. sativa L.,as it can reflect the genetic diversity of the population.
Key words: wild Cannabis sativa L.; ISSR; genetic diversity; sampling strategy
0 引言
【研究意義】大麻(Cannabis sativa L.)是世界上最古老、分布最廣泛的栽培作物之一,為一年生草本植物,通常為雌雄異株。大麻在我國種植歷史悠久,是我國傳統的經濟作物,也因其含有具致幻成癮作用的四氫大麻酚(THC)而被聯合國禁毒公約列為毒品源植物之一。近年來,由于工業大麻在造紙、紡織、食用及藥用等方面具有突出優勢,在高附加值原料產品大麻二酚(CBD)的開發利用和生態保護方面也具有多種優勢(如抗病蟲草害性能強、對重金屬的高吸附作用、可用作環保新材料和農業碳匯等)(張慶瀅等,2011;Amaducci et al.,2015),在國內外已成為倍受關注的熱點經濟作物。野生大麻資源作為大麻研究與利用的天然基因庫和寶貴資源,保存著栽培大麻不具備或已消失的遺傳基因,是培育低THC含量、優質、高產、抗病(蟲)及抗逆大麻新品種的重要物質基礎。我國是大麻的重要起源地之一(Gilmore et al.,2007),擁有豐富的大麻資源,但由于人口壓力、生境惡化及禁毒鏟除等因素影響,野生大麻面臨資源嚴重散失的窘境。因此,全面了解我國大麻資源的遺傳多樣性,對制定野生大麻保護策略具有重要意義。【前人研究進展】近年來,RAPD、ISSR、AFLP、SRAP和SSR等分子標記技術在種質資源遺傳多樣性、遺傳圖譜構建、群體遺傳分析等方面已得到廣泛應用(倪先林等,2015;肖政等,2015;周娜等,2015)。Hakki等(2007)、Kayis等(2010)在利用RAPD、ISSR分子標記對毒品大麻和工業大麻進行鑒別、毒品來源地追溯等方面均獲得了理想效果。湯志成等(2013)利用RAPD分子標記對我國12份野生大麻資源進行了遺傳多樣性評價,但未涉及對群體內部遺傳變異和結構等內容。Gao等(2014)利用SSR分子標記成功將115份大麻栽培品種分成四大類群。宗成堃等(2015)研究認為,聯合利用SSR、SRAP和ISSR 3種分子標記技術可有效地構建高密度、高飽和性丹參分子遺傳圖譜。張影波等(2016)研究認為,SRAP和AFLP標記技術均可用于艾納香遺傳多樣性分析。【本研究切入點】進行群體遺傳多樣性分析時需首先解決代表某一群體總體遺傳多樣性水平的樣本采集問題,但目前針對野生大麻自然居群或大麻群體研究樣本量選擇的研究未見報道。【擬解決的關鍵問題】采用ISSR分子標記方法分析遼寧科爾沁沙地野生大麻自然居群的遺傳多樣性,通過隨機抽取不同樣本量和進行計算機模擬,確定可代表居群總體遺傳多樣性水平的樣本量,為開展野生大麻群體遺傳和保護利用研究提供參考依據。
1 材料與方法
1. 1 試驗材料
以遼寧科爾沁沙地的野生大麻自然居群為研究對象,在居群約4 km2范圍內隨機選取96個野生大麻單株,采集樣本時選取干凈、無病蟲害的正常葉片,及時用硅膠進行干燥,進行總DNA提取并保存于-80 ℃冰箱中備用。取樣時取樣植株樣本間的最小直線距離不低于10 m,96個樣本盡量覆蓋4 km2的取樣范圍。
1. 2 試驗方法
1. 2. 1 DNA提取 試驗采用CTAB法(Doyle,1991)提取大麻基因組DNA。由于大麻葉片含有大量酚類物質,為獲得較高純度的基因組DNA,對該方法進行改良,增加Buffer洗滌(200 mmol/L Tris-Cl,250 mmol/L NaCl,50 mmol/L EDTA)步驟以去除酚類等雜質(陳璇等,2015)。對96 份單株材料進行總DNA提取,經0.8%瓊脂糖凝膠電泳及分光光度計檢測后保存備用。
1. 2. 2 引物篩選及PCR反應條件 以試驗居群的8個野生大麻植株單株基因組DNA為模板,對60條ISSR引物進行篩選,其中18條來自Hakki等(2007)的研究,4條來自Kojoma等(2002)的研究,38條隨機選自英國哥倫比亞大學ISSR引物試劑盒。同時對擴增體系進行優化,對各引物進行退火溫度梯度(47、50、53、56、58和60 ℃)PCR擴增試驗,以確定每條引物的相應退火溫度。優化后的PCR反應體系25.0 μL,包含1.5 μL引物(母液濃度10 μmol/L),2.0 μL dNTP(母液濃度10 mmol/L),2.0 μL DNA模板(25~30 ng/μL),0.3 μL Taq DNA聚合酶(5 U/μL),2.5 μL 10×Buffer(10 mmol/L Tris-HCl,pH 8.3,50 mmol/L KCl),以ddH2O補足至25.0 μL。擴增程序:94 ℃預變性4 min;95 ℃ 45 s,47~60 ℃退火(根據不同引物有所不同)50 s,72 ℃ 90 s,進行38個循環;72 ℃延伸10 min。PCR產物在0.5倍TBE緩沖液中用1.8%瓊脂糖凝膠電泳,電壓4 V/cm。每條引物2次重復擴增。
1. 3 數據處理
以Trans2K PlusⅡ DNA Marker(100~8000 bp)為相對分子量標準,按照擴增DNA片段的有(1)或無(0)構建ISSR數據矩陣。采用計算機隨機抽樣,從科爾沁沙地野生大麻居群96個單株總體樣本中形成由5、10、15、20、25、30、35、40、50、60、70、80、90和96個個體組成的14個抽樣群體,每個抽樣群體各20次重復,將獲得的[0,1]數據矩陣在POPGENE 1.32中進行分析,計算用于評價居群遺傳多樣性的相關指標,包括觀測等位基因數(Na)、有效等位基因數(Ne)、Neis基因多樣性指數(H)、Shannons信息指數(I)和多態位點百分率(P)。
計算不同抽樣群體20次重復的遺傳多樣性參數平均值,并將各平均值轉換為占總體遺傳多樣性參數值的百分比,用SPSS 17.0中的S曲線模型對抽樣群體的遺傳多樣性水平隨樣本量增加而增加的趨勢進行擬合分析,擬合公式為lnY=b0+(b1/t),其中b0和b1為擬合參數,t為樣本量,Y為各抽樣群體的遺傳參數百分比。
將5種遺傳參數值占居群總體遺傳多樣性的百分比與樣本量的5條擬合曲線用SPSS 17.0進行協方差分析(ANCOVA),檢驗截距和斜率的差異,分析Na、Ne、H、I和P 的擬合曲線差異顯著性。
2 結果與分析
2. 1 引物篩選結果
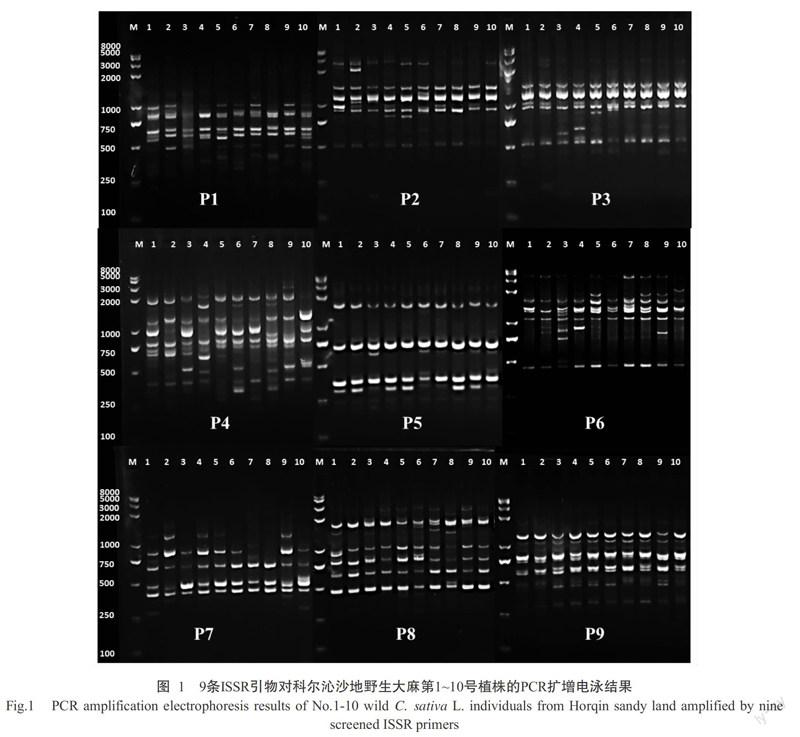
根據PCR擴增結果,基于擴增條帶數目適中(6~20條條帶)、清晰度高及重復性好等原則,最終優選出9條適合野生大麻群體遺傳多樣性分析的ISSR引物,并確定其最佳退火溫度(表1)。其中,1~6號引物來自Hakki等(2007)的研究,7~9號引物篩選自英國哥倫比亞大學ISSR引物試劑盒。圖1為9條ISSR引物對科爾沁野生大麻居群第1~10號植株個體樣本的擴增結果。
2. 2 群體遺傳多樣性分析結果
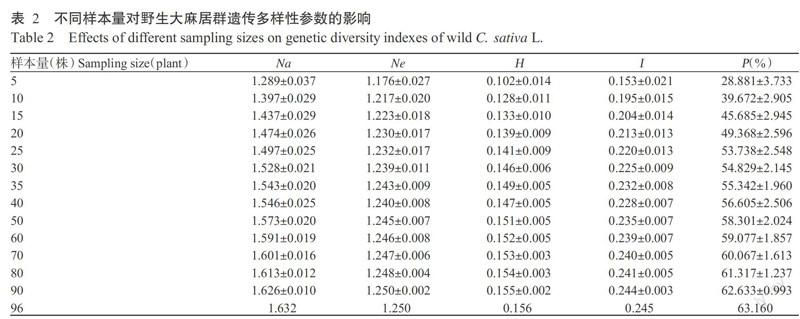
使用篩選出的9條ISSR引物對科爾沁沙地野生大麻居群96個個體進行擴增,在DNA片段長度250~ 2500 bp間共檢測出76個清晰、可重復的有效位點,其中48個位點為多態位點,占63.16%。由表2可知,14個抽樣群體遺傳參數的變化范圍:Na為1.289~1.632,Ne為1.176~1.250,H為0.102~0.156,I為0.153~0.245,P為28.881%~63.160%。依據對96個個體的計算機抽樣及計算結果(表2),各抽樣群體的遺傳多樣性參數隨著樣本量的增加而增加,而標準差隨著樣本量的增加而減少。
2. 3 抽樣樣本量與遺傳多樣性參數的關系
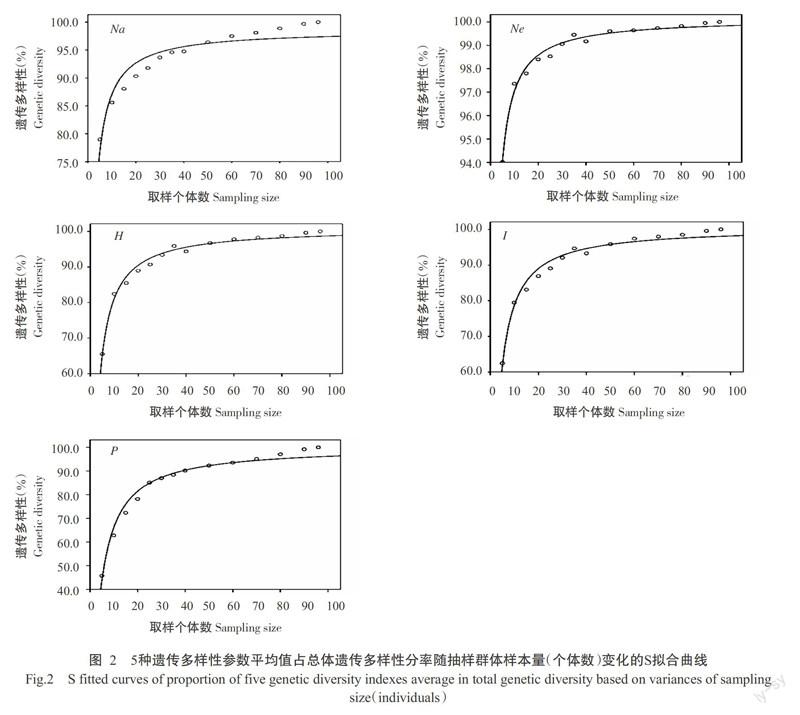
對14個抽樣群體樣本量與其遺傳多樣性參數(Na、Ne、H、I和P)占總體遺傳多樣性參數的百分比進行S曲線擬合分析,結果顯示,其R2分別為0.911、0.986、0.988、0.984和0.980,擬合度較好。當抽樣群體樣本量為20個個體時,Na達90.3%;當抽樣群體樣本量為25個個體時,Na達91.7%,Ne達98.6%,P達85.0%,H和I分別達90.4%和89.8%。從各遺傳參數擬合曲線(圖2)可看出,初始的4種抽樣群體(5、10、15和20個個體)遺傳多樣性水平呈急速增加趨勢,之后隨著樣本量的加大,遺傳多樣性水平的增加趨勢明顯變緩。當樣本量達25個個體時,Na、Ne、H和I均超過總體樣本遺傳多樣性的90.0%,P也達到總體樣本遺傳多樣性的85.0%。
對5條擬合曲線用SPSS 17.0進行協方差分析(ANCOVA),通過檢驗截距與斜率的差異,發現3種遺傳多樣性參數(Na,He和I)的擬合曲線間差異不顯著 (α=0.05水平)。
3 討論
取樣策略是生物多樣性有效保護和利用研究面臨的最基本問題,關系到植物總體和各居群遺傳多樣性評價的正確性和估算的準確性,對制定有效的保護及利用策略意義重大(趙茹等,2006)。在生物多樣性研究中,H和I是兩個最常用的遺傳多樣性評價參數(李鈺瑩和董寬虎,2014;李紹臣等,2016;王夢亮等,2016)。本研究采用ISSR分子標記對抽樣群體進行分析,所獲得的H和I均在取樣樣本量為25個個體時達到總體樣本遺傳多樣性的90.0%,在樣本量超過25個個體后,H和I兩個遺傳多樣性參數隨樣本量的增加呈微幅上升,而在樣本量達到25個個體前,5個遺傳多樣性參數均呈快速上升趨勢。由此判斷,ISSR分子標記在樣本量不小于25個個體時才能代表總體90%以上的遺傳變異。
野生大麻在我國云南、西藏、內蒙古、新疆和東北等地區均有分布,這些地區的野生大麻是我國大麻種質資源的重要組成部分。合理取樣是野生大麻群體遺傳學研究的前提,在很大程度上受大麻植株自身生物學特性、分布范圍、生態環境及取樣目的等因素的影響。通常認為植物居群水平上遺傳多樣性受繁育系統因素的影響最大,風媒傳粉異交>動物傳粉異交>混交>自交,居群內的雜合程度越高,等位基因在個體間的分布越均勻,較少的個體即可代表整個居群的遺傳變異(金燕和盧寶榮,2003)。陳堅等(2015)對異花授粉、種子繁殖植物紫云英進行SSR分子標記取樣量研究,認為取樣30個個體時遺傳多樣性指數達最佳值。譚龍濤等(2012)對中苧1號(苧麻為雌雄同株異花植物,兼有無性繁殖和種子繁殖)的研究結果表明,SSR分子標記在中苧1號樣本量達50個以上個體時遺傳參數值變化不明顯,而SRAP分子標記在中苧1號樣本量達60個以上個體時結果才較穩定。從上述研究結果可看出,不同的植物由于其生物學特性不一樣,在進行群體遺傳學研究時,要求抽取的樣本量通常不同。就大麻而言,由于具有雌雄異株、異花授粉、風媒等特性,其群體內個體間差異較明顯,基因雜合程度高,與自花授粉植物或無性繁殖植物相比,在進行遺傳多樣性評估時其取樣量可相對較小。
大麻通常為雌雄異株(在人工選擇壓力下可形成雌雄同株品種)植物,具異花授粉、風媒、種子繁殖和一年生等生物學特性。雌雄異株、異花授粉植物群體內遺傳多樣性豐富,個體間差異較明顯,基因雜合程度高,與自花授粉植物或無性繁殖植物相比,在對遺傳多樣性評估時其取樣量相對較小。
4 結論
采用ISSR分子標記評估野生大麻群體的遺傳多樣性時,群體取樣樣本量不宜小于25個個體才能較好地反映該居群總體的遺傳多樣性水平。
參考文獻:
陳堅,林新堅,鐘少杰. 2015. 取樣策略對SSR標記鑒別紫云英品種能力的影響[J]. 植物遺傳資源學報,16(6):1249- 1256. [Chen J,Lin X J,Zhong S J. 2015. Effect of sampling strategy on identification of cultivars of Astragalus sinicus L. by SSR marker[J]. Journal of Plant Genetic Resources,16(6):1249-1256.]
陳璇,郭蓉,萬睿璇,許艷萍,張慶瀅,郭孟璧,郭鴻彥,楊明. 2015. 云南省5個雌雄異株工業大麻群體遺傳結構評價[J]. 分子植物育種,13(9):2069-2075. [Chen X,Guo R,Wan R X,Xu Y P,Zhang Q Y,Guo M B,Guo H Y,Yang M. 2015. Genetic structure of five dioecious industrial hemp varieties in Yunnan[J]. Molecular Plant Breeding,13(9):2069-2075.]
金燕,盧寶榮. 2003. 遺傳多樣性的取樣策略[J]. 生物多樣性,11(2):155-161. [Jin Y,Lu B R. 2003. Sampling stra-
tegy for genetic diversity[J]. Biodiversity Science,11(2):155-161.]
李紹臣,李鳳明,張立民,任軍,林玉梅. 2016. 吉林省天然黃檗種群遺傳多樣性ISSR分析[J]. 生態學報,36(13):4006-4012. [Li S C,Li F M,Zhang L M,Ren J,Lin Y M. 2016. Analysis of genetic diversity in wild populations of Phellodendron amurense Rupr. in Jilin Province using inter simple sequence repeat[J]. Acta Ecologica Sinica,36(13):4006-4012.]
李鈺瑩,董寬虎. 2014. 山西白羊草種質資源遺傳多樣性的ISSR分析[J]. 草業學報,23(1):217-222. [Li Y Y,Dong K H. 2014. ISSR analysis of genetic diversity of germplasm resources of Bothriochloa ischaemum in Shanxi[J]. Acta Prataculturae Sinica,23(1):217-222.]
倪先林,趙甘霖,劉天朋,胡炯凌,李元,陳國民,汪小楷,丁國祥. 2015. SSR分子標記在糯高粱種質資源遺傳多樣性分析中的應用[J]. 江蘇農業學報,31(1):16-22. [Ni X L,Zhao G L,Liu T P,Hu J L,Li Y,Chen G M,Wang X K,Ding G X. 2015. Genetic diversity analysis of glutinous sorghum germplasm by simple sequence repeat[J]. Jiangsu Journal of Agricultural Sciences,31(1):16-22.]
譚龍濤,喻春明,陳平,王延周,陳繼康,溫嵐,熊和平. 2012. 樣本量對中苧1號群體遺傳多樣性參數的影響[J]. 中國麻業科學,34(4):179-183. [Tan L T,Yu C M,Chen P,Wang Y Z,Chen J K,Wen L,Xiong H P. 2012. Effects of sample size on genetic diversity parameters for “Zhong Zhu No.1” group[J]. Plant Fiber Sciences in China,34(4):179-183.]
湯志成,陳璇,張慶瀅,郭鴻彥,楊明. 2013. 野生大麻種質資源表型及其RAPD遺傳多樣性分析[J]. 西部林業科學,42(3):62-66. [Tang Z C,Chen X,Zhang Q Y,Guo H Y,Yang M. 2013. Genetic diversity analysis of wild Cannabis in China based on morphological characters and RAPD markers[J]. Journal of West China Forestry Science,42(3):62-66.]
王夢亮,任曉琳,崔晉龍,王俊宏. 2016. 野生紅景天的RAPD和ISSR遺傳多樣性分析[J]. 中草藥,47(3):469-473. [Wang M L,Ren X L,Cui J L,Wang J H. 2016. Genetic diversity of wild plants in Rhodiola L. with two molecular marker methods of RAPD and ISSR[J]. Chinese Traditional and Herbal Drugs,47(3):469-473.]
肖政,蘇家樂,劉曉青,李暢,何麗斯,陳尚平. 2015. 基于ISSR標記的杜鵑花種質資源遺傳多樣性分析[J]. 江西農業學報,27(1):6-10. [Xiao Z,Su J L,Liu X Q,Li C,He L S,Chen S P. 2015. Analysis of genetic diversity of Rhododendron germplasm resources based on ISSR markers[J]. Acta Agriculturae Jiangxi,27(1):6-10.]
張慶瀅,郭鴻彥,楊明. 2011. 加拿大工業大麻生產貿易概況及科研進展[J]. 中國麻業科學,33(6):302-306. [Zhang Q Y,Guo H Y,Yang M. 2011. Production,trade and research progress on hemp in Canada[J]. Plant Fiber Sciences in China,33(6):302-306.]
張影波,袁媛,龐玉新,王丹,胡璇. 2016. 艾納香遺傳多樣性的SRAP和AFLP對比分析[J]. 南方農業學報,47(8):1261-1267. [Zhang Y B,Yuan Y,Pang Y X,Wang D,Hu X. 2016. Comparative analysis of SRAP and AFLP marker for genetic diversity of Blumea balsamifera D C.[J]. Journal of Southern Agriculture,47(8):1261-1267.]
趙茹,程舟,陸偉峰,盧寶榮. 2006. 基于分子標記的野生大豆居群遺傳多樣性估算與取樣策略[J]. 科學通報,51(9):1042-1048. [Zhao R,Cheng Z,Lu W F,Lu B R. 2006. Genetic diversity analysis and sampling strategy of Glycine soja population on molecular marker[J]. Chinese Science Bulletin,51(9):1042-1048.]
周娜,李丹丹,陶偉林,沈虹,羅云米,汝學娟,柳李旺. 2015. 蘿卜種質遺傳多樣性的ISSR,RAPD與RAMP分析[J]. 西南農業學報,28(2):704-712. [Zhou N,Li D D,Tao W L,Shen H,Luo Y M,Ru X J,Liu L W. 2015. Genetic diversity analysis in radish(Raphanus sativus) germplasm with ISSR,RAPD and RAMP[J]. Southwest China Journal of Agricultural Sciences,28(2):704-712.]
宗成堃,宋振巧,陳海梅,劉昶,王建華,郭林林,劉甜,潘玉玲. 2015. 利用SSR、SRAP和ISSR分子標記構建首張丹參遺傳連鎖圖譜[J]. 藥學學報,50(3):360-366. [Zong C K,Song Z Q,Chen H M,Liu C,Wang J H,Guo L L,Liu T,Pan Y L. 2015. Construction of the first genetic linkage map of Salvia miltiorrhiza Bge. using SSR,SRAP and ISSR markers[J]. Acta Pharmaceutica Sinica,50(3):360-366.]
Amaducci S,Scordia D,Liu F H,Zhang Q Y,Guo H Y,Testa G,Cosentino S L. 2015. Key cultivation techniques for hemp in Europe and China[J]. Industrial Crops and Pro-
ducts,68(1):2-16.
Doyle J J. 1991. DNA Protocols for Plants-CATB Isolation[M]. Berlin:Springer-Verlage.
Gao C H,Xin P F,Cheng C H,Tang Q,Chen P,Wang C B,Zang G G,Zhao L N. 2014. Diversity analysis in Cannabis sativa based on large-scale development of expressed sequence tag-derived simple sequence repeat markers[J]. PLoS One,9(10):e110638.
Gilmore S,Peakall R,Robertson J. 2007. Organelle DNA haplotypes reflect crop-use characteristics and geographic origins of Cannabis sativa[J]. Forensic Science International,172(2-3):179-190.
Hakki E E,Kayis S A,Pinarkara E,Sag A. 2007. Inter simple sequence repeats separate efficiently hemp from marijuana (Cannabis sativa L.)[J]. Electronic Journal of Biotechno-
logy,10(4):570-581.
Kayis S A,Hakki E E,Pinarkara E. 2010. Comparison of effectiveness of ISSR and RAPD markers in genetic characterization of seized marijuana(Cannabis sativa L.) in Turkey[J]. African Journal of Agricultural Research,5(21):2925-2933.
Kojoma M,Iida O,Makino Y,Sekita S,Satake M. 2002. DNA fingerprinting of Cannabis sativa using inter-simple sequence repeat(ISSR) amplification[J]. Planta Medica,68(1):60- 63.
(責任編輯 思利華)

