玉米種子萌發響應淹水脅迫的定量蛋白質組學研究
張瑋 阮龍 張欣 左曉龍
摘要[目的]從蛋白質組水平上研究淹水脅迫對玉米種子萌發的影響,篩選重要蛋白質,闡明相關的代謝通路,為深入研究植物種子萌發過程中的耐淹機制提供新的思路。[方法]以玉米自交系196為試驗材料,對種子萌發進行淹水脅迫72 h處理,利用TMT標記結合LC-MS/MS的定量蛋白質組學技術對蛋白質組成進行分析,對差異表達的蛋白質進行鑒定及功能分析。[結果]此次試驗總共鑒定到1 456個蛋白,通過比較、篩選,鑒定到281個差異蛋白,其中244個上調蛋白,37個下調蛋白。通過對差異表達的蛋白質進行了GO功能富集分析和KEGG通路富集分析,發現這些差異蛋白大多參與了碳代謝、糖酵解過程、氨基酸代謝、抗逆與脅迫等過程。[結論]試驗表明淹水脅迫抑制了玉米種子的萌發,通過不同代謝類型的動態變化和不同的信號轉導來提高種子耐受性。
關鍵詞玉米;定量蛋白質組學;淹水脅迫
中圖分類號S513文獻標識碼A文章編號0517-6611(2017)09-0134-03
Study on Quantitative Proteomics of Maize Seed Germination in Response to Waterlogging Stress
ZHANG Wei1,RUAN Long1,ZHANG Xin2,ZUO Xiaolong1*
(1.Tobacco Research Institute,Anhui Academy of Agricultural Sciences,Hefei,Anhui 230031;2.School of Life Sciences,Anhui Agricultural University,Hefei,Anhui 230036)
Abstract[Objective] To study the effects of waterlogging stress on maize seed germination from the level of proteome, screen important proteins and elucidate the related metabolic pathways,which provide new ideas for further study of flooding mechanism during seed germination.[Method]We chose maize inbred lines 196 as experimental materials to study the seeds germination under water stress for 72 hours.The protein composition was analyzed by TMT-labeled LC-MS/MS quantitative proteomics techniques.The differentially expressed proteins were analyzed by identification and functional analysis.[Result]A total of 1 456 proteins were identified in this trial.By comparison,we identified 281 differential proteins,of which 244 were upregulated proteins and 37 downregulated proteins.Through GO analysis and KEGG pathway analysis,we found those differential proteins were involved in the process of carbon metabolism,glycolysis,amino acid metabolism and stress resistance.[Conclusion]The experiment shows that waterlogging stress inhibits the germination of maize seed,and the seeds improve tolerance by dynamic changes of different metabolic types and different signal transduction.
Key wordsMaize;Quantitative proteomics;Waterlogging stress
我國黃淮海地區是夏玉米生產的重要區域[1],這一區域的玉米種子在播種出苗過程中,剛好處于高濕、多雨季節。種子萌發是植物個體發育過程中最關鍵的時期,處于萌發時期的玉米種子對水分需求十分敏感,土壤水分過飽和會影響玉米種子的正常發育,使玉米種子的萌發受到抑制[2]。研究表明,種子在萌發時期長期處于逆境條件下,其生理、生化、遺傳和代謝等指標會發生復雜的變化[3]。目前,有關玉米種子萌發抗逆的研究多集中在鹽脅迫[4]、水分脅迫[5]、外源激素調控[6]、真菌感染[7]、冷脅迫[8]、重金屬脅迫[9]等方面。而針對澇漬脅迫下種子萌發的蛋白響應機制研究少見報道。揭示玉米種子對澇漬脅迫的響應機制,可以為玉米耐澇性的研究和耐澇種質的創制提供理論依據。
目前,質譜技術已逐漸成為蛋白質組學研究的主流技術。隨著蛋白質組學研究的不斷深入,定量蛋白質組學已成為蛋白質組學研究的熱點之一。定量蛋白質組學主要是針對不同狀態下蛋白質的表達量進行分析比較,既可以鑒定出表達的蛋白質,又能對其豐度進行精確定量。TMT是目前定量蛋白質組學最為常用的體外化學標記法之一。它是一種串聯質量標簽,可以與位于肽段N末端和氨基酸側鏈的氨基特異性結合。TMT標記最大的一個優勢就是標記效率高,可以同時對多達10個樣品進行分析,有效節省了質譜分析所用的時間和成本。該研究利用玉米自交系196為材料,采用TMT標記定量蛋白質組學技術,以期能檢測種子在澇漬過程中一些重要蛋白質的表達模式,了解其功能,繼而揭示其在蛋白質組水平上的響應機制。
1材料與方法
1.1供試材料
以玉米自交系196為供試材料,由安徽省農業科學院煙草研究所供種。
1.2玉米種子萌發培養
選取大小一致且無破損的玉米種子,用10%次氯酸鈉消毒10 min,蒸餾水沖洗干凈,再用濾紙吸干表面水分,將種子均勻播于沙盤上,使沙盤完全浸沒于水中,置于人工氣候箱中25 ℃暗培養,對照組正常條件下萌發。由于對照組在培養40 h后胚根將突破種皮完成萌發,所以將對照的時間點選在胚根即將突破種皮之前。處理組在淹水處理72 h后從沙中取出,剝胚進行后續試驗。
1.3玉米種子定量蛋白質組學分析
1.3.1玉米胚的總蛋白提取。參照三氯乙酸(TCA)/丙酮法提取玉米種子胚中的蛋白質。具體操作步驟:稱取0.5 g玉米胚在液氮下研磨,而后加入1.5 mL預冷的TCA-2ME-丙酮溶液,旋渦振蕩1 min,混勻后置于-20 ℃1 h,10 000 r/min、4 ℃離心10 min,棄上清,加入1.5 mL預冷的2ME-丙酮溶液懸浮沉淀,以去除TCA,置于-20 ℃1 h,10 000 r/min、4 ℃離心15 min,棄上清,重復1次。將蛋白粉末在室溫下揮干后于8 mol/L尿素中室溫復溶。
1.3.2胰蛋白酶水解和TMT標記蛋白質定量。
復溶的蛋白濃度用BCA(Solarbio,Beijing)法測定。每個樣品取100 μg蛋白,用二硫蘇糖醇還原和碘乙酰胺烷基化后,再用胰蛋白酶(Promega,Fitchburg)37 ℃酶解過夜。為了準確定量蛋白,使用Thermo公司的TMT試劑標記酶解后的樣品。取15 μL溶解好的TMT試劑加到蛋白溶液中,混勻后室溫標記反應1 h,然用5%的羥胺終止反應。用128標記淹水72 h處理后的胚蛋白樣品,用130標記對照。終止反應后將標記完的樣品進行混合,用Waters公司的Sep-Pak除鹽柱除鹽,之后樣品用HPLC分離肽段。
1.3.3 LC-MS/MS分析及質譜鑒定。
酶解后的產物經TMT標記后上nano-HPLC分離,之后進入Thermo Q Exactive質譜儀中。nano-HPLC的分離條件為流速250 nL/min,時長2 h,流動相A為0.1%的甲酸溶液,流動相B為0.1%的乙腈溶液。所用的分離柱是自制的填充C-18(孔徑300 A、粒徑5 μm)的石英毛細管柱(直徑75 μm,長度150 mm)。一級質譜的掃描在Orbitrap中進行,掃描范圍為400~1 800 m/z,分辨率75 000。每個一級質譜后面接著10次數據依賴性的二級質譜掃描。得到的二級譜圖利用Proteome Discoverer(1.4)軟件在Zea mays數據庫中進行搜庫分析。Score值小于5一般認為可信度較低。試驗結果TMT比值128比130大于1.50,認為這些蛋白是上調蛋白;試驗結果TMT比值128比130小于0.67,認為這些蛋白是下調蛋白。玉米蛋白搜庫數據庫從UniProt上下載。差異蛋白用EasyGO軟件進行富集分析。
2結果與分析
2.1淹水脅迫對玉米種子萌發形態的影響
每隔24 h,對淹水處理的種子進行觀察。由觀察可知,淹水24 h,種子處于快速吸水階段,對照組和處理組沒有明顯變化;淹水48 h,對照組的胚根突破種皮,處理組的種子依舊沒有變化;淹水72 h,對照組胚根迅速伸長,胚芽長出,而處理組的種子鮮重基本保持不變,生長依舊處于停滯狀態,這說明淹水處理能明顯抑制種子的萌發。
2.2淹水脅迫下玉米種子蛋白質組分析
試驗中,將胚內蛋白酶解成肽段,使用TMT6-128標記淹水處理組肽段,使用TMT6-130標記對照組肽段。將不同試驗組的肽段混合在一起,使用LC-MS/MS儀器進行分析。加入標記后,同一條序列肽段的氨基端和賴氨酸上的氨基就帶有了TMT標記。經過高能誘導解離,產生了帶標記的2種碎片離子,這2種碎片的相對離子強度代表蛋白質中肽段的豐度。
試驗總共鑒定到1 456個蛋白,通過篩選、鑒定,發現在淹水處理下,玉米胚內共得到281個差異蛋白,其中244個上調蛋白,37個下調蛋白。
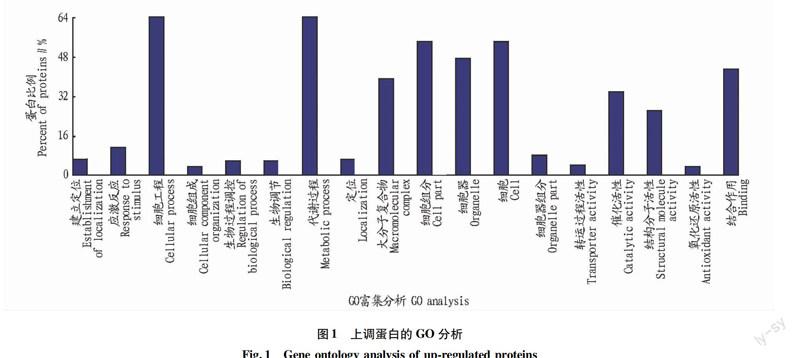
通過對差異蛋白進行GO功能富集分析,從生物過程、細胞組分、分子功能3個方面對所有相應的蛋白數量進行了分類,結果如圖1所示。從圖1可以看出,按生物過程來分,大部分的蛋白都與代謝過程和細胞過程相關,其次有11%的蛋白是與刺激響應相關的蛋白,這些蛋白可能與淹水脅迫下種子的應激反應有關;按照細胞組分來分類,這些上調蛋白有55%分布于細胞質和細胞的其他部位;按照分子功能來看,39%的蛋白具有結合作用,34%的蛋白是代謝相關的酶類,另外27%的蛋白具有細胞骨架蛋白的功能。
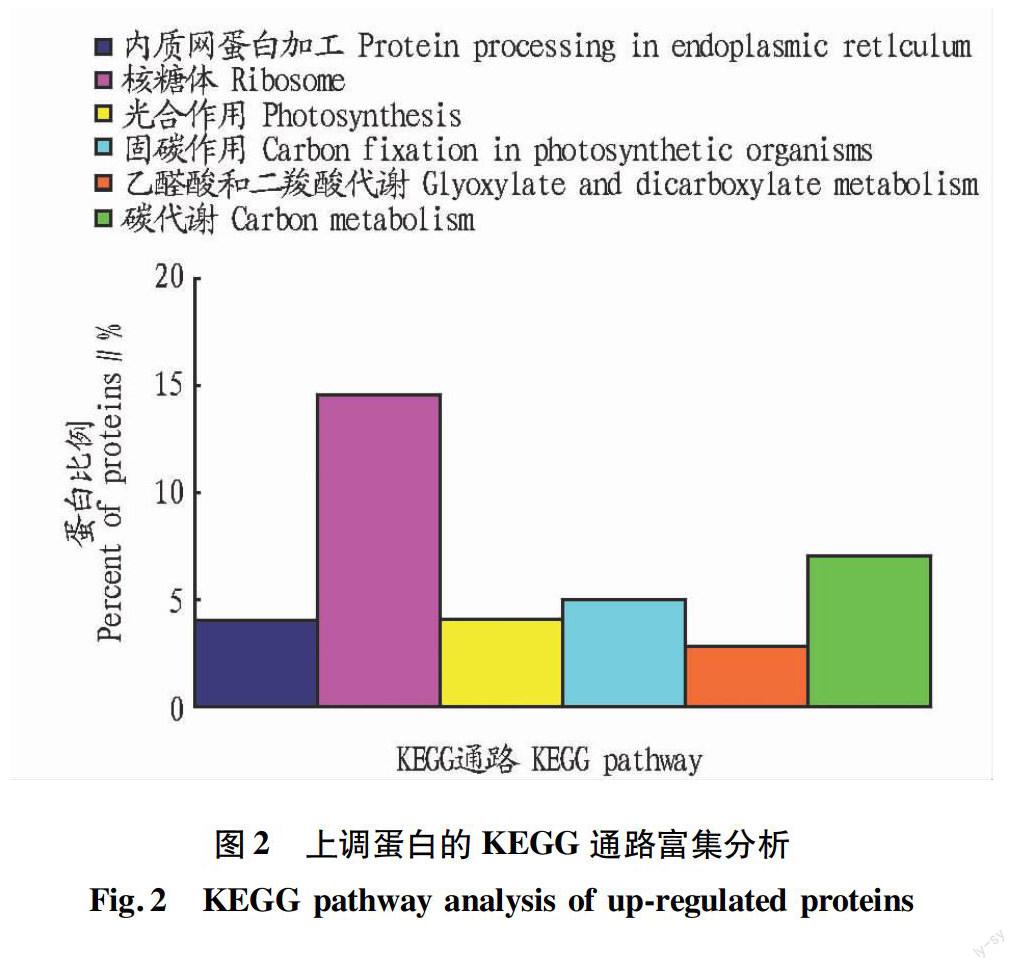
對所鑒定的上調蛋白進行了KEGG Pathway代謝通路富集分析,發現涉及38個KEGG 通路,其中P<0.05的有6個通路(圖2),包括核糖體通路、碳代謝通路、糖酵解通路等。研究表明,淹水脅迫影響了玉米萌發的多個生理代謝通路。
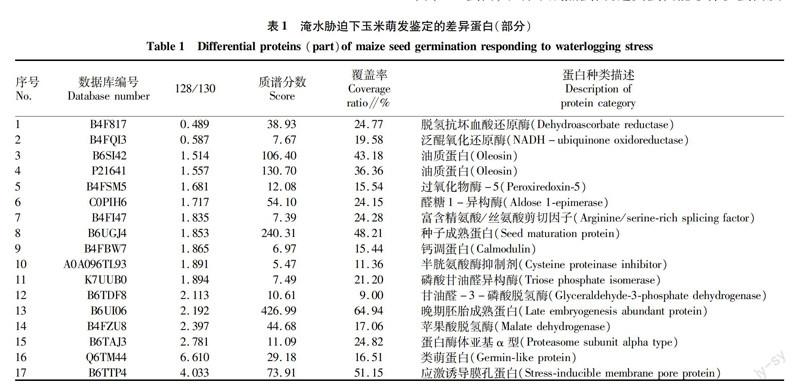
通過定量蛋白質組分析,定量了一些鑒定到的差異蛋白(表1)。在淹水脅迫下,萌發種子胚中脫氫抗壞血酸還原酶下調至0.49倍。NADH泛醌氧化還原酶下調了0.59倍。貯藏物相關蛋白均上調,豐度為1.50倍,有的甚至高達9.10倍。糖酵解過程中相關蛋白,例如甘油醛3磷酸脫氫酶表達豐度也累積增加。一些調節脂類的蛋白表達豐度升高,表明脂肪酸的合成可能增強了種子對逆境的適應性。還鑒定到一些熱激蛋白,在淹水脅迫下,不同熱激蛋白的變化規律并不相同,編號為B4F817的Class I heat shock protein 1發生了下調,降低至0.49倍,另外6個鑒定到的熱激蛋白均上調,豐度在1.60倍~4.23倍。
安徽農業科學2017年
3結論與討論
種子萌發過程中,吸漲水的種子打破休眠并激活了多種代謝活性,包括貯藏物相關蛋白。這些蛋白對環境因素比較敏感,例如淀粉能夠為萌發過程中的呼吸和代謝中間物的合成提供碳源[10],是主要能源物質。該研究中,淀粉合酶(K7V1M1,uniprot編號)、油質類蛋白(B6SI42,uniprot編號)表達豐度顯著增加。這表明在淹水脅迫下,種子可能加強了淀粉合成途徑,從而有利于積累更多的能源。
種子萌發過程需要大量的能量。糖酵解能為萌發過程中的能量供應提供基本的代謝中間物。多個研究表明在植物中過表達甘油醛-3-磷酸脫氫酶基因能提高種子的萌發率[11]。該試驗中甘油醛-3-磷酸脫氫酶在淹水處理后豐度增加,可能是由于在淹水條件下,種子萌發處于低氧環境下,只能靠糖酵解途徑來增加能量,抵抗逆境。
該試驗還鑒定出一類疏水蛋白,即晚期胚胎發生豐富蛋白(LEA蛋白)和種子成熟蛋白。這類蛋白能夠保護蛋白質
的結構,維持膜的穩定性,是一種脫水保護劑[12]。這類蛋白對環境變化也比較敏感,可以在營養生長過程中被干旱、鹽漬、滲透脅迫、ABA等誘導表達。該試驗中,在淹水脅迫下,uniprot編號為B6SGN7的胚胎蛋白和編號為Q6TM44的萌發類蛋白豐度上調表達,這與HUANG等[13]在干旱脅迫下對玉米種子萌發的蛋白質組研究結果一致。另外,熱激蛋白是一類受溫度或其他逆境誘導而表達的逆境脅迫蛋白。它能防止蛋白質變性,幫助蛋白的正常折疊,使其恢復原有的空間構象和生物活性。該試驗還鑒定出一批小分子熱激蛋白,在淹水條件下,能夠增加種子的耐受性。
玉米的蛋白質組學研究已經應用于各個領域,但是大部分的蛋白都未能得到有效的鑒定。在該試驗中,鑒定出來的蛋白有33%分子功能未知,70%的蛋白KEGG通路未知,這就導致研究方法存在諸多局限性。未來隨著蛋白質組學研究的快速發展,期望能夠更快更好地完善玉米的蛋白質組數據庫,使其在玉米相關研究中的應用越來越廣泛。
參考文獻
[1]
余衛東,馮利平,盛紹學,等.黃淮地區澇漬脅迫影響夏玉米生長及產量[J].農業工程學報,2014,30(13):127-136.
[2] 陳國平,趙仕孝,楊洪友,等.玉米澇害及其防御措施的研究:I.芽澇對玉米出苗及苗期生長的影響[J].華北農學報,1988,3(2):12-17.
[3] 朱敏,史振聲,李鳳海.玉米耐澇機理研究進展[J].玉米科學,2015,23(1):122-127,133.
[4] 孟令波.玉米種子萌發的蛋白質組學研究[D].哈爾濱:東北林業大學,2008.
[5] FINCHSAVAGE W E,BLAKE P S,CLAY H A.Desiccation stress in recalcitrant Quercus robur L.seeds results in lipid peroxidation and increased synthesis of jasmonates and abscisic acid[J].J Exp Bot,1996,47(298):661-667.
[6] KOORNNEEF M,VAN EDEN J,HANHART C,et al.Genetic finestructure of the GA1 locus in the higher plant Arabidopsis thaliana[J].Genet Res,1983,41(1):57-68.
[7] SCOTT S J,JONES R A.Quantifying seed germination responses to low temperatures:Variation among Lycopersicon spp.[J].Environ and Exp Bot,1985,25(2):129-137.
[8] RAJJOU L,BELGHAZI M,HUGUET R,et al.Proteomic investigation of the effect of salicylic acid on Arabidopsis seed germination and establishment of early defense mechanisms[J].Plant Physiol,2006,141(3):910-923.
[9] CAMPO S,CARRASCAL M,COCA M,et al.The defense response of germinating maize embryos against fungal infection:A proteomics approach[J].Proteomics,2004,4(2):383-396.
[10] ZEEMAN S C,KOSSMANN J,SMITH A M.Starch:Its metabolism,evolution,and biotechnological modification in plants[J].Annu Rev of Plant Biol,2010,61(1):209-234.
[11] ZHANG X H,RAO X L,SHI H T,et al.Overexpression of a cytosolic glyceraldehyde3phosphate dehydrogenase gene OsGAPC3 confers salt tolerance in rice[J].Plant Cell,Tiss and Organ Cult,2011,107:1-11.
[12] GOYAL K,WALTON L J,TUNNACLIFFE A.LEA proteins prevent protein aggregation due to water stress[J].Biochem J,2005,388:151-157.
[13] HUANG H,MOLLER I M,SONG S Q.Proteomics of desiccation tolerance during development and germination of maize embryos[J].J Proteomics,2012,75(4):1247-1262.

