對7個化學疑難問題的解析及思考
吳朝輝
摘要:解析了7個源自學生的疑問:為什么鉀密度比鈉小,為什么CO2以雙鍵結合而SiO2卻是單鍵,為什么晶體硅能作半導體而金剛石卻不能,為什么有叁鍵結構的N2卻不易加成,為什么Fe參加反應先失去最外層電子;為什么SiCl4極易水解而CCl4卻不易,為什么P的最高價含氧酸可以是H3PO4而N卻是HNO3。解決學生疑問、清除學習障礙的同時,更嚴謹認識“結構決定性質,性質反映結構”的科學原理。實踐表明,解析疑難問題可以激勵學生提出問題的興趣,開闊學生的知識眼界,提升教師積淀深厚的專業功底。
關鍵詞:物質結構;疑難問題解析;化學教學研討
文章編號:1005–6629(2017)4–0091–04 中圖分類號:G633.8 文獻標識碼:B
物質結構與元素周期律是化學重要理論,可幫助學生樹立“結構決定性質,性質反映結構”為核心的物質結構觀,同時培養學生類比思維和知識遷移能力。“通過研究典型,歸納共性,使得無數復雜、離散的化學知識變得簡單、有序。但是,隱藏在共性背后的特性既是教學的難點,也是學生常見的學習障礙,因而不可等閑視之”[1]。特別是在類推失敗后,學生本能地想知道:“為什么不能類推?”“為什么會失敗?”這就需要教師深入解釋其中的化學原理,幫助學生清除學習障礙。
筆者從多年收集疑難問題中,遴選出了7個重現率較高的問題,并嘗試從物質結構理論角度進行解釋,在幫助學生開闊與發散思維的同時,也深化對“結構決定性質、性質反映結構”規律的認知。
問題1 為什么鉀的密度比鈉小
通常情況下,同主族的單質的密度隨著序數的增大而增大。但在常溫下,鈉的密度為0.971g·cm-3,鉀為0.86g·cm-3。為什么鉀的密度反而比鈉小?
鈉、鉀的晶胞屬于體心立方堆積(如圖1),每個晶胞均含有2個原子。

問題2 為什么CO2中是碳氧雙鍵,而SiO2中卻是硅氧單鍵
CO2中C原子和O原子形成2個雙鍵,而SiO2中Si原子和O原子卻形成4個單鍵。為什么同一主族的最高價氧化物,成鍵方式會不同?
已知:E(C-O)=358kJ·mol-1,E(C=O)=805kJ·mol-1,E(Si-O)=466kJ·mol-1,E(Si=O)=638kJ·mol-1。假設SiO2具有與CO2相同結構,即形成O=Si=O。則可通過鍵能近似計算“雙鍵式SiO2”轉化為“單鍵式SiO2”的焓變:ΔrHm=638×2-466×4=-588kJ·mol-1。計算結果表明“雙鍵式SiO2”結構不穩定,Si原子與O原子會通過Si-O單鍵形成熱力學穩定的結構。
同理可算出“單鍵式CO2”轉化為“雙鍵式CO2”的焓變:ΔrHm=358×4-805×2=-178kJ·mol-1。所以C原子與O原子傾向于通過C=O雙鍵形成熱力學穩定的結構[2]。
成鍵方式的差異導致晶體結構不同。在SiO2中,形成Si-O單鍵后,O原子還剩余一個價鍵,可再與另外一個Si原子結合,形成無限聚合態——原子晶體。在CO2中,形成C=O鍵后,O原子已用完兩個價鍵,所以就形成了分子晶體。
問題3 Fe參加反應時,為什么先失去最外層電子,而非能量最高的電子
基態26Fe原子的核外電子排布式是[Ar]3d64s2,Fe2+的核外電子排布式是[Ar]3d6,學生不明白:Fe原子參與反應時,為什么先失去4s上的電子,而不是根據“能量越低越穩定”原則,失去能量最高的3d上的電子?
多電子原子中,電子具有的能量E決定于主量子數n和角量子數l [3]。我國化學家徐光憲教授根據E與n、l的關系,歸納得到一個近似規律:(n+0.7l)值越大,原子軌道能量越高。得出原子軌道能量E的高低順序與鮑林依據光譜實驗測定的結果一致:1s<2s<2p<3s<3p……。徐光憲教授同時還提出:(n+0.4l)值越大,離子軌道能量越高[4]。離子中的3d、4s的(n+0.4l)值分別為3.8和4.0(s,p,d,f的l分別等于0,1,2,3)。因為離子軌道的能量E4s>E3d,所以參與反應時,Fe原子先失去4s上的電子——既是最外層電子也是離子中能量最高電子。
問題4 為什么晶體硅是半導體,而金剛石卻不可以導電
金剛石晶體中,每個C原子通過sp3雜化,與相鄰的4個C原子形成共價單鍵,再不斷向外伸展形成無限聚合的空間網狀結構。由于每個C原子的4個價電子均參與成鍵,已不存在自由電子,所以金剛石不能導電。可結構與金剛石相似的晶體硅為什么卻是半導體?
半導體通常是由于熱激發產生價電子和空穴而導電[5]。因為硅原子半徑大,對電子的吸引能力弱,少數成鍵的共用電子在熱運動下會擺脫共價鍵的束縛而成為自由電子,并在原位留下空穴。其他電子在外加電場作用下遷移過來填補這些空穴,同時又留下新的空穴……借助電子和空穴的定向遷移,晶體硅能導電。而在金剛石中,由于碳原子半徑小,對共用電子的吸引能力強,共用電子對被牢固地束縛在成鍵原子周圍而無法成為自由電子,所以金剛石不能導電[6]。
問題5 為什么含有N≡N的N2不易發生加成反應
乙炔易發生加成反應,因為C≡C中的π鍵容易發生斷裂。可N2分子中也有叁鍵,為什么N2卻不易發生加成反應?
含π鍵的化合物性質都較活潑,因為π鍵容易斷裂,具有較強的反應活性,主要原因有[7]:第一,π鍵是成鍵軌道“肩并肩”交疊而成,不如σ鍵“頭碰頭”重疊的充分,故π鍵比σ鍵弱得多。第二,形成π鍵的電子云聚集在分子平面的兩側,容易受到缺電子試劑的進攻。第三,π鍵電子云比σ鍵電子云離核遠,原子核對它的束縛力較小,使π鍵電子云具有較大的流動性,易受外界電場的影響而發生極化。
但N2分子卻是一個例外。已知:E(N-N)= 167kJ/mol、E(N=N)=418kJ/mol、E(N≡N)=941.69kJ/mol。說明N≡N鍵中的E(π)≈387.35kJ/mol>E(σ)。在化學反應時,總是鍵能較小的化學鍵優先斷裂。所以當N2參加反應時,鍵能較小的σ鍵先斷裂,而σ鍵斷裂后,π鍵也難以存在,導致N2分子斷裂成兩個獨立的N原子,所以含有N≡N鍵的N2不易加成。
問題6 為什么SiCl4極易水解,而CCl4卻不易水解
室溫下,SiCl4遇水會強烈水解:SiCl4+4H2O=H4SiO4+4HCl。而CCl4卻不容易水解,故實驗室可用CCl4萃取溴水中的溴單質。為什么?
共價型化合物水解的必要條件是電正性原子要有空軌道。硅原子不僅有可供成鍵的3s和3p軌道,而且還有空的3d軌道。當SiCl4遇到水分子時,具有空軌道的硅原子可接受水分子中O原子提供的孤對電子,形成配位鍵,同時使原有的Si-Cl鍵消弱、斷裂,所以SiCl4遇水就會強烈水解[8]。
碳原子的L層只有2s、2p軌道,即電正性的碳原子沒有空軌道,水分子的O原子無法將電子對給予C原子,所以CCl4不容易水解。

氮元素為什么不能形成H3NO4?第一,N原子的孤對電子可以進入O原子的空2p軌道形成配位鍵,但N原子卻沒有空軌道接受O原子的反饋電子對。第二,N原子半徑較小,在狹小空間內連接三個羥基,使羥基H原子與另一羥基的O原子距離很近,從而形成較強的分子內氫鍵(H3PO4分子中也存在分子內氫鍵)。形成氫鍵時,兩個電負性大的原子越遠越好[10],在大多數情況下,一個連接在X原子上的H原子只能與一個電負性大的Y原子形成氫鍵,鍵角大多接近180°[11](因為距離越遠,電子云間的斥力越小)。在N原子周圍狹小空間內的三個羥基,會產生強烈的相互排斥,使得H3NO4分子很不穩定,在分子內氫鍵的作用下脫去H2O分子并形成N=O鍵,形成圖3(a)所示的結構[12]。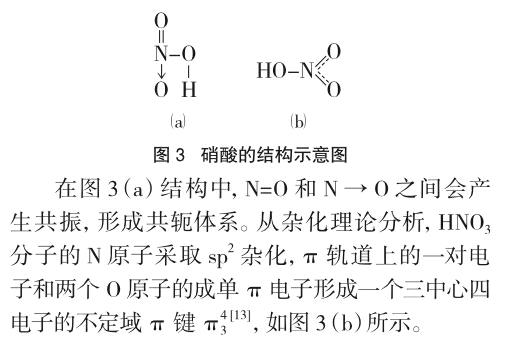
中科院院士、數學家林群提出“要培養學生不只會證明,還要會發明,不只會解決問題,還要會提出問題、開辟新的問題”。高中新課程改革也強調要注重培養學生發現問題的能力,培養學生的質疑能力和批判性思維。筆者認為,要達成這些目標,不僅要鼓勵學生敢想、敢問,也需要教師能包容各種稀奇古怪的問題,不辜負學生的每個問題。
第一,面對學生提出的古怪刁鉆的問題,我們應欣慰他們在學習中能積極發散思維、主動類比,能發揮自己的主動學習的精神。同時更要從保護學生提出問題的興趣的高度認真解答這些問題,讓學生能“滿意而來,滿載而歸”。如果問題超出自身能力,比說聲“對不起”更積極的是用一周,甚至一個月去查找資料,形成簡明但又不失科學的解析。有時甚至在學生都可能已淡忘自己曾經提出的問題的情況下,依然給出科學解析,向學生表明對自己所提問題的尊重和嚴謹求真。這也會讓學生意識到自己的每個問題都能得到教師積極回應,這又將大大激勵他們提出新問題的意愿。
第二,這7個疑難問題也有助于拓寬學生的知識眼界,讓學生更深入領悟“結構決定性質,性質反映結構”的科學規律:“共性”源于相似結構,“特性”則因為結構存在差異;物質世界復雜多變,但支配復雜世界的規律卻是簡明的,找到關鍵因素這把鑰匙就能打開物質世界,窺探物質世界的奧妙與神奇。擁有這些認知與意識,可以增強學生在今后學習中直面未知挑戰的信心和勇氣。
第三,專業知識是教師自身發展的“本錢”,特別是清楚高中與大學的銜接知識,能幫助我們游刃有余地處理教材和課標、處理高考中的任何問題,輕松自如地解答學生的疑難問題,從而贏得學生的尊重[14]。來自于學生的疑難問題也能倒逼我們克服惰性,不放松對專業知識的再學習,增厚自己的專業知識功底,從而使自己的教學也更自信,更有底氣。
通過上述疑難問題,不僅有機會欣賞學生思維的靈動和自由,也讓筆者有機會對教學中的學科問題進行上位思考,不至于對化學教學問題的思辨退化成高中的水平[15]。但我們要仔細思量、慎重選擇:哪些問題適宜進入課堂教學,哪些問題只宜進行個別解答,以免教學失度,給學生帶來不必要的負擔。
說明:文中采用的各類常數數據,除已注明的外,均引用自武漢大學等校所編《無機化學(第3版)》。
參考文獻:
[1]王后雄.新理念化學教學論[M].北京:北京大學出版社,2009:80.
[2]大連理工大學無機化學教研室編.無機化學(第五版)[M].北京:高等教育出版社,2011:433.
[3][8][9][13]武漢大學、吉林大學等校編.無機化學(第三版)[M].北京:高等教育出版社,1994:77,758~764,575~681,667.
[4][5][11]浙江大學普通化學教研組.普通化學(第五版)[M].北京:高等教育出版社,2008:212~215,259,232.
[6]王懷寶.晶體結構相似的金剛石和晶體硅,為何性質不相似[J].化學教學,1984,(3):24.
[7][10]榮國斌,蘇克曼.大學有機化學基礎[M].上海:華東理工大學出版社,化學工業出版社,2002:90,2.
[12]王祖浩主編.普通高中課程標準實驗教科書·物質結構與性質(選修)[M].南京:江蘇教育出版社,2010:56.
[14]張希彬.實驗教學也可以“有思考”[N].中國教育報,2016-06-01,(10).
[15]編者的話.科學技術及化學學科新發展對化學教學的啟示[J].化學教學,2016,(10):3~6.

