重組毒素rCCK96-104PE38 靶向結腸癌生物特性研究
張嵩柳溪林李萌常江高世奇胡盼柳增善
(1. 吉林大學動物醫學學院 人獸共患病研究所教育部重點實驗室,長春 130062;2. 吉林大學中日聯誼醫院,長春 130033)
重組毒素rCCK96-104PE38 靶向結腸癌生物特性研究
張嵩1柳溪林2李萌1常江1高世奇1胡盼1柳增善1
(1. 吉林大學動物醫學學院 人獸共患病研究所教育部重點實驗室,長春 130062;2. 吉林大學中日聯誼醫院,長春 130033)
旨在原核表達并純化新型重組毒素rCCK96-104PE38,驗證其對結腸癌細胞的靶向殺傷作用。使用基因擴增技術將反向編譯的膽囊收縮素CCK96-104與綠膿桿菌外毒素PE38融合,構建原核表達載體。利用Ni-NTA親和層析進行純化。通過結腸癌細胞體外殺傷實驗以及結腸癌裸鼠模型的治療驗證rCCK96-104PE38的抗腫瘤能力。結果顯示,擴增出的rCCK96-104PE38序列正確,成功利用pET-28a原核表達系統實現了活性表達。純化后的重組蛋白能夠在體外誘導結腸癌細胞凋亡,并能抑制裸鼠模型體內的腫瘤生長。成功制備高純度、無標簽的rCCK96-104PE38重組免疫毒素,體內、體外實驗證實其具有抑制結腸癌的能力。
重組毒素;結腸癌;膽囊收縮素;綠膿桿菌外毒素
結腸癌是人類高發惡性腫瘤之一,其發病率一直呈上升趨勢,全球每年患結腸癌的病例超過100萬人[1]。目前,結腸癌的治療手段以手術治療為主,輔以化療、放療等治療手段,針對結腸癌的常用抗腫瘤藥物包括5-Fu(5-氟尿嘧啶)、伊立替康、奧沙利鉑、卡培他濱等[2],但術后腫瘤易復發,且副作用不容忽視。近年來,基因治療藥物、免疫治療藥物等靶向治療藥物得到了快速發展[3],為結腸癌的治療開辟了新途徑。
分子靶向治療是以腫瘤細胞過度表達的分子作為靶位,選擇針對性的阻斷劑,能夠作用于腫瘤細胞生長、運動等的信號傳導通路或誘導免疫因子識別并消滅腫瘤細胞等途徑,從而使腫瘤細胞生長變慢或者發展停止[4,5]。研究發現,在胃腸道腫瘤發生發展的過程中,膽囊收縮素2型受體(CCK2R)在腫瘤細胞中的表達顯著高于正常細胞,在部分結腸癌、大腸癌、胃癌細胞系中的過表達更加突出[6-9],是結直腸癌診斷和治療的理想靶點。
本研究根據結腸癌與正常組織表面CCK2R數量與親和力的巨大差異,利用基因工程技術構建新型重組毒素rCCK96-104PE38,即截取全長CCK的第96-104號氨基酸,反向重組后作為導向單元與具有高效細胞毒性的PE38(綠膿桿菌外毒素)結合,獲得可以靶向高效殺傷結腸癌細胞的分子藥物,并通過結腸癌體內體外實驗探索其靶向特性,為臨床前試驗奠定基礎。
1 材料與方法
1.1 材料
1.1.1 主要試劑 Ex Taq DNA聚合酶、限制性內切酶Nhe I和BamH I、低分子量蛋白Marker、DL2000核酸Marker、pMD-18T Kit、T4連接酶均購自日本TaKaRa公司;膠回收Kit、質粒小提Kit購自美國Axygen公司;卡那霉素、氨芐青霉素、IPTG購自北京鼎國公司;Ni-NTA親和層析介質、Tricorn 10/150玻璃柱購自瑞典GE公司;rTEV酶購自北京索萊寶公司;胎牛血清、RPMI1640培養基購自美國Gibco公司;PVDF膜購自美國Millipore公司;熒光染料Dylight 488,HRP標記羊抗鼠IgG抗體購自上海艾博抗公司;PE38單克隆抗體3B9為本實驗室制備;其他化學試劑均為國產分析純。
1.1.2 質粒、菌株、細胞、裸鼠 pET-28a質粒購自德國Novagen公司;pET-rG17PE38重組質粒、感受態BL21(DE3)PLysS、感受態DH5α、人肝細胞LO2、大腸癌細胞系SW116、結腸癌細胞系HCT8、SW620、SW480均為本實驗室保存,裸鼠購自上海斯萊克實驗動物有限公司。
1.2 方法
1.2.1 rCCK96-104PE38原核表達菌株的構建
1.2.1.1 引物 以本實驗室構建并保存到pET-rG17PE38為模板,利用PCR方法將反向的CCK96-104片段基因與PE38基因進行融合,并引入了rTEV酶特異性切割位點,人工合成引物為:其中,下劃線分別為Nhe I和BamH I酶切位點。
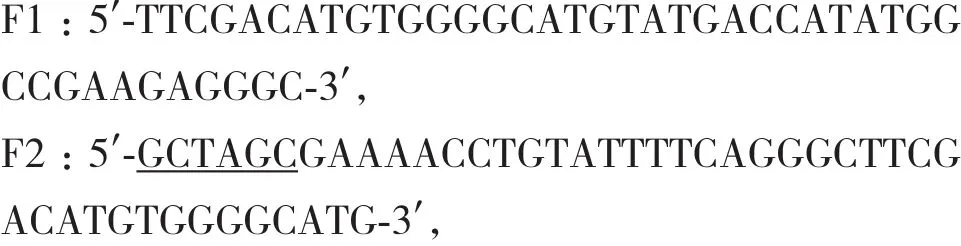
1.2.1.2 原核表達載體的構建 將PCR產物與pET-28a質粒分別進行雙酶切,然后通過1%瓊脂糖凝膠電泳鑒定雙酶切效果,并使用膠回收試劑盒回收目的基因和載體片段,使用T4連接酶水浴16℃過夜連接,連接產物轉化到BL21(DE3)PLysS感受態細胞中。
1.2.2 重組毒素 rCCK96-104PE38的表達與鑒定
1.2.2.1 低溫誘導表達 將重組菌按1∶100的比例接入LB培養基(Kana 50 ng/mL)中,于37℃ 7,1.5 h后,將培養箱溫度降至16℃ 6將培養箱溫度IPTG至終濃度0.1 mmol/L,搖培18 h。
1.2.2.2 Western blot 鑒定 將表達的rCCK96-104PE38重組蛋白進行 SDS-PAGE凝膠電泳,再通過電轉儀轉移到PVDF膜上,使用5%脫脂奶粉4℃封閉過夜后,先后加入PE38的單克隆抗體3B9(本實驗室制備),和HRP標記羊抗鼠IgG二抗。最后加入ECL化學發光顯色液顯色呈像。
1.2.3 重組毒素 rCCK96-104PE38的純化
1.2.3.1 Ni-NTA親和層析 使用?KTA蛋白純化儀進行純化。首先用5-10個柱體積的Ni-NTA親和層析平衡緩沖液Buffer A(50 mmol/L Tris-HCl,0.5 mol/L NaCl,10 mmol/L咪唑,10%甘油,pH7.0)充分平衡Ni-NTA親和層析柱;將超聲上清注入緩慢注入層析柱,再用洗脫緩沖液Buffer B(50 mmol/L Tris-HCl,0.5 mol/L NaCl,500 mmol/L咪唑,10%甘油,pH7.0)調節混合液咪唑濃度按梯度洗脫下目的蛋白。
1.2.3.2 rTEV酶切除組氨酸標簽 加入rTEV酶對組氨酸標簽切割,再通過Ni-NTA親和層析獲得切割標簽后的目的蛋白。
1.2.4 重組毒素rCCK96-104PE38體外抑瘤實驗
1.2.4.1 rCCK96-104PE38體外腫瘤細胞殺傷活性檢測 將對數生長期的HCT116細胞以及人肝細胞LO2分別經胰酶消化后,以5×103個細胞/孔鋪在96孔細胞培養板中,待細胞貼壁后加入終濃度為2 000 ng/mL的rCCK96-104PE38,用CCK-8試劑盒測定不同時間點重組毒素對腫瘤細胞的抑制率。
1.2.4.2 受體免疫熒光檢測 在培養好的HCT116細胞中加入4%多聚甲醛固定30 min;5%胎牛血清封閉30 min;加入終濃度為2 000 ng/mL rCCK96-104PE38KDEL重組蛋白,37℃孵育10 min,再先后孵育PE38單抗和熒光二抗,通過熒光顯微鏡觀察。
1.2.4.3 腫瘤抑制率測定 在對數生長期的人正常肝細胞、結腸癌細胞系HCT116、HCT8、SW620、胃癌細胞系BGC823、黑色素瘤B16、宮頸癌細胞系HeLa中,加入不同濃度的rCCK96-104PE38重組蛋白,孵育48 h后,使用CCK-8試劑盒測定腫瘤抑制率及IC50值。
1.2.5 重組毒素rCCK96-104PE38動物體內抑瘤實驗
1.2.5.1 免疫缺陷鼠腫瘤模型的建立 取1×107個HCT116細胞溶于200 μL生理鹽水中,用注射器注入裸鼠右前肢腋下。7 d后觀察小鼠注射部位是否出現腫塊。
1.2.5.2 rCCK96-104PE38治療腫瘤模型 選取腫瘤體積達到50-100 mm3的腫瘤模型小鼠30只,平均分成6組,G1組:每日每只注射200 μL生理鹽水;G2組:每日每只注射5 mg/kg rCCK96-104PE38;G3組:每日每只注射10 mg/kg rCCK96-104PE38;G4組:每日每只注射20 mg/kg rCCK96-104PE38;G5組:每日每只注射10 mg/kg奧沙利鉑;G6組:每日每只注射10 mg/kg奧沙利鉑和10 mg/kg rCCK96-104PE38。注射方式為尾靜脈注射,連續注射14 d,治療結束后將小鼠處死,記錄瘤重、瘤體積,體重等指標。
2 結果
2.1 rCCK96-104PE38重組毒素的表達與鑒定結果
如圖1所示,經10% SDS-PAGE電泳分析,誘導后的重組菌株在40 kD附近表達重組蛋白,與設計的rCCK96-104PE38大小相符。Western blot結果表明,該重組蛋白能與PE38抗體特異性結合。
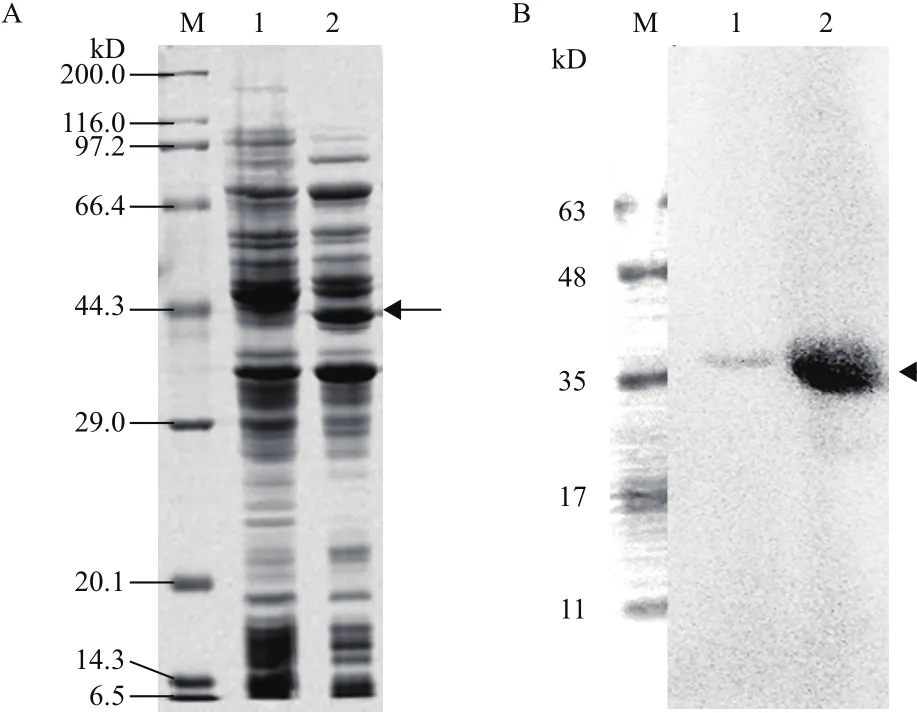
圖1 重組蛋白rCCK96-104PE38的SDS-PAGE重組蛋白表達(A)與Western-blot鑒定結果(B)
2.2 Ni-NTA親和層析純化結果
經10% SDS-PAGE凝膠電泳分析,結果(圖2)顯示,在300-450 mmol/L咪唑濃度下,重組蛋白rCCK96-104PE38被洗脫下來。
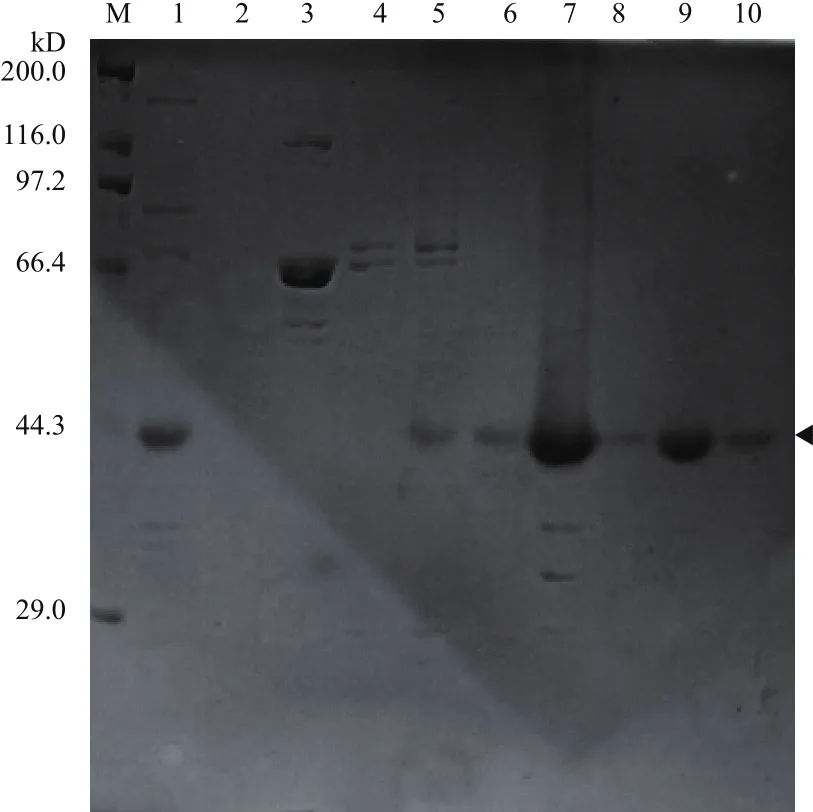
圖2 Ni-NTA金屬螯合親和層析純化(梯度洗脫)
2.3 腫瘤抑制曲線
如圖3所示,在培養基中加入rCCK96-104PE38后,結腸癌細胞HCT116迅速凋亡,其致凋亡速率與PE毒素相近,而對人正常肝細胞沒有顯著影響;而PE毒素不僅能殺死腫瘤細胞,也能夠致死正常的肝細胞,顯示出對真核細胞的廣譜殺傷性。
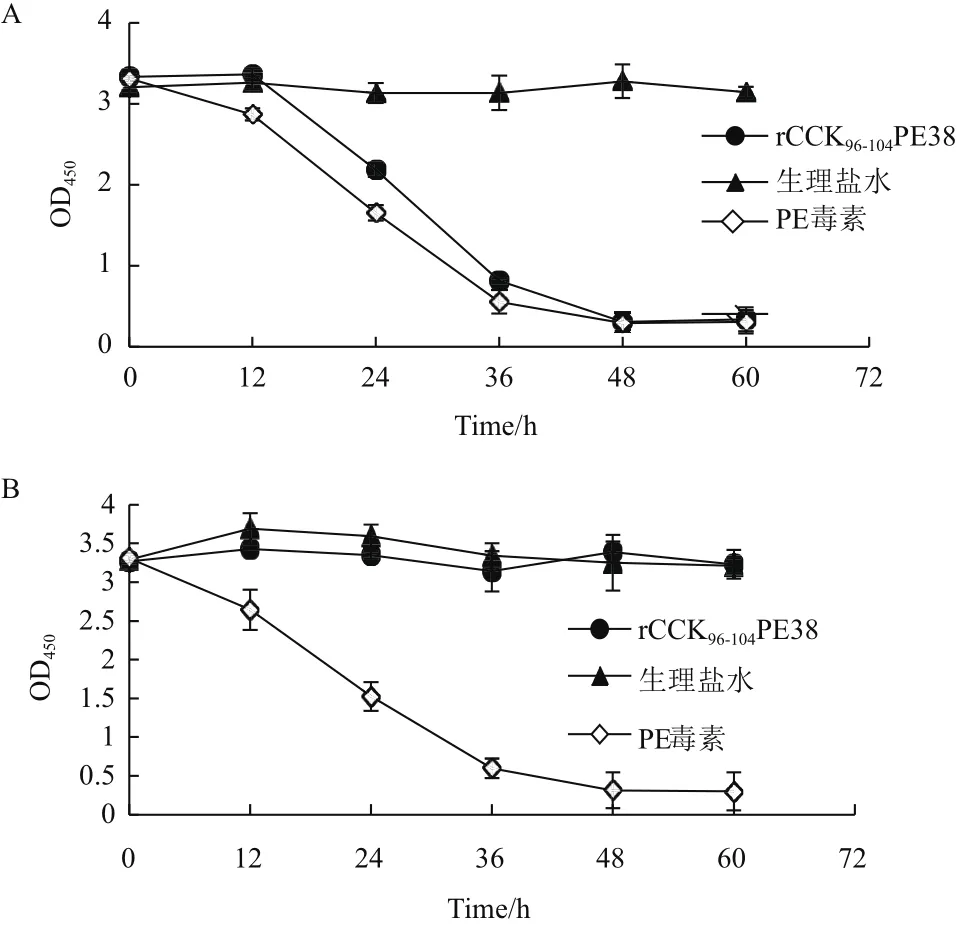
圖3 抑制曲線
2.4 rCCK96-104PE38在靶細胞上的定位
通過間接免疫熒光實驗,發現rCCK96-104PE38重組蛋白能夠特異性的吸附在結腸癌細胞HCT116表面,而在肝細胞LO2上檢測不到強的綠色熒光;PE毒素在HCT116及LO2細胞上均有結合,見圖4。
2.5 rCCK96-104PE38對不同細胞的抑制效果
通過CCK8法測定不同濃度的重組蛋白對不同細胞的抑制率,并使用SPSS統計分析軟件計算獲得相應的IC50值(半抑制濃度)。如表1所示,rCCK96-104PE38對結腸癌細胞系的抑制效果最好,對胃癌細胞BGC823也有一定的作用,而對黑色素瘤B16、宮頸癌HeLa、人肝臟細胞LO2均沒有顯著抑制效果,與預期相符。
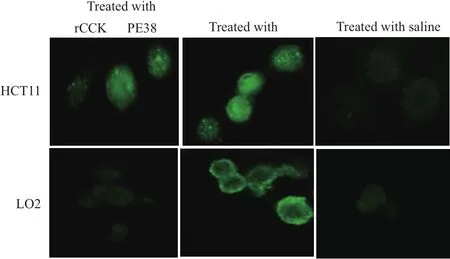
圖4 間接免疫熒光檢測rCCK96-104PE38在靶細胞上的定位
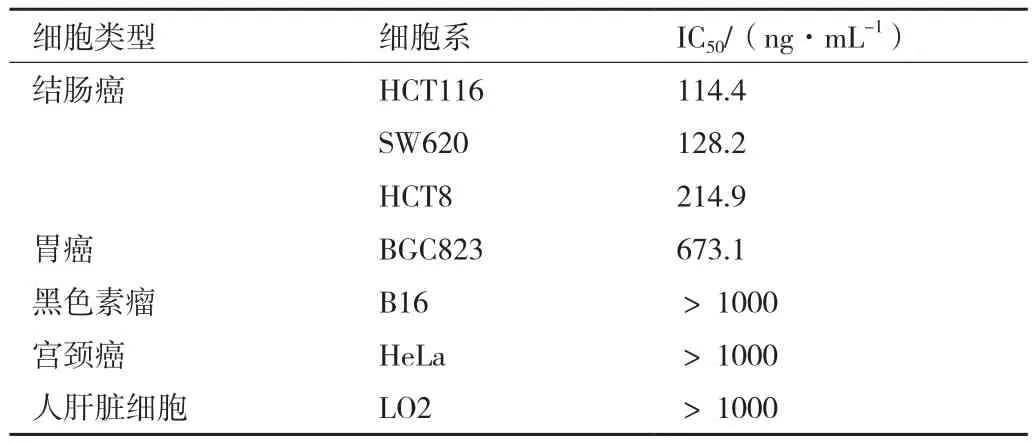
表1 rCCK96-104PE38對不同細胞殺傷效果(IC50)
2.6 毒性測試
裸鼠模型在單次注射30 mg/kg時即出現中毒現象,當劑量增加到60 mg/kg時有小鼠出現死亡(表2)。

表2 rCCK96-104PE38的急性毒力測試
2.7 體內抑瘤效果
以不同劑量的重組毒素和常規藥物對結腸癌裸鼠模型進行治療發現,20 mg/kg的rCCK96-104PE38能夠顯著抑制腫瘤的生長,與常規化療藥物奧沙利鉑聯合給藥的抑瘤效果最好,見圖5。
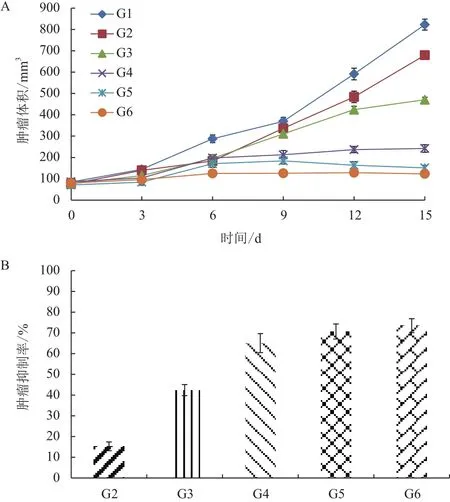
圖5 體內抑瘤效果
3 討論
重組免疫毒素是一種融合了靶向分子和毒素的人造蛋白,根據靶向分子的不同主要分為兩類,一類是融合了靶向某種特異性受體的天然配體,一類是融合的抗體或單鏈抗體[10,11],本研究的rCCK96-104PE38重組免疫毒素就屬于第一類重組免疫毒素,具有特異性靶向殺傷結腸癌腫瘤細胞的能力。
PE毒素,即綠膿桿菌外毒素,由638個氨基酸構成的一個單鏈多肽,屬于雙組分AB毒素家族[12]。PE毒素的優勢在于,普通人體內沒有PE毒素的預存抗體,而且PE毒素不僅毒性強,而且毒性機理研究已經很清楚,便于進行編輯改造及活性表達[12,13]。通過將PE分子非特異結構域1-252位和365-380位的氨基酸殘基去除,得到了38 kD大小的PE38,具有更低的免疫原性,同時,將PE38羧基端的REDLK突變為KDEL,能夠使細胞毒性提升6-10倍[14,15]。
膽囊收縮素(CCK)是由十二指腸和近端盲腸的I型腸內分泌細胞和大腦神經元合成分泌,其主要生理功能是刺激胰腺分泌、膽囊收縮、抑制胃酸分泌,產生飽腹感等[16]。CCK發揮作用均與CCK2R(膽囊收縮素2型受體)相關,而CCK2R在腫瘤細胞中過表達,因此可以將CCK作為重組免疫毒素特異性識別腫瘤細胞的識別元件[17]。CCK在人體內以多種長短不同的分子形式存在,均為含115個氨基酸的CCK原加工剪切形成的多肽[18],本研究最終選擇了能發揮CCK2R親和作用的第96-104位的Asp-Tyr-Met-Gly-Trp-Met-Asp-Phe-Gly九個氨基酸作為重組毒素的導向元件。
在測定rCCK96-104PE38重組免疫毒素對不同細胞的抑制效果時發現,其對胃癌細胞系BGC823也有明顯的致凋亡作用,原因是CCK2R不僅在結腸癌細胞上高表達,在部分胃癌細胞、部分胰腺癌中也高表達[19-21],進一步證實了rCCK96-104PE38是通對CCK2R進行定位并發揮細胞毒作用。
4 結論
本實驗室成功構建rCCK96-104PE38的原核表達載體,低溫誘導表達出可溶性重組毒素蛋白,并通過Western blotting驗證。重組蛋白經Ni-NTA親和層析純化。通過體外細胞實驗和結腸癌裸鼠模型體內實驗證實,rCCK96-104PE38具有靶向殺傷結腸癌的功能。
[1]Cunningham D, Atkin W, Lenz HJ, et al. Colorectal cancer[J]. Lancet, 2010, 375:1030-1047.
[2] 宮媛, 吳本儼. 循證醫學評價結腸癌輔助化療藥物及新進展[J]. 中國新藥雜志, 2007, 16(10):757-761.
[3]劉靜, 黃紅. 結腸癌發病機制中原癌基因與抑癌基因研究及相關藥物治療進展[J]. 中國藥房, 2014, 25(45):4302-4304.
[4]Shan L, Liu Y, Wang P. Recombinant immunotoxin therapy of solid tumors:Challenges and strategies[J]. Journal of Basic and Clinical Medicine, 2013, 2(2):1-6.
[5]Mazor R, Eberle JA, Hu XB, et al. Recombinant immunotoxin for cancer treatment with low immunogenicity by identification and silencing of human T-cell epitopes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(23):8571-8576.
[6]Feng XL, Liu ZS, Liu XL, et al. Establishment of a three-step purification scheme for a recombinant protein rG17PE38 and its characteristics identification[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2015, 981-982:48-56.
[7]Quattrone A, Dewaele B, Wozniak A, et al. Promoting role of cholecystokinin 2 receptor(CCK2R)in gastrointestinal stromal tumour pathogenesis[J]. The Journal of Pathology, 2012, 228(4):565-574.
[8]Hayakawa Y, Jin G, Wang H, et al. CCK2R identifies and regulates gastric antral stem cell states and carcinogenesis[J]. Gut, 2015, 64(4):544-553.
[9]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA:A Cancer Journal for Clinicians, 2016, 66(2):115-132.
[10]Kaplan G, Lee F, Onda M, et al. Protection of the furin cleavage site in low-toxicity immunotoxins based on Pseudomonas Exotoxin A[J]. Toxins(Basel), 2016, 8(8):pii:E217.
[11]Liu XF, Xiang LM, Zhou Q, et al, Actinomycin D enhances killing of cancer cells by immunotoxin RG7787 through activation of the extrinsic pathway of Apoptosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(38):10666-10671.
[12]Michalska M, Wolf P. Pseudomonas Exotoxin A:optimized by evolution for effective killing[J]. Frontiers in Microbiology, 2015, 6:963.
[13]祁志榮, 李虹. PE類重組免疫毒素的研究進展[J]. 微生物學免疫學進展, 2006, 34(1):50-53.
[14]杜世彧. 綠膿桿菌外毒素A的結構、功能及其重組毒素[J].生物化學與生物物理進展, 1995, 22(2):112-117.
[15]Hui Q, Ma J, Song J, et al. In vitro and in vivo studies of antitumor effects of the recombinant immunotoxin MSH-PE38KDEL on melanoma[J]. Neoplasma, 2014, 61(4):392-400.
[16]杜靜, 張連峰, 秦川. 膽囊收縮素作用的研究進展[J]. 中國比較醫學雜志, 2007, 17(4):233-236.
[17]Sherman PJ, Separovic F, Bowie JH. The investigation of membrane binding by amphibian peptide agonists of CCK2R using(31)P and(2)H solid-state NMR[J]. Peptides, 2014, 55:98-102.
[18]Kossatz S, Behe M, Mansi R, et al. Multifactorial diagnostic NIR imaging of CCK2R expressing tumors[J]. Biomaterials, 2013, 34(21):5172-5180.
[19]Reubi JC. Targeting CCK receptors in human cancers[J]. Curr Top Med Chem, 2007, 7:3.
[20]Roy J, Putt KS, Oppola DS, et al. Assessment of cholecystokinin 2 receptor(CCK2R)in neoplastic tissue[J]. Oncotarget, 2016, 7(12):14605-14615.
[21]Gao S, Song J, Chen F, et al, A novel immunotoxin-rCCK8PE38 targeting of CCK-R overexpressed colon cancers[J]. J Drug Target, 2015, 23(5):462-468.
(責任編輯 馬鑫)
Characterization of Recombinant Toxin rCCK96-104PE38 Targeting Colon Cancer
ZHANG Song1LIU Xi-lin2LI Meng1CHANG Jiang1GAO Shi-qi1HU Pan1LIU Zeng-shan1
(1. Key Laboratory of Zoonosis,Research Ministry of Education,College of Veterinary Medicine,Jilin University,Changchun 130062;2. China-Japan Union Hospital of Jilin University,Changchun 130033)
This work aims to conduct the prokaryotic expression and purification of a novel recombinant toxin rCCK96-104PE38,and to verify the targeted killing effect on colon cancer cells. A reversed cholecystokinin(rCCK96-104)was conjunct to pseudomonas exotoxin(PE38)by gene amplified technology to construct a prokaryotic expression vector. Ni-NTA affinity chromatograph was used for purification. The anti-tumor ability of rCCK96-104PE38 was verified by in vitro cytotoxicity of colon cancer cells and vivo experiment with nude mice model. Results showed that the amplified gene of rCCK96-104PE38 was in correct sequence as designed,i.e.,the active expression was successfully achieved using prokaryotic expression system of pET-28a. The purified recombinant protein induced the apoptosis of colon cancer cells in vitro,and inhibited the tumor growth in nude mice model. Conclusively,it was successful to produce the recombinant toxin rCCK96-104PE38 in high purity and with no tags,the vitro and vivo experiments confirmed that it had inhibitory ability on colon cancer.
recombinant toxin;colon cancer;cholecystokinin;pseudomonas exotoxin
10.13560/j.cnki.biotech.bull.1985.2017.04.032
2016-12-21
國家青年科學基金項目(81401953),中國博士后科學基金面上項目(2014M561303),中國博士后科學基金特別資助項目(2015T80312),吉林省青年基金項目(20160520162JH),教育部博士點基金項目(20120061110078),吉林省科學技術廳計劃項目(20120966)
張嵩,男,碩士研究生,研究方向:動物性食品安全;E-mail:442557139@qq.com
柳增善,男,教授,研究方向:動物性食品安全,E-mail:zsliu1959@sohu.com;胡盼,女,講師,研究方向:動物性食品安全,E-mail:hupan84@163.com

