深海大洋最小含氧帶(OMZ)及其生態環境效應
李學剛, 宋金明, 袁華茂, 李 寧, 段麗琴, 王啟棟
?
深海大洋最小含氧帶(OMZ)及其生態環境效應
李學剛1, 2, 3, 宋金明1, 2, 3, 袁華茂1, 2, 3, 李 寧1, 2, 3, 段麗琴1, 2, 3, 王啟棟1
(1. 中國科學院 海洋研究所 海洋生態與環境科學重點實驗室, 山東 青島 266071; 2. 中國科學院大學, 北京 100049; 3. 青島海洋科學與技術國家實驗室 海洋生態與環境科學功能實驗室, 山東 青島 266237)
大洋最小含氧帶(Oxygen minimum zone, OMZ)通常是指大洋水體中氧含量缺乏的水層, 一般在水深200~1000 m之間, 其形成主要與厭氧細菌降解有機物導致的溶解氧消耗有關。但到目前為止對OMZ的濃度及水層都沒有一個統一的標準, 如以DO低于20 μmol/L為標準, 低于此標準的海域面積可占全球大洋面積的8%, 水體體積可達大洋體積的7%, 分布的主要區域包括東北太平洋(ENP)、東南太平洋(ESP)、阿拉伯海(AS)和孟加拉灣(BB)等海域。OMZ在全球海洋氮循環中有極為重要的作用, 在那里不同化學形態的氮(NH4+、NO2–、NO3–、N2O、N2)在微生物的參與下會發生多種復雜反應。在OMZ的上部混合層, 硝化作用將NH4+轉化為NO3–, 但在OMZ核心區主要進行著反硝化作用和厭氧氨氧化作用過程, 可以將NO3–、NO2–和NH4+轉化為氣態氮(如N2、N2O), 釋放到大氣中, 造成大洋生物可利用氮含量更加不足。大洋OMZ區的存在不僅影響浮游生物的豐度、分布、多樣性, 而且影響生物的生存和遷移行為, 但低氧區并不意味著是生物的貧乏區。同時, OMZ有利于有機質在沉積物中的保存, 影響Fe、Mn、S等對氧化還原環境敏感元素的遷移與轉化。盡管已有研究揭示了大洋OMZ對全球物質循環、大洋生態系統和極端環境下生物演化過程有重要作用, 但對大洋OMZ可能帶來的復雜生態環境效應的認識仍然很有限, 目前亟須深入探討大洋OMZ的形成過程及其生態環境效應。
最小含氧帶(Oxygen minimum zone, OMZ); 分布與成因; 生態環境效應; 大洋
氧是生物地球化學循環的關鍵要素, 也是大洋碳、氮循環的主要參與者, 海洋溶解氧含量的變化, 與全球氣候系統關系密切。自從Schmidt于1925年第一次報道在太平洋的巴拿馬遠洋海域存在“氧含量低到沒有”的遠洋海域以來, 相似條件的海域在東部南北太平洋、阿拉伯海或強度稍低的南大西洋的納米比亞外海相繼被發現[1]。于是Cline和Richards[2]在1972年提出最小含氧帶(Oxygen minimum zone, OMZ)的概念, 專指大洋水體中氧含量缺乏的水層。OMZ被認為在整個地質時期具有顯著的變化, 很可能改變了大洋攜帶碳、氮的能力, 因而備受關注。
OMZ在全球氮循環中起著極為重要的作用, 在那里氮的不同化學形態(NH4+、NO2–、NO3–、N2O、N2)在微生物的參與下會發生多種復雜反應。在氧化條件下, 也就是在OMZ的上邊界層, 硝化作用將NH4+轉化為NO3–, 但在氧含量不足的OMZ區, 反硝化作用和厭氧氨氧化作用可以將NO3–、NO2–和NH4+轉化為氣態氮(如N2、N2O), 并釋放到大氣中, 造成大洋氮含量更加不足。特別是OMZ也與影響氣候變化的主要氣體有關: (i)大洋產生的N2O有50%在這里形成; (ii)形成H2S和CH4, 尤其在OMZ的沉積物界面; (iii)限制大洋吸收大氣CO2(直接影響: 有機質礦化的最終產物——CO2的生成。間接影響:因氮的流失限制總初級生產, 從而影響對大氣CO2的吸收); (iv)因較高的微生物活性導致DMS的消耗。在化學方面, OMZ還與海水酸化、物質的還原等有關。另外, OMZ還可以看作是孕育生命的初期缺氧的大洋, OMZ區從高到低的不同氧含量的轉變可以模擬不同古環境條件下的生物多樣性。OMZ可以作為適應低氧環境的特殊生物躲避捕食或其他種競爭的避難所(如巨辮硫菌)在OMZ的下邊界甚至成了許多大型生物的棲息地。作為呼吸的屏障, OMZ也與生物的垂直遷移有關(如浮游動物)。在地質歷史時期, 海洋缺氧事件與大量物種的滅絕有關(如白堊紀中期)。OMZ對氣候和海洋生態系統的潛在影響取決于OMZ的強度。這種強度因各種原因而變化, 如氣候變化(因分層導致的交換不暢, O2溶解度的降低)、上升流和河流輸入或大氣沉降輸入的營養鹽或金屬所導致的自然和人為的施肥等。在當前條件下, 根據最近幾十年的觀察OMZ的強度一直在增加或加強。
從理論上來說, 低氧區的形成主要有兩個基本機制, 一是水體中的溶解氧被不斷消耗, 二是被消耗的溶解氧得不到及時的補充。對大洋來說, 消耗溶解氧的過程有很多, 如水體中有機物的降解、無機物的氧化反應、底泥耗氧及浮游植物呼吸作用等; 而氧的補充主要依靠大洋環流, 但目前有關海洋環流供氧和生物地球化學耗氧間可能的相互作用仍不清楚, 預測OMZ的位置、強度和他們的時空變化仍是一個具有挑戰性的任務。
由于大洋最小含氧帶(OMZ)具有獨特的水動力環境和氧含量特征, 其內部的生物活動和生物地球化學循環過程和周圍大洋明顯不同, 導致大洋最小含氧帶的研究越來越受到關注。本文通過對大洋最小含氧帶的分布、以及其對海洋碳、氮循環及生態系統的影響進行了系統總結, 以期對大洋最小含氧帶的生態環境效應有一個全面的認識。
1 大洋最小含氧帶的分布特征與成因
1.1 大洋最小含氧帶的分布
大洋最小含氧帶(Oxygen minimum zone, OMZ)通常是指大洋水體中溶解氧含量不足的水層, 但到目前為止還沒有一個統一的標準值來確定OMZ。常用的描述低氧環境的名詞有多種, 如亞氧化(Suboxia)是生物學家和生物地球化學家用來定義氧化物從O2到NO3–的轉換層, 閾值在0.7~20?μmol/kg之間。缺氧(Hypoxia)是指大型生物不能生存的含氧環境(8?μmol/kg), 但依據的生物不同最高可到40?μmol/kg, 如鳀魚。貧氧(Dysoxia,O2<4?μmol/kg) 和微氧(microxia, O2<1?μmol/kg) 主要與大型生物, 如魚類的氧需求有關。無氧(Anoxia, (O2<0.1?μmol/kg)被定義為由NO3–向硫酸鹽被還原的轉換的條件。不同的研究者往往由于研究的目的不同而選用不同的標準, 所以在文獻中描述的每一個OMZ的標準可能是不同的, 例如: Helly和 Levin[3]在研究全球陸架邊緣海低氧區時采用的臨界值是20?μmol/kg (0.5?ml/L), Karstensen等[4]在研究大西洋和太平洋最小含氧帶時使用的標準是低氧(suboxic level, 4.5 μmol/kg), 稍嚴格的標準(45?μmol/kg)和比較寬松的標準(90?μmol/kg)。
根據the World Ocean Atlas 2001(WOA01)調查數據, 全球大洋海水中溶解氧的含量分布如圖1所示,其中溶解氧含量小于20 μmol/kg的水體占全球海洋體積的1%, 而≤10 μmol/kg的水體占比<0.3%。但是Fuenzalida等[5]認為這個數值被嚴重低估了, 估值被低估了約90%。造成這種結果的原因之一就是數據量太少[6]。
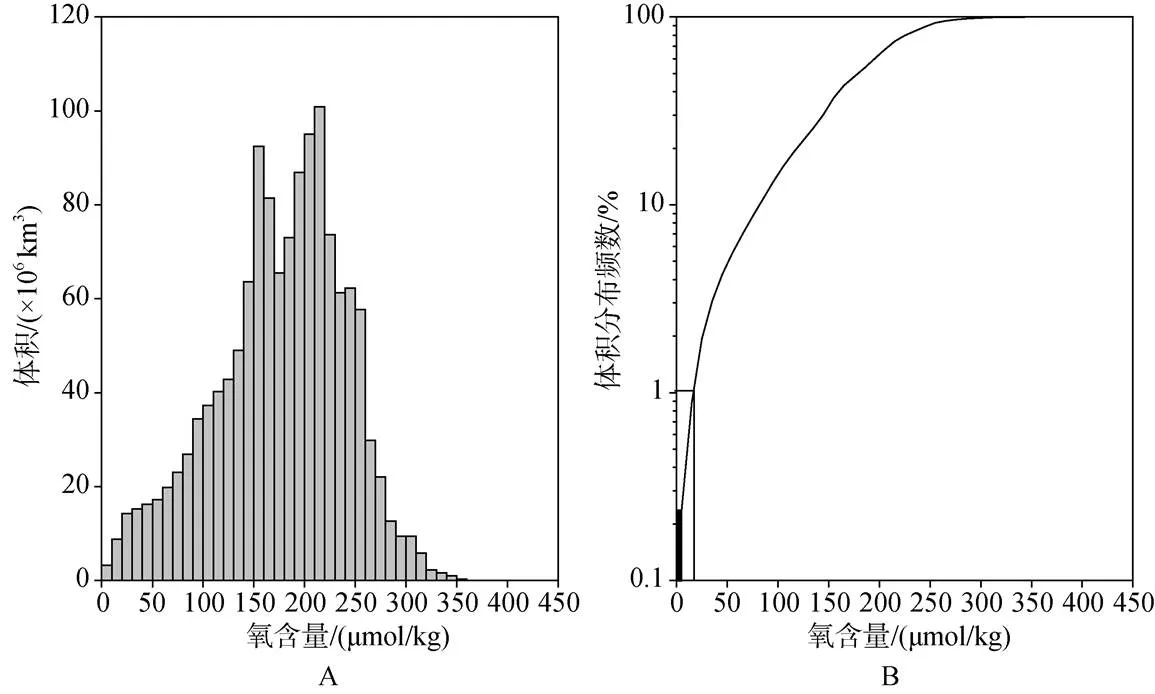
圖1 全球大洋中溶解洋含量的分布[6]
A: 體積分布; B: 體積分布頻數; 黑色方塊代表溶解氧含量≤10?μmol/kg的海水體積百分比; 白色方塊代表溶解氧含量≤20 μmol/kg的海水體積百分比
A: The volume Distribution of the dissolved oxygen content; B: Cumulative volume frequency for the oxygen concentration. The black box represents the percentage of waters with≤10 μmol/kg dissolved oxygen and the white box the percentage of waters with ≤20 μmol/kg.
Paulmier和Ruiz-Pino[2]根據WOA2005獲得的1894–2004年間全球大洋溶解氧數據繪制了全球OMZ分布圖(圖2), 可以看到大洋最小含氧帶普遍存在, 但以東北太平洋(ENP, Eastern North Pacific)、東南太平洋(ESP, Eastern South Pacific)、阿拉伯海(AS, Arabian Sea) 和孟加拉灣(BB, Bay of Bengal)含量最低。為O2含量低于20 μmol/kg的低氧區的面積可占全球大洋面積的8%, 水體體積可占大洋體積的7%。
圖2 O2含量最小層中氧的分布[2]
Fig. 2 O2distribution (μmol/kg) at depth where O2concen-tration is minimal[2]
比例尺棒中, 在0~20?μmol/kg的間隔為1?μmol/kg± 2?μmol/kg; 在30~340?μmol/kg的間隔為20?μmol/kg ± 2?μmol/kg。等深線是OMZ核心區深度, 間隔為100?m; AS: 阿拉伯海; BB: 孟加拉灣; BLS: 黑海; BS: 巴拉提克海; ESP東南太平洋; ENP: 東北太平洋; ESTNP: 熱帶北太平洋東南部; ETNP: 熱帶北太平洋東部; GA: 阿拉斯加灣; PG: 波斯灣; RS: 紅海; SWACM: 西南非洲陸架邊緣; WBS: 白令海西部
The color barscale corresponds to a 1?μmol/kg ± 2 μmol/kg interval between 0 and 20 μmol/ kg, and a 20 μmol/kg ± 2 μmol/kg interval between 20 and 340 μmol/kg. The isolines indicate the limit of the upper OMZ coredepth in meters with a 100-m contour interval. AS: Arabian Sea; BB: Bay of Bengal; BlS: Black Sea; BS: Baltic Sea; ESP: Eastern South Pacific; ENP: Eastern North Pacific; ESTNP: eastern subtropical North Pacific; ETNP: Eastern Tropical North Pacific; GA: Gulf of Alaska; PG: Persian Gulf; RS: Red Sea; SWACM: Southwest African continental margin; WBS: western Bering Sea.
特別是Karstensen等[4]的研究也證實, 在大西洋和太平洋的東赤道海域的100~900?m 深度廣泛分布著最小含氧帶(OMZ)。在東太平洋的300~500?m深度溶解氧含量達到最小值, 可低于1?μmol/kg, 形成亞氧化環境(suboxic, DO<4.5?μmol/kg)。在東大西洋不會形成亞氧化環境, 具有相對較高的最小溶解氧值; 在南大西洋約為17 μmol/kg, 在北大西洋約高于40?μmol/kg。當以45?μmol/kg(或90?μmol/kg)為OMZ溶解氧含量的上限時, 大約20%(40%) 的北太平洋水體為OMZ海域, 但在南太平洋OMZ的面積相對較小, 相對占比不到北太平洋的一半, 僅有7%(13%);南大西洋的OMZ區域占總海域的1%(7%), 北大西洋只有約0%(5%)。
根據最近幾十年的觀察, OMZ的強度在近年來一直在增加或加強。而根據“未來海洋”模型的預測, 在全球變暖條件下溶解氧的含量會降低, OMZ區域會擴展。但在季節或年際間仍然會有較大的波動, 如Helly和Levin[3]的調查發現, 在1997–1998年的厄爾尼諾期間, 秘魯和智利北部外海的東南太平洋OMZ區域(<20?μmol/kg)的面積縮減了60%。至于產生這種波動的原因仍不清楚。
大洋最小含氧帶(OMZ)根據其氧含量的垂直變化特征可以劃分為3個層: 上部氧躍層(UO, 氧含量由正常急劇減少)、核心層(OMZ, 氧含量最低)、下部氧躍層(LO, 氧含量從最低逐漸恢復)(圖3)。在OMZ的上方是混合層(ML, 氧含量較高), 下方是亞氧躍層(SO, 氧含量繼續升高)。其中, 上部氧躍層被認為是OMZ的引擎, 大部分高強度的礦化在那里發生, 導致OMZ增強, 同時也可發生硝化作用和反硝化作用; 在OMZ核心區, 反硝化作用等典型的厭氧過程在這里發生; 在下部氧躍層, 硝化作用是其主要過程, 總之, 在OMZ的不同區域因氧化還原的能力不同, 致使發生的地球化學反應不同。但K?llner等[7]在熱帶北大西洋氧最小帶進行的示蹤擴散實驗發現, OMZ核心區域氧的擴散速率和氧躍層區域并沒有明顯的降低。
1.2 OMZ形成的原因
大洋中最小含氧帶(OMZ)一般在水深200~1000?m, 其在大洋的形成主要與厭氧細菌降解有機物導致氧的消耗, 而所消耗的氧又得不到及時補充有關。但不同海域導致氧消耗和補充的具體過程又有所不同。
在熱帶海域, 最小含氧帶(OMZ)主要分布在水交換不暢的區域。在印度洋OMZ主要分布在阿拉伯海和孟加拉灣, 那里水交換時間為30年或更長。阿拉伯海OMZ(ASOMZ)是世界上熱帶海域第二大的OMZ, 主要分布在200~1000?m水深, 氧含量低于5?μmol/kg, 遠低于發生反硝化作用發生的含量, 氧含量最低的區域對應于初級生產力最高的區域。孟加拉灣OMZ (BBOMZ)的強度小于阿拉伯海OMZ, 氧含量高于發生反硝化作用的水平。次表層水如果沒有氧的補充, 沉降到次表層水中有機碎屑的持續分解將消耗光水層中所有的氧。阿拉伯海和孟加拉灣中的氧主要來自南半球, 沿南極繞極流北部邊緣形成的高溶解氧的中層水貫穿整個印度洋。其他來源包括來自波斯灣和紅海的高氧水, 波斯灣水可進入阿拉伯海溫躍層的下部, 而紅海水可到達中層(300~1000?m)。另外, 印度尼西亞貫穿流也影響印度洋的上層水, 包括影響阿拉伯海的溫躍層特征, 中尺度渦也可能促進氧的交換與擴散[9]。除了位于水交換不暢的區域外, 到目前為止對保持印度洋OMZ的關鍵過程仍沒有定論。如是什么物理和生物過程決定了低氧區的強度和結構?環流和渦流在高氧水的擴散和混合過程中起什么作用?
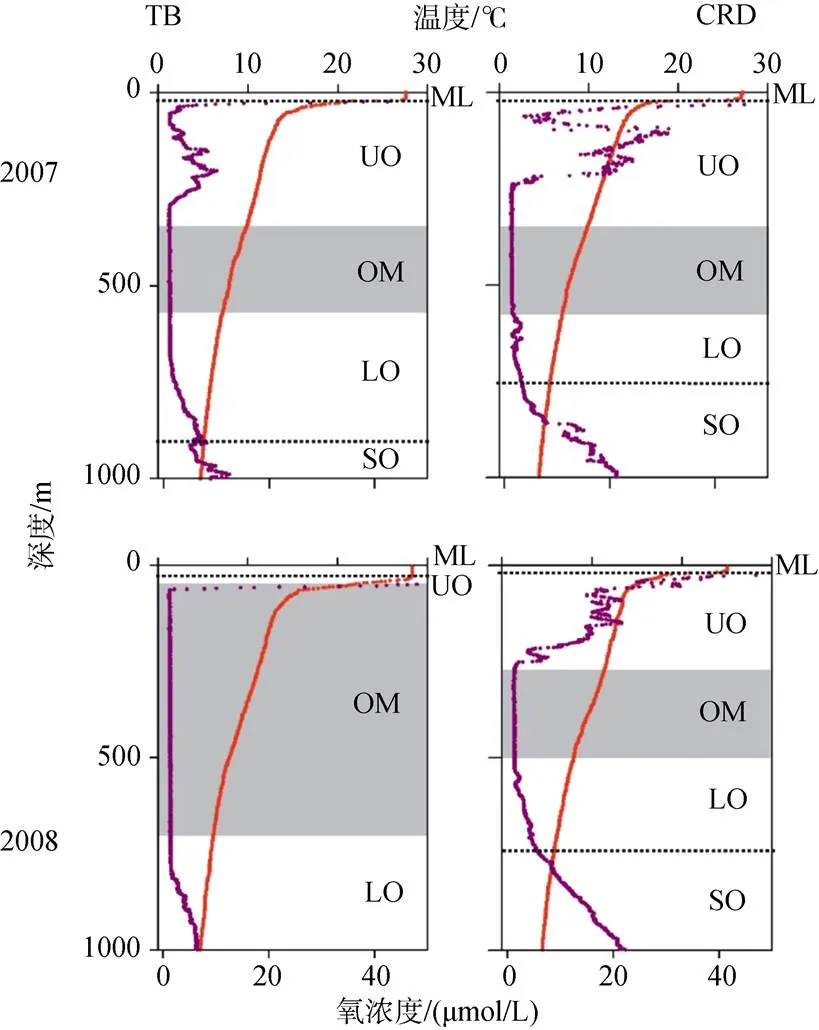
圖3 OMZ的垂直分區[8]
紅色曲線為溫度曲線, 紫色曲線為溶解氧曲線; ML混合層、UO上部氧躍層、OM 核心低氧帶、LO下部氧躍層、SO亞氧躍層
The red lines indicate the temperature, the purple lines indicate the dissolved oxygen; ML: mixed layer; UO: Upper oxycline; OM: OMZ core; LO: Lower oxycline; SO: Suboxycline
除了水文條件外, 生物是OMZ形成的關鍵因素之一。當地有機質的微生物降解是OMZ溶解氧消耗的主要因素, 而浮游動物的呼吸也是一個因素。按平均消耗量, 有機質的微生物降解消耗約80%的氧, 浮游動物呼吸消耗約20%的氧[10]。
2 大洋最小含氧帶的生態環境效應
2.1 大洋最小含氧帶對氮循環的影響
除了溶解氧濃度低外, OMZ的另一個特征是相對于無機磷來說更加缺乏無機氮。在表層形成的有相對固定氮磷比(Redfield比)的有機質沉降和礦化后, 釋放出相同比例的N和P, 所以大洋中氮磷濃度的摩爾比接近有機質中的比值(16︰1)。但是, 在OMZ區, 通過異養反硝化作用和厭氧氨氧化作用生成N2而逸出, 導致無機氮(主要是NO2–+NO3–)顯著偏離Redfield比, 造成氮缺乏。
OMZ在全球氮循環中起著關鍵作用, 在那里氮的多種化學形態(NH4+、NO2–、NO3–、N2O、N2)在微生物的參與下會發生多種復雜反應。在氧化條件下, 也就是在OMZ的上部混合層, 硝化作用將NH4+轉化為NO3–, 但是OMZ主要與反硝化作用有關。反硝化作用將NO3–轉化為氣態氮(如N2、N2O), 可以釋放到大氣中, 造成大洋氮含量更加不足。但最近發現的厭氧氨氧化過程, 在OMZ區無論是在沉積物還是水體中都可以將NO2–和NH4+轉化為氮氣。Farias等[11]研究了OMZ對N2O循環過程的影響, 發現水體中N2O和NO3–的最大值位置與緊鄰真光層的強烈的氧躍層有關。NO2–在氧躍層下部積累, 可以達到9?μmol/L。在氧躍層的上部即混合層底部和氧躍層的中間點之間, O2從250?μmol/L下降到50?μmol/L, O2和NO3–都有較大的濃度梯度(二者是反向的), 表明在真光層中的硝化作用產生N2O和NO3–; 在氧躍層的下部即OMZ的上邊界區, O2從50?μmol/kg下降到11?μmol/kg, NO3–開始被還原, 會生成約41%~68%的N2O, 在這一層N2O循環中涉及硝化作用和NO3–的還原作用。在OMZ核心區, O2的濃度比較穩定(O2<11?μmol/kg), 在這一層N2O和NO3–持續減少, 但生成大量的NO2–。
厭氧氨氧化是氨被NO2–或NO3–厭氧氧化為N2的過程, 在氧缺乏體系中會導致氮的流失。厭氧氨氧化是被一組屬于浮霉菌門的特殊菌完成的, 但目前對厭氧氨氧化菌的分布、活動性和控制因素了解不多[12]。Galan等[12]公布了智利北部海域厭氧氨氧化菌的系統進化的多樣性、垂直分布和活動性特征, 該海域是第一個被報道的東太平洋OMZ。他們發現厭氧氨氧化菌的微觀多樣性比早前報道的高, 他們描述了一個新的代表性的海洋微生物系統發生世系。在秘魯和阿拉伯海也有類似的報道。Galan等[12]也定量報道了這些細菌的豐度、垂直分布和活性, 在OMZ的上層部分達到一個峰值, 可能與這一層強烈的生物地球化學循環有關。
在厭氧氨氧化發現之前, 氨的生物氧化被認為是在硝化過程中被厭氧氨氧化菌專門發生的。然而, 因為這一過程需要氧, 所以被認為是在氧躍層而不是在OMZ核心區發生的硝化作用。但分子學研究顯示氨氧化細菌基因在表層氧化性水體和OMZ海域都存在。Molina和Farias[13]發現, 無論是在氧躍層還是在OMZ核心區的硝化速率, 都足以滿足氨氧化和二氧化碳暗固定(dark carbon fixation)的需要。Molina和Far?as[13]對智利北部熱帶南太平洋低氧區的研究發現, 在核心低氧區, 有氧氨氧化速率高于低氧區上部的氧躍層, 通過有氧氨氧化固定的碳占弱光層總固碳量的33%~57%, NO2–在核心低氧區和其上部的氧躍層消耗較高, 但有氧氨氧化可以貢獻8%~ 76%的NO2–產量, 也就是說對反硝化作用貢獻較大。總之, 有氧氨氧化在低氧帶及其上部邊界層中的氮和碳循環中起著重要的作用。
雖然厭氧氨氧化作用對氮損失貢獻的確很大, 但反硝化作用仍然是低氧區氮損失的重要途徑, 在一些區域內反硝化作用仍占主導地位。Dalsgaard等[14]利用15N 示蹤法研究了南太平洋東部的智利和秘魯沿岸海域的N2O和N2的來源, 發現72%的N2是由反硝化作用產生的。Mashifane等[15]對非洲西南沿岸本格拉OMZ區的研究認為, 硝化作用和厭氧氨氧化、反硝化作用對本格拉海域的高氮通量的貢獻相當。
Bohlen 等[16]的研究發現, 在秘魯陸架和上陸坡(水深80~260?m, 低氧帶)沉積物中存在大面積的細菌席, 硝酸鹽異化還原成氨(DNRA)在總氮的轉化中占主導地位, 大約有≥65%的NO3–+NO2–被沉積物吸收, 但沉積物并不是溶解無機氮(NO3–+NO2–+NH4+)的匯, 因為DNRA將NO3–, 甚至部分NO2–還原為NH4+, 因此, 由于相對低的反硝化速率和較高的DNRA釋放氨的速率和有機質氨化速率, 陸架和上陸坡沉積物成為DIN的再循環場所。這一發現與目前的主流觀點——OMZ下覆沉積物是DIN的強匯相反。在這里, 反硝化作用是主要過程, 可移除占沉積物中55%~73%的NO3–和NO2–, DNRA和厭氧氨氧化占剩余的部分。厭氧氨氧化在陸架和陸坡并不算重要, 但在水深1 000?m處可貢獻總生成氮的62%。這一研究結果表明海洋沉積物是DIN的匯還是再循環場所主要由氧化態氮(NO3–, NO2–)進行DNRA和反硝化過程來控制, 所以在低氧帶氧化態氮的底層吸收速率對海洋環境中氮的虧損并不是必要的。
世界大洋中的最小含氧帶(OMZ)具有強烈的厭氧氮的轉化, 如最大的OMZ——阿拉伯海最小含氧帶中氮損失的30%~50%為氮的厭氧轉化。在氧含量很低的水體中通過N2生產而造成氮的流失被認為是造成過量氮氣和硝酸鹽匱乏的主要原因。通過添加15NH4+、15NO2–、46N2O的對阿拉伯海OMZ中的海水進行示蹤培養實驗, 發現反硝化作用速率與海水中NO2–濃度密切相關, 向海水中添加有機質和氨并不能促進反硝化速率, 反硝化作用是阿拉伯海OMZ產生N2的主要作用[17]。
De Pol-Holz等[18]分析了沉積物和水體中的N穩定同位素, 發現沉積物中的δ15N具有強烈的緯度效應, 其沿智利海岸向北不斷增加。他們認為智利沿岸沉積物中的δ15N在41°S以南主要由浮游植物的同化作用控制, 在30°S以北主要由反硝化作用控制。Schwartz等[19]測定了巴基斯坦邊緣海OMZ的沉積反硝化作用, 發現在整個阿拉伯海OMZ和緊鄰海域(如400?m和1 200?m)內沉積反硝化作用是一個持續過程。在西南季風期間沉積反硝化作用加強。該區域沉積反硝化作用速率與其他陸架環境相當, 但高于深海。整個巴基斯坦邊緣海OMZ的沉積反硝化通量可達1.1~10.5 Tg/a。
OMZ無論在水體還是沉積物都是氮流失的關鍵區域。Sommer等[20]發現秘魯(OMZ)的O2含量在約500?m處最低, 氧含量在檢測限以下。這里底部氮循環存在明顯的不平衡, 沉積物釋放出大量的NH4+, 遠遠超過氨化所形成的NH4+, 他們認為這是硝酸鹽異化還原成銨(DNRA)造成的。秘魯OMZ中的底部氮、硫循環表現出特別易受底層水中O2、NO3–和NO2–波動的影響, 當NO3–和NO2–被消耗后將加強低氧區的作用。
OMZ被認為是溫室氣體的強源N2O和/或CO2潛在的源。Paulmier等[21]對智利東南太平洋OMZ(大洋中強度最大的淺水OMZ之一)中N2O和CO2的海氣界面通量進行了估算, 發現智利OMZ是大洋強的N2O和CO2的源。N2O的平均通量是太平洋和印度洋開放大洋區域OMZ的5~10倍。高溫室氣體源區與近岸富含N2O和CO2的上升流有關。
熱帶東南太平洋具有強的近岸上升流、狹窄的大陸架和廣泛分布的中層水最小含氧帶(OMZ)。這種水動力特征決定了中層水物質向表層的長久輸送, 使富含營養鹽的表層水具有較低的無機N︰P。為了研究影響上升流的OMZ對浮游植物生長、元素和生物組成的影響, Franz等[22]研究了從狹窄大陸架上部的上升流區到具有良好分層的大洋東部邊界的廣大東南熱帶太平洋區域中的水動力和生物地球化學參數, 沿岸上升流區的新生產力主要由大型浮游植物(如硅藻)貢獻, 他們通常具有較低的N︰P(<16︰1)。在整個海域硝酸鹽和磷酸鹽并不限制浮游植物的生長, 但在遠岸海域, 浮游植物的生長受硅限制。位于陸架坡折處上方次表層水處的溫躍層葉綠素豐度最高, 與微型-微微型(聚球藻、鞭毛蟲)和小型浮游植物的分布一致, 在溫躍層N︰P比接近Redfield比值。在分層的寬闊大洋具有高的PON︰POP(20︰1), 與微型藍細菌——原氯球藻的豐度一致。過量磷酸鹽的存在并沒有促進固氮浮游植物的生長, 在OMZ內生成的過量磷酸鹽中, 大部分是被表層水中非Redfield比值的大型浮游植物消耗的。
2.2 OMZ對有機質降解的影響
雖然氧含量是影響有機質的降解的主要因素, 但在OMZ區有機質的降解過程中氧的具體作用仍不清楚。有機質的厭氧降解通常被認為比微生物有氧降解緩慢, 這是因為在陸架邊緣缺氧區下面的有機質含量比較豐富, 同時厭氧過程產生的能量少于有氧過程。為了估算有氧和低氧條件下活性有機質的降解動力學過程, Pantoja等[23]利用沉積物捕集器研究了智利北部OMZ區顆粒有機碳的降解特征, 發現絕大部分(82%)光合作用產生的蛋白質在上部30?m內降解, 另外15%在30~300?m (弱氧化層內)降解, 只有大約1%能到達1 200?m深的表層沉積物。沉降的蛋白質在上部300?m仍保持著降解活性, 可以作為新鮮物質的降解指數和降解速率常數的指示指標。他們認為顆粒蛋白質的降解不受30~300?m間的弱氧化層存在的影響, 這一結論與顆粒蛋白質的降解受細胞外的蛋白水解酶控制而不依賴于氧的模式一致。活性溶解有機質在智利氧化和亞氧化海水中具有相似的微生物降解速率。肽水解和氨基酸吸收速率在氧被消耗的水體中并不低, 水解速率在上部20?m為65~160?nmol/(L·h), 在100~300?m(氧消耗區)為8~28?nmol/(L·h), 在600~800?m為14~19 nmol/(L·h);在同一深度溶解自由氨基酸吸收率分別為9~26、3~17和6?nmol/(L·h)[24]。這一結果與墨西哥灣浮游植物產生的活性物質的降解速率一致, 說明在高或低溶解氧含量水體中降解速率的不同可能是底物活動性不同造成的。對比水解和吸收速率的不同可以發現微生物肽降解的速率與氨基酸吸收速率接近或快一些, 肽水解不是活動大分子物質完成再礦化的限制速率。低氧水每小時可以處理大約10?t肽, 在表層氧水體中可以處理雙倍的肽。在OMZ, 上升到表層的溶解有機質的低溶解度可能影響碳平衡。在受洪堡流系影響的高生產力的智利沿岸大洋的一個顯著特征就是存在OMZ, 溶解有機質的很大一部分在OMZ被處理。浮游動物進出OMZ是將大量新生產的碳輸入OMZ區最有效的機制[25]。Espinosa等[26]對智利水體懸浮顆粒物中來自脂肪酸甲酯的細菌磷脂的分析發現, Antofagasta外海水中脂肪酸甲酯的垂直分布不能說明微生物活性的隔離區, 可能因為風生沿岸上升流改變了環境特征, 使不同微生物群落混合在一起。智利北部水體中脂質生物標志物的垂直分布說明硫酸鹽還原菌產生的脂質生物標志物不僅僅限于OMZ。這種混合可能是深部富營養鹽及CO2飽和的冷水傳輸造成的垂直混合的結果。
海水中的顆粒有機碳沉降到海底后會繼續發生著各種變化, 對其積累/保存進行的研究發現, OMZ區氧濃度與沉積物中有機質的保存密切相關。在研究較多的阿拉伯海OMZ區, 中陸坡沉積物受OMZ的影響使有機碳得以更好地沉積, 從而使這一區域成為世界大洋沉積有機碳含量最高的區域[27]。在水深300~1000?m的陡峭陸坡的海底, 因缺乏大型底棲生物、游泳生物, 故無生物擾動, 有機碳含量高、沉積層序良好等都說明該區域為近無氧條件[28]。位于低氧帶內比低氧帶外的沉積物具有顯著低的氧化還原環境、高的碳酸鹽含量、以及不同的巖土特征和不同的生物擾動特征, 而且這些差異與低氧程度和水深有關。在低氧帶內, Eh、pH和碳酸鹽含量隨水深而增加, 而總有機質(TOM)和含水率隨水深降低[29]。Weijden等[30]認為OMZ內部和OMZ下方沉積物中有機質的生物和微生物過程不同而導致二者存在有機質保存的差異。在氧含量較高的條件下, 生物擾動和活性Fe、Mn氧化物均是影響微生物介導的有機質降解的重要因素。而阿拉伯海OMZ下方的沉積物在低溶解氧條件下, 不僅減少了有機質的好氧礦化作用, 而且減少了底棲生物活動引起的OM降解作用和微生物利用Mn、Fe氧化物作為電子受體的低氧礦化作用。Vandewiele等[31]發現OMZ沉積物中有機碳含量和有機碳與礦物表面積的比值(OC/SA)在核心低氧區和低氧區下轉換區明顯升高, 而且這兩個區域的沉積物含有更多的活性有機質, 比如含有更高濃度的水解性氨基酸(THAA), THAA中的氮對總氮的貢獻更大。雖然沉積物中的有機質都發生了礦化, 但低氧區上部轉換區和低氧區下部沉積物中的有機質分解更多。
2.3 OMZ對金屬遷移的影響
OMZ的生態環境可由氧化性變為弱氧化性、甚至是無氧狀態的還原性, 而對氧化還原環境最為敏感的元素, 如Fe、Mn、S等受OMZ的影響最為顯著。例如, 東熱帶南太平洋海域具有較高的固氮速率, 但表層Fe常常太低不足以支撐固氮生物的生長, Kondo等[32]發現該區域OMZ內的Fe(II), 約占溶解鐵的8%~68%, OMZ在Fe向上層400?m水體的輸送過程中起著重要作用。在阿拉伯海的OMZ帶沒有檢測到游離的H2S, 但檢測到了金屬硫化物。相對于表層海水, OMZ帶內的硫化物含量稍高, 可能與有機質降解釋放出硫有關。在低濃度的金屬和S2–條件下, 硫化合物的存在形式有兩種。首先, 金屬如Mn、Fe、Co、Ni形成硫氫化物(HS–), 活動性強, 易于參加反應; 其次, 像Cu、Zn一類的金屬與S2–形成多核化合物, 可以從穩定到易于分解, 比S2–(HS–)和活動的金屬硫氫化物的活動性弱。Zn、Cu硫化物對低氧海水中H2S的存在至關重要[33]。
海水中的錳的地球化學特征受其氧化還原特性控制, 其中Mn(II)可溶于水, 而Mn(IV)形式不溶于水, 但二者通過一系列的氧化還原過程可以相互轉化, 溶解Mn在還原條件下可以聚集而在氧化環境下被消耗。在秘魯上升流區——以強還原條件下寬廣的大陸架和遠離海岸的強最小含氧帶為特征, 是熱帶南太平洋東部潛在的最大錳的來源。但Vedamati等[34]對秘魯上升流和OMZ中錳、氧和氮循環的研究發現令人詫異, 即溶解錳的消耗是在秘魯大陸架較為還原的條件下進行的, 溶解錳的含量在近岸表層水中增加, 說明來自秘魯大陸架海水的水平運移不是錳的主要來源, 在氧躍層而不是OMZ帶內的次表層水中觀察到錳的最大含量, 說明錳來自有機質的礦化釋放, 而不是錳氧化物的還原。大陸架水體中錳含量比預期的低說明從陸源河流輸入的錳是有限的, 其行為與鐵明顯不同, 鐵在陸架水體中含量較高而且與氧化還原過程密切相關。Lewis和Luther III[35]發現阿拉伯海的OMZ強烈影響了錳的分布。在OMZ, 可以觀察到兩個明顯的溶解錳最大值, 分別在200~ 300?m 和600?m。后者的峰值大約可以達到6?nmol/L。這個中等深度的最大值與OMZ的低氧核心([O2] <2 μmol/kg)有關。上部溶解錳最大值(200~300?m深)比600 m處的峰值分布寬的多, 溶解錳的濃度在3~ 8 nmol/L, 與NO2–的次最大值有關, 都處于反硝化區。霧狀層也與這個深度有關。顆粒錳在相同的深度也表現出類似的最小濃度、低Mn/Al和活性錳/難溶錳比值, 表明錳氫氧化物的還原性溶解。所有的觀測都表明原位微生物降解過程可能是OMZ上層溶解錳最主要的源, 而對深層水來說水平輸送更重要。
Chakraborty等[36]研究了阿拉伯海OMZ帶內外沉積物中金屬存在的形式的變化。他們利用連續浸取法將沉積物中的金屬分為水溶態、離子交換和碳酸鹽態、Fe–Mn氧化物態、有機態和殘渣態, 研究了底層水中溶解氧含量的變化對Cu、Zn等金屬存在狀態的影響。底層水溶解氧水平的變化(富氧到缺氧再到低氧)造成了不同結合態金屬的再分配。沉積物中銅的活性隨底層水溶解氧濃度的降低而逐漸降低, 即穩定性增加。底層水溶解氧含量的降低加強了Cu與沉積物中有機質的聯系。但是Pb與Fe–Mn氧化物相的相關性隨上覆水中溶解氧濃度的降低而降低。沉積物中Pb配合物的活動性隨底層水中氧濃度的降低而增加。底層水中氧的濃度是控制沉積物中Cu、Pb配合物穩定性和活動性的一個關鍵因素。在阿拉伯低氧帶沉積物中與有機質和Fe–Mn氧化物態結合的Cu、Pb是沉積物中最主要的存在形式。Chakraborty等[37]發現阿拉伯海低氧區有機碳的含量隨上覆底層水DO水平的降低而增加, 而有機質含量的增加也會導致沉積物中Hg積累的增加。但上覆底層水中DO的消耗不會加強表層沉積物中甲基汞的含量。沉積物中甲基汞含量隨有機質和總汞含量的增加而增加, 有機質是控制沉積物中Hg分布和存在形態的關鍵因子, 沉積物中有機質含量的增加會導致有機汞含量的增加, 但甲基化的速率會降低。總的來說有機質控制了阿拉伯低氧區內沉積物中甲基汞的行為。
2.4 大洋最小含氧帶對生態系統的影響
OMZ廣泛分布于世界大洋的中層水, 強烈影響了浮游生物和底棲生物的分布和多樣性特征, 因此, 其對生態系統的影響也是OMZ研究的重點。Wishner等[8]認為全球氣候變化或自然氣候波動將使大洋OMZ在全球范圍內的空間和垂直分布上進一步擴展, 這種擴展將對生態系統結構和功能產生更加顯著的影響。
2.4.1 OMZ影響生物的分布
對東赤道北太平洋的研究發現, 無論OMZ的強度如何, 溫躍層是浮游動物生物量最高的區域, 下部氧躍層具有獨特的浮游動物組合和第二生物量峰值, 與特定的氧濃度2?μmol/kg密切相關。對阿曼近海OMZ的研究也發現浮游生物和弱游泳生物的生物量在上層100 m水深內的含量最高, 這可能與該層具有較高的氧含量有關。在這一層以膠質生物為主, 還含有一群游泳的蟹類。相當大量的蛇鼻魚、發光魚和十足目甲殼動物白天聚集在氧躍層的下方, 但在晚上遷移到表層[38]。Williams等[39]的研究發現熱帶北太平洋東部(ETNP)浮游植物的同位素組成和營養(級)生態的水平和垂直分布明顯受低氧帶的控制。最顯著的是同位素組成在低氧帶的上下界面處有明顯垂直梯度。在低氧帶的上部δ13C明顯偏低, 可能與被浮游動物攝食的化能自養生物有關。在浮游動物的δ15N在下部氧躍層內隨深度有一個顯著的降低, 說明在緊靠核心低氧帶的下方營養物質增加。淺層POM(0~110?m)是混合層、上部氧躍層、核心低氧帶浮游動物最重要的食物源, 而深層POM是下部氧躍層浮游動物最主要的食物來源(除了季節性遷移的橈足類)。
浮游動物的分布與溶解氧濃度和梯度關系密切。Saltzman和Wishner[40-41]對東赤道太平洋一海山OMZ浮游動物的分布進行了研究, 發現OMZ是影響溫躍層下浮游動物類群垂直分布的重要因素, 在OMZ底層界面區域出現浮游動物第二峰值似乎是OMZ區域的獨特現象。不同類群組具有4種垂直分布模式, 說明他們具有不同的低氧耐受能力。最常見的垂直分布模式是在混合層和溫度躍層區有最大豐度, 在OMZ下界面區(600~1000?m)出現第二峰值,、、、和是這種分布模式。低氧濃度不限制這些物種的分布, 因為他們在整個OMZ都可出現。第二種垂直分布模式是浮游動物在溫躍層和OMZ之間垂直遷移的結果,表現出這種分布模式, 晚上在溫躍層區具有最大豐度, 白天在OMZ核心區豐度最大。特別是在在OMZ下界面區(600~1000?m)出現第二峰值。第三種類型的分布是橈足類在OMZ的上、下界面區豐度高。、和就是這種分布模式的主要類群, 他們在混合層中缺失或在混合層和上部OMZ具有類似的豐度。第四種分布模式是橈足類在白天和夜晚主要生活在OMZ上方。在其他OMZ區也發現類似的分布, 表明低氧是主要控制因素。
2.4.2 OMZ影響生物的遷移
Antezana[42]對秘魯寒流生態系統中OMZ區物種晝夜垂直遷移的特性進行了研究, 發現OMZ決定了遷移強度:只向淺層氧躍層遷移, 而、、和則向OMZ的核心區遷移,向OMZ核心區的底部遷移。在定時遷移和持續遷移中的向上、向下和在淺層或深層的駐留時間也有一些差異。、和在日出時正常向下遷移, 在日落時向上遷移。和在日出時也向下遷移, 但是在下午就開始向上遷移, 縮短了他們在深層水的駐留時間表現出在淺層水中的最長駐留時間和最短的垂直遷移路徑。浮游生物定期遷入和遷出OMZ區在白天和夜晚的垂直分層和差異說明群落結構建立在一個通過避免在時間和空間上共存而形成的棲息地分離機制。Escribano等[25]在智利北部也發現類似的分布規律, 如大型橈足類生活在氧躍層的下部, 可通過晝夜遷移進入OMZ, 而豐度很大的在表層水和OMZ核心(200?m)進行晝夜遷移, 甚至穿越OMZ。
2.4.3 不同生物對OMZ的響應不同
Cook等[43]發現低溶解氧對線蟲的分布沒有影響, 而食物則是影響線蟲分布的主要因素。東熱帶太平洋獨有的大型深海魷魚——巨型魷魚能垂直遷移進入深海OMZ, 但在低氧區魷魚的代謝率降低(68%)[44]。Wishner等[45]發現在阿拉伯海OMZ核心區、下部氧躍層和氧躍層底部具有不同的橈足類群落。橈足類在含氧的環境中具有最大的多樣性, 物種豐度的排序和下部氧躍層和氧躍層底部類似。在OMZ核心區一些種類缺失或相當少。橈足類在OMZ的垂直分帶受低氧、潛在捕食者和潛在食物源的綜合控制。總體來說, 生物的粒徑越小越有利于在低氧區生存, 因為較小的生物能更好的滿足自身新陳代謝的需求[46]。但Teuber等[47]認為無論是深度還是當前的OMZ的低氧條件對浮游動物的呼吸都沒有很強的和持久的影響。
2.4.4 低氧區并不意味著是生物貧乏區
雖然從理論上來講, 低氧不利于生物的生長與生存, 但實際調查結果經常有令人詫異的發現。如Davies等人[48]對東赤道太平洋墨西哥外海從OMZ的上邊界(約0.2?mL/L)到海表的仔魚棲息地的分布進行了分析, 發現氧最低棲息地大部分位于溫躍層下面的低氧帶(<1?mL/L; 約70?m深)和無氧區(<0.2?mL/L,約80?m深), 而且在低氧棲息地具有最多的種和最高的仔魚豐度。同樣, 一般認為低氧區底棲生物的豐度和多樣性都會大大降低, 但在OMZ區底棲生物對低氧的響應和我們想象的完全不同。例如智利中部Concepcion Bay陸架和陸坡的OMZ(122~206?m)大型生物密度較高(16478~21381 individualsm2), 69%~89%的生物為軟體生物, 在陸架拐點處(206 m)生物密度最高(21381 individuals/m2), 但生物量最低(16.95 g wet weight/m2), 生物個體最小(0.07 mg C/indivi-duals),多毛類占總生物豐度71%、甲殼類占 16%、軟體生物只占2%。在OMZ下方的陸坡中部(約–840?m)甲殼動物49%, 多毛類占43%。雖然有文獻表明在OMZ區生物的密度和生物量都低于OMZ下方的區域, 但在該調查區只有生物密度較低。生物量的分布隨水深呈凹型, 高值出現在OMZ的上部邊緣(122 m)和下方(840 m)。說明大型生物的結構與底層溶解氧濃度、葉綠素a、脫鎂葉綠酸和硫化物濃度有關, 與沉積物的粒度、C、N、泥、孔隙度、氧化還原條件、底層水溫度等無關[49]。在巴基斯坦半深邊緣海OMZ區大型動物的多樣性、優勢種和洞穴數量在氧濃度(5~9?μmol/kg)時達到極限, 在這個濃度之下表現為較少的生物和較好的沉積層序, 在這個濃度之上表現為較多生物和充分擾動的沉積物。長久洞穴的形成和腐食性決定了OMZ區大型底棲生物的生活方式, 允許沉積層在高生物密度和生物量的條件下存在并保留下來。在永久嚴重缺氧區, 食物的可利用性決定了動物的豐度和生物結構的深度。在巴基斯坦邊緣海氧影響模式的多樣性和主導性及其與有機質的相互作用決定了動物區系的分布特征[50]。Levin等[51]對阿拉伯海OMZ內部和下部大型底棲生物的調查也發現了類似的規律, OMZ內的生物密度和生物量要比OMZ下部的海域高, 且個體大小沒有顯著差異。但Hughes等[52]對巴基斯坦邊緣海OMZ大型底棲生物的研究發現, 大型底棲生物的密度在OMZ淺水140m水深站位最高, 但在OMZ下邊界(1200?m)密度并未升高, 在OMZ核心(300?m)相當低, 這與阿拉伯其他區域OMZ的調查結果明顯不同, 說明在OMZ大型底棲生物的組成受局地因素的影響更重要。另外, Zettler等[53]對納米比亞北部上升流區域底棲生物的調查發現, 與近岸高生物多樣性的區域相比, OMZ底棲生物種類的數量急劇降低, 但是在氧含量0.06~0.88?mL/L的區域內, 生物密度和生物量非常高, 也說明OMZ大型底棲生物的組成與分布受局地因素的影響。
3 大洋最小含氧帶(OMZ)研究之思考
大洋最小含氧帶(OMZ)一般在水深200~1000?m, 其在大洋的形成主要與厭氧細菌降解有機物導致氧的消耗有關。在深度>1000 m處, 大洋再次復氧, 主要因底層流帶來冷的、富氧、極地水有關。在大陸平臺, 與OMZ接觸的沉積物也是缺氧環境, 有利于埋藏有機質的保存。OMZ在控制全球生態群落結構方面起著重要作用。在這一區帶內重要的代謝活動控制著幾種與生命有關的元素的循環, 如氮循環。在缺氧帶, 生物必須發展出特殊的生存策略, 如反硝化菌、異養厭氧菌能通過反硝化作用消耗硝酸鹽中的氧, 后者是將NO3–轉化為N2的主要代謝過程, 與全球大氣圈-水圈中氮循環有關。另外, 對生活在OMZ的原核生物群落的研究還可以發現能在類似缺氧的環境中生存的特殊生命演化和特殊的分解/代謝活動的重要線索。雖然當前已認識到大洋OMZ在全球物質循環、大洋生態系統和極端環境下生物演化的重要作用, 但對大洋OMZ的認識仍存在許多疑問, 未來幾年應當在如下幾個方面進行重點研究。
(1) 大洋最小氧帶(OMZ)標準的確定。由于當前獲得的大洋溶解氧的數據較少, OMZ標準的選取常常依賴于研究者的興趣(如低氧生物化學過程研究采用的是O2濃度低于20?μmol/kg, 但是物理過程認為這又包括了弱氧化和還原條件), 而且當前在每一個OMZ采取的標準可能是不同的, 有的標準過于苛刻, 使部分溶解氧含量較低的區域不在OMZ的范圍之內。所以建立統一的OMZ的標準是對大洋OMZ進行深入研究的基礎, 也是必須完成的工作。
(2) 大洋最小氧帶(OMZ)的成因。雖然從理論上來說OMZ的形成是中層溶解氧被消耗又得不到及時補充造成的, 但具體到每一個海域又有其特殊成因, 如消耗溶解氧的有機質從哪里來?表層生產力的年變化強度較大, 為什么OMZ的年變化較弱?是什么物理和生物過程決定了低氧區的強度和結構?環流和渦流在高氧水的擴散和混合過程中起什么作用?大洋OMZ強度和全球變化如何相互作用?導致不同區域OMZ強度不同的主要因素是什么?
(3) 大洋OMZ中的氮循環。雖然OMZ被認為是全球氮的匯區, 但異養反硝化作用相對于厭氧氨氧化的相對貢獻仍然沒有解決。厭氧氨氧化有助于解釋OMZ水體中氨的缺乏, 對N2的流失有明顯的貢獻, 但不能解釋N2O的分布和循環, 也不能解釋傳統的反硝化作用涉及的高基因多樣性。另外, 最新的模型結果顯示大洋OMZ在全球大氣N2固定中起著重要作用, 但對其與氮氣流失的耦合關系知之甚少。可見, 對大洋OMZ氮循環過程的研究還需進一步加強。
(4) 大洋OMZ中其他元素的生物地球化學循環過程。大洋低氧環境下氮循環過程也會影響其他元素的生物地球化學循環過程, 比如碳、硫、鐵、錳等元素, 加強不同元素遷移轉化之間的關系研究, 有助于更好的理解海洋生物地球化學循環。
(5) 大洋OMZ對生態系統的影響。當前對大洋OMZ生態系統中研究最多的是浮游生物和底棲生物, 但對OMZ水體和沉積物中微生物的生態學和生物多樣性知之甚少。即使是研究最多的浮游生物, 對他們的新陳代謝/遺傳對低氧環境的適應性和他們的生物地球化學作用也知之不多, 更不用說是微生物了。加強大洋OMZ生態系統研究是了解低氧環境下生物地球化學關鍵過程的前提。
[1] Thamdrup B, Dalsgaard T, Revsbech N P. Wide spread functional anoxia in the oxygen minimum zone of the Eastern South Pacific[J]. Deep-Sea Research I, 2012, 65: 36-45.
[2] Paulmier A, Ruiz-Pino D. Oxygen minimum zones (OMZs) in the modern ocean[J]. Progress in Oceano-graphy, 2009, 80: 113-128.
[3] Helly J, Levin L. Global distribution of naturally occurring marine hypoxia on continental margins[J]. Deep- Sea Research I, 2004, 51: 1159-1168.
[4] Karstensen J, Stramma L, Visbeck M. Oxygen minimum zones in the eastern tropical Atlantic and Pacific oceans[J]. Progress in Oceanography, 2008, 77: 331-350.
[5] Fuenzalida R, Schneider W, Garcés-Vargas J, et al. Vertical and horizontal extension of the oxygen minimum zone in the eastern South Pacific Ocean[J]. Deep- SeaResearchII, 2009, 56: 992-1003.
[6] Ulloa O, Pantoja S. The oxygen minimum zone of the eastern South Pacific[J]. Deep-Sea Research II, 2009, 56: 987-991.
[7] K?llner M, Visbeck M, Tanhua T, et al. Diapycnal diffusivity in the core and oxycline of the tropical North Atlantic oxygen minimum zone[J]. Journal of Marine Systems, 2016, 160: 54-63.
[8] Wishner K F, Outram D M, Seibel B A, et al. Zooplankton in the eastern tropical north Pacific: Boundary effects of oxygen minimum zone expansion[J]. Deep-Sea Research I, 2013, 79: 122-140.
[9] McCreary J P, Yu Z J, Hood R R, et al. Dynamics of the Indian-Ocean oxygen minimum zones[J]. Progress in Oceanography, 2013, 112-113: 15-37.
[10] Raateoja M, Kuosa H, Flinkman J, et al. Late summer metalimnetic oxygen minimum zone in the northern Baltic Sea[J]. Journal of Marine Systems, 2010, 80: 1-7.
[11] Farias L, Paulmier A, Gallegos M. Nitrous oxide and N-nutrient cycling in the oxygen minimum zone off northern Chile[J]. Deep-Sea Research I, 2007, 54: 164- 180.
[12] Galán A, Molina V, Thamdrup B, et al. Anammox bacteria and the anaerobic oxidation of ammonium in the oxygen minimum zone off northern[J]. Chile Deep-Sea Research II, 2009, 56: 1021-1031.
[13] Molina V, Far?as L. Aerobic ammonium oxidation in the oxycline and oxygen minimum zone of the eastern tropical South Pacific off northern Chile (~20°S)[J]. Deep-Sea Research II, 2009, 56: 1032-1041.
[14] Dalsgaard T, Thamdrup B, Farías L, et al. Anammox and denitrification in the oxygen minimum zone of the eastern South Pacific[J]. Limnology and Oceanography, 2012, 57(5): 1331-1346.
[15] Mashifane T B, Vichi M, Waldron H N, et al. Modelling nitrite dynamics and associated feedback processes in the Benguela oxygen minimum zone[J]. Continental Shelf Research, 2016, 124: 200-212.
[16] Bohlen L, Dale A W, Sommer S, et al. Benthic nitrogen cycling traversing the Peruvian oxygen minimum zone[J]. Geochimicaet Cosmochimica Acta, 2011, 75: 6094- 6111.
[17] Bulow S E, Rich J J, Naik H S, et al. Denitrification exceeds anammox as a nitrogen loss pathway in the Arabian Sea oxygen minimum zone[J]. Deep-Sea Research I, 2010, 57: 384-393.
[18] De Pol-Holz R, Robinson R S, Hebbeln D, et al. Controls on sedimentary nitrogen nisotopes along the Chilemargin[J]. Deep-SeaResearch II, 2009, 56: 1042- 1054.
[19] Schwartz M C, Woulds C, Cowie G L. Sedimentary denitrification rates across the Arabian Sea oxygen minimum zone[J]. Deep-Sea Research II, 2009, 56: 324- 332.
[20] Sommer S, Gier J, Treude T, et al. Depletion of oxygen, nitrate and nitrite in the Peruvian oxygen minimum zone cause an imbalance of benthic nitrogen fluxes[J]. Deep-Sea Research I, 2016, 112: 113-122.
[21] Paulmier A, Ruiz-Pino D, Garcon V. The oxygen minimum zone (OMZ) off Chile as intense source of CO2and N2O[J]. Continental Shelf Research, 2008, 28: 2746-2756.
[22] Franz J, Krahmann G, Lavik G, et al. Dynamics and stoichiometry of nutrients and phytoplankton in waters influenced by the oxygen minimum zone in the eastern tropical Pacific[J]. Deep-Sea Research I, 2012, 62: 20-31.
[23] Pantoja S, Sepúlveda J, González H E. Decomposition of sinking proteinaceous material during fall in the oxygen minimum zone off northern Chile[J]. Deep-Sea Research I, 2004, 51: 55-70.
[24] Pantoja S, Rossel P, Castro R, et al. Microbial degra-dation rates of small peptides and amino acids in the oxygen minimum zone of Chilean coastal waters[J]. Deep-Sea Research II, 2009, 56: 1055-1062.
[25] Escribano R, Hidalgo P, Krautz C. Zooplankton associated with the oxygen minimum zone system in the northern upwelling region of Chile during March 2000[J]. Deep-Sea Research II, 2009, 56: 1083-1094.
[26] Espinosa L F, Pantoja S, Pinto L A, et al. Water column distribution of phospholipid-derived fatty acids of marinemicroorganisms in the Humboldt Current System off northern Chile[J]. Deep-Sea Research II, 2009, 56: 1063-1072.
[27] Gonsalves M J, Paropkari A L, Fernandes C E G, et al. Predominance of anaerobic bacterial community over aerobic community contribute to intensify ‘oxygen mi-ni-mum zone’ in the eastern Arabian Sea[J]. Continental Shelf Research, 2011, 31: 1224-1235.
[28] Rad U, Schulz H, Khan A A, et al. Sampling the oxygen minimum zone off Pakistan: glacial-interglacial variations of anoxia and productivity (preliminary results, Sonne 90 cruise)[J]. Marine Geology, 1995, 125: 7-19.
[29] Meadows A, Meadows P S, West F J C, et al. Bioturbation, geochemistry and geotechnics of sediments affected by the oxygen minimum zone on the Oman continental slope and abyssal plain, Arabian Sea[J]. Deep- Sea Research II, 2000, 47: 259-280.
[30] Weijden C H, Reichart G J, Visser H J. Enhanced preservation of organic matter in sediments deposited within the oxygen minimum zone in the northeastern Arabian Sea[J]. Deep-Sea Research I, 1999, 46: 807-830.
[31] Vandewiele S, Cowie G, Soetaert K, et al. Amino acid biogeochemistry and organic matter degradation state across the Pakistan margin oxygen minimum zone[J]. Deep-Sea Research II, 2009, 56, 318-334.
[32] Kondo Y, Moffett J W. Iron redox cycling and subsur-face offshore transport in the eastern tropical South Pacific oxygen minimum zone[J]. Marine Chemistry, 2015, 168: 95-103.
[33] Theberge S M, Luther G W, Farrenkopf A M. On the Existence of free and metal complexed sulfide in the Arabian Sea and its oxygen minimum zone[J]. Deep-SeaResearch Ⅱ, 1997, 44(6-7): 1381-1390.
[34] Vedamati J, Chan C, Moffett J W. Distribution of dissolved manganese in the Peruvian Upwelling and oxygen minimum zone[J]. Geochimicaet Cosmochimica Acta, 2015, 156: 222-240.
[35] Lewis B L, Luther III G W. Processes controlling the distribution and cycling of manganese in the oxygen minimum zone of the Arabian Sea[J]. Deep-Sea Research I, 2000, 47: 1541-1561.
[36] Chakraborty P, Chakraborty S, Jayachandran S, et al. Effects of bottom water dissolved oxygen variability on copper and lead fractionation in the sediments across the oxygen minimum zone, western continental margin of India[J]. Science of the Total Environment, 2016, 556: 1052-1061.
[37] Chakraborty P, Mason R P, Jayachandran S, et al. Effects of bottom water oxygen concentrations on mercury distribution and speciation in sediments below the oxygen minimum zone of the Arabian Sea[J]. Marine Chemistry, 2016, 186: 24-32.
[38] Herring P J, Fasham M J R, Weeks A R, et al. Across- slope relations between the biological populations, the euphotic zone and the oxygen minimum layer off the coast of Oman during the southwest monsoon (August, 1994)[J]. Progress in Oceanography, 1998, 41: 69-109.
[39] Williams R L, Wakeham S, McKinney R, et al. Trophic ecology and vertical patterns of carbon and nitrogen stable isotopes in zooplankton from oxygen minimum zone regions[J]. Deep-Sea Research I, 2014, 90: 36-47.
[40] Saltzman J, Wishner K F. Zooplankton ecology in the eastern tropical Pacific oxygen minimum zone above a seamount: 1. General trends[J]. Deep-Sea Research I, 1997, 44(6): 907-930.
[41] Saltzman J, Wishner K F. Zooplankton ecology in the eastern tropical Pacific oxygen minimum zone above a seamount: 2. Vertical distribution of copepods[J]. Deep- Sea Research I, 1997, 44(6): 931-954.
[42] Antezana T. Species-specific patterns of diel migration into the oxygen minimum zone by euphausiids in the Humboldt Current Ecosystem[J]. Progress in Oceanography, 2009, 83: 228-236.
[43] Cook A A, Lambshead P J D, Hawkins L E, et al. Nema-tode abundance at the oxygen minimum zone in the Arabian Sea[J]. Deep-Sea Research II, 2000, 47: 75-85.
[44] Trübenbach K, Teixeira T, Diniz M, et al. Hypoxia tolerance and antioxidant defense system of juvenile jumbo squids in oxygen minimum zones[J]. Deep-Sea Research II, 2013, 95: 209-217.
[45] Wishner K F, Gelfman C, Gowing M M, et al. Vertical zonation and distributions of calanoid copepods through the lower oxycline of the Arabian Sea oxygen minimum zone[J]. Progress in Oceanography, 2008, 78: 163-191.
[46] Quiroga E, Quin? ones R, Palmab M, et al. Biomass size-spectra of macrobenthic communities in the oxygen minimum zone off Chile[J]. Estuarine, Coastal and Shelf Science, 2005, 62: 217-231.
[47] Teuber L, Kiko R, Séguin F, et al. Respiration rates of tropical Atlantic copepods in relation to the oxygen minimum zone[J]. Journal of Experimental Marine Biology and Ecology, 2013, 448: 28-36.
[48] Davies S M, Sánchez-Velasco L, Beier E, et al. Three- dimensional distribution of larval fish habitats in the shallow oxygen minimum zone in the eastern tropical Pacific Ocean off Mexico[J]. Deep-Sea Research I, 2015, 101: 118-129.
[49] Gallardo V A, Palma M, Carrasco F D, et al. Macrobe-nthic zonation caused by the oxygen minimum zone on the shelf and slope off central Chile[J]. Deep-Sea Research II, 2004, 51, 2475-2490.
[50] Levin L A, Whitcraft C R, Mendoza G F, et al. Oxygen and organic matter thresholds for benthic faunal activity on the Pakistan margin oxygen minimum zone (700—1100 m)[J]. Deep-Sea Research II, 2009, 56: 449-471.
[51] Levin L A, Gage J D, Martin C, et al. Macrobenthic community structure within and beneath the oxygen minimum zone, NW Arabian Sea[J]. Deep-Sea Research II, 2000, 47: 189-226.
[52] Hughes D J, Lamont P A, Levin L A, et al. Macrofaunal communities and sediment structure across the Pakistan margin oxygen minimum zone, North-East Arabian Sea[J]. Deep-Sea Research II, 2009, 56: 434-448.
[53] Zettler M L, Bochert R, Pollehne F. Macrozoobenthos diversity in an oxygen minimum zone off northern Namibia[J]. Mar Biol, 2009, 156: 1949-1961.
The oxygen minimum zones (OMZs) and its eco-environmen-tal effects in ocean
LI Xue-gang1, 2, 3, SONG Jin-ming1, 2, 3, YUAN Hua-mao1, 2, 3, LI Ning1, 2, 3, DUAN Li-qin1, 2, 3, WANG Qi-dong1
(1. Chinese Academy of Sciences Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Laboratory for Marine Ecology and Environmental Sciences, Qingdao National Laboratory for Marine science and Technology, Qingdao 266237, China)
Oxygen minimum zones (OMZs) are the O2-deficient layers in the ocean water column that develops between 200 and 1000 m below the sea level. The development of the OMZ in oceans is mainly related to the consumption of oxygen by aerobic bacteria degrading dead organisms descending through the water column from the above oxygenated ocean layer. There is no currently agreed upon threshold in oxygen that defines an OMZ. If the threshold were chosen as 20 μmol/L, all OMZs surface account for 8% of the present global ocean surface and a mean volume of OMZs account for 7% of the ocean volume. The main regions of OMZ are in the Eastern North Pacific, Eastern South Pacific, Arabian Sea, and Bay of Bengal. In addition, OMZs have been mainly known to play an essential role in the global nitrogen cycle in which various chemical species, according to their degree of oxidation (e.g., ammonium, NH4+; nitrite, NO2; nitrate, NO3; nitrous oxide, N2O; dinitrogen, N2), and different bacterial processes intervene. Under oxic conditions and at the upper boundary (oxycline) of an OMZ, nitrification transforms NH4+into NO3–. However, the core of OMZs is especially associated with denitrification and anaerobic ammonium oxidation (anammox) that can convert NO3–, NH4+, NO2–into gaseous nitrogen (Ngas, for example, N2O, N2) that is lost to the atmosphere and contributes to the oceanic nitrate deficit. The OMZ affects the abundance, distribution, and diversity of plankton and affects the survival and migration of organisms. However, the low oxygen zone does not mean the lack of living organisms. At the same time, the oxygen deficiency in OMZ enhances the preservation of organic matter in sediments and affects the migration and transformation of elements, such as Fe, Mn, and S, that are most sensitive to the redox environment. Although the OMZ has been recognized the important role in the global material cycle and the biological evolution in the ocean ecosystem and extreme environmental conditions, there are still many questions to understand the ocean OMZ. Consequently, further research is needed.
oxygen minimum zones (OMZs); distribution and formation; eco-environmental effects; ocean
(本文編輯: 康亦兼)
[Qingdao National Laboratory for Marine Science and Technology (the Preliminary Deep Sea Research)(2016ASKJ14); Strategic Priority Research Program of the Chinese Academy of Sciences, No. XDA11030202]; Science & Technology Basic Resources Investigation Program of China (2017TY100802)]
Aug.21, 2017
李學剛(1969-), 男, 河南汝南人, 研究員, 博士, 主要從事海洋化學研究, 電話: 0532-82898891, E-mail: lixuegang@qdio.ac.cn; 宋金明,通信作者, 研究員, 博士, 主要從事海洋化學研究, 電話: 0532-82898809, E-mail: jmsong@qdio.ac.cn
P734.2
A
1000-3096(2017)12-0127-12
10.11759/hykx20170821003
2017-08-21;
2017-10-19
青島海洋科學與技術國家實驗室鰲山科技創新計劃項目(2016ASKJ14); 中國科學院戰略性先導科技專項(XDA11030202); 科技基礎資源調查專項(2017FY100802)

