應用CRISPR/Cas9編輯廣東小耳花豬MSTN基因
王 敏,黃 翔,石 翾,劉小鳳,曾檢華,劉小紅,陳瑤生,何祖勇
(1.中山大學生命科學學院/有害生物控制與資源利用國家重點實驗室,廣東 廣州 510006;2.廣東壹號食品股份有限公司,廣東 廣州 510620)
應用CRISPR/Cas9編輯廣東小耳花豬MSTN基因
王 敏1,黃 翔1,石 翾1,劉小鳳1,曾檢華2,劉小紅1,陳瑤生1,何祖勇1
(1.中山大學生命科學學院/有害生物控制與資源利用國家重點實驗室,廣東 廣州 510006;2.廣東壹號食品股份有限公司,廣東 廣州 510620)
MSTN基因是肌肉生長抑制基因,破壞MSTN基因的表達成為提高畜禽肌肉產量的有效途徑。通過應用CRISRP/Cas9編輯技術對廣東小耳花豬MSTN基因的外顯子區域進行編輯,破壞MSTN基因的讀碼框來抑制其表達,從而提高廣東小耳花豬的肌肉產量。共設計了6條靶向MSTN基因3個不同外顯子的gRNA,經過T7E1酶切檢測和TA克隆分析,發現其中3條gRNA能夠發生有效切割,其中切割效率最高的達28.3%,最低為17.0%。gRNA1-1和gRNA3-3突變的廣東小耳花豬PEF細胞系,突變效率均在50%以上,其中三號外顯子上突變位點的突變率達到61.5%。試驗結果為后續進行體細胞核移植,生產MSTN基因編輯的廣東小耳花豬奠定了基礎。
MSTN;CIRSPR/Cas9;廣東小耳花豬;基因編輯
MSTN (Myostatin)基因是肌肉生成抑制基因,在機體中主要發揮肌肉生長的負調節作用。因此,破壞MSTN基因的表達成為提高畜禽肌肉產量的有效途徑。MSTN基因是Mcpherron在研究轉化生長因子(TGF-β)時發現的,并在隨后試驗中指出,MSTN在脊椎動物的骨骼肌中特異表達,MSTN基因功能的缺失能夠有效增加小鼠的肌肉產量,靶向破壞MSTN基因的小鼠體重是野生小鼠體重的兩倍[1]。MSTN作為肌肉生長調節抑制因子,自被發現以來就受到廣泛重視,研究也越發深入。Hanset等[2]發現表現雙肌性狀的比利時藍牛和皮埃蒙特牛比普通牛的肌纖維數量更多,而在胎牛中的肌纖維數量是普通牛的兩倍[3]。進一步研究表明,比利時藍牛中表現雙肌性狀是由其MSTN基因編碼區一段11 bp的堿基缺失引起的,而皮埃蒙特牛則是由相同MSTN基因區域單堿基G>A突變所致[4]。2000年,Thomas等[5]研究發現,MSTN導致P21(一種細胞周期依賴性蛋白激酶抑制因子)表達上調,使得 cdk2蛋白活性下降,導致低磷酸化Rb蛋白累積,最終成肌細胞在G1期阻滯。2001年,Taylor等[6]檢測了重組MSTN在小鼠成肌細胞C2C12中的作用,結果顯示重組MSTN蛋白能夠抑制細胞增殖,抑制DNA和蛋白合成,推測MSTN能夠通過抑制肌肉的生長和再生從而影響肌肉重量。2002年,Rios等[7]為探究MSTN在成肌分化過程中扮演的角色,用小鼠MSTN cDNA穩定轉染C2C12細胞,發現MSTN cDNA的過表達會下調肌肉調控因子MyoD和myogenin mRNA的表達水平,起到可逆的抑制成肌過程的作用。2003年,Joulia等[8]同樣闡明了MSTN能夠抑制細胞的增殖和分化,過表達非內生性MSTN能夠降低MyoD蛋白的表達水平,并且導致磷酸化模式的改變。由此可見,機體內MSTN基因能夠通過調控成肌相關因子的表達來抑制成肌分化,從而減少機體的肌肉量。
CRISPR/Cas9(clustered regularly interspaced short palindromic repeats/CRISPR-associated protein 9)系統是細菌在進化過程中逐漸演化形成的一種針對外源DNA的適應性免疫防御系統,存在于約40%的細菌和幾乎所有的古細菌中[9]。該系統能夠將入侵的外源DNA剪切成喪失生物活性的小片段,并整合到自身序列中,形成規律間隔短回文重復序列。CRISPR/Cas9系統由DNA小片段轉錄而成crRNA和帶有Cas9蛋白結合位點的tracrRNA,以及具有分子剪刀作用的Cas9蛋白組成。作用時crRNA和tracrRNA相結合,引導Cas9蛋白識別靶標DNA序列的PAM(NGG)位點進行切割[10]。目前,應用CRISPR/Cas9系統進行基因編輯的技術已發展成熟。2013年,Mali等[11]利用CRISPR/Cas9系統編輯人類細胞AAVS1基因,在293T細胞中編輯效率達到10%~25%,在K562細胞中編輯效率達到8%~13%,在誘導的多能干細胞中編輯效率為2%~4%。同年,Friedland等[12]利用CRISPR/Cas9編輯了新桿狀線蟲生殖細胞系,實現了靶標位點可遺傳的編輯。2014年,Platt等[13]成功獲得CRISPR/Cas9介導的基因敲入小鼠,并構建了能同時研究KRAS、p53和LKB1(肺癌細胞中3種最重要的突變基因)的動力學模型,使CRISPR/Cas9系統在構建疾病模型的研究和應用中又前進了一步。同樣,CRISPR/ Cas9系統在提高豬的生長性和抗病性過程中也發揮著重要作用。2015年,Wang等[14]在PEF細胞中編輯MSTN基因,通過體細胞核移植,得到了表現明顯“雙肌”性狀的小豬。2016年,Whitworth等[15]利用CRISPR/Cas9突變了豬繁殖與呼吸綜合征病毒PRRSV進入細胞的受體CD163基因,從而阻滯了PRRSV的作用,得到了抗藍耳病的豬。上述試驗思路,結合MSTN基因對肌肉生長的關鍵作用,啟發了我們利用CRISPR/Cas9技術編輯豬功能基因來改善中國地方豬種的肌肉生長性能普遍較低的弱點,以期獲得高生長性能和高肌肉產量的廣東小耳花豬新品種。
廣東小耳花豬屬于我國華南型地方豬種,具有肉質鮮美、肉色鮮紅、系水力強、肌內脂肪含量高和肌纖維直徑小[16]等優點,但是生長緩慢,產肉量低。目前,國內育種工作者利用傳統的選育技術以及現代分子育種技術對其遺傳改良和利用的效果不太理想,還處于較為簡單的雜交利用階段。基于MSTN基因的研究進展以及CRISPR/Cas9系統技術日趨成熟,本研究擬通過CRISPR/Cas9系統編輯廣東小耳花豬MSTN基因,解除其對肌肉生長的抑制作用,從而進一步嘗試培育產生具備高產肉量、肉質優良的廣東小耳花豬新品種。試驗共設計gRNA 6條,將它們分別克隆進帶有U6啟動子、CRISPR系統發揮作用所必需的骨架RNA(crRNA和tracrRNA)以及綠色熒光標記蛋白的PX458載體中,得到6種靶向廣東小耳花豬MSTN基因不同位置的CRISPR/Cas9敲除載體。通過細胞轉染,24 h后可根據綠色熒光的表達情況估計CRISPR/Cas9敲除載體轉染進入細胞的比例,若敲除載體進入細胞,則U6啟動子發揮作用,敲除載體各部分得以表達,綠色熒光蛋白的標記作用顯現,此時細胞發綠光;若敲除載體沒有進入細胞,則載體不能得以表達,細胞不發光。轉染48 h后進行流式分選。流式細胞術也是根據綠色熒光將敲除質粒成功轉染和未轉染的細胞分開,并且精確統計各部分的細胞數量,因此,我們可以準確計算出轉染效率,并對成功轉染的細胞群進行T7E1酶切分析以及TA克隆系列實驗,從而得到成功轉染的細胞群中有多少被CRISPR/Cas9系統切割的細胞比例,了解切割后機體通過同源重組(Homology-directed repair,HDR)和非同源末端連接(Non-homologous ending-joining,NHEJ)方式修復所產生的插入或缺失類型。本試驗篩選出了3條能夠發生有效切割的gRNA,可用于后續體細胞核移植實驗。
1 材料與方法
1.1 試驗材料
廣東小耳花豬胎兒來源于廣東壹號食品股份有限公司核心育種場,成纖維細胞由實驗室分離建立,pX458質粒購自Addgene(北京中原公司代理,貨號為#48138)。
1.2 試驗方法
1.2.1 gRNA設計與oligo合成 試驗所用的骨架載體為pX458,利用張鋒團隊開發的CRISPR設計網站(crispr.mit.edu)[10]設計gRNA,分別選取MSTN基因的3個外顯子區域序列輸入,依據間隔相鄰基序(proto-spacer adjacent motif,PAM),共篩選6條gRNA,其中一號外顯子3條、二號外顯子2條、三號外顯子1條。具體序列見圖1。
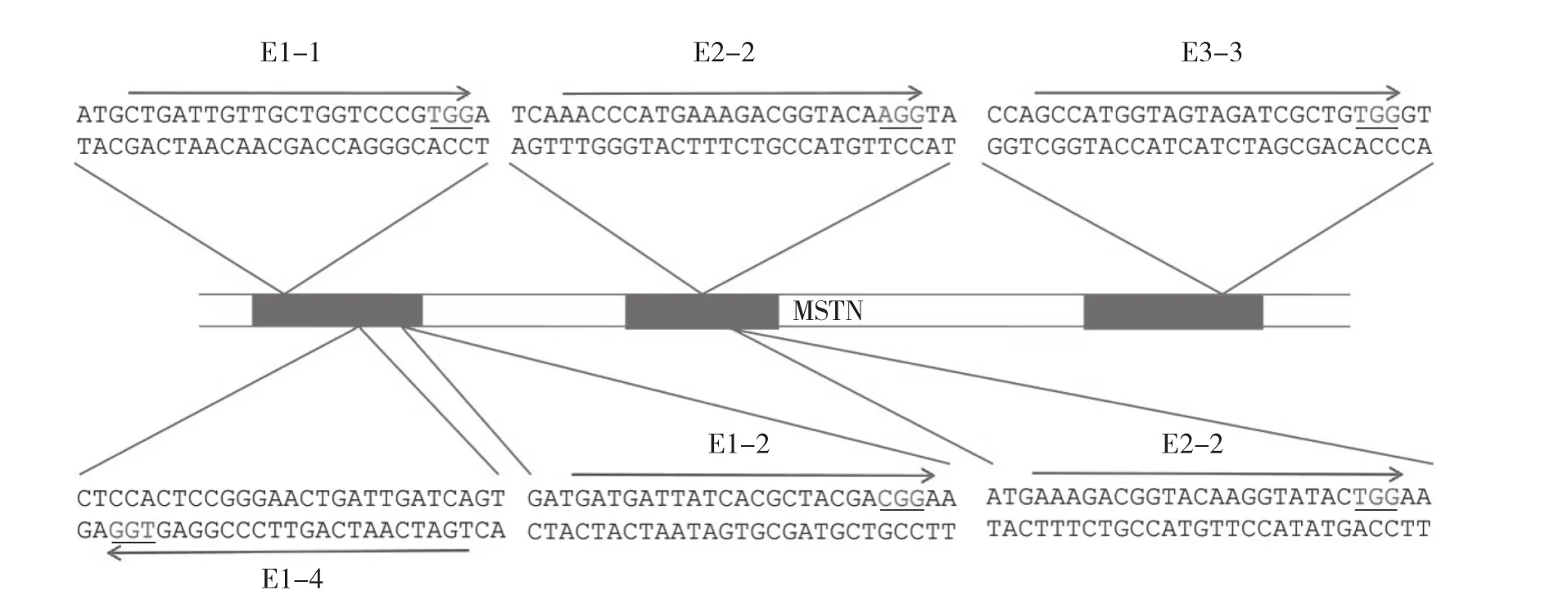
圖1 gRNA序列
由于設計好的gRNA序列要插入到骨架載體pX458的相應位置,因此gRNA序列兩側需要添加BbsⅠ酶酶切骨架載體pX458后的末端堿基互補序列,之后送至生工生物工程有限公司合成。具體序列見表1。

表1 oligo序列
1.2.2 CRISPR敲除載體構建 合成的oligo加水稀釋到100μmol/L,取正義鏈、反義鏈各1 μL,另添加10×T4 連接酶緩沖液、T4 PNK,補充雙蒸水到10 μL,進行退火磷酸化反應,反應條件為:37℃ 30 min,95℃ 5 min,緩慢降溫至25℃(5℃/min)。得到雙鏈片段,再用BbsⅠ酶酶切pX458質粒,得到線性化載體;之后用T4連接酶將雙鏈目的片段與線性化載體Px458質粒連接,反應條件為:37℃ 5 min,21℃ 5 min,共6個循環。得到含有能夠結合廣東小耳花豬基因組中靶標位點片段的CRISPR/Cas9載體;將載體轉化至DH5α感受態細胞中,涂板,37℃恒溫倒置培養14 h;挑取生長良好的單克隆送至生工生物工程有限公司測序。根據測序結果,選取載體構建成功的單克隆擴大搖菌,提取質粒備用。
1.2.3 廣東小耳花豬PEF原代細胞獲取與培養 廣東小耳花豬PEF原代細胞從35日齡胚胎組織中分離獲得。首先,將羊膜包裹的胎兒分別用碘酒、PBS浸泡清洗;之后用消毒的鑷子撕破羊膜流出羊水,將胎兒暴露出來放在加有少量PBS的培養皿中;去除胎兒的頭、尾、四肢以及內臟,剩余背部組織塊;用剪刀將組織塊剪碎,后轉移至培養瓶中,加入適量培養基(含20%血清)混勻,置于CO2培養箱。3 d后可見PEF細胞從組織塊中滲出。之后觀察細胞,適時換液傳代。
1.2.4 PEF細胞轉染 選取生長良好、密度在80%左右的細胞進行電轉。首先消化細胞,PEF細胞用PBS清洗兩遍,加入適量胰酶,置于CO2培養箱1 min,顯微鏡下觀察,細胞呈圓形且漂浮時即可加入含20%血清的培養基終止消化。之后將細胞轉移至離心管中,1 600 r/min離心 5 min,棄上清,加入適量PBS重懸細胞,進行細胞計數。原則上電轉100 μL體系每個樣需要的細胞數量為1×106~5×106,需要載體質粒5~10 μg。細胞計數后根據樣品數量計算需要的重懸液體積,在細胞中加入適量的細胞重懸液R,再分裝至1.5 mL離心管中;隨后在每份細胞中加入等質量的含有不同gRNA的CRISPR/ Cas9載體質粒,靜置3 min;另外,在電轉杯中加入3~5 mL電轉緩沖液E2。最后,使用電轉儀,按照1 650 V、10 ms、3 次脈沖的程序電轉細胞,電轉完的細胞加入預先準備好的六孔板中,置于CO2培養箱培養。24 h后換液,用熒光顯微鏡觀察轉染情況;48 h后過流式細胞儀,根據CRISPR/Cas9載體上攜帶的綠色熒光標記,篩選中靶細胞。
1.2.5 流式細胞儀分選 電轉培養的細胞用PBS清洗2遍,胰酶消化,經濾網過濾到流式管中。上機,根據CRISPR/Cas9載體攜帶的綠色熒光蛋白標記篩選中靶細胞,繼續培養。
1.2.6 T7E1試驗 經過分選的細胞培養至足夠數量,提取細胞基因組(QIAGEN試劑盒),用T7E1上下游引物(具體序列見表2)進行PCR,擴增出CRISPR/Cas9載體切割位點上下游共500 bp左右的片段,將目的片段切膠回收(OMEGA試劑盒),之后進行退火,400 ng膠回收產物,另添加2 μL buffer2、補充雙蒸水至20 μL,反應條件為:95℃ 10 min;95~85℃(-2.0℃/min);85℃ 1 min;85~75℃(-0.3℃/min);75℃ 1 min;75~65℃(-0.3℃/min);65℃ 1 min;65~55℃(-0.3℃/min);55℃ 1 min;55~45℃(-0.3℃/min);45℃ 1 min;45~35℃(-0.3℃/min);35℃ 1 min;35~25℃(-0.3℃/min);25℃ 1 min;25~4℃(-0.3℃/min)。在退火完成后的20 μL體系中加入0.5 μL T7E1酶,按照37℃ 40 min的反應條件進行酶切。最后恒壓跑膠(120 V,90 min),在EB中浸泡10 min顯色后,用曝光儀曝光條帶。通過軟件IMAGE J對條帶進行灰度掃描,用以下公式:切割率=1-(1-切除片段所占百分比)0.5計算切割效率。
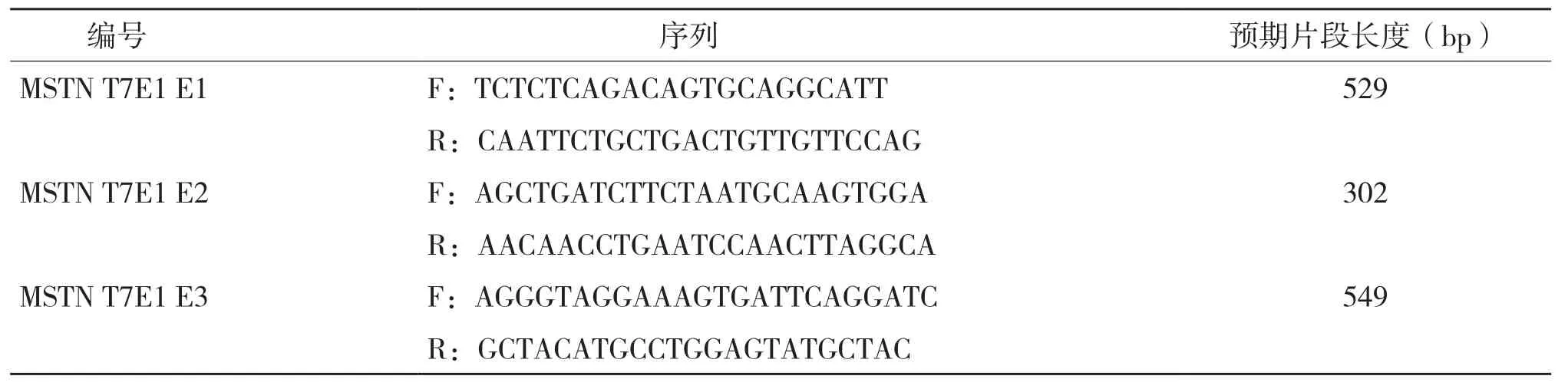
表2 MSTN敲除位點擴增引物
1.2.7 測序分析 將上一步切膠回收的產物連接到PMD18載體中,反應體系為:膠回收產物1μL、SolutionⅠ 5 μL、PMD18載體1 μL,補充雙蒸水至10 μL。反應條件為:16℃水浴30 min。隨即進行轉化,30 μL感受態DH5α與5 μL連接產物混合,依次進行如下步驟:冰上放置25 min,42℃ 45 s,冰上放置2 min,加入1 mL無抗液體LB,37℃ 220 r/min搖菌1 h;8 000 r/min離心2 min,棄上清800 μL,其余混勻,涂板。12~16 h后挑取單克隆送生工生物工程有限公司進行測序。測序結果與野生型廣東小耳花豬MSTN基因組進行比對,明確CRISPR/Cas9載體在MSTN基因中的突變位置和突變類型。
2 結果與分析
2.1 CRISPR敲除質粒轉染廣東小耳花豬PEF細胞
電轉PEF細胞后24 h,利用熒光顯微鏡觀察熒光表達情況,可見綠色熒光表達率較高(圖2A);48 h通過流式細胞術分選細胞,根據表達的綠色熒光可將CRISPR/Cas9切割質粒轉染成功的細胞分選出來,分析可見熒光率,即轉染成功的效率均在30%以上(圖2B)。
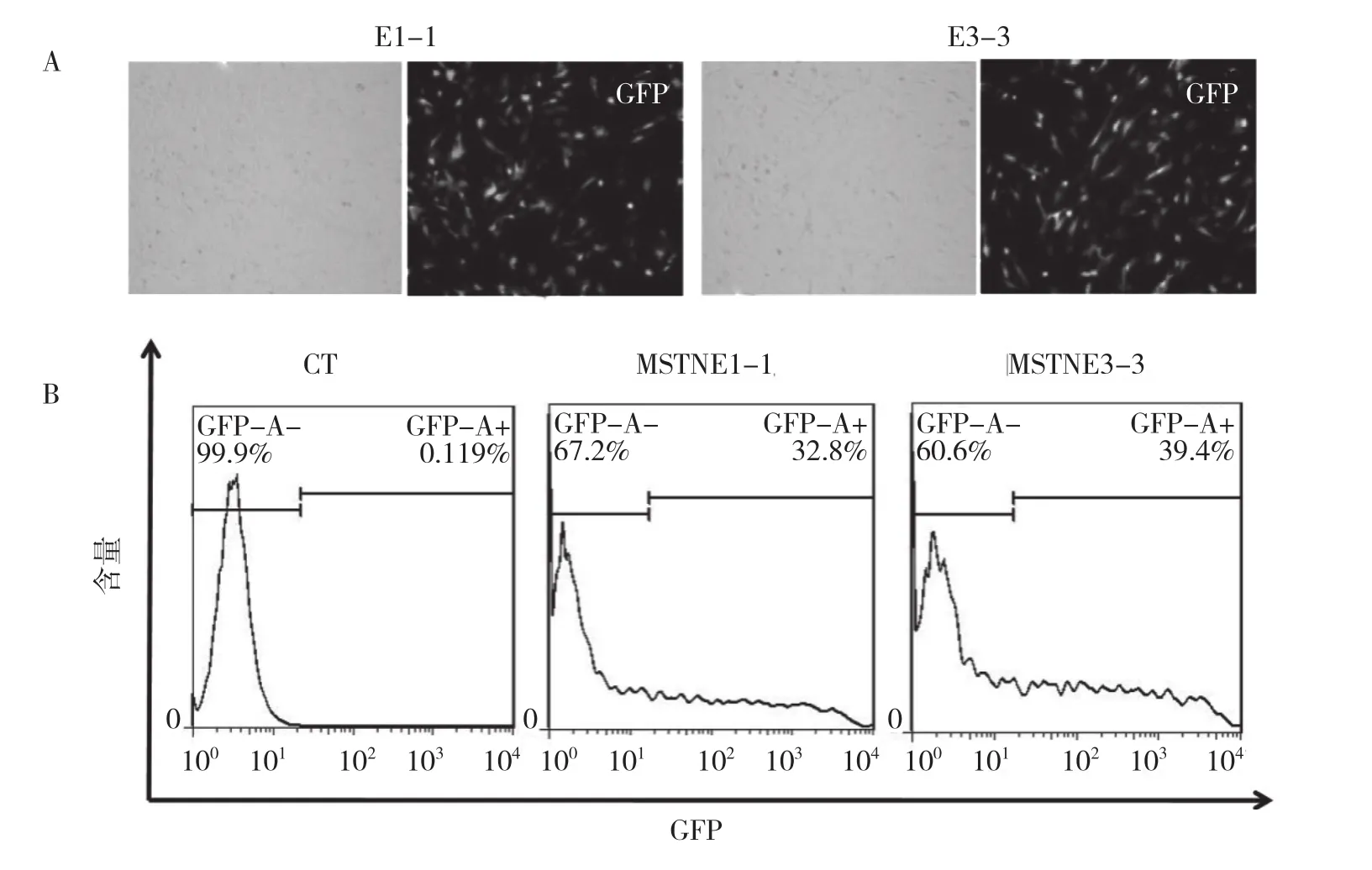
圖2 CRISPR敲除質粒轉染廣東小耳花豬PEF細胞
2.2 T7E1酶切鑒定
從圖3可以看出,試驗設計的6條gRNA 中5條發生了切割,其中3條發生了有效切割。由于gRNA2-1和gRNA2-2與陰性對照相比有部分條帶重疊,且后續測序結果顯示在發生的所有突變中有一部分是本身就存在于基因組中的突變,因此gRNA2-1和gRNA2-2的切割效率不能準確計算,從而認為它們發生無效切割。綜合3次重復試驗結果,切割效率如下:gRNA1-1為26.0%,gRNA1-2為17.0%,gRNA3-3為28.3%。
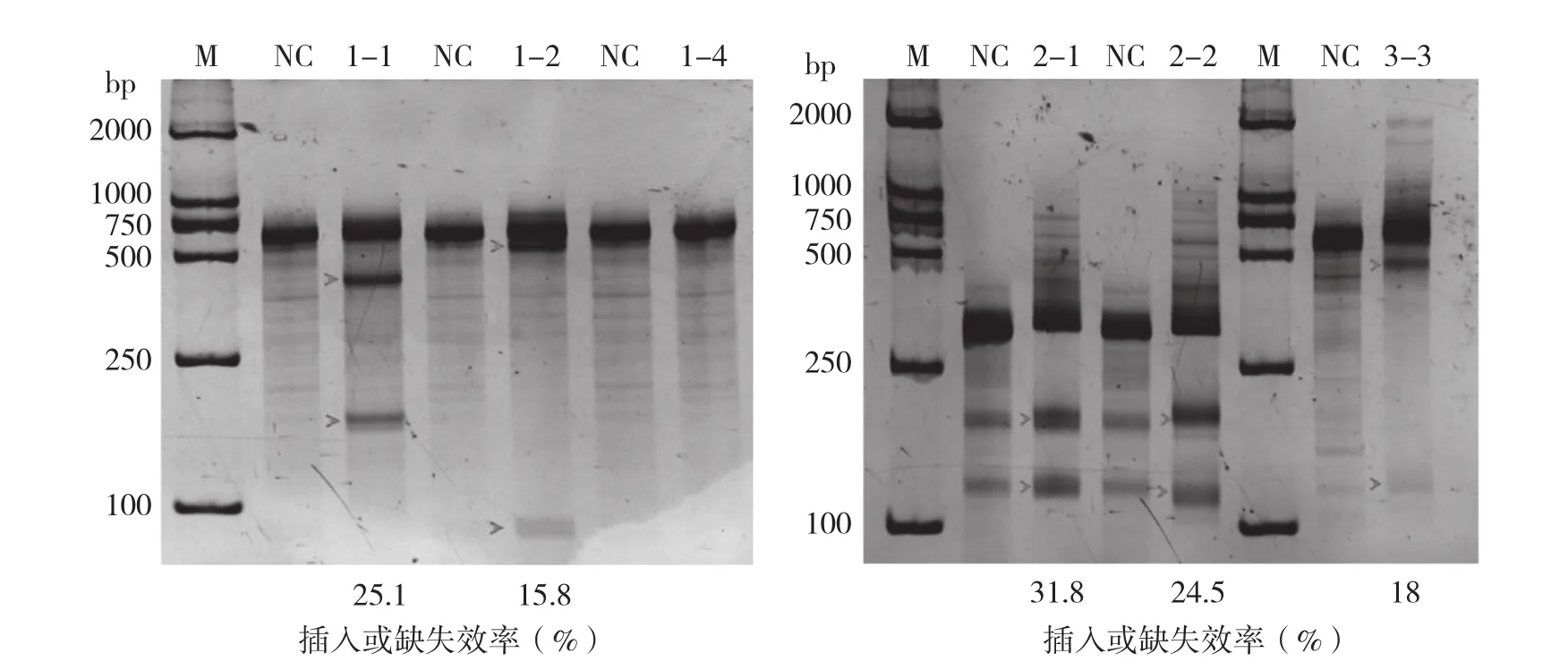
圖3 T7E1酶切鑒定結果
2.3 TA克隆測序分析
后續選取切割效率較高的gRNA1-1和gRNA3-3做TA克隆,并送測序。測序結果(圖4)表明,gRNA1-1發生突變的類型有4種,全部為切割位點附近堿基的缺失,差別在于缺失的堿基數目差異;gRNA3-3發生突變的類型有1種,即切割位點單堿基的缺失。經計算,兩條gRNA的突變效率分別如下:gRNA1-1為50%,gRNA3-3為61.5%。

圖4 TA克隆測序結果
3 結論與討論
本試驗旨在獲得廣東小耳花豬MSTN基因失活的細胞系,以期解除MSTN對中國地方豬種廣東小耳花豬肌肉生長的抑制,使其在保證優良肉質性狀和口感的前提下,能夠適當增加肌肉產量。CRISPR/Cas9技術的出現與日益成熟的應用,為本試驗的開展提供了較好的技術保障。本試驗設計了6條靶向廣東小耳花豬MSTN基因的gRNA,最終篩選出2條突變率較高的gRNA,后續將進一步進行體細胞核移植,為生產MSTN基因編輯豬奠定了基礎。
本試驗最終獲得了gRNA1-1和gRNA3-3突變的廣東小耳花豬PEF細胞系,突變效率均在50%以上,其中三號外顯子上突變位點的突變率達到61.5%。張冬杰等[17]用CRISPR/Cas9定點突變豬MSTN基因獲得38%的突變率;Han等[18]利用CRISPR/Cas9敲除綿羊MSTN基因,所設計的3條gRNA得到的平均突變率為19.3%;胡曼等[19]驗證了CRISPR/Cas9在雞MSTN基因上的突變效率,編碼了一號外顯子和二號外顯子上的兩個靶點,突變率分別為64.3%和23.3%。與已有相關數據相比,本試驗結果比較樂觀。較高的突變率表示在一群細胞中,CRISPR/Cas9系統編輯過的細胞數量較多,細胞群移植到豬體內得到基因編輯豬的可能性較大。我們在之前的試驗中證明了轉染進細胞的質粒會在轉染21 d后就檢測不到,即該載體不會整合進細胞基因組,降低了生物安全問題[20]。本試驗證明了CRISPR/Cas9技術在中國地方豬種基因編輯改造上的可能性,目前該技術也已成為畜禽育種的新方法之一,試驗結果中取得的較高的突變效率也為進一步開展體細胞核移植試驗奠定了堅實基礎。
[1]McPherron A C,Lee S J. Suppression of body fat accumulation in myostatin-deficient mice[J]. The Journal of Clinical Investigation,109(5):595-601.
[2]Hanset R,Michaux C,Dessy-Doize C,et al. Studies on the 7th Rib Cut in Double Muscled and Conventional Cattle. Anatomical,histological and biochemical aspects[M].//Muscle hypertrophy of genetic origin and its use to improve beef production. Springer Netherlands,1982:341-349.
[3]Swatland H J,Kieffer N M. Fetal development of the double muscled condition in cattle1[J]. Journal of Animal Science,1974,38(4):752-757.
[4]Jinqing W,Gui M,Zhiguo L,et al. Improving gene targeting efficiency on pig IGF2 mediated by ZFNs and CRISPR/Cas9 by using SSA reporter system[J]. Yi Chuan,2015,37(1):55-62.
[5]Thomas M,Langley B,Berry C,et al. Myostatin,a Negative Regulator of Muscle Growth,Functions by Inhibiting Myoblast Proliferation[J]. Journal of Biological Chemistry,2000,275(51):40235-40243.
[6] Taylor W E,Bhasin S,Artaza J,et al. Myostatin inhibits cell proliferation and protein synthesis in C2C12 muscle cells[J]. American Journal of Physiology - Endocrinology And Metabolism,2001,280(2):e221.
[7]Ryìos R,Carneiro I,Arce V M,et al. Myostatin is an inhibitor of myogenic differentiation [J]. American Journal of Physiology - Cell Physiology,2002,282(5):C993-C999.
[8]Joulia D,Bernardi H,Garandel V,et al. Mechanisms involved in the inhibition of myoblast proliferation and differentiation by myostatin[J]. Experimental Cell Research,2003,286(2):263-275.
[9]Horvath P,Barrangou R. CRISPR/Cas,the immune system of bacteria and archaea[J]. Science,2010,327(5962):167-170.
[10]Ran F A,Hsu P D,Wright J,et al. Genome engineering using the CRISPR-Cas9 system[J]. Nat. Protocols,2013,8(11):2281-2308.
[11]Mali P,Yang L,Esvelt K M,et al. RNA-Guided Human Genome Engineering via Cas9[J]. Science,2013,339(6121):823-826.
[12]Friedland A E,Tzur Y B,Esvelt K M,et al. Heritable genome editing in C. elegans via a CRISPR-Cas9 system[J]. Nat Meth,2013,10 (8):741-743.
[13]Platt Randall J,Chen S,Zhou Y,et al. CRISPRCas9 Knockin Mice for Genome Editing and Cancer Modeling[J]. Cell,2014,159(2):440-455.
[14]Wang K,Ouyang H,Xie Z,et al. Efficient Generation of Myostatin Mutations in Pigs Using the CRISPR/Cas9 System[J]. Sci Rep,2015,5:16623.
[15]Whitworth K M,Rowland R R,Ewen C L,et al. Gene-edited pigs are protected from porcine reproductive and respiratory syndrome virus[J]. Nat Biotechnol,2016,34(1):20-22.
[16]張仲葛,張曉嵐,李錦鈺. 中國豬的優良種性及其對世界養豬業的貢獻[J]. 自然資源學報,1994,9(1):1-8.
[17]張冬杰,劉娣,張旭,等. 利用CRISPR_Cas9系統定點突變豬MSTN基因的研究[J]. 畜牧獸醫學報,2016,47(1):207-212.
[18]Hongbing HAN,Yonghe MA,Tao WANG,et al. One-step generation of myostatin gene knockout sheep via the CRISPR/Cas9 system[J]. Front. Agr. Sci. Eng,2014,1(1):2-5.
[19]胡曼,康倩倩,胡曉湘,等. CRISPR/Cas9系統在雞MSTN上的效率驗證[J]. 中國家禽,2016,38 (7):5-9.
[20]He Z,Shi X,Du B,et al. Highly efficient enrichment of porcine cells with deletions induced by CRISPR/Cas9 using dual fluorescence selection[J]. J Biotechnology,2015,214:67-74.
(責任編輯 崔建勛)
Editing MSTN gene of Guangdong Xiaoerhua pig by using CRISPR/Cas9
WANG Min1,HUANG Xiang1,SHI Xuan1,LIU Xiao-feng1,ZENG Jian-hua2,LIU Xiao-hong1,CHEN Yao-sheng1,HE Zu-yong1
(1.State Key Laboratory of Biocontrol,School of Life Sciences,Sun Yat-sen University,Guangzhou 510006,China;2.Guangdong YIHAO Food Co.,Ltd.,Guangzhou 510620,China)
MSTN (Myostatin) gene functions as a negative regulator of muscle growth. Therefore,disrupting the expression of MSTN has been proved as an efficient strategy to improve the muscle mass in livestock and poultry. In this study,we edited the exons of MSTN gene to disrupt its expression in order to increase muscle production of Guangdong Xiaoerhua pig by using the cutting-edge genome editing technology—CRISPR/Cas9. We designed six guide RNAs targeting on loci across three exons of MSTN gene. Through T7E1 assay and TA cloning analysis,we found that three guide RNAs were capable of targeted cutting on MSTN gene efficiently, with the targeting efficiency ranging from 17.0% to 28.3%. The editing efficiency of gRNA1-1 and gRNA3-3 in PEF cells of Guangdong Xiaoerhua pig,were both up to 50%. Particularly,editing efficiency in the third exon was as high as 61.5%. This study provides basis to generate MSTN-edited Xiaoerhua pigs by somatic cell nuclease transfer(SCNT) in future.
MSTN; CRISPR/Cas9; Guangdong Xiaoerhua pig; gene editing
Q789;S813.3
A
1004-874X(2017)02-0141-08
2016-11-15
國家轉基因生物新品種培育重大專項(2016ZX08006003-006);廣東省自然科學基金(2016A0 30313310);廣東省揚帆計劃項目(2014YT02H042)
王敏(1992-),女,在讀碩士生,E-mail:907825503@qq.com
何祖勇(1981-),男,博士,副教授, E-mail:zuyonghe@foxmail.com
王敏,黃翔,石翾,等.應用CRISPR/Cas9編輯廣東小耳花豬MSTN基因[J].廣東農業科學,2017,44(2):141-148.

