Osborne分級法提取藜麥清蛋白的響應(yīng)面分析
田旭靜,張婧婷,陳文超,葉錚,范三紅
(山西大學生命科學學院,山西太原030006)
Osborne分級法提取藜麥清蛋白的響應(yīng)面分析
田旭靜,張婧婷,陳文超,葉錚,范三紅
(山西大學生命科學學院,山西太原030006)
以藜麥為研究對象,采用超聲輔助Osborne分級法對藜麥中清蛋白的提取條件進行優(yōu)化,確定其最佳提取方案。在單因素試驗的基礎(chǔ)上,以提取溫度、料液比、提取時間為影響因子,以清蛋白提取率為響應(yīng)值;利用Box-Behnken中心組合原理和響應(yīng)面分析法優(yōu)化提取條件,并作了響應(yīng)面和等高線圖。結(jié)果顯示,藜麥清蛋白的最優(yōu)提取條件為:提取溫度45℃,料液比1∶25(g/mL),提取時間17 min,此條件下,藜麥清蛋白提取率為63.91%;與理論預測值64.72%相比,其相對誤差約為1.25%,說明通過響應(yīng)面分析優(yōu)化后,得到的多元回歸方程可以指導實踐操作;各因素對清蛋白提取率的影響先后順序為:提取溫度>提取時間>料液比。
藜麥;清蛋白;Osborne分級法;響應(yīng)面分析法
藜麥(Chenopodium quinoa)亦稱南美藜、奎奴亞藜、藜谷、印第安麥等,原產(chǎn)地在“喀喀湖”(Lake Titicaca)沿岸[1],位于南美洲安第斯山區(qū)秘魯和玻利亞境內(nèi)。在5 000 a以前,古代印加人稱藜麥為“糧食之母”[2]。藜麥作為一種超級谷物,還被國際營養(yǎng)學家稱為“未來食品”、丟失的遠古“營養(yǎng)黃金”[3]。藜麥是未來最具發(fā)展?jié)摿Φ霓r(nóng)作物之一[4],我國自1987年由西藏開始引種試驗研究,現(xiàn)在陜西、山西、青海、四川等地區(qū)已經(jīng)實現(xiàn)了種植的規(guī)模化[5]。藜麥中含有大量的優(yōu)質(zhì)蛋白[6],其蛋白質(zhì)含量遠高于水稻、大麥和玉米等作物,與小麥蛋白質(zhì)含量相當[7],而且特別容易被人體吸收[8]。藜麥的蛋白質(zhì)主要由清蛋白和球蛋白組成,醇溶蛋白和谷蛋白含量較低[9],其中,藜麥清蛋白由于二硫鍵的作用穩(wěn)定性較好[10],有研究表明,清蛋白有減肥和輔助降血脂作用。對藜麥加工后可以使其蛋白質(zhì)功效得以提高[11]。藜麥含有比例均衡且人體容易吸收的9種必需氨基酸,其中,一般谷物中缺乏的賴氨酸含量尤其高[12-13]。
目前,國內(nèi)只對藜麥蛋白質(zhì)進行氨基酸分析,研究其組成和結(jié)構(gòu),而對于藜麥的種植及產(chǎn)品的開發(fā)研究仍處在初級階段,對蛋白提取工藝優(yōu)化少有報道。
本研究以藜麥為原料,通過響應(yīng)面分析對超聲輔助Osborne分級法提取藜麥清蛋白的最佳條件進行優(yōu)化,旨在為進一步開發(fā)藜麥提供理論依據(jù)。
1 材料和方法
1.1 材料
藜麥由山西省忻州市靜樂縣娑婆迎朝陽藜麥農(nóng)業(yè)合作社提供。
1.2 試劑與儀器設(shè)備
所用試劑均為分析純。SP-2000UV型紫外可見分光光度計(上海光譜儀器有限公司);TDL-5離心機(上海安亭科學儀器制造);HRHS24型電熱恒溫水浴鍋(青島海爾醫(yī)用低溫科技有限公司);868型pH測試儀(美國奧立龍公司);其他儀器均為常規(guī)。
1.3 試驗方法
1.3.1 材料預處理篩選藜麥飽滿種子,粉碎過0.5 mm篩,置35℃鼓風干燥箱烘干,冷卻后密封干燥,備用。
1.3.2 標準曲線的制作橫坐標為牛血清白蛋白濃度,縱坐標為吸光值,得到標準曲線方程為Y=0.007 3X+0.010 9(R2=0.998 1)。具有良好的線性相關(guān)性[14]。
1.3.3 原料成分含量的測定水分含量測定采用105℃烘箱恒重法[15](GB/T20264—2006);脂肪含量測定采用索氏抽提法[16](GB/T 5009.6—2003);蛋白質(zhì)含量測定采用微量凱氏定氮法[17](GB 5009.5—2010),考馬斯亮藍法比色法;灰分含量測定采用600℃灰化法(GB5009.4—2010)。
1.3.4 藜麥分級蛋白提取的工藝流程[18]藜麥中加入一定比例的蒸餾水,均勻攪拌,在40℃超聲輔助提取15 min,4 000 r/min離心20 min,得到上清液A和殘渣A;上清液A經(jīng)過沉淀、洗滌、干燥等處理步驟得到清蛋白。向所得的殘渣A中加入同比例2% NaCl溶液,提取過程同清蛋白,離心后得到上清液B和殘渣B;上清液B經(jīng)過同上處理得到球蛋白。向所得殘渣B中加入同比例70%乙醇溶液,提取過程同清蛋白,離心后得到上清液C和殘渣C;上清液C經(jīng)過同上處理得到醇溶蛋白。向所得殘渣C中加入同比例0.05 mol/L NaOH溶液,提取過程同清蛋白,離心后得到上清液D和殘渣D。上清液D經(jīng)過同上處理得到谷蛋白。采用考馬斯亮藍法測定藜麥中4種蛋白質(zhì)組分質(zhì)量分數(shù)。
1.3.5 清蛋白等電點的測定[19]取藜麥水溶性蛋白提取液7份,用磷酸鹽緩沖溶液調(diào)節(jié)pH值分別為3.1,3.4,3.7,4.0,4.3,4.6,4.9,靜置后,蛋白質(zhì)發(fā)生沉淀,離心后取上清液進行吸光度值測定。蛋白質(zhì)的等電點為吸光度值最小的點。
1.3.6 單因素試驗采用控制變量法[20]對藜麥中提取清蛋白的工藝進行單因素試驗設(shè)計,分別考察料液比、提取溫度、提取時間對清蛋白提取率的影響。固定提取溫度40℃,提取時間15 min,在料液比為1∶20,1∶25,1∶30,1∶35,1∶40(g/mL)條件下測定清蛋白提取率;固定料液比為1∶25(g/mL),提取溫度40℃,在提取時間為5,15,25,35,45 min條件下測定清蛋白提取率;固定料液比為1∶25(g/mL),提取時間為15 min,在提取溫度為20,30,40,50,60℃條件下測定清蛋白提取率[21]。
蛋白質(zhì)提取率=(提取液蛋白質(zhì)含量×提取液體積)/(樣品蛋白質(zhì)含量×樣品取樣量)×100%。
1.3.7 響應(yīng)面試驗根據(jù)單因素試驗結(jié)果進行響應(yīng)面試驗,Box-Behnken中心組合試驗[22]因素水平設(shè)計列于表1。

表1 Box-Behnken試驗設(shè)計因素水平
1.4 數(shù)據(jù)處理
采用Origin 7.0軟件繪制單因素試驗圖表,采用Design Expert 8.0.6軟件進行Box-Behnken設(shè)計及分析。
2 結(jié)果與分析
2.1 原料成分分析
由表2可知,藜麥中蛋白質(zhì)含量最多,其次依次是水分和脂肪,灰分含量相對較少。此測定結(jié)果為研究藜麥蛋白的理化性質(zhì)打下了良好的基礎(chǔ)。
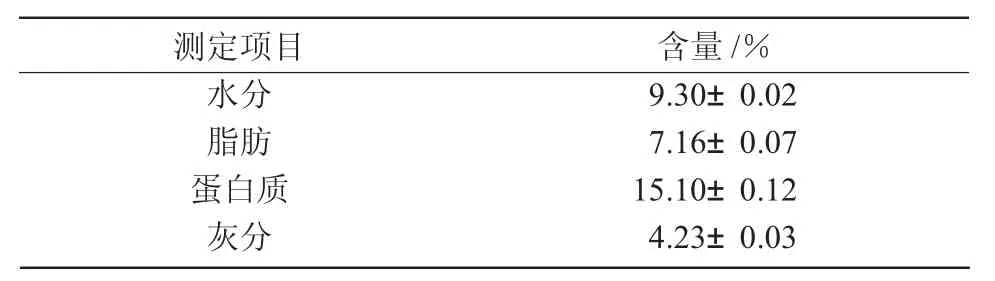
表2 藜麥基本成分分析
2.2 藜麥中4種蛋白的含量分析
由圖1可知,藜麥蛋白經(jīng)過Osborne分級法提取后,分為清蛋白、球蛋白、醇溶蛋白、谷蛋白,其中,藜麥中清蛋白占蛋白總量的48.21%,4種蛋白中含量最多;藜麥球蛋白占27.37%,僅次于清蛋白;藜麥谷蛋白占7.43%;而醇溶蛋白含量最少,只占3.56%。
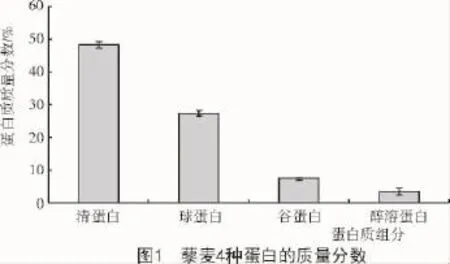
2.3 清蛋白等電點的測定
由圖2可知,pH值為3.4時,其吸光度值最小,此時蛋白沉淀最多,所以,pH值3.4為藜麥清蛋白的等電點。
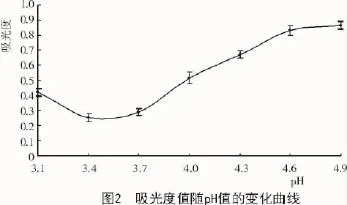
2.4 單因素試驗結(jié)果
2.4.1 提取溫度對藜麥清蛋白提取率的影響由圖3可知,隨提取溫度增加,清蛋白提取率先上升后下降,溫度在40℃時提取率最大,溫度繼續(xù)升高提取率開始下降,可能是因為清蛋白是熱敏性較強的蛋白質(zhì),溫度繼續(xù)上升,部分蛋白質(zhì)的結(jié)構(gòu)可能被破壞而無法溶出,使得溶出量下降,導致提取率降低。根據(jù)試驗結(jié)果,確定最佳提取溫度為40℃。
2.4.2 提取時間對藜麥清蛋白提取率的影響由圖4可知,藜麥清蛋白提取率隨著提取時間的增加先逐漸提高后大幅下降,這是因為在一定時間內(nèi),隨著時間的延長,浸入提取液的蛋白質(zhì)也會隨之增多,15 min時提取率達到最大,為37.9%;浸提時間過長,會使蛋白質(zhì)部分分解和變性,使得提取率降低。因此,確定15 min為最適提取時間[23]。
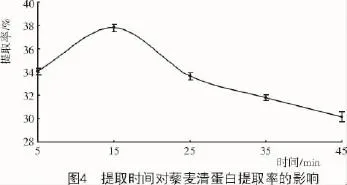
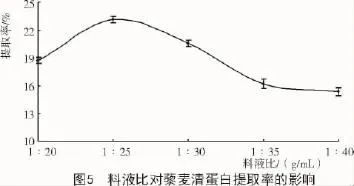
2.4.3 料液比對藜麥清蛋白提取率的影響由圖5可知,隨著料液比的減小,清蛋白提取率呈先上升再下降的趨勢,在1∶25(g/mL)時達到最大,清蛋白提取比較徹底;隨著料液比繼續(xù)減小,反而降低了提取液中的可溶性清蛋白的含量。因此,確定1∶25(g/mL)時為最適料液比。
2.5 響應(yīng)面試驗結(jié)果
響應(yīng)面試驗方案及結(jié)果列于表3。
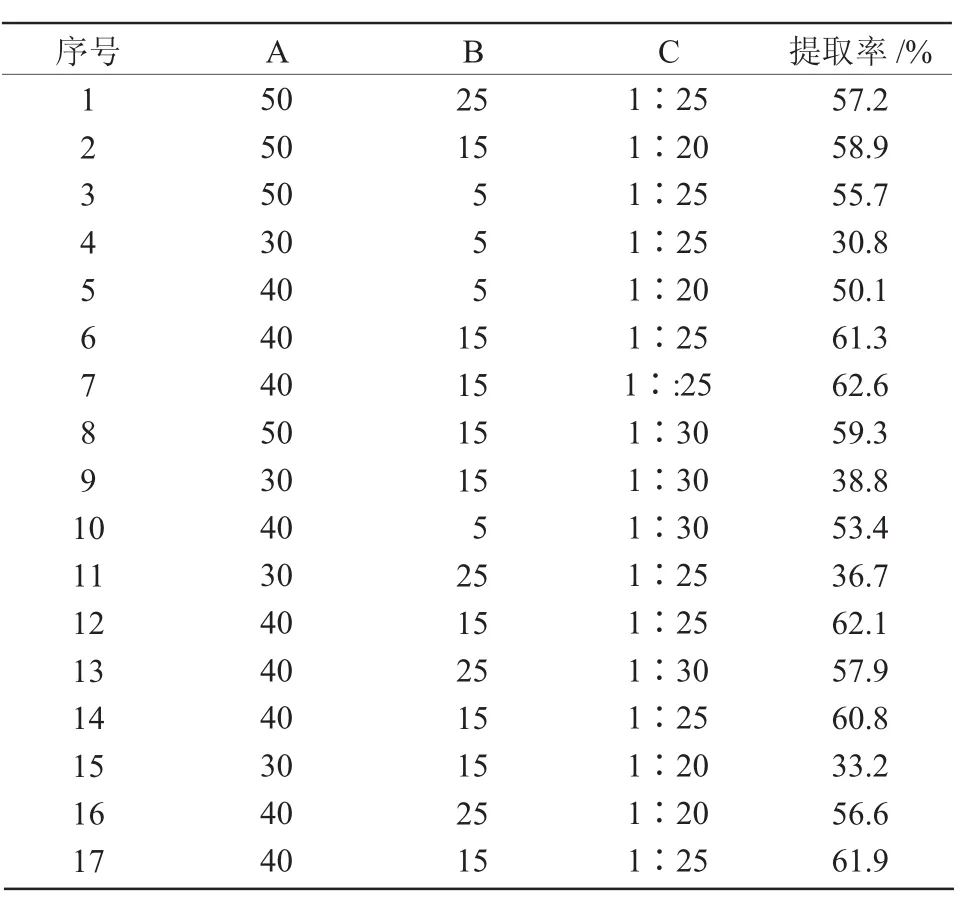
表3 響應(yīng)面試驗設(shè)計及結(jié)果
2.5.1 回歸方程的建立與方差分析利用Design Expert 8.0.6軟件對表3數(shù)據(jù)進行多元回歸擬合,建立提取工藝參數(shù)回歸模型,回歸方程為Y=61.74+11.45A+2.30B-1.32C-1.10AB+1.30AC+0.50BC-11.80A2-4.84B2-2.40C2。該方程中各項系數(shù)的絕對值越大,說明該因素對響應(yīng)值的影響程度越深,系數(shù)的正、負反映了影響的方向[23]。由方程的一次項系數(shù)可以得出,影響藜麥清蛋白提取率的因素先后順序為提取溫度>提取時間>料液比。對模型進行方差分析,結(jié)果列于表4。
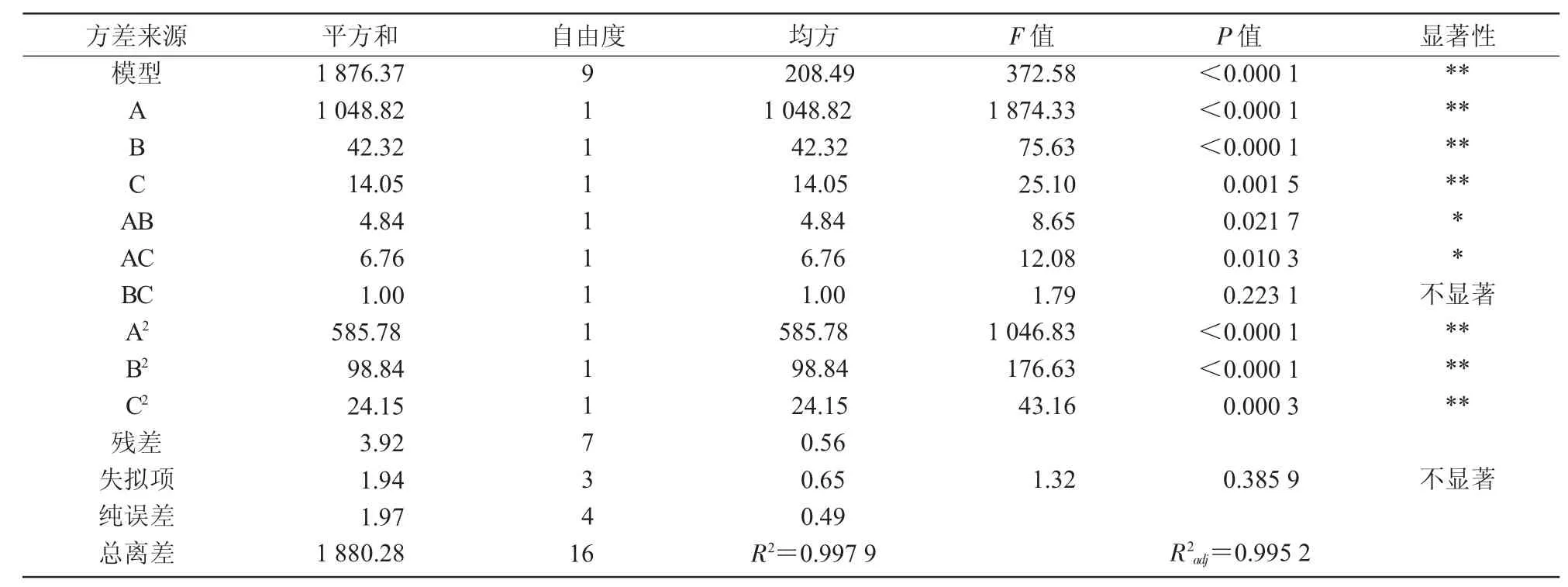
表4 回歸方程方差分析
從表4可以看出,A,B,C,A2,B2,C2對響應(yīng)值的影響達到極顯著,三因素兩兩交互中AB,AC項對響應(yīng)值的影響顯著,而BC項P>0.05,提取時間和料液比兩因素的交互作用影響不顯著。從整體分析,模型P<0.000 1,表明該二次多項回歸模型達到極顯著;失擬項P=0.385 9>0.05,說明失擬項差異不顯著,失擬因素在試驗中不存在,可以充分反映實際情況,回歸模型是適合的[24];R2=0.997 9,說明預測值和實測值之間具有高度的相關(guān)性[25],模型方程能夠很好地反映真實的試驗值;R2adj=0.995 2,說明未控制因素對試驗結(jié)果影響較小。所以,該模型可以用于藜麥中清蛋白提取率的分析和預測。
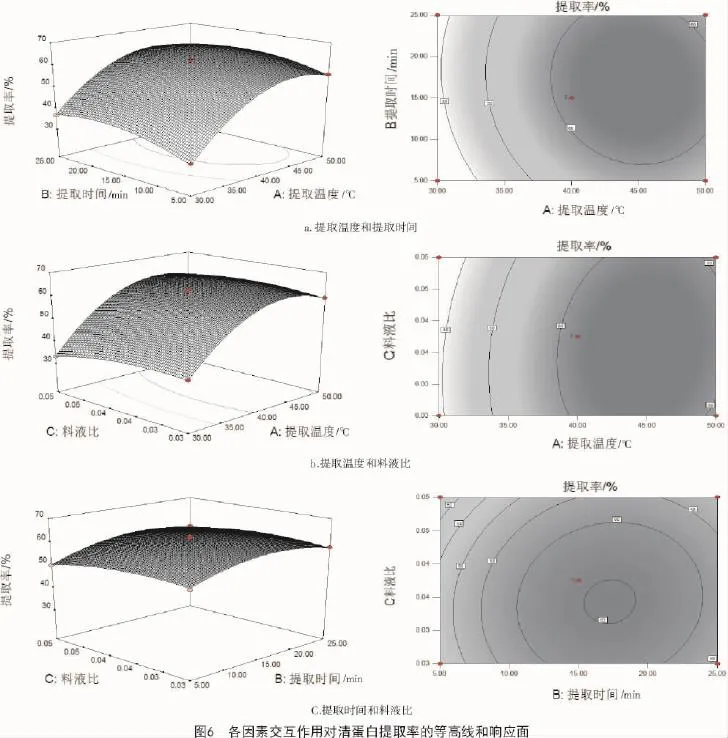
2.5.2 響應(yīng)面分析響應(yīng)面坡度陡峭程度越高,表明控制條件發(fā)生改變,響應(yīng)值越敏感,該控制因素對清蛋白提取率的影響越大;反之則影響較小。由圖6可知,提取溫度(A)曲線最陡,而料液比(C)和提取時間(B)曲線相對比較平緩,響應(yīng)值變化隨其數(shù)值的變化不是很大,說明這2個因素對清蛋白提取率的影響程度相對于提取溫度(A)較弱,這與方差分析的結(jié)果一致。交互作用的強弱也可從等高線的形狀體現(xiàn)出來,越接近橢圓形交互作用越強,越接近圓形交互作用越不強,分析可知,提取溫度(A)和提取時間(C)交互作用最顯著,其后是提取溫度(A)和料液比(B)交互作用較顯著,而提取時間(B)和料液比(C)的交互作用不顯著。
從圖6-a可以看出,料液比處于0水平時,提取溫度和提取時間的交互作用較強,當固定提取時間時,隨著提取溫度的增加,清蛋白提取率也增大,但增大到一個峰值后又開始緩慢下降;清蛋白提取率在提取溫度40~45℃水平和提取時間15~17 min水平之間有最大值。圖6-b顯示,提取時間處于0水平時,提取溫度與料液比的交互作用極強,由等高線圖可知,料液比對清蛋白提取率影響相對較小,提取溫度對清蛋白提取率影響較大。由圖6-c可知,提取時間和料液比的交互作用最不顯著。比較圖6-b和圖6-c可知,提取溫度對清蛋白提取率影響比提取時間更高,再比較圖6-a與圖6-c可知,提取溫度對清蛋白提取率的影響較料液比顯著。
由Design Expert 8.0.6軟件得出,清蛋白的最佳提取條件為:提取溫度44.70℃,提取時間16.78min,料液比1∶25(g/mL)。此條件下,模型預測的最大提取率為64.72%。考慮到操作的實際可行性,將理論值修正為提取溫度45℃,提取時間17 min,料液比1∶25(g/mL),再進行驗證試驗,可得清蛋白提取率為63.91%,與理論值64.72%接近,說明該模型預測實際提取率較好。
3 結(jié)論
本研究藜麥通過Osborne分級法進行蛋白提取后,得到4種蛋白,其中,清蛋白占蛋白總量的48.21%,含量最多;球蛋白占27.37%,僅次于清蛋白;谷蛋白占7.43%;而醇溶蛋白含量最少,只占3.56%。
對藜麥中清蛋白采用水提的方法進行提取,通過單因素試驗和響應(yīng)面分析法相結(jié)合,確定的最優(yōu)工藝條件為提取溫度45℃,料液比1∶25(g/mL),提取時間17 min,在該條件下,藜麥清蛋白提取率為63.91%。方差分析得到因素的主效應(yīng)關(guān)系為:提取溫度>提取時間>料液比。
目前,國內(nèi)外對藜麥中蛋白的研究尚未見報道,藜麥在其蛋白開發(fā)利用方面還具有很大的潛力。因此,進一步完善藜麥中蛋白提取的理論和方法,加大科研力度,充分開發(fā)利用藜麥蛋白,對實現(xiàn)工業(yè)產(chǎn)業(yè)化生產(chǎn)具有重要意義。
[1]ALBERTO ESTRADA,BING L,BERNARD LAARVELD.Adjuvantaction ofChenopodium quinoa saponins on the induction ofantibodyresponses tointragastric and intranasal administered antigens in mice[J].Immun Microbiol&Infect,1998,21:225-236.
[2]劉洋,熊國富,閆殿海,等.“糧食之母”,“超級食物”——藜麥“落戶”青海[J].青海農(nóng)林科技,2014(4):95-98.
[3]郭曉鳳.試論藜麥的推廣前景及栽培技術(shù)[J].現(xiàn)代農(nóng)業(yè),2015(2):61-63.
[4]ATULB,SUDHIR S,DEEPAKO.Chenopodium quinoa—An Indian perspective[J].Industrial Crops and Products,2006,23:73-87.
[5]肖正春,張廣倫.藜麥及其資源開發(fā)利用[J].中國野生植物資源,2014,33(2):62-66.
[6]ABUGOCH L E,ROMERO N,TAPIA C A,et al.Study of some physicochemical and functional properties of quinoa(Chenopodium quinoa Willd.)protein isolates[J].Journal of Agricultural and Food Chemistry,2008,56:4745-4750.
[7]WRIGHT K H,PIKE O A,F(xiàn)AIRBANKS D J,et al.Composition of Atriplex hort ensis,sweet and bitter Chenopodium quinoa seeds[J]. Journal ofFood Science,2002,67(4):1383-1385.
[8]王黎明,馬寧,李頌,等.藜麥的營養(yǎng)價值及其應(yīng)用前景[J].食品工業(yè)科技,2014,35(1):381-384.
[9]LINDEBOOM N,CHANG P R,F(xiàn)ALK K C,et al.Characteristics of starch from eight quinoa lines[J].Cereal Chemistry,2005,82(2):216-222.
[10]BRINEGAR C,SINE B,NWOKOCHA L.High-cysteine 2S seed storage proteins from quinoa(Chenopodium quinoa)[J].Journal of Agricultural and Food Chemistry,1996,44(7):1621-1623.
[11]STIKIC R,GLAMOCLIJA D,DEMIN M,et al.Agronomical and nurtional evaluation of quinoa seed(Chenopodium quinoa Willd.)as an ingredient in bread formulations[J].Journal of Cereal Science,2012,55:132-138.
[12]KARYOTIS T,ILIADIS C,NOULAS C,et al.Preliminary research on seed production and nutrient content for certain quinoa varieties in a saline-sodic[J].Journal of Agronomy and Crop Science,2003,189:402-408.
[13]胡小靜,鄭大川,黃鳳勤.高溫壓榨對花生蛋白功能性質(zhì)的影響[J].文山學院學報,2010,23(3):9.
[14]柳蔭,吳鳳智,陳龍,等.考馬斯亮藍法測定核桃水溶性蛋白含量的研究[J].中國釀造,2013,32(12):131-132.
[15]張建新,郭倩,何桂梅,等.大麥蟲水溶蛋白的分離純化及抗氧化性研究[J].食品科學,2011,32(18):31-33.
[16]謝音,屈小英.食品分析[M].北京:科學技術(shù)文獻出版社,2006:99-113.
[17]衛(wèi)生部.GB/T5009.5—2003食品中蛋白質(zhì)的測定[S].北京:中國標準出版社,2003.
[18]全越,王長遠.Osborne分級法提取燕麥麩球蛋白的響應(yīng)面分析[J].糧食加工,2015,40(5):34-35.
[19]訾艷,王常青,陳曉萌,等.白蕓豆清蛋白提取工藝及分子組成研究[J].食品工業(yè)科技,2014,35(15):121-122.
[20]和法濤,劉光鵬,朱風濤,等.響應(yīng)面法優(yōu)化熱水法浸提猴頭菇多糖工藝提高多糖得率[J].食品科技,2015,40(1):210-215.
[21]張素斌,張欣,李敏,等.龍利葉多酚提取條件優(yōu)化及其抗氧化活性研究[J].河南農(nóng)業(yè)科學,2017,46(2):148-152.
[22]張瑤,李嘯,潘冬瑞,等.Box-Benhnken設(shè)計優(yōu)化植物乳桿菌培養(yǎng)基[J].天津農(nóng)業(yè)科學,2013,19(7):1-5.
[23]肖衛(wèi)華,韓魯佳,楊增玲,等.響應(yīng)面法優(yōu)化黃芪黃酮提取工藝的研究[J].中國農(nóng)業(yè)大學學報,2007,12(5):52-56.
[24]陳紅梅,謝翎.響應(yīng)面法優(yōu)化半枝蓮黃酮提取工藝及體外抗氧化性分析[J].食品科學,2016,37(2):48-49.
[25]鞠興榮,稅丹,何榮,等.響應(yīng)面分析法優(yōu)化菜籽多糖酸法提取工藝的研究[J].中國糧油學報,2012,27(3):89-93.
Osborne Classification Method to Extract the Quinoa Albumin Response Surface Analysis
TIANXujing,ZHANGJingting,CHENWenchao,YE Zheng,F(xiàn)ANSanhong
(College ofLife Science,Shanxi University,Taiyuan 030006,China)
Taking quinoa as the research object,albumin extraction conditions from quinoa were optimized by ultrasonic auxiliary Osborne classification method,to determine the best extraction solution.Three extraction parameters including solid-liquid ratio,extraction temperature and extraction time were optimized using central composite design and response surface methodology based on single factor investigations for achievingmaximumthe protein extraction rate.Based on the response surface and contour plots established with protein extraction ratioas the response value.The results showed that optimal extraction conditions were determined as a solid-liquid ratio of 1∶25(g/mL),an extraction temperature of 45℃,and an extraction time of 17 min.Under these optimized conditions,quinoa albumin extraction yield was 63.91%,compared to the theoretical value 64.72%,the relative error was 1.25%.The multiple regression equation by response surface analysis optimization derived some practical significance.The sequence of factors that worked on the extraction rate ofalbumin was as follows:extractingtemperature>extractingtime>solid-liquid ratio.
quinoa;albumin;Osborne classification method;response surface analysis
TS201.1
A
1002-2481(2017)04-0621-06
10.3969/j.issn.1002-2481.2017.04.33
2016-12-02
山西省自然科學基金項目(2012011031-4);2016年山西省高等學校教學改革創(chuàng)新項目(J2016003);2016年山西省研究生教育改革研究課題(2016JG26);山西省重點研發(fā)計劃(一般項目)(201603D221004-4)
田旭靜(1992-),女,山西汾陽人,在讀碩士,研究方向:農(nóng)產(chǎn)品綜合利用開發(fā)。范三紅為通信作者。

