基于化學核心素養的高中生自主探究能力的培養
廣東實驗中學(510375)
范 婭●
基于化學核心素養的高中生自主探究能力的培養
廣東實驗中學(510375)
范 婭●
以碳酸亞鐵的制備探究為例,展示了如何根據學生在課堂上提出的問題進行探究,在探究中培養高中生的化學核心素養和自主探究能力.
自主探究;化學核心素養;碳酸亞鐵
一、化學核心素養
什么是核心素養呢?北京師范大學林崇德教授指出:“核心素養是學生在接受相應學段的教育過程中,逐步形成的適應個人終生發展和社會發展需要的必備品格與關鍵能力.”它是關于學生知識、技能、情感、態度、價值觀等多方面要求的綜合體;它指向過程,關注學生在其培養過程中的體悟,而非結果導向;同時,核心素養兼具穩定性與開放性、發展性,是一個伴隨終生可持續發展、與時俱進的動態優化過程,是個體能夠適應未來社會、促進終生學習、實現全面發展的基本保障.
筆者認為核心素養是指學生借助學校教育所形成的解決問題的素養與能力.
化學作為一門基礎性、實用性以及創造性較強的學科,在漫長的發展過程中,化學科學積累豐富知識的同時,也積淀了化學家認識物質、改造物質和應用物質的思想觀點、科學方法、思維方式等.很顯然,化學科學承載著豐富的教育價值,化學教育根植于化學科學,必須彰顯化學科學的魅力和特征,只有這樣,化學教育才有生命力,才能促進學生化學核心素養的發展.
二、關于自主探究能力
從化學核心素養的構成體系中,不難發現學生自主探究能力的培養是化學核心素養的重要組成部分.新課程改革倡導探究性學習和自主學習,其目的是讓學生像科學家一樣去探索問題,學習科學研究的方法,培養學生的觀察、思維、操作、想象能力,讓學生積極主動去獲取知識,激發興趣,培養創新精神和實踐能力.
那么如何在教學中培養學生的自主探究能力?筆者認為在課程的實施中,學生自主探究能力的培養依賴于教師有意識的按照學生知識獲得和能力形成的規律,去創設適宜的教學情景,或者提出有探究價值的問題激發學生興趣.情景的創設和問題的提出并不需要教師們刻意的設計或者安排,有的時候基于習題中的問題,或者學生提出的問題,老師們就可以引導學生進行探究.本文以學生習題中遇到的關于碳酸亞鐵的制備問題為例展示如何在教學中培養學生的自主探究能力.
三、教學案例的展示分析
1.基于學生提出問題的問題,創設情境(見表1)
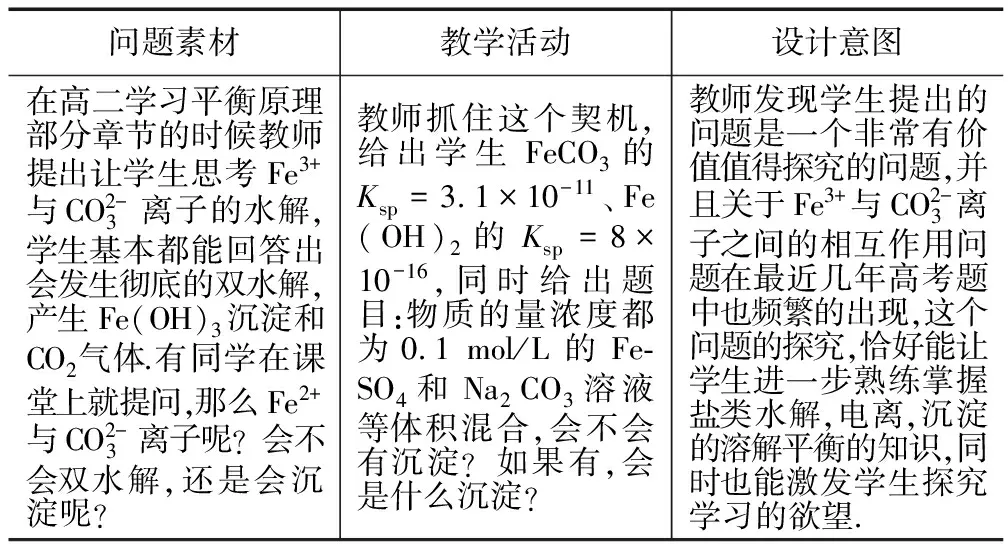
表1 情境創設1
學生表現:
生2:也可能會發生雙水解,生成Fe(OH)2和CO2氣體.
教師針對兩位同學的回答,提出表揚,進而提出新的思考,我們可以通過計算得出會有FeCO3沉淀,那么大家能不能通過粗略的計算來驗證一下是否會有Fe(OH)2沉淀呢?
教師巡堂發現,同學們都能計算出來混合后溶液中Fe2+的濃度,對于OH-濃度,不知如何下手,教師在這個時候給予提示:請大家思考一下,對于一個反應能否發生或者反應的程度怎么樣,我們可以從哪個角度來判斷?
學生齊聲回答:平衡常數可以判斷
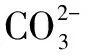

在計算過程中學生能寫出以上平衡的常數的表達式,但是無法找到與之相關的量或者濃度進行計算,教師進一步引導,學生思考:當我們無法計算出某個平衡的平衡常數的時候,我們是不是可以找出與之相關的幾個平衡來計算呢?
學生受到啟發,找出 與這個平衡相關的幾個平衡,并查閱平衡常數
K=K1K2K3=6.02×103
學生通過計算發現產生Fe(OH)2沉淀的程度也較大,所以判斷也會有Fe(OH)2的沉淀.那么到底反應現象會是怎么樣呢?教師演示實驗,見表2.

表2 教師演示實驗
教師提出問題:為什么幾乎看不到FeCO3的沉淀?
生:碳酸鈉堿性太強,所以會有較多的Fe(OH)2
教師繼續追問:那要怎樣改進一下實驗
學生提出用濃度較低的Na2CO3溶液,設計表3所列實驗進行驗證
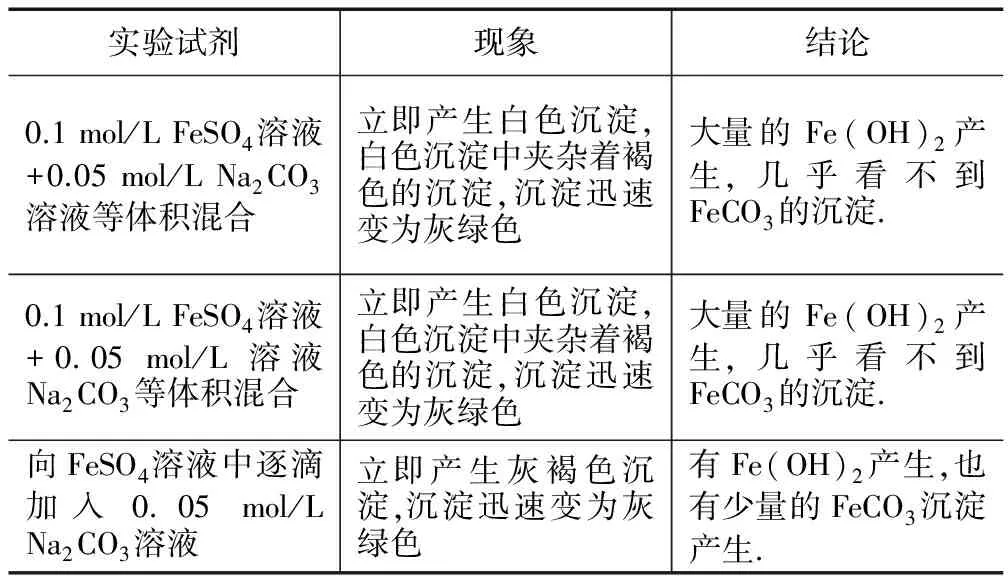
表3 學生探究實驗1
教師引導學生總結:用FeSO4與Na2CO3制備FeCO3是可行的,但是控制不好量會有的較多Fe(OH)2雜質產生,學生總結是因為 Na2CO3堿性太強.
學生提問:那么我們是否可以在硫酸亞鐵溶液中加入一定量的硫酸降低堿性呢?
實驗改進:見表4.

表4 學生探究實驗2
教師:為什么會出現這樣的現象呢?
學生思考:酸性太強,碳酸根直接與氫離子反應生成二氧化碳跑走了,看來酸性太強也不行.
2.提出新問題創設新情境并繼續引導學生進行探究(見表5)
生3:要減少Fe(OH)2的沉淀的產生,我們就要減少OH-離子的濃度,其實就是溶液的堿性需要降低.
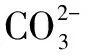
生6:我們可以用剛才的計算方法來試著計算一下啊
有了剛才計算的基礎,學生很快就能寫出總反應并找出與之相關的平衡并查閱資料進行計算,過程如下:
如果生成Fe(OH)2,那么反應應為
與這個平衡相關的幾個平衡
如果生成FeCO3反應應為:
與這個平衡相關的幾個平衡:
K5=K6K7K8=3.41×106
學生總結:通過計算發現,反應生成FeCO3沉淀的程度很大,利用碳酸氫鹽與硫酸亞鐵鹽來制備碳酸亞鐵是可行的.
生4:那么到底是選用碳酸氫鈉、碳酸氫氨還是碳酸銨呢?
生5:肯定選用碳酸氫氨
教師:為什么呢?
生7:因為碳酸氫銨堿性最小,還有碳酸根
學生笑聲嘀咕:這幾種鹽的水解程度都沒計算,怎么知道酸堿性呢?
生8:有pH試紙,測一下不就知道了么.
學生用pH試紙測定0.1 mol/L的碳酸氫鈉、碳酸氫氨和碳酸銨的pH.通過實驗,同學們最終決定選用碳酸氫銨與硫酸亞鐵反應嘗試著制備碳酸亞鐵沉淀
并設計了表6所列實驗方案
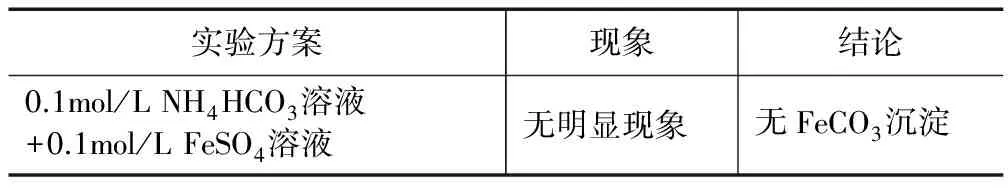
表6 學生探究實驗3
教師提問:為什么沒有現象呢?
學生疑惑不解,教師引導:我們顧及了溶液的堿性,但是大家也許忽略了要產生沉淀,必須要滿足什么條件呢?
學生恍然大悟:達到沉淀的Ksp才會有沉淀.
學生:哦,可能是碳酸氫氨濃度太低了,電離出的碳酸根濃度更低,所以就沒有沉淀.
學生進行實驗(見表7).
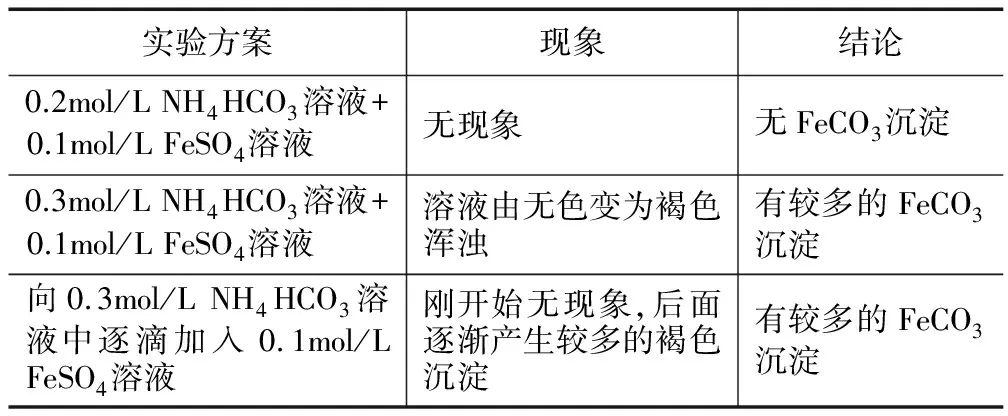
表7 學生探究實驗4
3.總結歸納拓展,產生新的問題給學生課后探究
教師總結:FeCO3的制備,用FeSO4溶液與稍過量的NH4HCO3溶液混合,得到含FeCO3的濁液.請同學們思考得到FeCO3的濁液后如何得到干燥的FeCO3沉淀,同時大家課后查閱資料設計實,驗探究碳酸亞鐵的性質.
四、教學反思
通過以上案例我們發現,整個教學過程中,教師只是一個引導者的角色,只是給予適當的信息并且通過創設教學情境,提出問題來激發學生思考探究的欲望,學生在整個教學活動中也會不斷有新的問題的涌現,而學生提出的問題都通過實驗或者理論計算加以驗證,解決,學生在這個過程中還復習了各個物質的性質,鹽類水解,電解質電離,沉淀溶解平衡等相關知識,提升了學生對化學平衡的理解和應用能力.課堂上學生可以大膽的猜測,提出假設,課堂活躍,學生討論激烈.在不斷的自主學習過程中學生既習得了知識,又培養了獨立思考,自主探究的能力.
[1] 林崇德 . 21 世紀學生發展核心素養研究 [M]. 北京:北京師范大學出版社,2016.
[2]畢華林,萬延嵐.化學的魅力與化學教育的挑戰[J].化學教學,2015(5): 3-7.
[3]邢玉琴,婁兆文.中學化學探究式教學的問題與對策.教育教學論壇,2016(3):232-233.
G632
B
1008-0333(2017)07-0090-02

