Hedgehog參與西伯利亞鱘側線機械和電感受器分化的初始證據
唐智嬌范純新王 健宋佳坤
(1. 上海海洋大學水產與生命學院, 上海 201306; 2. 上海海洋大學海洋生物系統與神經科學研究所, 上海 201306; 3. 上海海洋大學省部共建水產種質資源發掘與利用教育部重點實驗室, 上海 201306)
Hedgehog參與西伯利亞鱘側線機械和電感受器分化的初始證據
唐智嬌1,2,3范純新1,2,3王 健1,3宋佳坤1,2,3
(1. 上海海洋大學水產與生命學院, 上海 201306; 2. 上海海洋大學海洋生物系統與神經科學研究所, 上海 201306; 3. 上海海洋大學省部共建水產種質資源發掘與利用教育部重點實驗室, 上海 201306)
為揭示Hedgehog (Hh)信號與神經丘和壺腹器官分化的關系, 研究以西伯利亞鱘(Acipenser baerii Brandt)為模型, 首先對再生過程中的神經丘和壺腹器官的轉錄組進行比較分析, 發現Hh信號通路關鍵基因(Shh、Patched 1)在兩類感受器中差異表達, 且它們的表達在再生過程中呈現動態性。然后用環巴胺(Cyclopamine, Hh信號抑制劑)處理西伯利亞鱘胚胎(st29), 用掃描電鏡和FM1-43熒光染色對西伯利亞鱘仔魚(st43-st44)分析發現環巴胺顯著抑制了壺腹器官的發育。整體原位雜交表明, Shh、Patched1、Smoothened、Gli2在腹面側線區域的表達受到了環巴胺的抑制。以上結果暗示Hh信號通路與神經丘和壺腹器官的發育有關, 推測Hh信號在神經丘和壺腹器官的分化過程中起到了重要作用。
西伯利亞鱘; 神經丘; 壺腹器官; Hedgehog信號; 環巴胺
包括魚類和兩棲類在內的低等水生脊椎動物具有側線這一重要的感覺器官。在系統演化過程中, 盡管真骨魚的電感受器發生了丟失, 但軟骨魚和非新鰭亞綱的側線系統都是由感受機械振動的機械感受器(神經丘)和感受弱電場的電感受器(壺腹器官)組成[1,2]。這兩類功能迥異的側線感受器都由感覺細胞、支持細胞和神經細胞組成, 且它們都起源于一系列的側線基板[3]。頭部側線基板通過延伸形成感覺嵴, 然后在感覺嵴的中央區形成神經丘原基, 旁側區形成壺腹器官原基[1]。目前, 兩類側線感受器分化的分子基礎尚不清楚, 而這是理解電感受器在系統進化中出現-消失-再出現的關鍵。
Hedgehog基因最先在果蠅(Drosophila melanogaster)突變體篩選中發現, 其編碼的蛋白是一類重要的形態生成素, 控制果蠅胚胎的分節模式。脊椎動物中存在3個Hedgehog的同源基因: Shh、Ihh和Dhh, 分別編碼Shh、Ihh和Dhh蛋白。Hh信號轉導關鍵分子還包括識別Hh信號的受體膜蛋白Patched (Ptc)和調控膜蛋白Smoothened (Smo), 以及可進入細胞核的轉錄因子Gli蛋白。當Ptc和Hh結合以后,解除對Smo的抑制作用, 促使Gli蛋白結合PKA及CK1等因子與微管形成大分子復合物, 使得完整Gli蛋白進入核內激活下游靶基因轉錄[4—6]。在脊椎動物發育過程中, Hh信號通路調控許多器官和組織的模式形成, 例如眼睛、中樞神經系統、肺、腸和四肢等[7]。
Sapède和Pujades[8]通過Hh信號抑制劑環巴胺處理斑馬魚(Danio rerio)胚胎, 證明了Hh通路對橢圓囊后側聽斑(Macula of utricle)毛細胞的產生和特定神經支配的形成至關重要。Koebernick等[9]用環巴胺處理非洲爪蟾(Xenopus)胚胎, 發現Hh信號調控非洲爪蟾內耳發育。有趣的是, 側線系統和內耳均起源于頭部神經基板[10,11], Koebernick等[9]又進一步證明了Smo的高表達也阻礙了側線基板發育,說明Hh信號通路參與聽-側線系統的分化。側線系統中的機械感受器和電感受器都來自側線基板, 兩者的分化是否也受到Hh信號調控?本文以西伯利亞鱘(Acipenser baerii Brandt)胚胎為實驗材料, 經轉錄組分析神經丘和壺腹器官再生過程中Hh信號的表達, 通過掃描電鏡和FM1-43熒光染色觀察環巴胺對西伯利亞鱘仔魚側線系統的影響, 并結合整體原位雜交技術, 初步探討Hh信號在西伯利亞鱘側線系統機械和電感受器發育中的作用。
1 材料與方法
1.1 西伯利亞鱘胚胎和仔魚
西伯利亞鱘受精卵購自大連永新鱘魚開發有限公司, 在實驗室條件下, 養在盛有滅菌胚胎水(63 mg/L CaSO4、10 mg/L MgSO4、4 mg/L KCl、1.1 mg/L NaH2PO4、0.01 mg/L亞甲基藍)的燒杯中, 每500 mL胚胎水1000顆受精卵, 維持水溫18℃左右, 氣泵供氧[12]。
1.2 轉錄組測序
st44期西伯利亞鱘經200 μmol/L新霉素處理2h,胚胎水漂洗3次, 每次5min, 之后于胚胎水中培養。分別于處理后0、12h和24h取神經丘、壺腹器官和表皮于Trizol中保存。每次取樣前用0.1% DASPEI熒光染色2min, 胚胎水漂洗3次, 0.05%MS-222麻醉,然后用Stemi-2000立體顯微鏡在熒光下取樣。Trizol法提RNA, 分析RNA的濃度、完整度、質量后用Hiseq-1500測序儀進行轉錄組測序。
1.3 環巴胺處理胚胎
致畸劑環巴胺對Hh信號的抑制非常特異, 直接抑制Smo信號活性[13]。將西伯利亞鱘胚胎從st29期(此時基板開始形成)開始經20 μmol/L環巴胺(Merck millipore, 用DMSO溶解)處理到st37期, 即出膜后1d (環巴胺共處理4d)。用胚胎水清洗2遍, 之后繼續用胚胎水培養。每300 mL胚胎水500顆受精卵,維持水溫18℃左右, 氣泵供氧。同時, 以等量DMSO處理的胚胎作為對照組, 取樣的時間點根據對照組的發育階段進行確定。部分樣品用新鮮的4%多聚甲醛(4%PFA, 4 g多聚甲醛固體溶于100 mL PBS中) 4℃固定過夜后, 經甲醇脫水, 保存于-80℃, 用于整體原位雜交。
1.4 掃描電鏡
環巴胺處理的st43期的西伯利亞鱘仔魚和相應發育時期的對照組用混合固定液(4%PFA和2.5%戊二醛, 用0.1 M PBS稀釋) 4℃固定過夜, 再用0.1 mol/L PB于4℃清洗樣品6次, 每次15min。梯度酒精(30%—50%—70%—95%)脫水, 每個酒精濃度脫水各5min,最后無水酒精10min。接著CO2臨界點干燥, 噴金。最后用S-3400NⅡ掃描電鏡觀察并拍照。
1.5 FM1-43染色
將st44期西伯利亞鱘仔魚用PBS沖洗3次, 放入用胚胎水配制的0.1% FM1-43中染色2—5min, 再用胚胎水漂洗3次, 0.05% MS-222 (間氨基苯甲酸酯甲磺酸鹽)麻醉, 最后用SMZ-16體視顯微鏡觀察并拍照。
1.6 Hh信號通路相關基因的克隆
我們根據轉錄組測序中的序列信息, 利用IDT網站上設計引物工具設計了用以擴增Shh、Patched1 (Ptch1)、Smoothened (Smo)和Gli2四個基因部分編碼序列(CDS)的引物(表 1)。我們以西伯利亞鱘胚胎cDNA為模板, 加入設計好的引物, PCR擴增得到這4個基因的cDNA片段, 純化并連接pBSK載體, 轉化DH-5α感受態, 將陽性克隆送至上海生工生物技術有限公司測序鑒定。
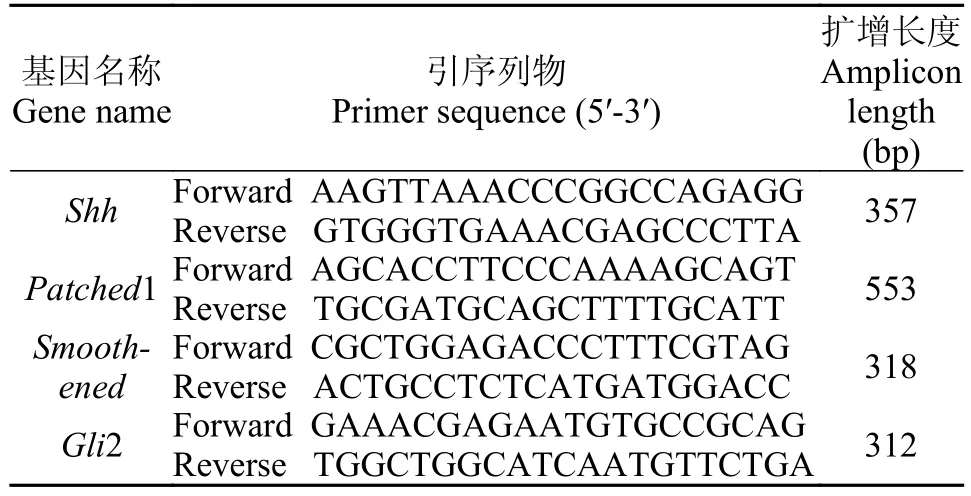
表 1 實驗所使用的引物序列Tab. 1 Primer sequences used in the current study
1.7 整體原位雜交
以連有目的基因片段的線性化重組質粒為模板, 用T7或T3 RNA聚合酶合成地高辛(DIG)標記的反義RNA探針。實驗前將玻璃容器于180℃高溫烘烤6h以上, 溶液用0.1%焦炭酸二乙酯(DEPC)處理過夜。首先將保存于-80℃甲醇中的西伯利亞鱘仔魚用3% H2O2溶液強光下脫色30min左右, 梯度甲醇(75%—50%—30%)復水, PBST洗滌3次, 每次各5min。再用蛋白酶K(1 μg/mL, sigma)于室溫消化10—30min, 新鮮4% PFA固定20min, PBST清洗4次,每次5min。然后將仔魚轉至預雜交液[50%去離子甲酰胺; 5×SSC (pH 7.0); 0.1% Tween20; 500 μg/mL酵母tRNA; 100 μg/mL肝素; 9.2×10-5mol/L檸檬酸]中于65℃孵育3h, 之后換為含探針(0.5 ng/μL)的雜交液65℃孵育過夜。次日依次經梯度2×SSC (25%—50%—75%—100%)稀釋的雜交液于65℃輕搖洗滌,各10min; 然后用0.2×SCC洗滌2次, 每次30min; 再經梯度0.2×SSC (75%—50%—25%)輕搖洗滌, 各10min; PBST洗滌1次, 10min。接著用封閉緩沖液[2%羊血清; 2 mg/mL小牛血清白蛋白(BSA)(用PBST配制)]室溫封閉仔魚3h, 再經抗DIG堿性磷酸酶聯抗體(按1∶5000用封閉緩沖液稀釋)于4℃下輕搖孵育過夜; PBST輕搖洗滌4次, 每次15min; 顯色緩沖液[100 mmol/L NaCl; 100 mmol/L Tris-HCl (pH 9.5); 50 mmol/L MgCl2; 0.1% Tween-20]洗滌3次, 每次5min; 于現配的NBT/BCIP顯色液中暗處染色30—60min; PBS洗滌3次, 每次15min; 甲醇洗滌30min; PBS洗滌3次, 每次5min; 新鮮4% PFA室溫固定20min; PBS洗滌3次, 每次5min; 最后將仔魚浸于100%甘油中待SMZ-16體視顯微鏡觀察拍照。
2 結果
2.1 神經丘和壺腹器官轉錄組中Hh信號通路基因的表達分析
我們的前期工作通過200 μmol/L新霉素破壞st44期西伯利亞鱘仔魚機械和電感覺毛細胞, 分別建立了0、12h和24h的cDNA文庫。我們發現Hh信號通路相關基因Shh、Smoothened、Patched1、Gli2在壺腹器官和神經丘的不同再生階段中都有表達,我們通過FPKM (Fragment Per Kilobase of exon model per Million mapped reads)對這幾個基因的表達進行了比較分析(圖 1)。Shh和Patched1的表達均隨感覺毛細胞的再生逐漸提高, 24 hpt時, Shh和Patched1在壺腹器官和神經丘的表達量最高, 且 0和24 hpt時在壺腹器官的表達量明顯高于神經丘,表達差異顯著(圖 1a、b)。Gli2和Smoothened的表達在感覺毛細胞再生的3個時間點未明顯改變, 僅12 hpt時Gli2基因在神經丘的表達上升, 且在神經丘的表達量明顯高于壺腹器官, 表達差異顯著(圖1c、d)。
2.2 環巴胺處理后神經丘和壺腹器官形態學觀察和表面結構變化
將st29期西伯利亞鱘胚胎經20 μmol/L環巴胺處理4d, 在st44期利用普通光學顯微鏡進行觀察, 對照組發育正常而處理組仔魚較對照組發育遲緩, 眼中晶狀體缺失且黑色素沉著較少, 觸須缺或變短,上下唇缺失, 卵黃囊較大, 背鰭、尾鰭發育不完整,軀干后部呈彎曲狀(圖 2)。
為具體闡明環巴胺對西伯利亞鱘仔魚神經丘和壺腹器官的影響, 我們利用掃描電鏡, 觀察st43期西伯利亞鱘頭部腹面形態結構。與對照組相比, 處理組仔魚頭部腹面受環巴胺影響較大, 口部僅有開口未見唇發育, 觸須短到幾乎沒有(圖 3a、b), 這與光鏡觀察到的結果相似。處理組頭部腹面側線區域神經丘和壺腹器官分布與對照組相比沒有明顯異常, 也主要分為眶下管和眶下管背腹兩側的壺腹區(圖 3c、d)。但神經丘開口明顯比對照組小, 且形狀不規則(圖 3e、f)。處理組頭部腹面側線區域壺腹器官數量明顯少于對照組(圖 3c、d), 且壺腹器官明顯小于對照組, 形狀不規則(圖 3g、h)。經t test統計學分析顯示, 處理組頭部腹面壺腹器官數量與對照組相比, 差異及其顯著, 而處理組神經丘數量無明顯變化(圖 3i)。以上結果反映了環巴胺對西伯利亞鱘仔魚側線系統表面結構的影響, 我們還利用FM1-43熒光染料標記st44期功能性神經丘, 分析了環巴胺對神經丘的影響。結果表明: 與對照組相比, 環巴胺處理組功能性神經丘數量也無明顯差異(圖 4a、b)。
圖 1 神經丘和壺腹器官再生過程中Hh信號通路相關基因的表達Fig. 1 Gene expression of Hh signaling during hair cell regeneration in neuromasts and ampullary organShh、Patched1、Smoothened、Gli2是與Hh信號通路關鍵基因; hpt為新霉素處理后時間; FPKM. 每1百萬個map上的reads中映射到外顯子的每1千個堿基上的片段個數; NM: 神經丘; AO. 壺腹器官; *: P<0.05; **: P<0.01Shh, patched1, smoothened and Gli2 is key genes of Hh signaling pathway; hpt for hours post neomycin treatment; FPKM. Fragment Per Kilobase of exon model per Million mapped reads; NM. neuromast; AO. ampullary organ; *: P<0.05; **: P<0.01

圖 2 環巴胺對西伯利亞鱘仔魚(44期)形態的影響Fig. 2 The effect of cyclopamine on the morphology of Siberian sturgeon larva (st44)a. 對照組; b. 環巴胺處理組; e. 眼睛; v. 觸須; l. 唇; ys. 卵黃囊; df. 背鰭; tf. 尾鰭; 標尺為1 mma. control group; b. cyclopamine treatment group. e. eye; v. vibrissa; l. lip; ys. yolk sac; df. dorsal fin; tf. tail fin. The scale bar, 1 mm
2.3 Shh、Patched1、Smoothened、Gli2基因在西伯利亞鱘頭部的表達

圖 3 st43西伯利亞鱘頭部腹面觀掃描電鏡圖Fig. 3 The scanning electron micrographs of the ventral view of the head of Siberian sturgeon of stage 43a. 對照組頭部腹面觀; b. 環巴胺處理組頭部腹面觀; c, d. 頭部腹面左側放大圖(長箭頭. 神經丘; 小箭頭. 壺腹器官); e, f. 神經丘放大圖(長箭頭. 神經丘毛細胞); g, h. 壺腹器官放大圖(小箭頭. 壺腹器官感覺細胞); i. 神經丘和壺腹器官數量統計學分析圖; NM. 神經丘; AO. 壺腹器官a. head ventral view of control group; b. head ventral view of cyclopamine treatment group; c, d. higher magnification of the ventral part of the head on the left side (the long arrows refer to neuromasts; head arrows refer to ampullary organs); e, f. higher magnification of the neuromast (the long arrows refer to the hair cells of neuromasts); g, h. higher magnification of the ampullary organ (head arrows refer to the sensory cells of ampullary organs); i. statistical analysis chart of the number of neuromasts and ampullary organs; NM. neuromast; AO. ampullary organ
為了說明環巴胺對西伯利亞鱘仔魚發育的一系列影響是其作用于Hh信號的結果, 我們通過整體原位雜交分析了Shh、Patched1、Smoothened、Gli2基因在西伯利亞鱘環巴胺處理組和對照組中的表達。結果顯示在st32和st36期的西伯利亞鱘中, Shh、Patched1、Smoothened、Gli2基因的表達較為廣泛,都在中樞神經系統、聽囊、鰓弓和脊索中表達, 與對照組相比, 環巴胺處理組Patched1和Gli2的表達減弱, 而Shh和Smoothened表達未發生變化(圖 5 st32, st36)。從st41期開始, 這幾個基因的表達量明顯下降, 表達范圍縮小, 主要集中于眼眶下和上下唇區域。環巴胺處理的西伯利亞鱘Shh基因在腹側眼眶下區域有微弱表達, 且在上下唇區域強烈表達; Smoothened基因在腹側眼眶下區域和上下唇區域均有微弱表達。相對對照組, Shh和Smoothened的表達均有所減弱。在環巴胺處理后的仔魚中, Patched1、Gli2基因在腹側眼眶下區域和上下唇區域幾乎不表達, 均與對照組的表達差異明顯(圖 5 st41)。
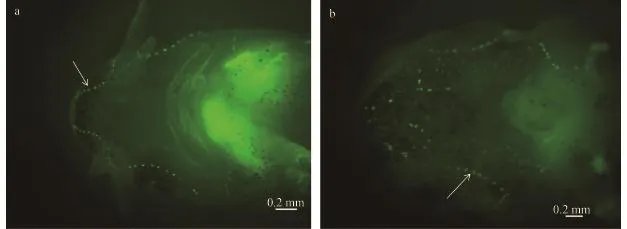
圖 4 st44西伯利亞鱘頭部腹面觀FM1-43熒光染色Fig. 4 Ventral view of the head of Siberian sturgeon by FM1-43 fluorescent staining of stage 44a. 對照組頭部腹面觀; b. 環巴胺處理組頭部腹面觀; 箭頭表示神經丘; 標尺為0.2 mma. head ventral view of control group; b. head ventral view of cyclopamine treatment group. The arrows label the neuromasts. The scale bar. 0.2 mm
3 討論
電感受器是一類低等水生脊椎動物特有的感覺器官, 且在系統進化中出現-消失-再出現。本研究以西伯利亞鱘仔魚為模型, 發現了Hh信號通路基因在兩類感受器間的差異表達, 且Hh抑制劑處理特異性降低了壺腹器官的數量, 首次揭示了Hh信號通路與神經丘和壺腹電感受器分化之間的相關性。研究表明: Hh信號可誘導脊髓神經元, 動-靜脈血管, 內耳-側線感覺細胞的分化[9,14,15]。
我們比較了再生過程中壺腹器官和神經丘轉錄組數據中Hh信號相關基因的差異。其中Shh和Patched1在再生不同階段動態性表達, 同時在神經丘和壺腹器官兩類感覺器官中呈現顯著的表達差異(再生中的壺腹器官表達顯著高于神經丘)。研究已發現大量的再生調控基因是胚胎發育關鍵基因的重新激活[16—18], 與之類似, 我們發現Shh信號相關基因同時也在西伯利亞鱘胚胎發育的頭部腹面口前區(壺腹集中的一個區域)表達。由于神經丘和壺腹器官緊密相鄰, Shh信號在兩類感受器發育過程中是否存在差異還有待進一步研究。由于側線系統中神經丘和壺腹器官在發育過程中難以分辨和解剖, 無法直接分析兩類感受器的轉錄組差異,進而找到它們的分化機制。我們發現通過再生的壺腹器官和神經丘中表達的基因是鑒定發育調控基因的一條有效途徑。
為了進一步印證Hh信號途徑與壺腹器官發育的關系, 我們利用20 μmol/L環巴胺處理側線系統發育前(st29)的西伯利亞鱘胚胎。我們發現環巴胺處理導致Hh信號相關基因在st41表達下降, 表明我們所選用的環巴胺處理條件在西伯利亞鱘胚胎中特異的抑制了Hh信號。環巴胺處理后的胚胎表型主要包括晶狀體、觸須和唇缺失, 背鰭、尾鰭發育不完整, 這與其他研究發現Hh信號參與脊椎動物的晶狀體和附肢發育相一致[19,20]。我們在此基礎上利用掃描電鏡和熒光染料染色, 發現環巴胺還抑制了西伯利亞鱘仔魚中神經丘的發育, 且對壺腹器官發育的作用更顯著。
我們通過整體原位雜交, 在分子水平上分析了Shh、Patched1、Smoothened、Gli2基因在西伯利亞鱘中的表達, 結果表明在st32和st36期的西伯利亞鱘中, Shh、Patched1、Smoothened、Gli2基因的表達較為廣泛, 環巴胺處理組Patched1和Gli2的表達減弱, 而Shh和Smoothened表達未發生變化。環巴胺是通過影響Smoothened蛋白的活化而特異性抑制Hedgehog信號, 且環巴胺的直接效應是抑制Hedgehog信號靶基因Patched1和Gli2的表達[13,21]。而從st41期開始, 這幾個基因的表達范圍縮小, 主要集中于眼眶下和上下唇區域。環巴胺處理的西伯利亞鱘Shh基因在腹側眼眶下區域有微弱表達, 且在上下唇區域強烈表達; Smoothened基因在腹側眼眶下區域和上下唇區域均有微弱表達。相對對照組, Shh和Smoothened的表達有稍微減弱, 但差異不明顯, 這是由于環巴胺只是抑制smoothened蛋白從而阻斷Hh信號通路[13], 而對Shh和Smoothened基因的表達沒有太大影響。在環巴胺處理后的仔魚中, Patched1、Gli2基因在腹側眼眶下區域和上下唇區域幾乎不表達, 均與對照組的表達差異明顯, 可能是因為環巴胺直接與smoothened蛋白緊密結合抑制smoothened的活性, 從而抑制下游通路, 這時下游的Gli蛋白在蛋白酶體內被截斷, 并以羧基端被截斷的形式進入細胞核內, 變成轉錄阻遏因子, 抑制下游靶基因Patched1、Gli2的轉錄[13,21]。
我們運用轉錄組測序分析、整體原位雜交等實驗技術, 在分子水平上初步表明了Hedgehog可能參與西伯利亞鱘側線機械和電感受器的分化。隨著近年來CRISPR/Cas9特異基因敲除技術的不斷進步, 在西伯利亞鱘中Hedgehog信號通路基因的特異性敲除將為我們提供更有利的證據。
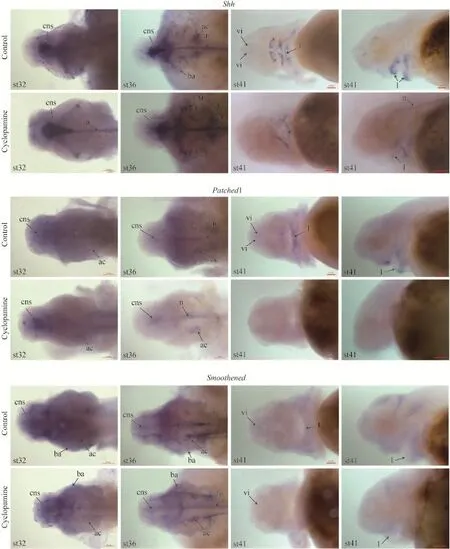
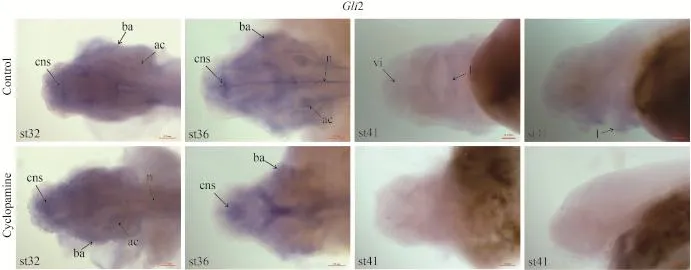
圖 5 Shh、Patched1、Smoothened、Gli2基因在西伯利亞鱘頭部的表達Fig. 5 The expression of Shh, Patched1, Smoothened and Gli2 in head of Siberian sturgeon st32, st36頭部背面觀; st41. 頭部腹面觀或側面觀; cns: 中樞神經系統; ac: 聽囊; ba: 鰓弓; n: 脊索; vi: 腹側眼眶下區域; l: 上下唇區域; 標尺為0.2 mmst32, st36. dorsal view; st41. ventral view or lateral view; cns: central nervous system; ac: auditory capsule; ba: branchial arch; n: notochord; vi: ventral infraorbital field; l: lip. The scale bar. 0.2 mm
[1]Northcutt R G, Catania K C, Criley B B. Development of lateral line organs in the axolotl [J]. Journal of Comparative Neurology, 1994, 340(4): 480—514
[2]Baker C V H, Modrell M S, Gillis J A. The evolution and development of vertebrate lateral line electroreceptors [J]. Journal of Experimental Biology, 2013, 216: 2515—2522
[3]Modrell M S, Buckley D, Baker C V H. Molecular analysis of neurogenic placode development in a basal rayfinned fish [J]. Journal of Genetics and Development, 2011, 49(4): 278—294
[4]Alcedo J, Ayzenzon M, Vonohlen T, et al. The Drosophila smoothened gene encodes a seven-pass membraneprotein, a putative receptor for the hedgehog signal [J]. Cell, 1996, 86(2): 221—231
[5]Stone D M, Hynes M, Armanini M, et al. The tumoursuppressor gene patched encodes a candidate receptor for Sonic hedgehog [J]. Nature, 1996, 384(6605): 129—134
[6]Marigo V, Davey R A, Zuo Y, et al. Biochemical evidence that patched is the Hedgehog receptor [J]. Nature, 1996, 384: 176—179
[7]Taipale J, Beachy P A. The Hedgehog and Wnt signalling pathways in cancer [J]. Nature, 2001, 411(6835): 349—354
[8]Sapede D, Pujades C. Hedgehog signaling governs the development of otic sensory epithelium and its associated innervation in zebrafish [J]. Journal of Neuroscience, 2010, 30(10): 3612—3623
[9]Koebernick K, Hollemann T, Pieler T. A restrictive role for Hedgehog signalling during otic specification in Xenopus [J]. Developmental Biology, 2003, 260(2): 325—338
[10]Platt C, Popper A N, Fay R R. The Ear as Part of the Octavolateralis System [M]. The Mechanosensory Lateral Line: Neurobiology and Evolution. Springer New York. 1989, 633—651
[11]Schlosser G, Kintner C, Northcutt R G. Development of neurogenic placodes in Xenopus laevis [J]. Journal of Comparative Neurology, 2000, 418(2): 121—146
[12]Song W, Song J K. Development of the lateral line system in juvenile Siberian sturgeon (Acipenser baerii) [J]. Zoological Research, 2012, 33(3): 261—270 [宋煒, 宋佳坤. 西伯利亞鱘仔魚側線系統的發育. 動物學研究, 2012, 33(3): 261—270]
[13]Taipale J, Chen J K, Cooper M K, et al. Effects of oncogenic mutations in Smoothened and Patched can be reversed by cyclopamine [J]. Nature, 2000, 406(6799): 1005—1009
[14]Briscoe J, Pierani A, Jessell T M, et al. A homeodomain protein code specifies progenitor cell identity and neuronal fate in the ventral neural tube [J]. Cell, 2000, 101(4): 435—445
[15]Williams C, Kim S H, Ni T T, et al. Hedgehog signaling induces arterial endothelial cell formation by repressing venous cell fate [J]. Developmental Biology, 2010, 341(1): 196—204
[16]Ma E Y, Rubel E W, Raible D W. Notch signaling regulates the extent of hair cell regeneration in the zebrafishlateral line [J]. Journal of Neuroscience, 2008, 28(9): 2261—2273
[17]Jiang L, Romero-Carvajal A, Haug J S, et al. Gene-expression analysis of hair cell regeneration in the zebrafish lateral line [J]. Proceedings of the National Academy of Sciences USA, 2014, 111(14): E1383—E1392
[18]Romero-Carvajal A, Navajas A J, Jiang L, et al. Regeneration of Sensory Hair Cells Requires Localized Interactions between the Notch and Wnt Pathways [J]. Developmental Cell, 2015, 34(3): 267—282
[19]Yamamoto K, Nakayama A, Yamamoto Y, et al. Val216 decides the substrate specificity of alpha-glucosidase in Saccharomyces cerevisiae [J]. European Journal of Biochemistry, 2004, 271(16): 3414—3420
[20]Dahn R D, Davis M C, Pappano W N, et al. Sonic hedgehog function in chondrichthyan fins and the evolution of appendage patterning [J]. Nature, 2007, 445(7125): 311—314
[21]Jiang J, Hui C C. Hedgehog signaling in development and cancer [J]. Developmental Cell, 2008, 15(6): 801—812
THE INITIAL EVIDENCE FOR HEDGEHOG SIGNALING INVOLVED IN THE DIFFERENTIATION OF MECHANORECEPTORS AND ELECTRORECEPTORS IN THE LATERAL LINE SYSTEM IN SIBERIAN STURGEON
TANG Zhi-Jiao1,2,3, FAN Chun-Xin1,2,3, WANG Jian1,3and SONG Jia-Kun1,2,3
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 2. Institute for Marine Biosystem and Neurosciences, Institute for Marine Sciences, Shanghai Ocean University, Shanghai 201306, China; 3. Key Laboratory of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China)
The lateral line system of some amphibians, all chondrichthyan and non-neopterygian fish is consisted of mechanoreceptors and electroreceptors that are originated from lateral line placodes. However, the molecular mechanism of mechanoreceptor and electroreceptor differentiation remains unclear. Hedgehog is a critical morphogen for pattern formation and stem cell differentiation of multiple organs. In this study, we investigated the relationship between hedgehog signaling and the differentiation of neuromast and ampullary organ in Siberian sturgeon. We found dynamic expression of Shh and Patched1 via the transcriptome analysis in regenerating neuromast and ampullary organ. Furthermore, inhibiting hedgehog signaling by cyclopamine from stage 29 to stage 37 reduced the number of ampullary organs specifically. In addition, cyclopamine repressed the expression of Shh, Patched1, Smoothened, and Gli2 in the ventral region of head. These results indicated that hedgehog signaling was related with the development ampullary organ in Siberian sturgeon.
Siberian sturgeon; Neuromast; Ampullary organ; Hedgehog signaling; Cyclopamine
Q344+.1
A
1000-3207(2017)02-0363-08
10.7541/2017.44
2016-03-15;
2016-06-24
上海海洋大學國際海洋研究中心(A-0209-15-0802); 上海高校水產學一流學科建設項目(A2-2019-14-0001-4); 上海市教委創新項目(12YZ129); 上海海洋大學博士啟動基金(A2-0203-00-100314)資助 [Supported by the International Center for Marine Studies, Shanghai Ocean University (Sensory Neurobiology A-0209-15-0802); Shanghai Universities First-class Disciplines Project of Fisheries (A2-2019-14-0001-4); Innovation Program of Shanghai Municipal Education Commission (12YZ129); Shanghai Ocean University Doctoral Scientific Research Foundation]
唐智嬌(1990—), 女, 江西贛州人; 碩士研究生; 主要研究方向為神經發育生物學。E-mail: zjtang2016@163.com
范純新, E-mail: cxfan@shou.edu.cn

