日本鰻鱺TLR21基因的鑒定、免疫應答與啟動子分析
李春艷黃 貝熊 靜彭喜霞梁 英聶 品黃文樹,
(1. 集美大學水產學院, 廈門 361021; 2. 鰻鱺現代產業技術教育部工程研究中心, 廈門 361021; 3. 中國科學院水生生物研究所淡水生態與生物技術國家重點實驗室, 武漢 430072; 4. 福建省海洋生物資源開發利用協同創新中心, 廈門 361005)
日本鰻鱺TLR21基因的鑒定、免疫應答與啟動子分析
李春艷1,2黃 貝1,2熊 靜1,2彭喜霞1,2梁 英1,2聶 品1,3黃文樹1,2,4
(1. 集美大學水產學院, 廈門 361021; 2. 鰻鱺現代產業技術教育部工程研究中心, 廈門 361021; 3. 中國科學院水生生物研究所淡水生態與生物技術國家重點實驗室, 武漢 430072; 4. 福建省海洋生物資源開發利用協同創新中心, 廈門 361005)
為研究TLR21 (Toll like receptor 21)在低等脊椎動物中的功能及表達調控機制, 我們擴增獲得了日本鰻鱺TLR21 (AjTLR21)cDNA序列, 其編碼的蛋白具有TLR家族的共同特征。AjTLR21基因結構與其他魚類和兩棲類TLR21相同, 由單個外顯子編碼。熒光定量結果顯示, AjTLR21在血液、鰓、脾臟、中腎等11個組織/器官中轉錄表達, 其中在血液中表達量最高。經Poly I:C誘導后8h, AjTLR21在脾臟和中腎中的表達量顯著性上調;誘導后16h, AjTLR21在血液、鰓、腸和脾臟中的表達量顯著性上調(P<0.05)。雙熒光素酶報告基因結果顯示,在AjTLR21 5′上游調控序列-1179 bp到+117 bp存在Poly I:C調節的正調控元件。經Edwardsiella tarda誘導后16h和72h, AjTLR21分別在血液和中腎組織的表達量顯著性上調, 表明AjTLR21同時也參與了抗細菌免疫應答,其在機體免疫系統中的功能具有多樣性。研究對于理解日本鰻鱺AjTLR21的免疫學功能具有重要的理論意義和應用價值。
日本鰻鱺; TLR21; 基因表達; 免疫應答; 啟動子
天然免疫系統是機體抵御病原入侵的第一道防線, Toll樣受體(Toll like receptors, TLRs)是天然免疫系統中的重要成分之一[1]。TLRs是可識別入侵微生物的病原相關分子模式(Pathogen associated molecular patterns, PAMPs), 包括細菌的脂多糖、脂肽、肽聚糖、糖脂、鞭毛蛋白、核苷酸等成分;真菌的酵母聚糖, 磷脂甘露糖、甘露聚糖等成分;寄生蟲的甘油肌磷脂、瘧原蟲色素、弓形體膠原蛋白樣分子(Profilin-like molecule)等成分; 病毒DNA、雙鏈/單鏈RNA分子、外殼蛋白等[2]。TLRs是Ⅰ型跨膜蛋白, 其胞外區為多個富含亮氨酸的重復序列(Leucine-rich repeat, LRR), 主要行使識別功能。胞內區含TIR結構域(Toll-IL-1 receptor domain, TIR結構域), 可募集同樣含有TIR結構域的銜接分子如髓樣分化因子88 (Myeloid differentiation primary response gene 88, MyD88)或β干擾素TIR結構域銜接蛋白[Toll/interleukin 1 receptor (TIR)-domain-containing adaptor protein inducing interferonβ, TRIF]等, 通過級聯反應, 將信號向下游傳遞, 進而調節靶基因的表達[3]。
迄今為止, 在人類中共克隆獲得10個TLR基因(TLR1—10, 其中TLR11為假基因)[4], 而硬骨魚類中目前已鑒定獲得了至少17種不同的TLR。其中, TLR14及TLR19—23、TLR25、TLR26是首先在硬骨魚類中被克隆、鑒定[5,6]。TLR21基因最早發現于河豚中, 且在人和小鼠基因組中未能發現其直系同源物, 一度被認為是一個魚類特有的TLR基因[7]。此后, 研究人員相繼從爪蟾[8]和紅原雞[9,10]中鑒定獲得了該基因。鳥類TLR21定位于內質網和內溶酶體, 其功能與哺乳動物TLR9類似, 參與識別病原微生物的CpG寡脫氧核苷酸。由于缺乏鳥類TLR9基因, TLR21被認為是TLR9的替代者[10], 有趣的是,魚類同時具有中TLR9和TLR21基因[11]。斑馬魚TLR21和TLR9具有相似的表達模式, 在胚胎發育早期就能檢測到其表達。在成魚中, TLR21和TLR9大量表達于免疫相關組織中, 包括腸、脾臟和腎臟[12]。斑馬魚TLR9廣泛識別不同基序的CpG-ODN。相比于其他CpG-ODN, 包含GACGTT或AACGTT基序的CpG-ODN可顯著上調TLR9介導的NF-κB的活化, 而斑馬魚TLR21則對包含GTCGTT基序的CpGODN的響應最為強烈[12]。已有研究表明, 魚類TLR21基因的表達具有多樣性。斑點叉尾TLR21基因廣泛表達于除肌肉外的各組織器官中[13]; 斜帶石斑魚TLR21基因主要表達于頭腎、中腎、脾臟和心臟中, 刺激隱核蟲感染后, 斜帶石斑魚的皮膚和鰓組織中TLR21基因表達量顯著上調[14]。牙鲆TLR21基因主要表達于鰓和脾臟中, 在血液、心臟, 肌肉中的表達量較低, 而在頭腎組織中表達量最低。鰻弧菌(Vibrio anguillarum)、CpG ODN和Poly I:C均可上調牙鲆TLR21基因的表達[15]。
鰻鱺(Anguilla spp.)是我國重要的養殖魚類, 特別是近十年來, 鰻鱺養殖發展迅速, 2014年, 我國鰻鱺產量近2.2×108kg, 主要集中在福建、廣東和江西三省[16]。由于養殖所需鰻苗完全依靠天然捕撈,在鰻苗資源逐年下降的背景下, 病害防治在鰻鱺養殖中的地位尤顯重要。目前, 有關鰻鱺免疫反應機理的研究較為匱乏, 對于鰻鱺免疫系統如何識別病原, 及針對所識別病原引發的免疫反應的分子機理未見報道。本研究首次克隆獲得了日本鰻鱺TLR21基因, 并對其基因結構、在不同病原感染狀態下的表達規律以及啟動子區域進行了初步分析。本研究結果有助于深入了解鰻鱺的抗病機制, 奠定其病害防治的免疫學基礎。另一方面, 對不同進化類群魚類的免疫系統的研究, 可豐富魚類先天免疫的理論, 有助于認識脊椎動物免疫系統的進化規律。
1 材料與方法
1.1 實驗動物
日本鰻鱺(203±53) g購于福建省集美大學水產養殖基地, 實驗前暫養2周, 養殖水溫 (28±2)℃。采樣前用0.05%的丁香酚麻醉。采集血液、鰓、心臟、肝臟、腸、胃、脾臟、中腎、鰾、皮膚和性腺用以研究AjTLR21在不同組織中的分布。免疫刺激實驗分組設置: 設PBS對照組、Poly I:C刺激組(1 mg/100 g魚, Sigma)、LPS刺激組(1 mg/100 g魚, Sigma)、遲緩愛德華氏菌(Edwardsiella tarda)刺激組(2×107cfu/100 g魚)。分別在腹腔注射8h、16h、 24h和72h后采樣, 每組每個時間點隨機取鰻鱺8尾,每尾魚分別采集上述組織/器官用以研究免疫刺激后AjTLR21的基因表達變化。采集血液及組織/器官樣品的處理參考本實驗室以前的研究[17]。
1.2 基因組DNA、RNA提取以及cDNA合成
采用MiniBEST Universal Genomic DNA Extraction Kit Ver.4.0試劑盒(TaKaRa, 日本)提取日本鰻鱺基因組DNA。總RNA提取參照Trizol?reagent試劑盒說明書。利用瓊脂糖凝膠電泳法檢測總RNA/DNA的完整性, 采用分光光度計NanoDrop 2000 (Thermo, 美國)檢測RNA或DNA的濃度及純度。
脾臟總RNA經RNase-free DNase Ⅰ (New England Biolabs Inc, 美國)處理后, 利用反轉錄試劑盒SMARTerTMRACE cDNA Amplification Kit (Clontech, 美國)合成第一鏈, 制備RACE PCR模板。
參照GoScripTMReverse Transcription System反轉錄試劑盒(Promega, 美國)說明書, 取4 μg各組織總RNA進行反轉錄用以制備熒光定量模板。所制備模板用1×TE buffer稀釋后保存于-20℃備用。
1.3 日本鰻鱺TLR21 cDNA、基因組以及啟動子序列克隆
以斑馬魚TLR21基因作為種子序列, 對日本鰻鱺基因組數據(GenBank登錄號: AVPY00000000.1)進行比對, 利用Primer Premier 6.0 軟件對所獲得最佳匹配序列的潛在編碼區設計引物(表 1)。以脾臟cDNA為模板進行PCR擴增。反應體系為: cDNA 1 μL, 上下游引物(表 1, 10 μmol/L)各1 μL, Taq DNA聚合酶(2.5 U/μL, HSTMKit, 東盛生物)0.25 μL, 2 ×HSTMReaction Mix 12.5 μL, 補充無菌水至總體積為25 μL, 反應條件為: 94℃預變性3min后; 94℃變性30s, 56℃退火30s, 72℃延伸 2min, 運行35個循環; 72℃延伸10min。根據獲得的中間片段設計RACE引物, 參照SMARTer試劑盒說明書進行PCR,獲得AjTLR21 cDNA全長。PCR反應條件為: 94℃預變性3min后; 94℃變性30s, 62℃退火30s, 72℃延伸2min, 運行7個循環; 94℃ 變性30s, 60℃ 退火30s, 72℃ 延伸2min, 18個循環; 72℃延伸10min。從第一輪PCR擴增產物中取1 μL做為第二輪PCR反應的模板, 反應條件同上, PCR反應運行35個循環。
以肌肉基因組DNA為模板, 引物Ex_TLR21_F和Ex_TLR21_R (表 1)進行擴增AjTLR21基因組全長。PCR反應體系: 基因組DNA 1 μL, 上下游引物(10 μmol/L)各1 μL, LA Taq DNA聚合酶(5 U/μL, TaKaRa, 日本)0.25 μL, 10 × LA PCR Buffer Ⅱ(Mg2+Plus) (TakaRa, 日本)2.5 μL, dNTP Mixture (2.5 mmol/L)4 μL, 補充無菌水至總體積為25 μL。反應條件為: 94℃ 預變性3min; 94℃ 變性30s, 64℃退火30s, 72℃ 延伸2min, 35個循環, 72℃延伸10min。
根據本地比對到的基因組序列, 設計5′側翼序列引物, 以肌肉基因組DNA為模板進行PCR擴增。利用JASPAR數據庫(http://jaspar.genereg.net/)分析其潛在的轉錄因子結合位點。根據位點設計引物(表 1), 構建全長及5個缺失表達載體并分別命名為pGL-3-TLR21P1- pGL-3-TLR21P6。
1.4 AjTLR21的轉錄表達研究
熒光定量PCR在Lightcycler 480 Ⅱ PCR儀(Roche, 德國)上進行。參照Lightcycler 480 SYBR Green I試劑盒(Roche, 德國)說明設置PCR反應體系, 體系如下: cDNA模板4 μL, 正反向引物(qTLR21F/ qTLR21R, 10 μmol/L)各0.25 μL, LightCycler 480 SYBR Green I Master (2×) 10 μL, 補充水至20 μL。反應條件: 95℃變性20 s, 58℃退火 20s, 72℃延伸25s, 80℃采集熒光信號, 運行40個循環。反應結束后分析擴增產物的溶解曲線, 檢驗擴增產物的特異性。
以β-actin作為內參基因。梯度稀釋已知拷貝數的AjTLR21和β-actin質粒樣品, 與組織/器官樣品同時進行PCR擴增, 繪制標準曲線, 計算擴增的濃度以及引物擴增效率。AjTLR21基因表達量用βactin進行校準; 刺激前后AjTLR21基因表達倍數變化是根據同一時間點(實驗組AjTLR21基因表達量)/ (對照組AjTLR21基因表達量)來表示[18]。
數據用Excel軟件和DPS軟件進行計算, 用單因素方差分析法和Student t test分析不同組織樣品和免疫原刺激樣品間AjTLR21表達量差異。P<0.05表示差異顯著, P<0.01和P<0.001表示差異極顯著。利用GraphPad.Prism.v5.0軟件進行作圖。
1.5 雙熒光素酶報告基因分析
將回收純化后的PCR產物TLR21P1-TLR21P6和熒光素酶報告基因pGL-3-Basic載體(Promega公司)經過BglⅡ/KpnⅠ雙酶切。酶切產物進行回收純化后, 利用T4 DNA連接酶將目的片段和載體連接, 構建獲得AjTLR21啟動子熒光素酶報告基因載體, 并將其分別命名為pGL-3-TLR21P1 (-1875/+117)、pGL-3-TLR21P2 (-1555/+117)、pG-L3-TLR21P3 (-1179/+117)、pGL-3-TLR21P4 (-907/+117)、pGL-3-TLR21P5 (-635/+117)、pGL-3-TLR21P6 (-332/+ 117)。
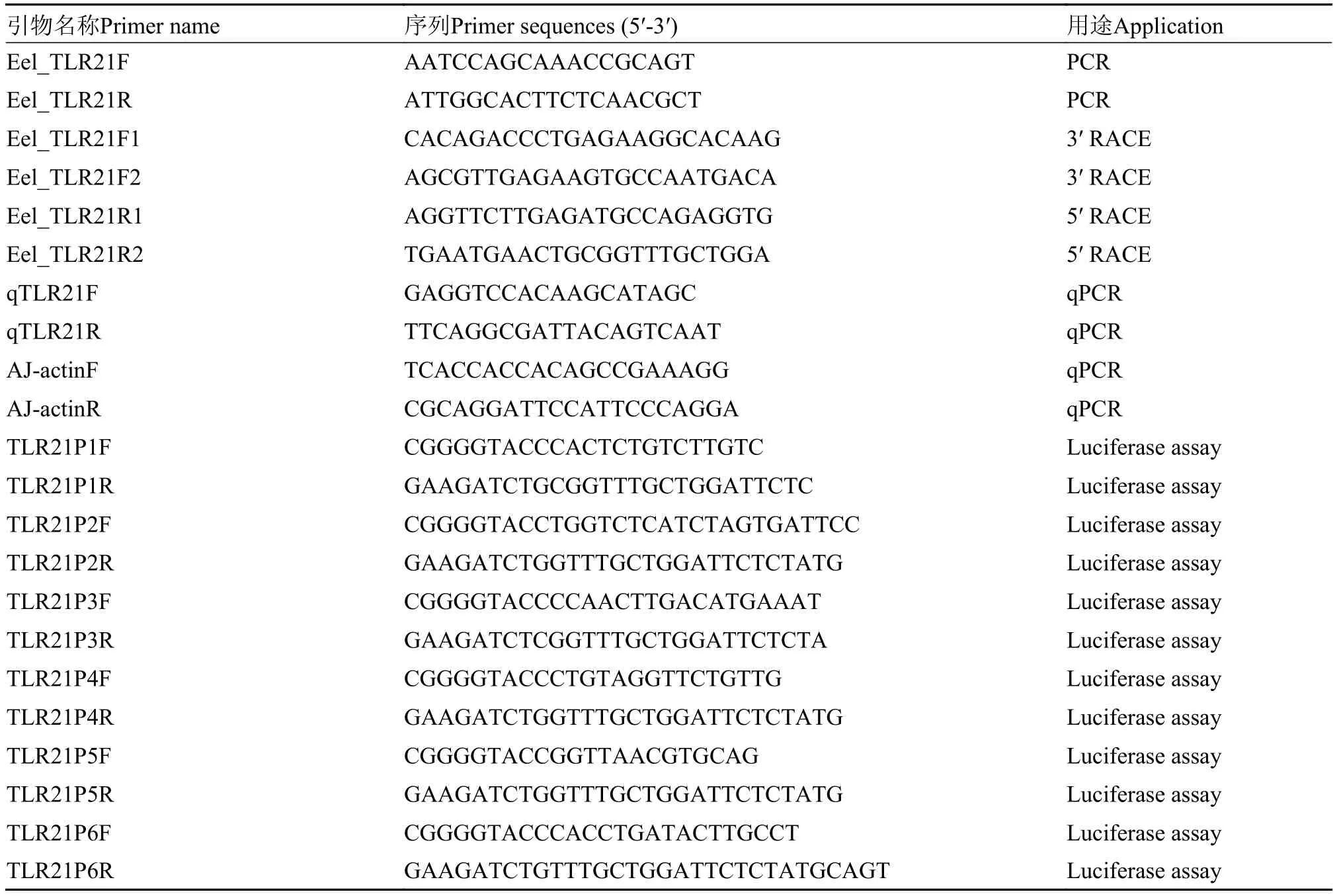
表 1 所用引物序列Tab. 1 Primers used in the study
用Endo-free Plasmid Mini Kit Ⅱ試劑盒(Omega, 美國)提取質粒。細胞轉染利用Lipofectamine3000試劑盒(Invitrogen, 美國), 按照產品說明書進行轉染。轉染前1天, 細胞以1×104/孔的密度接種于24孔板上。HEK293在含10%胎牛血清、100 Units/mL青霉素和100 μg/mL鏈霉素的高糖型DMEM培養基(Gibco, 美國)中培養, 培養條件為37℃、5% CO2, 細胞用0.25%胰蛋白酶-EDTA (Gibco, 美國)進行消化傳代。轉染時, pGL-3-TLR21P1-pGL-3-TLR21P6或pGL-3 Basic與pRL-TK共轉染HEK293細胞, 其中pRL-TK作為內參質粒。用Promega公司的Dual-Luciferase Reporter Assay System (E1910)進行樣品熒光素酶活性檢測。
1.6 序列生物信息學分析

圖 1 日本鰻鱺TLR21和其他脊椎動物TLR21基因結構及TIR結構域的比較Fig. 1 Comparative analysis in gene structure and TIR domain of TLR21 in vertebrates多重比對灰色部分表示TIR結構域上3個保守基序: Box1-Box3在序列上方注釋; 序列上方的箭頭表示TIR結構域二級結構中的β折疊,矩形框表示α螺旋The grey parts in the alignments indicate three conserved motifs of TIR domain, Box1-Box3 that annotated above the sequence. The arrows above the sequence represent β folding structure of TIR domain, and the boxes represent α helix
如圖 1, 用NCBI網站中的Blast (http://blast.ncbi. nlm.nih.gov/Blast.cgi)進行序列查找, 利用ExPASy的翻譯工具(http://web.expasy.org/translate/)推導AjTLR21的氨基酸序列, ExPASy (http://web.expasy. org/compute_pi/)預測分子量和pI值, 用SignalP 4.1 Server程序(http://www.cbs.dtu.dk/services/SignalP/)分析信號肽, 用SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi)預測LRRs、TIR結構域和跨膜區; Phyre2程序(http://www.sbg.bio.ic.ac.uk/ phyre2/html/page.cgi?id=index)預測AjTLR21 TIR結構域的二級結構。利用DNAman軟件對AjTLR21的TIR結構域進行氨基酸序列的多重比對, 應用MEAG6.0軟件, 采用鄰位相接法(NJ法)構建系統發育樹。其他魚類基因組數據來源于Ensembl數據庫(http:// asia.ensembl.org/index.html)。
2 結果
2.1 日本鰻鱺TLR21基因序列分析
日本鰻鱺TLR21cDNA全長為4013 bp (AjTLR 21 GenBank登錄號: KU950320), 其中開放閱讀框(ORF)2937 bp, 5′ UTR 447 bp, 3′ UTR 629 bp。ORF編碼978個氨基酸, 其分子量為112.60 kD, pI為8.92。基因結構分析結果顯示, AjTLR21的結構類似于其他魚類TLR21, 由單個外顯子編碼。氨基酸序列結構分析結果顯示, AjTLR21由胞外區、跨膜區和胞內區構成, 其胞外區含有一個信號肽、14個LRRs, 各LRR都包含“LxxLxLxxN”這一共同基序;跨膜區為單次跨膜, 屬于Ⅰ型跨膜蛋白; 胞內區含有TIR結構域, 并含有3個典型基序: Box1 (FDAFISY), Box2 (LCY/LxxRDxLPG), Box3 (FW)(圖 1)。序列同源性比對分析結果顯示AjTLR21成熟肽的氨基酸序列與大西洋鮭相似性達68.2%; 其次為條石鯛和蟾胡鯰, 分別為65.74%和65.33% (表 2)。AjTLR21的TIR結構域也是與大西洋鮭相似性最高, 其次為蟾胡鯰和斑點叉尾。將硬骨魚類TLR21和其他脊椎動物TLRs氨基酸序列用MEGA6.0軟件構建了NJ系統進化樹(Jones Taylor Thornton model, JTT模型)。系統進化樹的拓撲結構表明: 脊椎動物TLR21聚為一枝, 然后再與魚類TLR19、TLR20、TLR22、TLR23、TLR26以及小鼠TLR11聚為一枝, 并與小鼠其他TLR分開(圖 2)。
2.2 AjTLR21基因在不同組織中的分布
定量結果顯示, AjTLR21在所檢測的不同組織/器官中均有轉錄表達, 其中血液中的表達量最高,其平均表達量是β-actin的0.13倍(圖 3), 性腺中的表達量最低。

表 2 各物種TLR21的序列信息和相似性Tab. 2 Sequence information and similarity of TLR21
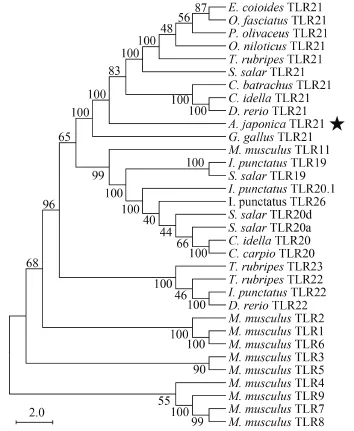
圖 2 魚類TLR21及脊椎動物TLRs系統進化分析Fig. 2 Phylogenetic analysis of teleost TLR21 and vertebrate TLRs節點上的數字表示為bootstrap的置信度。所用序列的Gen-Bank登錄號如下: 斜帶石斑魚TLR21 AEK49148.1; 條石鯛TLR21 AIT52504.1; 牙鲆TLR21 AFW04263.1; 羅非魚TLR21 AHK 13949.1; 紅鰭東方鲀TLR21 AAW69371.1; TLR22 AAW69372.1; TLR23 AAW70378.1; 蟾胡鯰TLR21 AGM39445.1; 草魚TLR20 AHH85805.1; TLR21 AGM21642.1; 斑馬魚TLR21 NP_0011-86264.1; TLR22 AAI63527.1; 日本鰻鱺TLR21 KU950320; 紅原雞TLR21 NP_001025729.1; 斑點叉尾TLR19 AEI59675.1; TLR20.1 AEI59676.1; TLR22 AEI59679.1; TLR26 AEI59681.1;大西洋鮭TLR19 CDH93609.2; TLR20a CDH93610.2; TLR20d CDH93613.1; TLR21 CDH93614.1; 鯉TLR20 AHN49762.1; 小鼠TLR1 AAG37302.1; TLR2 EDL15415.1; TLR3 AAH99937.1; TLR4 EDL31078.1; TLR5 AAI25248.1; TLR6 BAA78632.1; TLR7 AAI32386.1; TLR8 EDL40710.1; TLR9 EDL21125.1; TLR11 AAI09165.1Bootstrap values are indicated at nodes. GenBank accession numbers are as follows: E. coioides TLR21 AEK49148.1; O. fasciatus TLR21 AIT52504.1; P. olivaceus TLR21 AFW04263.1; O. niloticus TLR21 AHK13949.1; T. rubripes TLR21 AAW69371.1; TLR22 AAW69372.1; TLR23 AAW70378.1; C. batrachus TLR21 AGM39445.1; C. idella TLR20 AHH85805.1; TLR21 AGM21642.1; D. rerio TLR21 NP_001186264.1; TLR22 AAI63527.1; A. japonica TLR21 KU950320; G. gallus TLR21 NP_001025729.1; I. punctatus TLR19 AEI59675.1; TLR20.1 AEI59676.1; TLR22 AEI59679.1; TLR26 AEI59681.1; S. salar TLR19 CDH93609.2; TLR20a CDH93610.2; TLR20d CDH93613.1; TLR21 CDH93614.1; C. carpio TLR20 AHN49762.1; M. musculus TLR1 AAG37302.1; TLR2 EDL15415.1; TLR3 AAH99937.1; TLR4 EDL31078.1; TLR5 AAI25248.1; TLR6 BAA78632.1; TLR7 AAI32386.1; TLR8 EDL40710.1; TLR9 EDL21125.1; TLR11 AAI09165.1
2.3 免疫刺激后AjTLR21的基因表達變化
日本鰻鱺在感染遲緩愛德華氏菌后, 其血液中的AjTLR21的表達量在16h上調7.66倍(P<0.05)。而感染72h后, 其中腎組織中AjTLR21的表達量上調5.83倍(P<0.01)(圖 4)。Poly I:C能顯著誘導AjTLR21的上調表達。在刺激8h后, 脾臟中AjTLR21的表達量極顯著性上調(P<0.01)并達到最高水平, 為對照組的6.44倍, 隨后開始下降, 在16h后, Poly I:C刺激組的表達量為對照組的。Poly I:C刺激后16h, AjTLR21在血液、皮膚、鰓、腸和腎中的表達量顯著上調,分別為對照組的5.76、3.32、5.47、5.83和4.40倍(圖 5)。
2.4 AjTLR21啟動子活性分析
利用生物信息學軟件對我們所擴增得到的AjTLR21 5′側翼序列中所包含的潛在的轉錄因子結合位點進行分析, 發現其中含有C/EBP-β、AP-1、STAT 、NF-κB、IRF、Sp-1等轉錄因子結合位點(圖 6A)。對所獲得的TLR21 5′調控序列進行刪除突變。將截短后的片段與載體pGL-3 Basic相連, 構建重組質粒, 即pGL-3-TLR21P1- pGL-3-TLR 21P6。將重組質粒轉染到HEK293細胞中, 利用雙熒光素酶報告基因系統檢測啟動子活性。結果顯示, pGL-3-TLR21P1-pGL-3-TLR21P5的熒光素酶活性均顯著高于對照組, 分別為對照組的2.28、2.81、5.51、2.79、4.06倍(P<0.01), 其中pGL-3-TLR21P3的熒光素酶活性最高, 推測在該區域(-635/-332)具有控制AjTLR21啟動子轉錄活性的關鍵片段(圖 6B)。此外, 在Poly I:C(50 μg/mL)刺激下, 轉染pGL-3-TLR21P3的HEK293細胞的熒光素酶活性升高, 為對照組的2.59倍(圖 6C)。
3 討論
本研究首次從日本鰻鱺中克隆得到了TLR21基因, 并對其基因結構、表達模式和啟動子活性等進行了初步的研究。AjTLR21基因結構與已報道的硬骨魚類、兩棲類TLR21基因結構類似, 其編碼區無內含子[8,11,13,14,19,20]。而鳥類TLR21基因由兩個外顯子構成[21]。序列相似性比對分析結果顯示脊椎動物TLR21的胞外區的相似性為58%—63%, 跨膜區的相似性為44%—81%, 胞內區TIR結構域的相似性為64%—91%。這表明相比于其胞外區和跨膜區, TLR21的TIR結構域在脊椎動物進化的過程中更為保守。已有的研究揭示, TLR基因的胞外區主要由2—25個LRR結構域構成, 負責識別病原相關分子模式[22]。AjTLR21胞外區含有14個LRR重復序列, 除第6個LRR外, 其LRR重復序列中都含有典型的LxxLxLxxN基序, LRR6中第三位的亮氨酸被疏水性的苯丙氨酸所替代。在LxxLxLxxN基序中, 其側鏈中3個位置十分保守的亮氨酸用以形成疏水性核心, 天冬氨酸則可保持蛋白整體結構。其中亮氨酸偶有被疏水性氨基酸, 如纈氨酸、異亮氨酸和苯丙氨酸所替代, 末端的天冬氨酸可被蘇氨酸、絲氨酸和半胱氨酸所替代[4]。AjTLR21胞內段的TIR結構域含有3個保守的基序, Box1-Box3, 其中Box1與Box2形成β折疊, 主要參與信號轉導; Box3則形成α螺旋, 可與細胞骨架的相互作用, 介導受體在細胞內的定位[23,24]。位于Box2中的脯氨酸對TLR分子的信號轉導至關重要, 突變該位點的小鼠TLR4對LPS的刺激無應答[23,25]。斑馬魚TLR21 TIR結構域Box2的C827、R831和L835突變后, 對CpGODN的刺激無應答[12]。對魚類TLR21序列比對結果顯示, 日本鰻鱺TLR21分子的TIR結構域都具有這些保守的基序, 表明其信號轉導機制可能類似于斑馬魚TLR21和其他脊椎動物TLRs。

圖 3 TLR21基因在健康日本鰻鱺不同組織/器官中相對表達量Fig. 3 Expression of TLR21 in different tissues/organs from Japanese eelβ-actin為內參基因, 誤差線表示平均數±SEM (N≥3)β-actin served as an internal control. Vertical bars indicating the mean±SEM (N≥3)

圖 4 日本鰻鱺TLR21在遲緩愛德華氏菌刺激后的表達變化Fig. 4 Expression of AjTLR21 following the E. tarda stimulation in Japanese eel檢測腹腔注射遲緩愛德華菌8、16、24和72h后日本鰻鱺的血液、皮膚、鰓、腸、脾臟和中腎組織中AjTLR21表達量; 以β-actin為內參基因; 星號表示誘導組和對照組存在顯著性差異(*P<0.05, **P<0.01); 誤差線表示平均數±SEM; N≥4The fish were injected intraperitoneally with E. tarda and tissues, such as blood, skin, gill, intestine spleen and kidney, were collected at 8, 16, 24 and 72 hour post injection for expression analysis. β-actin served as an internal control. The asterisk (*) indicates the significant difference between induced and control group (*P<0.05, **P<0.01). Vertical bars represented the mean±SEM (N≥4)
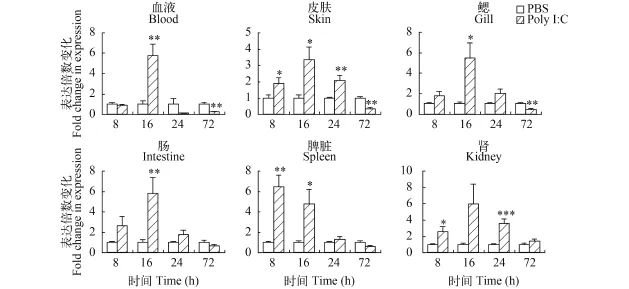
圖 5 日本鰻鱺TLR21在Poly I:C刺激后的表達變化Fig. 5 Expression of AjTLR21 following the Poly I:C stimulation in Japanese eel檢測腹腔注射Poly I:C 8、16、24和72h后日本鰻鱺的血液、皮膚、鰓、腸、脾臟和中腎組織中AjTLR21表達量; 以β-actin 為內參基因; 星號表示誘導組和對照組存在顯著性差異(*P<0.05, **P<0.01, ***P<0.001)。誤差線表示平均數±SEM; N≥4The fish were injected intraperitoneally with Poly I:C and tissues, such as blood, skin, gill, intestine spleen and kidney, were collected at 8, 16, 24 and 72 hour post injection for expression analysis. β-actin served as an internal control. The asterisk (*) indicates the significant difference between induced and control group (*P<0.05, **P<0.01, ***P<0.001). Vertical bars represented the mean±SEM (N≥4)

圖 6 AjTLR21啟動子活性分析Fig. 6 Analysis of AjTLR21 promoter activityA. AjTLR21的5′調控序列的潛在轉錄因子結合位點及報告基因構建模式圖, pGL-3-TLR21P1 (-1875/+117)、pGL-3-TLR21P2(-1555/+ 117)、pGL-3-TLR21P3(-1179/+117)、pGL-3-TLR21P4(-907/+117)、pGL-3-TLR21P5(-635/+117)、pGL-3-TLR21P6(-332/+117); B.在HEK293細胞中轉染AjTLR21啟動子缺失質粒; C. 用Poly I:C刺激HEK293細胞后的pGL-3-TLR21P3熒光素酶活性的變化。以pRLTK為內參, 誤差線表示平均數±SEM (N=4); 星號表示存在顯著性差異(***P<0.001)A. Schematic representation of AjTLR21 promoter construct and serial deletion constructs, pGL-3-TLR21P1 (-1875/+117, pGL-3-TLR21P2(-1555/+117), pGL-3-TLR21P3 (-1179/+117), pGL-3-TLR21P4 (-907/+117), pGL-3-TLR21P5 (-635/+117), pGL-3-TLR21P6 (-332/+117); B. HEK293 cells were cotransfected with the serial promoter constructs and pRL-TK which served as an internal control. C. Luciferase activity of pGL-3-TLR21P3 in HEK293 cells after stimulated by Poly I:C. pRL-TK was performed as an internal control. Vertical bars represented the mean±SEM (N=4). Asterisks (*) above each bar indicate significant difference (***P<0.001)
已有的研究表明, TLR21在不同硬骨魚中有不同表達模式。TLR21主要在大西洋鱈的腎臟、肝臟、鰓和精巢中表達[20]; 而草魚TLR21則在皮膚組織中表達量最高, 其次為脾臟和腸[26]。牙鲆TLR21在鰓和皮膚組織中表達量最高, 在頭腎組織中表達量最低[15]。大西洋鮭TLR21主要在脾臟、鰓、頭腎、肌肉和肝臟中表達。在本研究中, 熒光定量結果顯示日本鰻鱺TLR21基因在所檢測的不同組織/器官中均有轉錄表達, 其中血液中的表達量最高,其次為鰓、脾臟, 在性腺中表達量最低。Yeh等[12]通過體外實驗驗證, 斑馬魚TLR21主要參與識別含有GTCGTT基序的CpG寡脫氧核苷酸, 而對Poly I:C, LPS等無應答。在本研究中, 我們發現Poly I:C能顯著誘導日本鰻鱺脾臟組織AjTLR21上調表達,在刺激8h后, 其表達量最高。啟動子活性分析進一步證實了Poly I:C能顯著誘導AjTLR21的表達。日本鰻鱺感染遲緩愛德華菌后, 其血液和中腎組織中的AjTLR21表達量也顯著上調。Gao等[15]發現牙鲆TLR21在Poly I:C刺激或鰻弧菌感染1h后, 其表達量顯著上調, 在鰻弧菌感染4h后達到高峰。此外, 草魚感染呼腸孤病毒3h后, 其在鰓組織中TLR21基因顯著上調表達, 嗜水氣單胞菌可顯著上調草魚肝臟、脾臟中TLR21的表達[26]。條石鯛虹彩病毒、遲緩愛德華菌以及海豚鏈球菌均可顯著誘導石鯛脾臟組織中TLR21基因的上調表達, 表明TLR21參與了機體抗病毒、抗細菌的免疫應答[27]。有趣的是,在感染刺激隱核蟲的斜帶石斑魚的皮膚和鰓組織中, TLR21基因的表達量顯著上調[14]。這表明魚類TLR21在免疫系統中功能的具有多樣性。已有的研究揭示, TLR11家族成員多以異源二聚體形式行使其免疫識別的功能[28]。TLR21屬于TLR11家族, 魚類TLR21基因對多種免疫刺激物都有應答, 其免疫功能的多樣性是否源自于此, 亦或是TLR21基因的上調表達是機體為應對病原微生物感染所作出的次級應答, 還有待于進一步研究證實。
[1]Medzhitov R. Toll-like receptors and innate immunity [J]. Nature Reviews Immunology, 2001, 1(2): 135—145
[2]Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity [J]. Cell, 2006, 124(4): 783—801
[3]O'Neill L A, Bowie A G. The family of five: TIR-domain-containing adaptors in Toll-like receptor signaling [J]. Nature Reviews Immunology, 2007, 7(5): 353—364
[4]Kang J Y, Lee J O. Structural biology of the Toll-like receptor family [J]. Annual Review of Biochemistry, 2011, 80: 917—941
[5]Rebl A, Goldammer T, Seyfert H M. Toll-like receptor signaling in bony fish [J]. Veterinary Immunology and Immunopathology, 2010, 134(3—4): 139—150
[6]Palti Y. Toll-like receptors in bony fish: from genomics to function [J]. Developmental and Comparative Immunology, 2011, 35(12): 1263—1272
[7]Oshiumi H, Tsujita T, Shida K, et al. Prediction of the prototype of the human Toll-like receptor gene family from the pufferfish, Fugu rubripes, genome [J]. Immunogenetics, 2003, 54(11): 791—800
[8]Ishii A, Kawasaki M, Matsumoto M, et al. Phylogenetic and expression analysis of amphibian Xenopus Toll-like receptors [J]. Immunogenetics, 2007, 59(4): 281—293
[9]Brownlie R, Zhu J, Allan B, et al. Chicken TLR21 acts as a functional homologue to mammalian TLR9 in the recognition of CpG oligodeoxynucleotides [J]. Molecular Immunology, 2009, 46(15): 3163—3170
[10]Keestra A M, de Zoete M R, Bouwman L I, et al. Chicken TLR21 is an innate CpG DNA receptor distinct from mammalian TLR9 [J]. The Journal of Immunology, 2010, 185(1): 460—467
[11]Meijer A H, Gabby Krens S F, Medina Rodriguez I A, et al. Expression analysis of the Toll-like receptor and TIR domain adaptor families of zebrafish [J]. Molecular Immunology, 2004, 40(11): 773—783
[12]Yeh D W, Liu Y L, Lo Y C, et al. Toll-like receptor 9 and 21 have different ligand recognition profiles and cooperatively mediate activity of CpG-oligodeoxynucleotides in zebrafish [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(51): 20711—20716
[13]Baoprasertkul P, Xu P, Peatman E, et al. Divergent Toll—like receptors in catfish (Ictalurus punctatus): TLR5S, TLR20, TLR21 [J]. Fish and Shellfish Immunology, 2007, 23(6): 1218—1230
[14]Li Y W, Luo X C, Dan X M, et al. Molecular cloning of orange-spotted grouper (Epinephelus coioides) TLR21 and expression analysis post Cryptocaryon irritans infection [J]. Fish and Shellfish Immunology, 2012, 32(3): 476—481
[15]Gao H, Wu L, Sun JS, et al. Molecular characterization and expression analysis of Toll-like receptor 21 cDNA from Paralichthys olivaceus [J]. Fish and Shellfish Immunology, 2013, 35(4): 1138—1145
[16]Liu Z S, Li S M. China Fisheries Yearbook [M]. Beijing: China Agriculture Press. 2015, 315 [劉增勝, 李書民. 中國漁業年鑒. 北京. 中國農業出版社. 2015, 315]
[17]Duan M Z, Huang B, Liang Y, et al. Molecular cloning and expression analysis of a liver expressed antimicrobial peptide-2 in Japanese eel, Anguilla japonica [J]. Acta Hydrobiologica Sinica, 2016, 40(2): 252—260. [段明珠, 黃貝, 梁英, 等. 日本鰻鱺肝臟表達抗菌肽2基因的克隆與表達. 水生生物學報, 2016, 40(2): 252—260]
[18]Wang T, Gao Q, Nie P, et al. Identification of suppressor of cytokine signaling (SOCS) 6, 7, 9 and CISH in rainbow trout Oncorhynchus mykiss and analysis of their expression in relation to other known trout SOCS [J]. Fish and Shellfish Immunology, 2010, 29(4): 656—667
[19]Lee P T, Zou J, Holland J W, et al. Identification and characterisation of TLR18—21 genes in Atlantic salmon (Salmo salar) [J]. Fish and Shellfish Immunology, 2014, 41(2): 549—559
[20]Sundaram A Y, Kiron V, Dopazo J, et al. Diversification of the expanded teleost-specific toll-like receptor family in Atlantic cod, Gadus morhua [J]. BMC Evolutionary Biology, 2012, 12(1): 107—112
[21]Temperley N D, Berlin S, Paton I R, et al. Evolution of the chicken Toll-like receptor gene family: a story of gene gain and gene loss [J]. BMC Genomics, 2008, 9(1): 68—76
[22]Takeda K, Kaisho T, Akira S. Toll-like receptors [J]. Annual Review of Immunology, 2003, 21(1): 335—376
[23]Slack J L, Schooley K, Bonnert T P, et al. Identification of two major sites in the type I interleukin-1 receptor cytoplasmic region responsible for coupling to pro-inflammatory signaling pathways [J]. The Journal of Biological Chemistry, 2000, 275(7): 4670—4678
[24]O'Neill L A, Fitzgerald K A, Bowie A G. The Toll-IL-1 receptor adaptor family grows to five members [J]. Trends in Immunology, 2003, 24(6): 286—290
[25]Dunne A, Ejdeback M, Ludidi P L, et al. Structural complementarity of Toll/interleukin-1 receptor domains in Toll-like receptors and the adaptors Mal and MyD88 [J]. The Journal of Biological Chemistry, 2003, 278(42): 41443—41451
[26]Wang W, Shen Y, Pandit N P, et al. Molecular cloning, characterization and immunological response analysis of Toll-like receptor 21(TLR21) gene in grass carp, Ctenopharyngodon idella [J]. Developmental and Comparative Immunology, 2013, 40(3): 227—231
[27]Priyathilaka T T, Elvitigala D A, Whang I, et al. Molecular characterization and transcriptional analysis of nonmammalian type Toll like receptor (TLR21) from rock bream (Oplegnathus fasciatus) [J]. Gene, 2014, 553(2): 105—116
[28]Roach J C, Glusman G, Rowen L, et al. The evolution of vertebrate Toll-like receptors [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(27): 9577—9582
MOLECULAR CLONING AND CHARACTERIZATION OF TLR21 GENE FROM JAPANESE EEL, ANGUILLA JAPONICA
LI Chun-Yan1,2, HUANG Bei1,2, XIONG Jing1,2, PENG Xi-Xia1,2, LIANG Ying1,2, NIE Pin1,3and HUANG Wen-Shu1,2,4
(1. College of Fisheries, Jimei University, Xiamen 361021, China; 2. Engineering Research Center of the Modern Technology for Eel Industry, Ministry of Education PRC, Xiamen 361021, China; 3. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 4. Fujian Collaborative Innovation Center for Development and Utilization of Marine Biological Resources, Xiamen 361005, China)
Toll like receptor 21 (TLR21) is a non-mammalian Toll-like receptor that recognizes unmethylated CpG DNA to trigger innate immune responses against pathogenic microorganism infection. The present study cloned the full-length cDNA sequence of TLR21 (AjTLR21) from Japanese eel, Anguilla japonica, which had the common characteristics of Toll like receptors (TLRs). The intronless AjTLR21 shared similar gene structure with other vertebrate TLR21 genes. AjTLR21 widely expressed in all examined tissues/organs with the highest expression in blood. Poly I:C treatment significantly induced the expression of AjTLR21 in spleen and kidney at 8 hours and in blood, gill, intestine and spleen at 16 hours (P<0.05). Luciferase reporter assay exhibited that the 5′ flanking region of the AjTLR21 contains positive regulatory elements for Poly I:C induced AjTLR21 expression. The stimulation of Edwardsiella tarda also increased the expression of AjTLR21 in blood and kidney at both 16h and 72h, suggesting an important role in anti-bacterium immune response. Our results revealed multiple effects of teleosts TLR21 in immune system, which has important theoretical significance and application value to understand the immunological function of AjTLR21.
Anguilla japonica; TLR21; Expression; Immune response; Promoter
Q344+.1
A
1000-3207(2017)02-0296-10
10.7541/2017.36
2016-04-25;
2016-07-20
福建省自然科學基金(2014J05042、2012J06008); 國家自然科學基金(31402329、31174238和U1205123)資助 [Supported by the National Natural Science Foundation of Fujian Province (2014J05042, 2012J06008); the National Natural Science Foundation of China (31402329, 31174238 and U1205123)]
李春艷(1991—), 女, 河南安陽人; 碩士; 主要研究方向為魚類免疫學。E-mail: 1114291018@qq.com; 黃貝(1982—), 男, 江西萍鄉人; 博士; 主要研究方向為魚類免疫學。E-mail: huangbei@jmu.edu.cn
聶品, E-mail: pinnie@ihb.ac.cn; 黃文樹, E-mail: wshuang@jmu.edu.cn, Tel: 0592-6181597

