黃蜀葵花黃酮抗氧化性及對DNA氧化損傷的保護作用
黎 望 孫培冬 季曉彤 路 帥
(1. 江南大學食品膠體與生物技術教育部重點實驗室,江蘇 無錫 214122;2. 江南大學化學與材料工程學院,江蘇 無錫 214122)
黃蜀葵花黃酮抗氧化性及對DNA氧化損傷的保護作用
黎 望1,2孫培冬1,2季曉彤1,2路 帥1,2
(1. 江南大學食品膠體與生物技術教育部重點實驗室,江蘇 無錫 214122;2. 江南大學化學與材料工程學院,江蘇 無錫 214122)
采用石油醚、乙酸乙酯和正丁醇對黃蜀葵花乙醇提取物進行分級萃取,得到石油醚相、乙酸乙酯相、正丁醇相和水相4個不同極性成分。采用DPPH·清除、·OH清除和H2O2清除試驗考察了其抗氧化活性,研究了正丁醇相對·OH 和H2O2誘導DNA氧化損傷的保護作用,并利用HPLC—MS對正丁醇中黃酮類物質進行了鑒定。結果表明:黃蜀葵花黃酮主要富集于乙酸乙酯相和正丁醇相;乙酸乙酯相對DPPH·的清除能力最好,IC50值為0.038 6 mg/mL,而正丁醇相對·OH和H2O2的清除能力較好,IC50值分別為0.225 0, 0.575 7 mg/mL;正丁醇相對·OH和H2O2誘導的DNA氧化損傷都有保護作用;正丁醇相中含有11種黃酮類化合物。
黃蜀葵花;黃酮;萃取相;抗氧化活性;DNA氧化損傷
自由基是人體生物反應中產生的一類代謝產物,正常情況下處于動態平衡,但由于大氣污染、紫外線照射以及不良生活習慣等因素,常使人體內自由基過剩,從而引發DNA氧化損傷,導致衰老和各種疾病。大量研究[1-3]表明,黃酮類化合物具有較強的抗氧化作用,能夠通過多種方式有效地清除自由基,從而預防、治療疾病,減緩人體衰老等。而天然抗氧化劑的應用在食品、醫藥和化妝品行業日益凸顯其優勢。
黃蜀葵花為錦葵科秋葵屬植物黃蜀葵的干燥花。黃蜀葵花含有黃酮類、還原糖類、鞣質、長鏈烴類化合物、多糖類化合物以及其他化學成分[4],其中黃酮類化合物為黃蜀葵花主要活性成分。研究表明黃蜀葵花黃酮具有降血糖[5]、改善腎纖維化[6]、保護心肌損傷[7]和促進血管新生[8]等生物活性,但有關黃蜀葵花黃酮對DNA氧化損傷的保護作用尚未見報道。
本研究擬利用不同極性溶劑對黃蜀葵花乙醇提取物進行分級萃取,得到不同極性部位,并通過清除DPPH·、·OH 和H2O2試驗進行抗氧化活性篩選,對活性較好的部位進行·OH和H2O2誘導的DNA氧化損傷的研究,并對該組分的黃酮類物質進行鑒定,為黃蜀葵花黃酮的藥用機理研究提供理論依據。
1 材料與方法
1.1 材料與試劑
黃蜀葵花:產地河南,購自亳州市芝春堂藥材采購站;
蘆丁標準品:純度≥98%,上海源葉生物科技有限公司;
質粒pBR322 DNA:寶生物工程有限公司;
Goldview染料:上海寶曼生物科技有限公司;
DPPH(1,1-二苯基苦酰基苯肼):美國Sigma公司;
其他試劑:分析純,國藥集團化學試劑有限公司。
1.2 儀器與設備
電子天平:ME203E型,美國Mettler-Toledo公司;
超聲波清洗儀:KH-100B型,昆山禾創超聲儀器有限公司;
恒溫水浴鍋:HH-S2型,上海亞榮生化儀器廠;
旋轉蒸發儀:RE-5203型,上海亞榮生化儀器廠;
循環水式真空泵:SHB-Ⅲ型,鄭州長城科工貿有限公司;
雙光束紫外可見分光光度計:U-1901型,北京普析通用儀器有限公司;
熒光分光光度計:Cary Esclipse型,美國Varian公司。
1.3 試驗方法
1.3.1 黃蜀葵花黃酮樣品的制備 稱取黃蜀葵花粉末,用60%乙醇以1∶20(g/mL)的料液比在50 ℃下超聲提取30 min,抽濾,將濾液減壓濃縮得浸膏。將浸膏冷凍干燥得黃蜀葵花粗提物(ACF),再將其用適量水分散,依次用石油醚、乙酸乙酯、正丁醇進行少量多次的萃取,直至萃取相顏色較淺,將各相濃縮除盡溶劑后,干燥得到石油醚相(AFP)、乙酸乙酯相(AFE)、正丁醇相(AFB)和水相(AFW) 4部分萃取相固體,測各相得率及黃酮含量。將各萃取相均用水超聲溶解,并配制成不同濃度樣品備用。
(1)
式中:
Y——得率,%;
M1——各萃取相質量,g;
M0——粗提取物質量,g。
1.3.2 黃酮含量的測定 以蘆丁為標準品,采用NaNO2—Al(NO3)3—NaOH法[9]得到標準曲線A=11.645 71C-0.003 04(R2=0.999 7)。將各萃取相配制成相應濃度,分別測定其吸光度,根據式(2)計算黃酮含量。
(2)
式中:
X——黃酮含量,mg/g;
C——稀釋后樣品溶液黃酮濃度,mg/mL;
N——稀釋倍數;
V——體積,mL;
M——樣品質量,g。
1.3.3 黃蜀葵花各萃取相對DPPH·清除能力測定 參考文獻[10],在10 mL離心管中加入1 mL不同濃度的萃取相溶液和4 mL 0.04 mg/mL的DPPH溶液,混合均勻,室溫下避光反應30 min,在520 nm處測定吸光度,以Vc為陽性對照。
(3)
式中:
S1——DPPH清除率,%;
A1——1 mL萃取相溶液+4 mL DPPH溶液的吸光度;
A2——1 mL萃取相溶液+4 mL乙醇的吸光度;
A0——1 mL H2O+4 mL DPPH溶液的吸光度。
1.3.4 黃蜀葵花各萃取相對·OH清除能力測定 參考文獻[11],在10 mL離心管中依次加入1 mL 0.75 mmol/L鄰二氮菲溶液、2 mL磷酸緩沖溶液(pH=7.4)、1 mL 0.75 mmol/L 的FeSO4溶液、1 mL不同濃度萃取相溶液,最后加入1 mL 0.01% H2O2,振蕩搖勻,在37 ℃下水浴1 h,于510 nm處測吸光度,以Vc為陽性對照。
(4)
式中:
S2——·OH清除率,%;
A1——1 mL鄰二氮菲+2 mL磷酸緩沖溶液+1 mL FeSO4+1 mL H2O+1 mL H2O2的吸光度;
A2——1 mL鄰二氮菲+2 mL磷酸緩沖溶液+1 mL FeSO4+1 mL萃取相溶液+1 mL H2O2的吸光度;
A3——1 mL鄰二氮菲+2 mL磷酸緩沖溶液+1 mL FeSO4+2 mL H2O的吸光度。
1.3.5 黃蜀葵花各萃取相對H2O2清除能力測定 參考文獻[12],在10 mL離心管中加入40 mmol/L H2O2磷酸緩沖溶液(pH=7.4)0.5 mL,萃取相溶液0.5 mL,用PBS(pH=7.4)稀釋到8 mL,混勻,靜置反應15 min,在230 nm處測其吸光度。
(5)
式中:
S3——H2O2清除率,%;
A1——0.5 mL H2O2+0.5 mL萃取相溶液+7 mL PBS的吸光度;
A2——0.5 mL萃取相溶液+7.5 mL PBS的吸光度;
A0——0.5 mL H2O2+7.5 mL PBS的吸光度。
1.3.6 黃蜀葵花正丁醇相對·OH誘導DNA氧化損傷的保護作用 參考文獻[13],在微量熒光比色皿中依次加入1 μL 100 ng/μL DNA、10 μL 0.1 mol/L (NH4)2Fe(SO4)2溶液、10 μL 0.17 mol/L的EDTA-2Na溶液、10 μL 0.015% H2O2溶液、10 μL 10 mg/mL VC溶液、10 μL AFB溶液、40 μL 1×TE緩沖溶液及0.5 μL Goldview染料,混勻后靜置5 min,熒光測定條件為:狹縫Ex=5 nm,Em=10 nm,在激發波長486 nm下掃描500~700 nm范圍內的熒光強度。
1.3.7 黃蜀葵花正丁醇相對H2O2誘導DNA氧化損傷的保護作用 參考文獻[14],在微量熒光比色皿中依次加入1 μL DNA、1 μL 30% H2O2溶液,5 μL待測AFB溶液,95 μL 1×TE緩沖溶液以及0.5 μL Goldview溶液,混勻后放置10 min,再置于紫外燈下照射10 min,熒光測定條件同1.3.6。
1.3.8 黃蜀葵花正丁醇相的HPLC—MS解析 AFB用甲醇溶解,進行HPLC—MS分析。液相色譜條件:BEH C18柱(2.1 mm×100 mm,1.7 μm);流動相:乙腈—0.1%甲酸;梯度洗脫,流速:0.3 mL/min;柱溫:45 ℃;進樣量:5 μL;記錄200~400 nm紫外光譜。質譜條件:負離子模式;檢測范圍(m/z):100~1 000;毛細管電壓:3.5 kV;錐孔電壓:30 V;離子源溫度:100 ℃;脫溶劑溫度:400.0 ℃;脫溶劑氣流量:700 L/h;噴霧氣流量:50 L/h;檢測電壓:1 800 V。
2 結果與分析
2.1 各萃取相得率及黃酮含量
由表1可知,經萃取后水相的得率達到67.39%,但黃酮含量僅僅是113.9 mg/g,而乙酸乙酯相和正丁醇相中的黃酮含量分別達到491.24,417.68 mg/g。
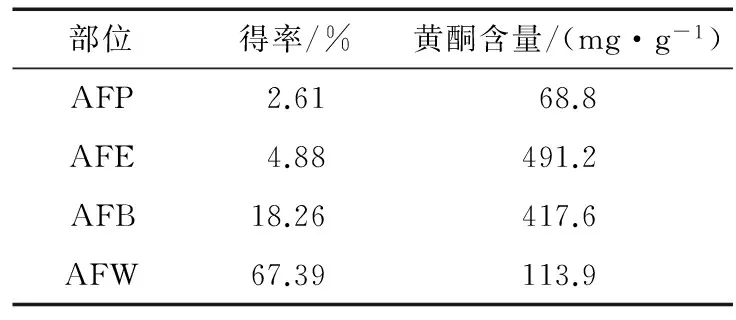
表1 不同極性部位得率及總黃酮含量Table 1 The yield and content of flavonoid in different phase
2.2 黃蜀葵花各萃取相對DPPH·的清除能力
由圖1可知,各萃取相和VC清除DPPH·的能力隨著質量濃度的增大而增強,且呈現量效關系。當質量濃度為0.18 mg/mL時,AFE 和AFB的清除率分別為95.233%,87.25%,而AFP和AFW對DPPH·的清除率低于50%。4個萃取相中AFE的清除能力最好,接近VC的清除能力。

圖1 各萃取相對DPPH·的清除作用Figure 1 Scavenging effect of extracts on free radical DPPH·
2.3 黃蜀葵花各萃取相對·OH的清除能力
由圖2可知,各萃取相對·OH的清除率隨著質量濃度的增大而增強。AFB和AFE對·OH的清除能力高于AFP和AFW。當樣品質量濃度達到0.4 mg/mL時,AFB和AFE對·OH的清除率均高于95%,AFW的清除率為56.33%,而AFP對·OH的清除率不足50%,表明 AFB和AFE有較強的清除·OH的能力。
2.4 黃蜀葵花各萃取相對H2O2的清除能力
由圖3可知,在測定的質量濃度范圍內,隨著質量濃度的增大,各萃取相對H2O2的清除能力也增強。當質量濃度為1.0 mg/mL時,AFP和AFW的清除率比較低,而AFE和AFB的清除率接近90%,AFE和AFB的IC50值分別為0.628 5,0.575 7 mg/mL。

圖2 各萃取相對·OH的清除作用Figure 2 Scavenging effect of extracts on free radical ·OH
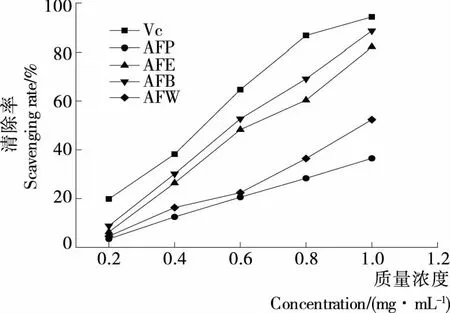
圖3 各萃取相對H2O2的清除能力Figure 3 The scavenging activity of extracts on H2O2
2.5 AFB對·OH誘導的DNA氧化損傷的保護作用
由圖4可知,Goldview-DNA在波長532 nm左右有最大發射光譜,在沒有·OH氧化損傷DNA時,其熒光強度為258.836 8 a.u.;引入·OH后,DNA的雙螺旋結構遭到破壞,影響DNA和染料Goldview之間的能量傳遞,導致體系熒光強度降低,此時熒光強度為61.324 7 a.u.。由圖5可知,加入AFB溶液后,熒光強度增強,說明樣品溶液的存在減弱了·OH對DNA 的氧化損傷程度。AFB濃度低于0.12 mg/mL時,隨著樣品溶液質量濃度的增加,其熒光強度增強,即對DNA氧化損傷的保護作用增強,當濃度超過0.12 mg/mL時,對DNA氧化損傷的保護作用隨著AFB濃度的增加而減弱。出現此現象的原因是:質量濃度低時,AFB主要用于消除體系中·OH,從而抑制DNA的氧化損傷;而濃度過高時,AFB除了清除·OH,還能與DNA發生相互作用,削弱了體系的熒光強度。
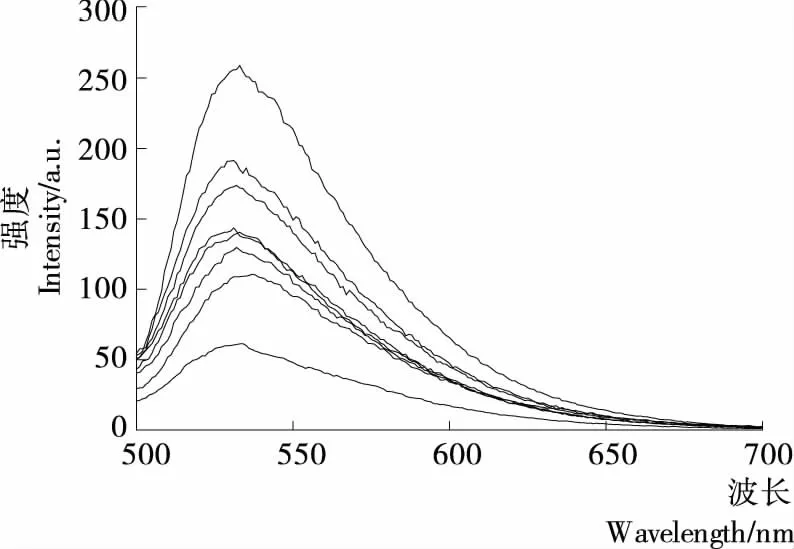
圖4 AFB對·OH誘導的DNA氧化損傷的保護作用Figure 4 Protection of AFB on ·OH-induced oxidative DNA damage

圖5 不同質量濃度時AFB體系的最大熒光強度Figure 5 The maximum fluorescence intensity of AFB system at different concentration
2.6 AFB對H2O2誘導DNA氧化損傷的抑制作用
由圖6、7可知,在該試驗條件下,Goldview-DNA在波長532 nm左右有最大發射光譜,沒有H2O2氧化損傷DNA時,其熒光強度為278.10 a.u.;引入H2O2后,其熒光強度降至91.521 a.u.,表明H2O2的加入使DNA氧化損傷。加入AFB之后,體系的熒光強度也發生了變化。AFB質量濃度低于0.12 mg/mL,體系的熒光強度隨著濃度的增加而增強;但濃度超過0.12 mg/mL后,體系的熒光強度就隨濃度的增加而降低,但均大于僅被H2O2氧化損傷的熒光強度,即AFB對H2O2氧化損傷的DNA保護作用減弱,但對氧化損傷的DNA仍有保護作用,即AFB濃度在0.04~0.60 mg/mL時,對H2O2氧化損傷的DNA有保護作用。
2.7 AFB中黃酮類化合物結構鑒定
經過HPLC—MS分析,檢測波長350 nm處的液相色譜圖見圖8,而相應的色譜峰對應的最大紫外吸收波長和質譜數據見表2,與相關的文獻對照,推斷鑒定出11個化合物。
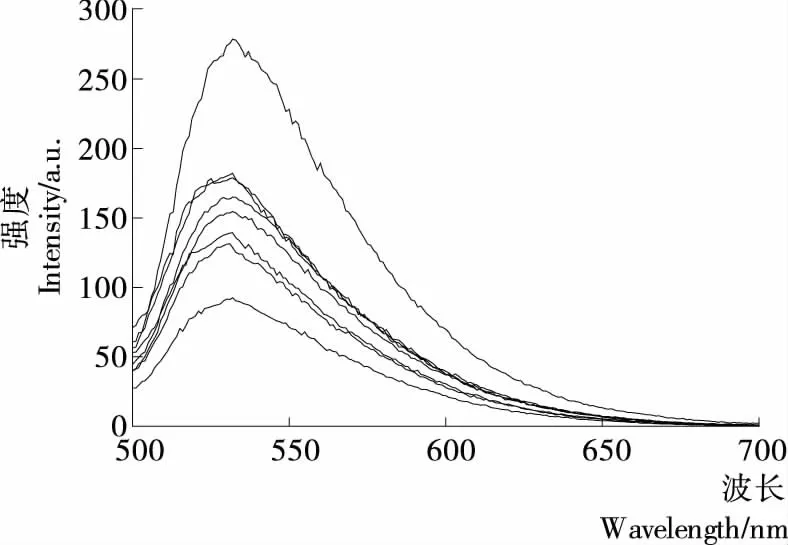
圖6 AFB對H2O2誘導的DNA氧化損傷的保護作用Figure 6 Protection of AFB on H2O2-induced oxidative DNA
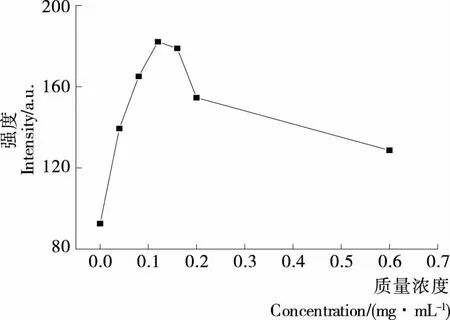
圖7 不同質量濃度時AFB體系的最大熒光強度Figure 7 The maximum fluorescence intensity of AFB system at different concentration
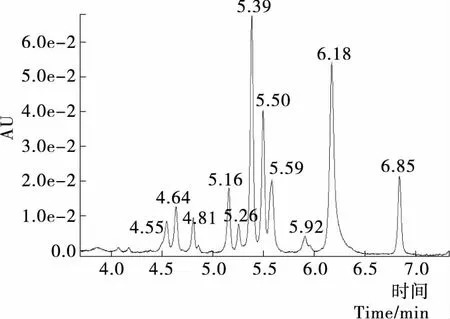
圖8 AFB在檢測波長350 nm的色譜圖Figure 8 Chromatogram of AFB at 350 nm
文獻[15]表明,負離子模式下的黃酮苷類化合物有如下裂解規律:3’位糖苷主要丟失糖分子,只產生[苷元-H]-離子,不產生[苷元-2H]-離子;7位糖苷丟失糖分子,不僅產生[苷元-H]-,還能產生[苷元-2H]-離子,但后者強度明顯低于前者;3位糖苷分別發生丟失糖分子和糖苷鍵均裂,同時產生[苷元-H]-和[苷元-2H]-離子,但后者強度高于前者。黃酮苷元為槲皮素的黃酮類化合物會產生m/z301或300離子;黃酮苷元為楊梅素和棉皮素的黃酮類化合物會產生317或316的離子,當同時有碎片離子峰195、167時為棉皮素。
表2中化合物1、5、6的分子離子峰都是m/z463,且都有碎片離子峰m/z301,300,表明苷元為槲皮素,而化合物5、6中m/z300的碎片峰強于m/z301的碎片峰,表明這兩種化合物中糖苷為3取代[15],而化合物1則相反,表明糖苷為7取代,在根據各物質的出峰時間,參考文獻[16],推測1、5、6依次為槲皮素-7-O-葡萄糖苷、異槲皮素、金絲桃苷。化合物2的分子離子峰為m/z493,且有碎片離子峰m/z317,表明苷元為楊梅素或槲皮素,同時有碎片m/z195和167,則苷元為棉皮素,參考文獻[16],推測該化合物為棉皮苷。化合物3的[M-H]-為505,其分子量為506,碎片離子峰m/z463,301與文獻[17]一致,推測為乙酰化金絲桃苷。化合物4、10、11分子離子峰都是m/z479,推測其分子量為480,都有碎片離子峰317,參考文獻[16]推測其依次為楊梅素-3’-O-葡萄糖、楊梅素-3-O-葡萄糖、楊梅素-3-O-半乳糖。化合物7、8的分子離子峰為m/z609,且都有m/z301、300的碎片離子峰,參考文獻[16],推測這兩種物質分別為槲皮素3-O-半乳糖基鼠李糖、蘆丁。化合物9的分子離子峰為m/z595,則分子量為596,由文獻[16]可知,該化合物為槲皮素-3-O-葡萄糖基阿拉伯糖苷。
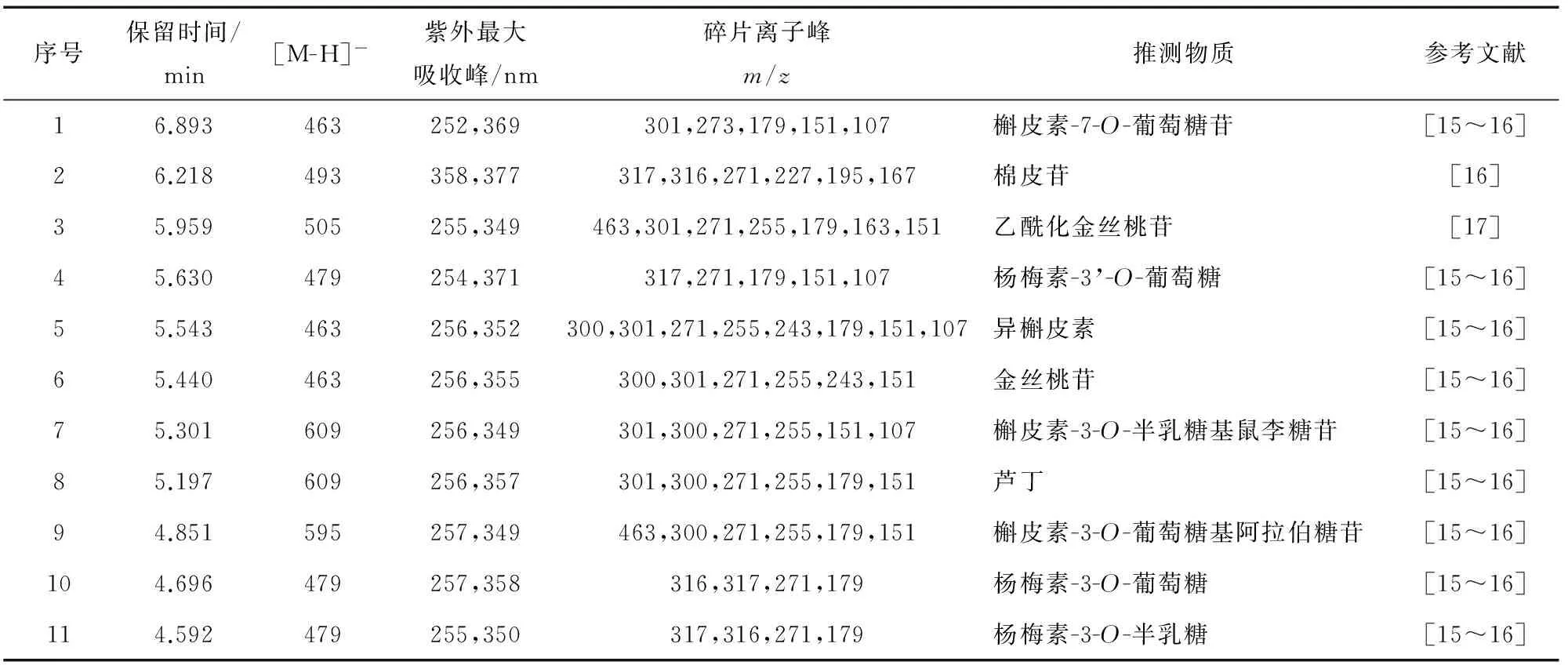
表2 HPLC分離化合物的質譜數據Table 2 Mass Spectrum data of compounds separated by HPLC
3 結論
黃蜀葵花粗提物經不同極性的溶劑萃取后,得到4個萃取相,黃酮富集于乙酸乙酯相和正丁醇相。抗氧化活性的研究表明乙酸乙酯相和正丁醇相的抗氧化性優于石油醚相和水相,這與兩相中總黃酮含量存在量效關系。其中乙酸乙酯相對DPPH·的清除能力最佳,清除率最高達95.23%,IC50值為0.038 6 mg/mL;而正丁醇相對·OH和H2O2的清除能力最好,清除率最高分別為96.21%和88.62%,IC50值分別為0.225 0 mg/mL和0.575 7 mg/mL。選取正丁醇相進行DNA氧化損傷的研究,結果表明在0.04~0.60 mg/mL時,AFB對·OH和H2O2誘導的DNA氧化損傷都有保護作用,當質量濃度為0.12 mg/mL時,對DNA損傷的保護作用最強。通過HPLC—MS鑒定了正丁醇相中的11種黃酮類化合物。綜上所述,黃蜀葵花黃酮具有較好的抗氧化活性,同時對DNA的氧化損傷也有較為顯著的保護作用,且初步鑒定正丁醇相中的11種黃酮類化合物。本研究可為黃蜀葵花總黃酮在化妝品、食品和醫藥等領域的開發提供理論依據,但黃蜀葵花黃酮保護DNA氧化損傷的機理還有待進一步研究。
[1] 唐春紅. 天然防腐劑與抗氧化劑[M]. 北京: 中國輕工業出版社, 2010: 182.
[2] 涂宗財, 傅志豐, 王輝, 等. 紅薯葉不同溶劑提取物抗氧化性及活性成分鑒定[J]. 食品科學, 2015, 36(17): 1-6.
[3] 吳秋敏, 蘇平, 劉蕓. 黃酮的抗氧化性和促氧化性研究進展[J]. 食品工業科技, 2014, 35(24): 379-383.
[4] 周雷. 黃蜀葵花總黃酮研究進展[J]. 遼寧中醫藥大學學報, 2012, 14(6): 42-44.
[5] 陳剛. 黃蜀葵花的化學成分和降糖活性研究[D]. 北京: 中國人民解放軍軍事醫學科學院, 2006: 43-47.
[6] 尹蓮芳. 黃蜀葵花對腎病大鼠尿排泄的影響及其作用機制[J]. 河北醫科大學學報, 2003, 24(6): 328-330.
[7] 范麗, 郭巖, 陳志武, 等. 黃蜀葵花總黃酮對小鼠急性心肌缺血缺氧損傷的保護作用[J]. 中國藥房, 2005, 16(3): 176-178.
[8] 潘武, 蔣萌. 黃蜀葵花總黃酮對人臍靜脈血管內皮細胞形成新生血管的影響[J]. 徐州醫學院學報, 2010, 30(6): 359-361.
[9] 賈霖, 黃國清, 肖軍霞. 金銀花中黃酮類化合物的提取工藝[J]. 食品研究與開發, 2013, 34(9): 41-43.
[10] 王丹, 翟梅枝, 毛光瑞, 等. 核桃花粉提取物的抗氧化性研究[J]. 食品工業科技, 2014, 35(16): 137-139.
[11] 孫鮮明, 李小方, 鄧瑞雪, 等. 流蘇花總黃酮超聲提取工藝及抗氧化活性研究[J]. 食品工業科技, 2015, 36(16): 266-272.
[12] 張溢, 孫培冬, 陳桂冰, 等. 芡實多糖的提取、抗氧化活性及對質粒DNA氧化損傷防護作用的研究[J]. 食品工業科技, 2015, 36(11): 122-126.
[13] 趙金蓮, 曾佑偉, 李寬, 等. 熒光光譜法分析花茶對羥基自由基(·OH)誘導的DNA氧化損傷的保護作用[J]. 華南師范大學學報: 自然科學版, 2010(3): 92-97.
[14] YANG Xu, LV Yuan-ping. Purification, characterization, and DNA damage protection of active components from Tartary Buckwheat (Fagopyrumtataricum) hull[J]. Food Sci Biotechnol, 2015, 24(6): 1 959-1 966.
[15] 阿布拉江·克依木. 黃酮苷類天然產物的質譜分析方法研究[D]. 北京: 中國協和醫科大學, 2006: 71.
[16] 池玉梅, 朱華云, 居羚, 等. 高效液相—四極桿飛行時間串聯質譜分析黃蜀葵花中黃酮醇類化合物[J]. 分析化學, 2009, 37(2): 227-231.
[17] 吳桂梅. 羅布麻葉中黃酮類化合物的分離提取及抗氧化、抗抑郁活性的研究[D]. 長春: 長春師范學院, 2011: 38-39.
The antioxidant activities and protection on DNA oxidative damage of flavonoid from the flowers ofAbelmoschusmanihot
LI Wang1,2SUNPei-dong1,2JIXiao-tong1,2LUShuai1,2
(1.MinistryofEducation,SchoolofChemicalandMaterialEngineering,JiangnanUniversity,Wuxi,Jiangsu214122,China;2.TheKeyLaboratoryofFoodColloidsandBiotechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China)
The ethanol extracts of flowers fromAbelmoschusmanihotwas extracted by petroleum ether、ethyl acetate and n-butyl alcohol, and four different polar portions were obtained. The scavenging effect of different phases on DPPH·, ·OH and H2O2were studied to research the antioxidant activities of each phase. Moreover, the protection of n-butyl alcohol phase on DNA oxidative damage was also studied, and the flavonoids component was identified by HPLC-MS. The results showed that the ethyl acetate phase had the best scavenging effect on DPPH·, withIC50value 0.038 6 mg/mL. However, the n-butyl alcohol phase had scavenge ·OH and H2O2best, and theIC50values were 0.225 0 and 0.575 7 mg/mL, respectively. The n-butyl alcohol phase was proved to show protective effect in some degree on DNA oxidative damage., and totally 11 kinds of flavonoids were found in the n-butyl alcohol phase.
Abelmoschusmanihotflower; flavonoids; extracts; antioxidant activity; DNA oxidative damage
黎望,女,江南大學在讀碩士研究生。
孫培冬(1967-),女,江南大學副教授,碩士。 E-mail: sunpeidong2004@126.com
2016—12—22
10.13652/j.issn.1003-5788.2017.02.029

