基于高通量測序的丁酸梭菌對肉雞盲腸菌群結構的影響
肖英平,楊彩梅,代 兵,李開鋒,陳鏡剛,楊 華,*
(1.浙江省農業科學院 農產品質量標準研究所,浙江 杭州 310021; 2.浙江農林大學 動物科技學院,浙江 杭州 311300)
基于高通量測序的丁酸梭菌對肉雞盲腸菌群結構的影響
肖英平1,楊彩梅2,代 兵2,李開鋒1,陳鏡剛1,楊 華1,*
(1.浙江省農業科學院 農產品質量標準研究所,浙江 杭州 310021; 2.浙江農林大學 動物科技學院,浙江 杭州 311300)
采用高通量測序技術分析飼料中添加丁酸梭菌對肉雞盲腸菌群結構的影響。選用300羽1日齡肉雞隨機分成2組,每組6個重復,每個重復25羽雞,分別飼喂基礎日糧和基礎日糧+丁酸梭菌3×107cfu·kg-1的試驗日糧。在42日齡階段稱量體質量后每個重復取3羽公雞用于采集盲腸內容物,提取其基因組DNA,用特異性引物擴增細菌16S rRNA基因V3-V4區,采用基于Illumina Miseq測序平臺對細菌16S rRNA基因進行測序分析。結果表明,添加丁酸梭菌可以顯著地降低肉雞的料肉比(P<0.05)。肉雞盲腸中細菌主要是硬壁菌門、擬桿菌門、變形菌門和軟壁菌門;在門的水平上,丁酸梭菌處理具有降低硬壁菌門豐度、增加擬桿菌門豐度的趨勢。在屬的水平上,瘤胃菌屬(Ruminococcaceae_uncultured)、糞棲桿菌屬(Faecalibacterium)、別樣桿菌屬(Alistipes)、毛螺菌屬(Lachnospiraceae_incertae_sedis)是肉雞盲腸中的主要優勢菌屬;丁酸梭菌處理使肉雞盲腸中糞棲桿菌(Faecalibacterium)、別樣桿菌(Alistipes)、類桿菌屬(Bacteroides)、Phascolarctobacterium和丁酸梭菌(Butyricicoccus)相對豐度顯著升高(P<0.05),毛螺菌屬(包括Lachnospiraceae_incertae_sedis和Lachnospiraceae_unclassified)、理研菌屬(Rikenella)、鏈球菌(Streptococcus)和Blautia屬相對豐度顯著降低(P<0.05),其中豐度顯著升高菌群為主要的短鏈脂肪酸生成菌。由此表明,日糧中添加丁酸梭菌可降低肉雞的料肉比,增加盲腸中產短鏈脂肪酸菌群的豐度。
丁酸梭菌;高通量測序;肉雞;菌群結構
早期腸道微生物研究主要基于傳統的分離培養技術,只能檢測可培養型微生物,而可培養細菌只占腸道菌群的 1%~10%,大多數的腸道菌群為非培養型菌[1]。近年來,基于分子生物學技術的熒光原位雜交、變性梯度凝膠電泳、熒光定量PCR、構建克隆文庫等方法在微生物群落研究中得到了廣泛的運用,但這些分析技術不能完整地反應整個群落結構信息,且耗時長、工作量大。現在快速發展的高通量測序技術在腸道微生物研究中的運用愈加廣泛,對微生物群落信息的采集與分析更準確、詳細,可深度研究微生物的菌群結構和功能,逐漸成為研究復雜腸道菌群最為有效的手段之一[2]。
肉雞等家禽消化系統包括嗉囊、胃(腺胃和肌胃)、小腸、盲腸和大腸,各個區段均分布著大量的微生物,硬壁菌門是主要的優勢微生物類群[3-4]。其中盲腸中食糜轉運速度較慢,微生物最為豐富,每克內容物含1010~1011cfu;高通量測序技術表明,盲腸微生物中含有大約2 200運算分類單元OTU(operational taxonomic units;95% sequence ID)和3 500個基因型[5]。腸道中的這些微生物對于宿主的營養消化吸收、免疫系統發育、機體能量代謝等具有重要的生理調節作用[1]。腸道菌群結構的平衡可有效地抑制病原微生物的侵襲,改善動物健康和生產性能,因此,使用益生菌、益生元等改善動物腸道菌群結構逐漸成為養殖業中提高生產效益的研究熱點之一[6]。丁酸梭菌(ClostridiumButyricum)作為一種有效的益生菌,可顯著促進肉雞的生長,提高其免疫力和腸道中乳酸桿菌、雙歧桿菌的數量,減少大腸桿菌、沙門氏菌、產氣莢膜梭菌的數量[7-8]。因此,采用高通量測序對丁酸梭菌處理肉雞腸道微生物進行深入研究,闡明其腸道菌群結構的變化,可更加清晰地理解丁酸梭菌等益生菌的作用機理,為益生菌的研發和推廣應用提供理論依據。
1 材料與方法
1.1 試驗材料
丁酸梭菌(Clostridiumbutyricum, CB)購自浙江惠嘉生物技術公司,活度為2×108cfu·g-1。試驗用Ross 308肉雞購自浙江正大肉雞有限公司。
1.2 試驗設計、飼料組成及飼養管理
將300羽1日齡肉雞隨機分成2個處理,為對照組和丁酸梭菌組,分別飼喂基礎日糧和基礎日糧+丁酸梭菌3×107cfu·kg-1的試驗日糧,每個處理6個重復,每個重復25羽雞。基礎日糧組成和營養成分見表1。
試驗在浙江大學實驗牧場進行,試驗前對雞舍全舍及飼養設備進行嚴格消毒。飼養周期為42 d。試驗期間采用人工投料,自由飲水和采食。試驗第1周保持溫度為35 ℃,每周逐漸減低2~3 ℃,直至室溫;保持通風良好。
1.3 樣品采集和保存
在試驗第42天時全群稱體質量,各組每個重復隨機取3羽公雞屠宰,收集盲腸內容物。宰前禁飼12 h,禁飼期自由飲水。按每個重復計算肉雞的平均日增重、飼料轉化率等。
1.4 DNA提取和16S rRNA 基因擴增PCR反應
將每個處理組的2個重復(即6羽雞)的盲腸內容物等量混合用于DNA提取。用QIAamp DNA Stool Mini Kit (QIAGEN, CA)試劑盒抽提肉雞盲腸內容物總基因組DNA,采用引物338 F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)擴增細菌16S rRNA基因V3-V4區[9]。

表1 日糧組成及主要營養成分
試驗雞在1~21 d飼喂小雞料,22~42 d飼喂中雞料。
The chickens were fed with starter diet from 1-day-old to 21-day-old and grower diet from 22-day-old to 42-day-old.
1.5 PCR反應和高通量測序分析
測序由上海美吉生物醫藥科技有限公司完成。采用Illumina Miseq高通量測序技術對肉雞盲腸微生物16s rRNA基因的V3-V4區進行了測序,獲得的序列通過Mothur軟件平臺,剔除低質量的DNA序列之后,計算序列之間的距離。每一個運算分類單元OTU代表序列相似度大于97%的DNA序列,用于對照組和丁酸梭菌處理組的樣品進行菌群多樣性分析和聚類分析,并使用Sliva和RPD數據庫對所有OTUs的代表性序列進行物種匹配,對樣品的各個細菌門組成進行統計,得到菌群分析結果[10]。
1.6 統計分析
平均日增重、飼料轉化率和微生物相對豐度變化采用SPSS軟件進行單因素方差分析(ANOVA),P<0.05為顯著性差異,P<0.10為具有顯著性差異的趨勢。結果以平均值±標準誤表示。
2 結果與分析
2.1 丁酸梭菌對肉雞生產性能的影響
由表2可知,日糧中添加丁酸梭菌對肉雞體質量、平均日增重和平均日采食量無明顯影響,但可顯著地降低料肉比(P<0.05)。
2.2 肉雞盲腸微生物物種豐度及多樣性
各樣品的有效序列數均較高,在24 798~36 667之間;覆蓋度指數也均大于0.99,說明了該測序結果已基本覆蓋樣本的多樣性(表3)。運用Mothur 軟件計算97%相似水平上各樣品的 OTU 數量,在所有樣品中,OTU 數量最多為407,最少為368,表明肉雞盲腸內容物中微生物的豐度較高。Alpha多樣性分析表明,對照組香農指數也高于丁酸梭菌組(P=0.03)。
表2 丁酸梭菌對肉雞生產性能的影響
Table 2 Effects ofC.butyricumon productive performance of broiler chickens (n=6)

項目Item對照組Controlgroup丁酸梭菌組CB-treatedgroupP值P-value體質量BW/g2489.98±196.872610.07±216.840.37平均日增重ADG/g58.13±4.6560.99±8.690.16平均日采食量ADFI/g108.11±12.39103.32±11.380.18料肉比F∶G1.86±0.041.69±0.030.04
表3 樣品測序概況
Table 3 Overview of sequencing results of each sample
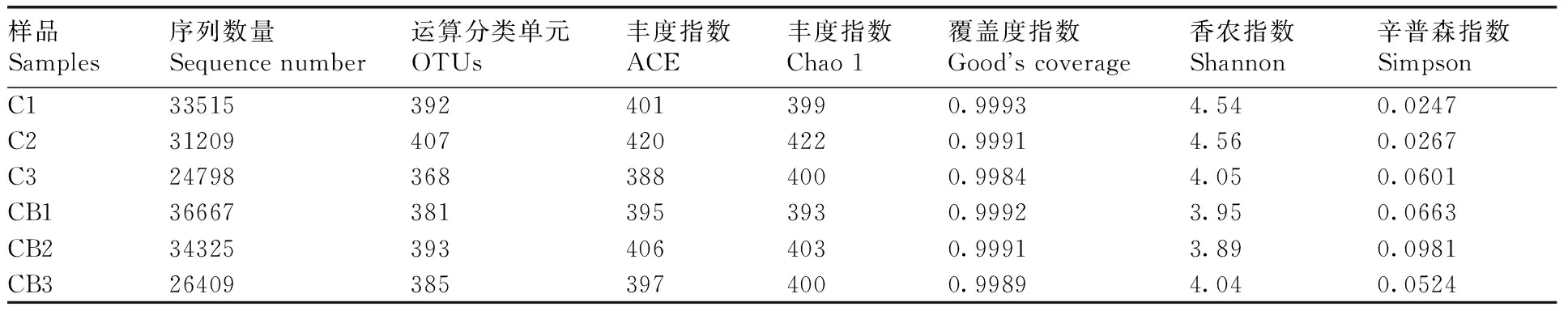
樣品Samples序列數量Sequencenumber運算分類單元OTUs豐度指數ACE豐度指數Chao1覆蓋度指數Goodscoverage香農指數Shannon辛普森指數SimpsonC1335153924013990.99934.540.0247C2312094074204220.99914.560.0267C3247983683884000.99844.050.0601CB1366673813953930.99923.950.0663CB2343253934064030.99913.890.0981CB3264093853974000.99894.040.0524
C1, C2, C3, 對照組樣品;CB1, CB2, CB3, 丁酸梭菌處理組樣品。下同。
C1, C2, C3, Control group samples; CB1, CB2, CB3, CB-treated group samples. The same as below.
依據隨機抽到的序列數與觀測到的 OTU 數量構建的稀釋性曲線結果如圖 1 所示。從圖上分析,各樣品曲線逐漸趨于平緩,說明有效測序數量已經能夠較好地覆蓋菌種的多樣性。
2.3 肉雞腸道菌群結構
在微生物分類門的水平上(圖2),通過Illumina Miseq測序,共檢測到 13 個菌門,對照組和丁酪梭菌組有4個相同的優勢微生物類群(豐度>0.5%為優勢菌群),分別是硬壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)、變形菌門(Proteobacteria)和軟壁菌門(Tenericutes),這些微生物共占肉雞盲腸微生物的99.38%以上。與對照組相比,丁酸梭菌處理表現出降低厚壁菌門豐度(對照組vs丁酸梭菌組,83.92% vs 80.36%;P=0.07)、增加擬桿菌門豐度(對照組vs 丁酸梭菌組,13.53% vs 17.01%;P=0.08)的趨勢。對照組和丁酸梭菌組厚壁菌門/擬桿菌門的比例分別為6.16和4.72。對照組和丁酸梭菌組變形菌門的平均豐度分別為1.11%和1.45%,軟壁菌門的平均豐度分別為0.99%和0.83%,差異不顯著。

圖1 腸道菌群稀釋性曲線分析Fig.1 Rarefaction curve analysis of cecal microflora

圖2 在門水平上的腸道菌群結構Fig.2 Relative abundance of sequences belonging to different bacterial phyla
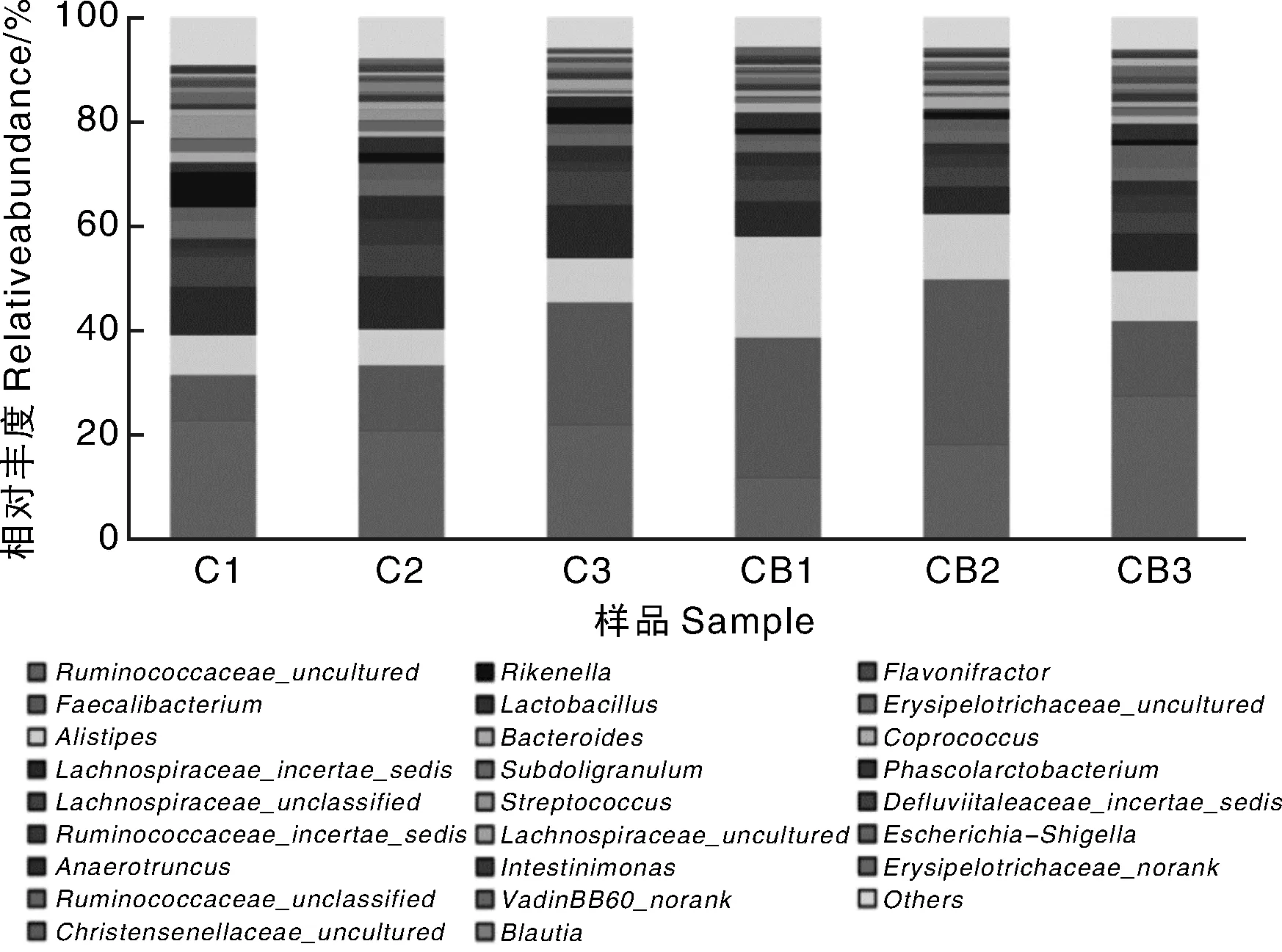
圖3 在屬水平上的腸道菌群結構Fig.3 Relative abundance of sequences belonging to different bacterial genus
在屬的水平上進行深入分析,能更清晰地反映出2組不同處理肉雞腸道菌群結構的變化趨勢。所有樣品共檢測到92個屬,其中瘤胃菌屬(Ruminococcaceae_uncultured)、糞棲桿菌屬(Faecalibacterium)、別樣桿菌屬(Alistipes)和毛螺菌屬(Lachnospiraceae)是主要的優勢屬(圖3)。選取相對豐度>0.2%的屬進行顯著性差異分析,結果(表4)發現,與對照組比較,丁酸梭菌處理使肉雞盲腸中糞棲桿菌屬(Faecalibacterium)、別樣桿菌屬(Alistipes)、類桿菌屬(Bacteroides)、Phascolarctobacterium和丁酸菌屬(Butyricicoccus)的相對豐度分別提高了62.68%、79.63%、55.12%、50.00%和350.00%(P<0.01或P<0.05);丁酸梭菌處理使毛螺菌屬Lachnospiraceae_incertae_sedis與Lachnospiraceae_unclassified、理研菌屬(Rikenella)、鏈球菌屬(Streptococcus)和Blautia屬相對豐度分別降低了35.13%、35.50%、72.35%、87.98%和35.56%(P<0.01或P<0.05)。
2.4 肉雞腸道菌群結構聚類分析
由圖4可知,對照組和丁酸梭菌組表現出不同的聚類趨勢。同樣地,在主要坐標分析圖上,丁酸梭菌組樣本也和對照組樣本顯著分離(圖5)。
表4 在屬水平上對照組和丁酸梭菌組顯著差異的序列
Table 4 Different taxonomic assignments between control group and CB-treated group at genus level
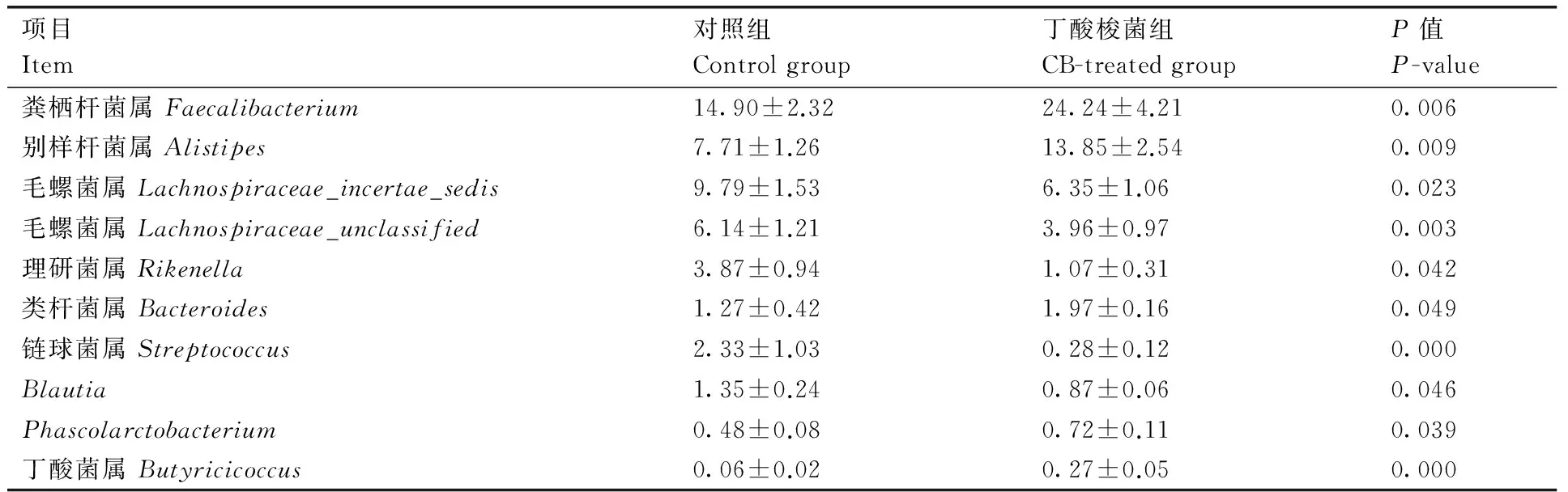
項目Item對照組Controlgroup丁酸梭菌組CB-treatedgroupP值P-value糞棲桿菌屬Faecalibacterium14.90±2.3224.24±4.210.006別樣桿菌屬Alistipes7.71±1.2613.85±2.540.009毛螺菌屬Lachnospiraceae_incertae_sedis9.79±1.536.35±1.060.023毛螺菌屬Lachnospiraceae_unclassified6.14±1.213.96±0.970.003理研菌屬Rikenella3.87±0.941.07±0.310.042類桿菌屬Bacteroides1.27±0.421.97±0.160.049鏈球菌屬Streptococcus2.33±1.030.28±0.120.000Blautia1.35±0.240.87±0.060.046Phascolarctobacterium0.48±0.080.72±0.110.039丁酸菌屬Butyricicoccus0.06±0.020.27±0.050.000

圖4 肉雞盲腸微生物的聚類分析圖Fig.4 Cluster analysis chart of flora in cecal contents of broilers
3 討論
動物腸道是一個復雜的微生態系統,棲居著大量的微生物,不同菌群之間保持著一定的比例關系,與宿主機體相互作用并處于動態平衡狀態。

圖5 肉雞盲腸微生物的主坐標分析Fig.5 PcoA (principal coordinate analysis) plot based on the weighted UniFrac metric
腸道微生物可以看作宿主體內的一個器官,對動物生理功能的發育以及疾病防治等都發揮著重要作用[11]。主要功能包括:促進腸道發育、發揮腸道屏障作用、介導免疫反應;消耗、儲存并重新分配能量;降解膳食中一些宿主自身無法消化的營養成分,比如果膠、纖維素、半纖維素、抗性淀粉等植物性多糖,產生單糖、短鏈脂肪酸等利于宿主吸收的營養物質[12]。
腸道微生物包括細菌、古菌和真核微生物,其中細菌1 000~1 150種,占大多數且絕大部分是厭氧細菌[13]。Qu等[5]研究發現,在雞盲腸中細菌的環境基因標簽 (environmental gene tags, EGTs)占97.3%,古菌EGTs為0.81%,真核生物EGTs為1.76%,病毒EGTs為0.12%,其中細菌主要是硬壁菌門、擬桿菌門和變形菌門。在本研究中,共檢測到肉雞盲腸微生物13個菌門,主要是硬壁菌門(Firmicutes)和擬桿菌門(Bacteroidetes),二者占據盲腸總細菌16S rRNA基因序列的95%以上,其次為變形菌門(Proteobacteria)和軟壁菌門(Tenericutes),與前人的研究相一致[4]。
丁酸梭菌是存在于人和動物腸道內的一種益生菌,可代謝產生丁酸,抑制腸道有害菌生長,并刺激粘膜免疫反應;同時丁酸梭菌還可以產生淀粉酶等多種酶類物質、B族維生素、維生素K、葉酸等對機體具有重要生理功能的物質[14]。在家禽飼料中添加丁酸梭菌,可有效地改善家禽的生產性能、腸道微生物結構和健康狀況[15]。Yang[7]和Cao等[8]研究表明,日糧中添加丁酸梭菌可以促進肉雞的生長,提高其免疫力和盲腸中乳酸桿菌、雙歧桿菌的數量,減少盲腸中大腸桿菌、沙門氏菌、產氣莢膜梭菌的數量,從而減少肉雞的下痢。劉亭婷等[16]發現,在蛋用仔公雞飼料中添加1 000 mg·kg-1丁酸梭菌能顯著增加腸道中乳桿菌和雙歧桿菌的數量,改善蛋用仔公雞小腸黏膜厚度、絨毛高度,增加黏膜上皮淋巴細胞、杯狀細胞及IgA陽性物質的數量。我們通過高通量測序技術發現,在門水平上,丁酸梭菌處理使硬壁菌門/擬桿菌門比例降低(對照組和丁酸梭菌組硬壁菌門/擬桿菌門比例分別為6.16和4.72),該2類細菌均是動物腸道中的優勢菌群,在營養物質的消化吸收和宿主能量代謝方面起著重要作用[17]。肉雞盲腸變形菌門在對照組和丁酸梭菌組的平均豐度分別為1.11%和1.45%,軟壁菌門在對照組和丁酸梭菌組的平均豐度分別為0.99%和0.83%。在屬的水平上,丁酸梭菌處理使肉雞盲腸中霍氏真桿菌屬(Faecalibacterium)、阿里葉柄屬(Alistipes)、類桿菌屬(Bacteroides)、Phascolarctobacterium、埃希氏桿菌屬(Escherichia-Shigella)和丁酸梭菌(Butyricicoccus)的相對豐度顯著升高。值得注意的是,霍氏真桿菌屬、阿里葉柄屬、類桿菌屬、Phascolarctobacterium和丁酸梭菌是產生短鏈脂肪酸的重要菌群[2],這從屬的水平上說明丁酸梭菌使產生短鏈脂肪酸的有益菌數量增加,也進一步解釋了Zhang等[18]的研究結果,即丁酸梭菌處理使肉雞盲腸中乙酸、丁酸和戊酸等短鏈脂肪酸濃度升高。而丁酸可以誘導禽類巨噬細胞、骨髓細胞和單核細胞AvBD9基因的表達,也可促進肉雞空腸和盲腸AvBD9、AvBD14和CathB1等宿主防御素基因的表達,有效地抑制異源微生物侵襲[19]。同時腸道中短鏈脂肪酸濃度較高時,腸道中pH降低,抑制有害微生物的生長,從而改善腸道菌群結構和提高生產性能。
[1] DENG P, YU Z. Intestinal microbiome of poultry and its interaction with host and diet[J].GutMicrobes, 2014, 5(1):108-119.
[2] ZHANG J, GUO Z, XUE Z, et al. A phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles, geography and ethnicities[J].TheISMEJournal, 2015, 9(9):1979-1990.
[3] YEOMAN C J, CHIA N, JERALDO P, et al. The microbiome of the chicken gastrointestinal tract[J].AnimalHealthResearchReview, 2012, 13(1):89-99.
[4] CHOI J H, KIM G B, CHA C J. Spatial heterogeneity and stability of bacterial community in the gastrointestinal tracts of broiler chickens[J].PoultryScience, 2014, 93(8):1942-1950.
[5] QU A, BRULC J M, WILSON M K, et al. Comparative metagenomics reveals host specific metavirulomes and horizontal gene transfer elements in the chicken cecum microbiome[J].PLoSOne, 2008, 3(8):e2945-1-e2945-19.
[6] STANLEY D, HUGHES R J, MOORE R J. Microbiota of the chicken gastrointestinal tract: influence on health, productivity and disease[J].AppliedMicrobiologyandBiotechnology, 2014, 98(10):4301-4310.
[7] YANG C M, CAO G T, FERKET P R, et al. Effects of probiotic,Clostridiumbutyricum, on growth performance, immune function, and cecal microflora in broiler chickens[J].PoultryScience, 2012, 91(9):2121-2129.
[8] CAO G T, XIAO Y P, YANG C M, et al. Effects ofClostridiumbutyricumon growth performance, nitrogen, metabolism, intestinal morphology and cecal microflora in broiler chickens[J].JournalofAnimalandVeterinaryAdvances, 2012, 11(15):2665-2671.
[9] ZHANG Y, WANG X, HU M, et al. Effect of hydraulic retention time (HRT) on the biodegradation of trichloroethylene wastewater and anaerobic bacterial community in the UASB reactor[J].AppliedMicrobiologyandBiotechnology, 2015, 99(4):1977-1987.
[10] SUEZ J, KOREM T, ZEEVI D, et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota[J].Nature, 2014, 514(7521):181-186.
[11] NICHOLSON J K, HOLMES E, KINROSS J, et al. Host-gut microbiota metabolic interactions[J].Science, 2012, 336(6086):1262-1267.
[12] CHO I, YAMANISHI S, COX L, et a1. Antibiotics in early life alter the murine colonic microbiome and adiposity[J].Nature, 2012, 488(7413):621-626.
[13] GILL S R, POP M, DEBOY R T, et a1. Metagenomic analysis of the Human distal gut microbiome[J]. Science, 2006, 312(5778):1355-1359.
[14] MO S J, KIM B S, YUN S J, et al. Genome sequencing ofClostridiumbutyricum, DKU-01, isolated from infant feces[J].GutPathogens, 2015, 7(8):1-7.
[15] ZHAO X, GUO Y, GUO S, et al. Effects ofClostridiumbutyricum, andEnterococcusfaecium, on growth performance, lipid metabolism, and cecal microbiota of broiler chickens[J].AppliedMicrobiologyandBiotechnology, 2013, 97(14):6477-6488.
[16] 劉亭婷, 滑靜, 王曉霞,等. 丁酸梭菌對蛋用仔公雞腸道菌群、形態結構及黏膜免疫相關細胞的影響[J]. 動物營養學報, 2012, 24(11):2210-2221. LIU T, HUA J, WANG X, et al.Clostridiumbutyricum: Effects on intestinal microflora, morphology and mucosal immunity-associated cells in egg-laying male chicks[J].ChineseJournalofAnimalNutrition, 2012, 24(11):2210-2221. (in Chinese with English abstract)
[17] TILG H, MOSCHEN A R. Microbiota and diabetes: an evolving relationship[J].Gut, 2014, 63(9):1513-1521.
[18] ZHANG B, YANG X, LONG Y G F. Effects of dietary lipids andClostridiumbutyricumon the performance and the digestive tract of broiler chickens[J].ArchivesofAnimalNutrition, 2011, 65(4):329-39.
[19] LAKSHMI T S, MALLIKA A, NICOLE B S, et al. Butyrate enhances disease resistance of chickens by inducing antimicrobial host defense peptide gene expression[J].PLoSOne, 2011, 6(11):e27225.
(責任編輯 盧福莊)
Effect ofClostridiumbutyricumin feed on structures of cecal microbiota in broilers based on high-throughput sequencing
XIAO Yingping1, YANG Caimei2, DAI Bing2, LI Kaifeng1, CHEN Jinggang1, YANG Hua1,*
(1.InstituteofQualityandStandardforAgro-products,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China; 2.CollegeofAnimalScience&Technology,ZhejiangA&FUniversity,Hangzhou311300,China)
The aim of this study was to investigate the effects ofClostridiumbutyricum(CB) on cecal microbiota in broiler chickens based on high-throughput sequencing. A total of 300 one-day-old birds were randomly allotted to 2 groups, representing control (basal diet) and CB-treated group (basal diet+3×107cfu·kg-1CB), 6 replications per group with 25 chickens per replication. All chickens were weighted and cecal contents were collected from 3 male chickens per replication to extract genomic DNA after a 42-d treatment. The V3 and V4 regions in 16S rRNA gene of bacteria were amplified and analyzed based on Illumine Miseq sequencing. Results showed that the feed to gain ratio significantly reduced (P<0.05) in CB treatment. Among all bacterial groups revealed by the interpretable sequences, Firmicutes, Bacteroidetes, Proteobacteria and Tenericutes were the predominant phylum in cecum of chickens. It indicated the trend that the relative abundance of Firmicutes decreased by CB treatment, whereas Bacteroidetes increased. At the genera level,Ruminococcaceaeuncultured,Faecalibacterium,Alistipes,Lachnospiraceae_incertae_sedisdominated in cecum. Compared with the control group, administration of CB increased the relative abundance ofFaecalibacterium,Alistipes,Bacteroides,PhascolarctobacteriumandButyricicoccus(P<0.05), but decreased the relative abundance ofLachnospiraceae_incertae_sedis,Lachnospiraceae_unclassified,Rikenella,StreptococcusandBlautia(P<0.05). Interestingly, the genera of increasing abundance were major bacteria which produce short-chain fatty acids (SCFAs) in cecum and large intestine. These findings suggested that the addition of CB to diet decreased the feed to gain ratio but increased the abundance of bacteria producing SCFAs in cecum of broiler chickens.
ClostridiumButyricum; high-throughput sequencing; broiler chicken; microbiota
10.3969/j.issn.1004-1524.2017.03.04
2016-07-18
國家自然科學基金(31402083);浙江省農業科學院國際合作項目
肖英平(1984—),男,江西興國人,博士,助理研究員,從事單胃動物營養研究。 E-mail: ypxiaozju@126.com
*通信作者,楊華,E-mail: yanghua806@hotmail.com
S831;Q93-332
A
1004-1524(2017)03-0373-07
浙江農業學報ActaAgriculturaeZhejiangensis, 2017,29(3): 373-379
http://www.zjnyxb.cn
肖英平,楊彩梅,代兵,等. 基于高通量測序的丁酸梭菌對肉雞盲腸菌群結構的影響[J].浙江農業學報,2017,29(3): 373-379.

