三維適形放療聯合EGFR-TKIs治療局部晚期非小細胞肺癌效果觀察
賈敬好,王 靜,王 巍,楊海芳,姚學敏,孫國貴
(河北省唐山市人民醫院放化療科,河北 唐山 063001)
·論 著·
三維適形放療聯合EGFR-TKIs治療局部晚期非小細胞肺癌效果觀察
賈敬好,王 靜,王 巍,楊海芳,姚學敏,孫國貴
(河北省唐山市人民醫院放化療科,河北 唐山 063001)
目的評價放療聯合靶向治療對局部晚期非小細胞肺癌(non-small cell lung cancer,NSCLC)的效果。方法回顧分析91例局部晚期NSCLC患者的臨床資料,病理均經組織學或細胞學證實,行三維適形放療或調強放療,常規分割每次1.8~2.0 Gy,每日1次,每周5次,計劃靶體積劑量56~64 Gy。其中單純放療39例,同時口服靶向藥物52例,對可能影響預后的相關指標進行單因素和多因素分析。結果所有患者1、2、3年生存率分別為63.4%、33.8%、17.0%,中位生存期為19.4個月。Log-Rank單因素分析顯示:鱗癌較腺癌無進展生存期和總生存期長、腫瘤靶區體積(gross target volume,GTV)≤250 cm3者較GTV>250 cm3者無進展生存期和總生存期長、照射劑量>60 Gy者較≤60 Gy者無進展生存期和總生存期長、表皮生長因子受體突變陽性者較野生型者無進展生存期和總生存期長、接受靶向治療者較不接受靶向治療者無進展生存期和總生存期長、療效越好無進展生存期和總生存期越長,差異有統計學意義(P<0.05)。Cox回歸多因素分析顯示:照射劑量、靶向治療、療效評價是影響NSCLC患者生存率的因素(P<0.05)。結論放療照射劑量、靶向治療及療效判定是局部晚期NSCLC的預后因素,放療聯合靶向治療是局部晚期NSCLC的有效方法。
癌,非小細胞肺;化放療;預后
在中國乃至全球,肺癌是發病率和病死率都非常高的疾病,其中80%為非小細胞肺癌(non-small cell lung cancer,NSCLC),且大多數患者在確診時已屬中晚期,失去手術機會。在放射治療方面,局部晚期NSCLC有縱隔淋巴結轉移或重要器官受損,均影響患者的耐受性和療效,目前美國國立綜合癌癥網絡指南推薦對于不可手術的晚期NSCLC患者,如體力狀態良好且預計生存期較長者應接受根治性同步放化療,而同步放化療療效不盡如人意,且耐受性較差[1-2]。隨著肺癌基因組學研究的進一步深入,表皮生長因子受體酪氨酸激酶抑制劑(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)為肺癌患者提供了一種有效的治療方案,第一代的代表藥物如特羅凱、易瑞沙及凱美納已廣泛應用于晚期NSCLC的治療。EGFR-TKIs主要通過競爭性結合三磷酸腺苷的酪氨酸激酶結構域,破壞EGFR活性,阻斷其信號傳遞,從而阻滯癌細胞的增殖、生長和存活等,EGFR-TKIs還具有放射增敏作用,EGFR下游信號通路的干擾可能與放療抵抗相關,埃羅替尼聯合放射治療可能會增加殺傷癌細胞[3-4]。且不良反應可控可耐受,多數經對癥治療后可緩解。雖然靶向治療有效,但是很容易出現耐藥,原因主要在于腫瘤的異質性和上皮細胞間質的轉化,精確放療與特異性靶向治療聯合策略可能有助于進一步提高療效,本研究重點探討放療聯合靶向治療的療效。
1 資料與方法
1.1 一般資料 選擇2012年1月—2015年8月在河北省唐山市人民醫院接受放療的91例局部晚期NSCLC患者臨床資料,本研究所有患者均經胸外科專家會診證實無法手術或患者家屬拒絕手術,且拒絕化療,均經病理學或細胞學證實為肺癌,男性46例,女性45例,年齡52~76歲,中位年齡67歲,鱗癌39例,腺癌52例,行單純放射治療39例,行放療同時口服特羅凱治療52例,EGFR突變陽性58例,野生型33例。
1.2 方法
1.2.1 靶向治療方案 52例患者行放療同時口服特羅凱治療,口服特羅凱治療的患者EGFR檢測均為陽性,劑量為150 mg/次,1次/d,口服特羅凱治療直至疾病進展或不良反應不能耐受為止,后續入組患者口服至隨訪之日。
1.2.2 放療計劃設計 應用Pinnacle3 7.0 治療計劃系統,患者仰臥位,體部熱塑膜固定行CT模擬定位,在定位CT圖像上勾畫放療靶區。在縱隔窗勾畫縱隔內腫物、陽性淋巴結及正常器官,在肺組織窗勾畫位于肺內的腫物。腫瘤靶區體積(gross target volume,GTV)包括肺部病灶和縱隔腫大淋巴結,臨床靶體積(clinical target volume,CTV)在GTV基礎上外放0.5 cm,包括治療前影像學證實轉移的淋巴結所在的整個淋巴引流區,計劃靶體積(planning target volume,PTV)在CTV基礎上向各方向均勻外擴0.5 cm。處方劑量:95%PTV 為56~64 Gy/28~32 F,單次劑量為2.0 Gy。95% PTV接受大于等于其處方劑量。正常器官限量:脊髓最大劑量<45 Gy;肺V20<30%,平均肺劑量<15 Gy;所有入組病例靶區及放療計劃均經本科室高年資副主任醫師及以上審核確認。本研究11例患者出現頸部淋巴結轉移,調強放療計劃不能實施時,加用單頸部淋巴結照射(病灶位于肺下葉,頸部淋巴結離靶區較遠,為避免過多正常組織受照,設計頸部單野電子線與X線混照),其中調強9例,單頸野治療2例,處方劑量為60Gy,均順利完成放射治療。
1.2.3 療效評價 放療結束后每3個月復查胸部、上腹部CT、頭顱MRI,觀察腫瘤縮退情況。按WHO實體瘤近期療效評價標準評估療效。
1.2.4 觀察終點總生存期 總生存期定義為從病理確診日期開始至患者出現死亡或末次隨訪日期。
1.3 統計學方法 應用SPSS 22.0 統計軟件分析數據。 Kaplan-Meier法進行生存分析,用Log-rank進行單因素分析,單因素分析P<0.1判定為接近統計學意義,并進入多因素Cox回歸模型進行分析。P<0.05為差異有統計學意義。
2 結 果
2.1 隨訪結果 全組患者采用電話、門診或住院等方式隨訪。截至2015年12月31日全組隨訪時間4~43個月,中位隨訪時間為19個月,隨訪率為100.0%,死亡46例(50.5%)。
2.2 近期療效 本組患者評價為完全緩解為14.3%(13/91),部分緩解67.0%(61/91),疾病穩定13.2%(12/91),疾病進展5.5%(5/91)。近期總有效率(完全緩解+部分緩解)為82.3%(74/91)。
2.3 預后分析
2.3.1 單因素分析 鱗癌較腺癌無進展生存期和總生存期長、GTV≤250 cm3者較GTV>250 cm3者無進展生存期和總生存期長、照射劑量>60 Gy者較≤60 Gy者無進展生存期和總生存期長、EGFR突變陽性者較野生型者無進展生存期和總生存期長、接受靶向治療者較不接受靶向治療者無進展生存期和總生存期長、療效越好無進展生存期和總生存期越長,見表1。
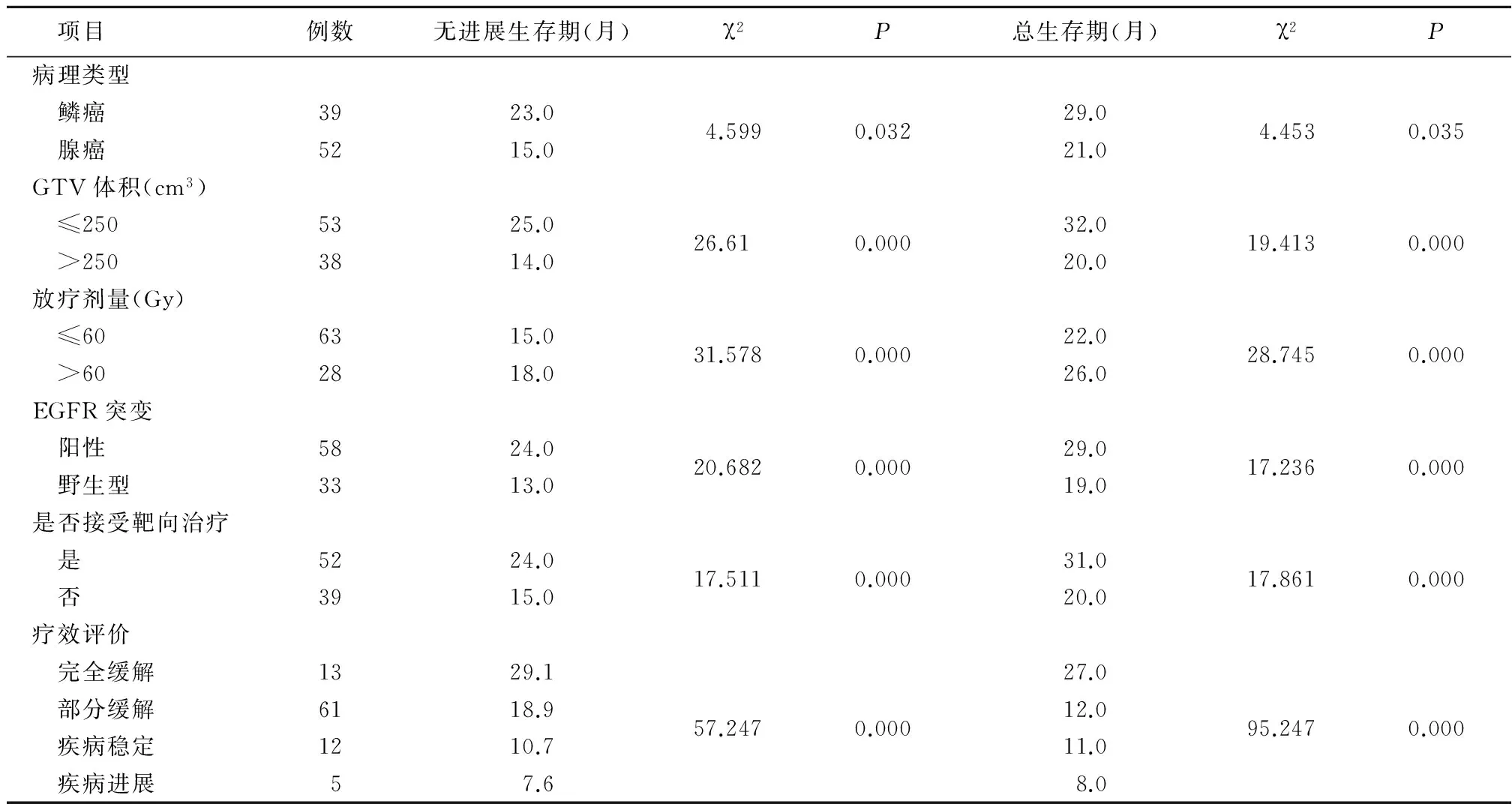
表1 91例局部晚期NSCLC患者預后的單因素分析結果
2.3.2 Cox回歸分析 以性別(男=1,女=2)、病理類型(鱗癌=1,腺癌=2)、GTV(≤250 cm3=1,>250 cm3=2)、PTV處方劑量(≤60 Gy=1,>60 Gy=2)、EGFR突變(野生型=1,突變陽性=2)、靶向治療(未接收=1,接受=2)、療效評價(完全緩解=1,部分緩解=2,疾病穩定=3,疾病進展=4)為自變量,以生存狀態(死亡=1,存活=2)進行多因素Cox回歸分析,結果顯示照射劑量、靶向治療、療效評價是影響NSCLC患者生存的因素(P<0.05),見表2。

表2 91例局部晚期NSCLC患者預后的Cox回歸分析
2.3.3 生存率 全組患者的中位總生存期為19.4個月(95%CI:16.7~28.9個月),全組1、2、3年生存率分別為63.4%、33.8%、17.0%,其余各處理組比較的生存率曲線見圖1~7。
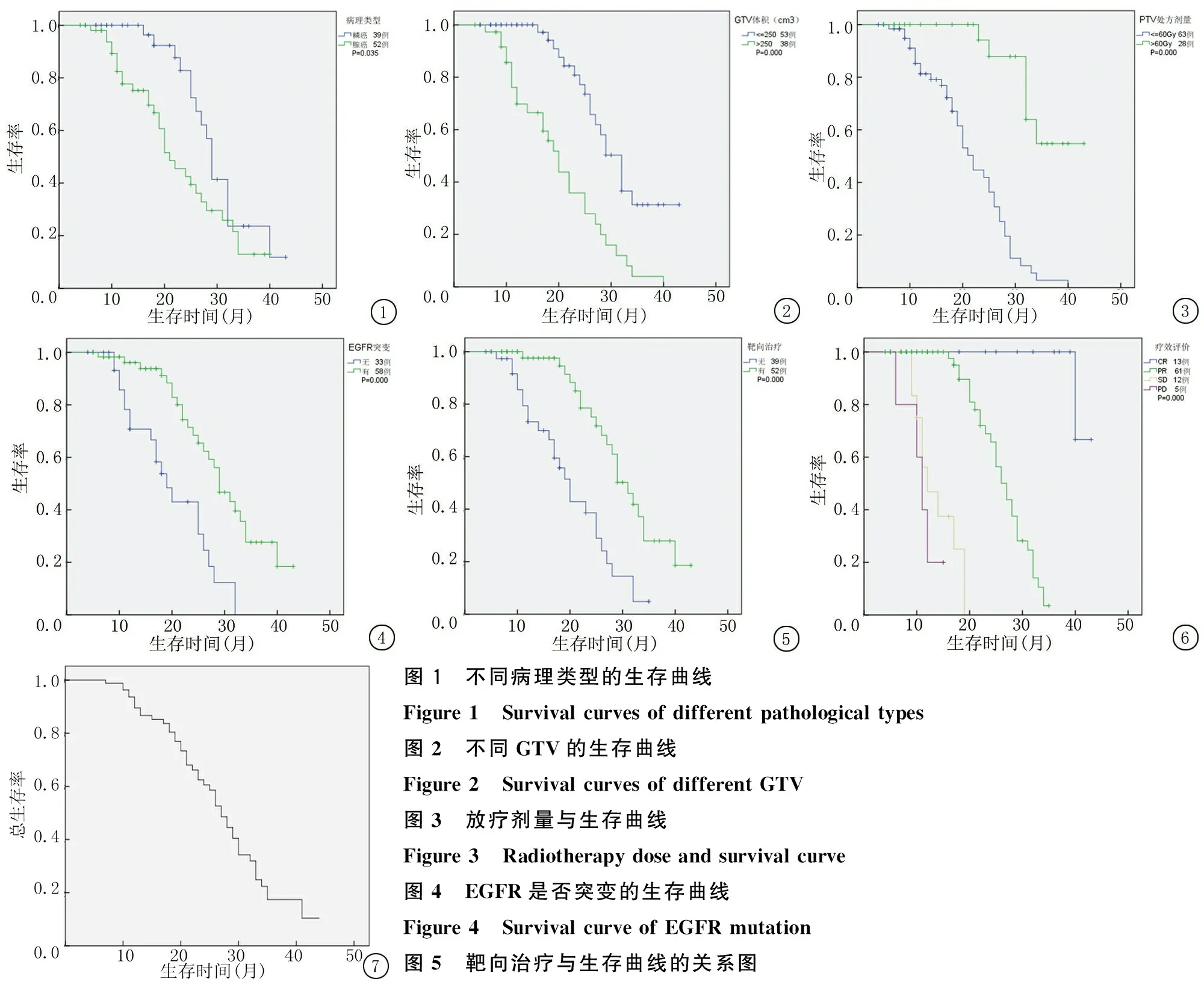
圖1 不同病理類型的生存曲線Figure1 Survivalcurvesofdifferentpathologicaltypes圖2 不同GTV的生存曲線Figure2 SurvivalcurvesofdifferentGTV圖3 放療劑量與生存曲線Figure3 Radiotherapydoseandsurvivalcurve圖4 EGFR是否突變的生存曲線Figure4 SurvivalcurveofEGFRmutation圖5 靶向治療與生存曲線的關系圖
Figure 5 The relationship between target therapy and survival curve
圖6 療效與生存曲線的關系圖
Figure 6 Relationship between efficacy and survival curve
圖7 全組患者的生存率曲線
Figure 7 Survival curve of the whole group
3 討 論
臨床上對于無手術指征的局部晚期NSCLC患者,同步放化療總體療效不佳,且耐受性較差。由于局部晚期NSCLC患者較多,治療起來非常棘手,過度追求多種治療方法的聯合可能也不是最佳治療方案,并且需要綜合考慮患者的身體耐受性及治療的不良反應,因而很多學者嘗試放療或化療聯合靶向治療,這已成為近年來的研究熱點[5-8]。Swaminath等[1]將40例新診斷的晚期NSCLC患者分成2組,接受3周的埃羅替尼治療,每日劑量為150 mg,放療前1周開始口服,胸部放療為30 Gy,10次,2周,放療結束繼續口服埃羅替尼。觀察指標包括生活質量的改善及總生存期。26例完成了完整的埃羅替尼治療,35例接受了完整的放療計劃,生活質量評分得到不同程度的改善,放療期間口服靶向治療與單獨放療組的整體無進展生存中位值為5.2和3.2個月。該研究者認為,埃羅替尼加姑息胸部放療可使局部晚期或轉移性NSCLC患者獲益。EGFR突變可能與療效的提高有關。本研究結果顯示,EGFR突變陽性和野生型生存時間分別為24.0個月和13.0個月。提示應根據EGFR突變情況選擇入組人群,使能接受放療、化療、靶向治療的患者得到合理的可以承受的有效治療。而研究顯示同步放化療期間接受EGFR-TKIs治療的Ⅲ期NSCLC患者較接受單純放療聯合EGFR-TKIs治療者總生存期短,陰性結果可能與化療聯合靶向不能增加療效有關。TKIs使腫瘤細胞停止增殖、細胞周期停滯,從而可能減少腫瘤細胞對細胞毒性藥物的敏感性,還有同步放化療降低患者對治療的耐受性,治療的不良反應影響患者的總生存期[5-7]。對于EGFR突變陽性的患者,給予靶向治療為基礎的綜合治療,嚴格掌握治療適應證可以使患者明顯獲益[9]。
基于上述研究,筆者嘗試TKIs聯合單純放療治療局部晚期NSCLC,本研究入組91例拒絕手術拒絕化療的Ⅲ期NSCLC患者,其中接受單純放射治療39例,放射治療+口服特羅凱治療52例,治療后中位無進展生存期和總生存期分別為14.4個月和24.9個月與20.1個月和30.8個月,1年總生存率為63.4%;另外,EGFR突變有無組中位無進展生存期和總生存期分別為13.5個月和24.3個月與20.1個月和29.8個月。表明EGFR突變狀態選擇入組人群可能帶來更好的生存獲益,結果與相關研究相似[10-11]。本研究結果顯示病理類型與患者的無進展生存期及總生存期相關,考慮入組患者基本篩選了EGFR突變結果,52例患者行放療同時口服特羅凱治療,EGFR突變為58例,EGFR突變且為腺癌的患者口服特羅凱所占比例較大。本研究結果同樣證實了GTV與生存時間的關系。GTV直接體現了通過解剖或功能影像所能顯示病變的局部侵犯以及縱隔淋巴結的轉移數目、位置和大小,直接體現了該患者的T分期和N分期,本研究統計時采取所有患者GTV中位數為分界值,統計結果充分體現了瘤負荷與生存時間的關系。提示TKIs同步放療對EGFR敏感突變的患者是有希望的治療方案,當然該結果仍需要大樣本研究進一步證實。另外,劑量與生存時間的關系多項研究均證實,常規分割情況下過度追求放療劑量的提高,并不能帶來理想的療效提高以及生存時間的延長。但本研究的治療模式為放射治療與靶向治療的結合,相對來說,治療強度偏弱,單純放療或放療聯合靶向治療2種模式在保證正常組織受量的前提下可適當提高放療計劃的劑量,不失為一種提高局部控制率的方法。如果放療靶區及計劃設計允許,考慮大分割照射可能更好,不過考慮到本研究入組患者均為局部晚期NSCLC患者,分期偏晚,提高放療劑量難度較大,有待進一步研究嘗試。療效的評價與生存時間的關系基本已有定論,本研究結果也證實局部長時間的控制可以換來長期的生存時間,這也為以后的臨床工作提供了思路,對于近期療效較佳的患者,應該給予更加高強度且患者身體可以接受的合理治療,腫瘤的治療任重而道遠,應當在患者有治療機會的短時間內給予患者最獲益的治療。目前,放療聯合靶向藥物的應用模式尚存在許多疑問,期待這些研究為臨床治療模式的確立提供更多的依據。
研究表明相當一部分的腫瘤細胞存在EGFR的過度表達,在NSCLC中EGFR的表達率為40%~85%。EGFR的過度表達在惡性腫瘤中不僅常見,而且與腫瘤細胞的轉移、浸潤及患者的預后密切相關[12-13]。有多中心臨床研究證明,EGFR-TKI藥物中吉非替尼與厄洛替尼在晚期EGFR基因突變類型的NSCLC一線治療中具有較高的臨床價值,且厄洛替尼在不良反應與耐受性方面較好。而且EGFR-TKI也具有全身治療的效果,其與三維適形放療均具有“靶向”治療性,厄洛替尼與放療聯合應用具有較高的增效作用,而肺部疾病與放射性損傷發生率并無明顯增加[13-14]。本研究結果顯示,放療聯合靶向治療明顯優于單純放療組,從總生存期、無進展生存期以及生存率方面均得到體現。表明三維適形放療聯合厄洛替尼治療能夠有效增加放療敏感度,可能與加重損傷、改善腫瘤細胞乏氧有關[15-16],提高近期療效以及在提高近期療效的基礎上對遠期疾病的局部控制率也有明顯提高作用。另外,本研究未特殊考慮患者的其他影響生存時間的臨床因素如是否合并基礎疾病(主要為基礎肺疾病以及心臟疾病)、吸煙史等。相關研究表明尼古丁不僅是吸煙成癮的主要物質,而且可以促進癌細胞出現異質性,從而加速實體瘤的增長以及轉移,引起癌細胞對治療的抵抗,降低治療效果[17]。可見患者的生存時間是多因素綜合影響結果。
本研究因入組病例時,考慮拒絕手術且拒絕化療,還要兼顧EGFR表達情況,入組緩慢,且病例數較少,初步療效較為理想,后續需進一步完善實驗設計,加大樣本量,繼續進行其他影響生存時間的臨床、病理及靶向藥物受體結合位點等研究,繼續隨訪治療療效。總之,三維適形放療聯合厄洛替尼治療NSCLC,不僅能夠有效提高近期與遠期療效,還能使腫瘤靶向周圍的正常組織得到保護,不致被損傷[18],適合在特定優勢人群里推廣應用。
[1] Swaminath A,Wright JR,Tsakiridis TK,et al. A phase Ⅱ trial of erlotinib and concurrent palliative thoracic radiation for patients with non-small-cell lung cancer[J]. Clin Lung Cancer,2016,17(2):142-149.
[2] Arrieta O,Vega-Gonzlez MT,Lpez-Macías D,et al. Randomized,open-label trial evaluating the preventive effect of tetracycline on afatinib induced-skin toxicities in non-small cell lung cancer patients[J]. Lung Cancer,2015,88(3):282-288.
[3] Kriegs M,Gurtner K,Can Y,et al. Radiosensitization of NSCLC cells by EGFR inhibition is the result of an enhanced p53-dependent G1 arrest[J]. Radiother Oncol,2015,115(1):120-127.
[4] Sato Y,Ebara T,Sunaga N,et al. Interaction of radiation and gefitinib on a human lung cancer cell line with mutant EGFR gene in vitro[J]. Anticancer Res,2012,32(11):4877-4881.
[5] Wu YL,Zhou C,Hu CP,et al. Afatinib versus cisplatinplus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6):an open-label,randomised phase 3 trial[J]. Lancet Oncol,2014,15(2):213-222.
[6] Brahmer JR,Lee JW,Trayno AM, et al. Dosing to rash:a phase II trial of the first-line erlotinib for patients with advanced non-small-cell lung cancer an Eastern Cooperative Oncology Group study(E3503)[J]. Eur J Cancer,2014,50(2):302-308.
[7] Xu J,Jin B,Chu T,et al. EGFR tyrosine kinase inhibitor(TKI) in patients with advanced non-small cell lung cancer(NSCLC) harboring uncommon EGFR mutations:A real-world study in China[J]. Lung Cancer,2016,96:87-92.
[8] 夏發明,文石兵,黃立功,等.吉非替尼治療進展期非小細胞肺癌療效分析及對血清MMP-9的影響[J].河北醫科大學學報,2012,33(6):632-635.
[9] Katakami N,Atagi S,Goto K,et al. LUX-Lung 4:a phase II trial of afatinib in patients with advanced non-small-cell lung cancer who progressed during prior treatment with erlotinib,gefitinib,or both[J]. J Clin Oncol,2013,31(27):3335-3341.
[10] Baek JH,Sun JM,Min YJ,et al. Efficacy of EGFR tyrosine kinase inhibtors in patients with EGFR-mutated non-small cell lung cancer except both exon 19 deletion and exon 21 L858R:a retrospective analysis in Korea[J]. Lung Cancer,2015,87(2):148-154.
[11] Lilenbaum R,Samuels M,Wang X,et al. A phaseⅡstudy of induction chemotherapy followed by thoracic radiotherapy and erlotinib in poor- risk stage Ⅲ non- small- cell lung cancer:results of CALGB 30605(Alliance)/RTOG 0972(NRG)[J]. J Thorac Oncol,2015,10(1):143-147.
[13] Talasila KM,Soentgerath A,Euskirchen P,et al. EGFR wild type amplification and activation promote invasion and development of glioblastoma independent of angiogenesis[J]. Acta Neuropathol,2013,125(5):683-698.
[14] Liccardi G,Hartley JA,Hochhauser D. Importance of EGFR/ERCC1 interaction following radiation- induced DNA damage[J]. Clin Cancer Res,2014,20(13):3496-3506.
[15] Tung CL,Jian YJ,Syu JJ,et al. Down-regulation of ERK1/2 and AKT- mediated X- ray repair cross- complement group 1 protein(XRCC1) expression by Hsp90 inhibition enhances the gefitinib- induced cytotoxicity in human lung cancer cells[J]. Exp Cell Res,2015,334(1):126-135.
[16] Metro G,Chiari R,Bennati C, et al. Clinical outcome with platinum-based chemotherapy in patients with advanced nonsquamous EGFR wild-type none small-cell lung cancer segregated according to KRAS mutation status[J]. Clin Lung Cancer,2014,15(1):86-92.
[17] Li H,Wang S,Takayama K,et al. Nicotine induces resistance to erlotinib via cross-talk between α1 nAChR and EGFR in the non-small cell lung cancer xenograft model[J]. Lung Cancer,2015,88(1):1-8.
[18] 宋曉,張志林,席強,等.多西紫杉醇聯合同步放療治療局部晚期非小細胞肺癌的臨床觀察[J].國際呼吸雜志,2016,36(22):1703-1706.
(本文編輯:許卓文)
Clinical observation on three dimensional conformal radiotherapy combined with EGFR-TKIs in the treatment of locally advanced non-small cell lung cancer
JIA Jing-hao, WANG Jing, WANG Wei, YANG Hai-fang,YAO Xue-min, SUN Guo-gui
(DepartmentofChemoradiotherapy,TangshanPeople′sHospital,HebeiProvince,Tangshan063001,China)
Objective To evaluate the effect of radiotherapy combined targeted therapy. Methods A retrospective analysis was performed on the medical records of 91 cases with locally advanced non-small cell lung cancer(NSCLC). The pathology was confirmed via histology and cytology, using three dimensional conformal radiation therapy or intensity-modulated radiation therapy, with 1.8-2.0 Gy per fraction once a day, five times a week and planning target volume 56-64 Gy. Thirty-nine received radiotherapy alone. And 52 received radiotherapy combined with erlotinib. The Kaplan-Meier method was used to calculate overall survival rate. The Cox regression model was used for multivariate prognostic analysis. Results For all the patients, the survival rate of one, two and three years were 63.4%, 33.8%, and 17.0% respectively, and the median survival time was 19.4 months. Univariate analysis by Log-rank test showed that the progress free survival and overall survival time varied significantly among lung cancer patients from different pathology type, gross target volume(GTV), irradiation dose and epidermal growth factor rececptor(EGFR) mutation or non-mutation and receiving target therapy or non-receiving target therapy(P<0.05),according to this research it indicated that lung cancer patient with squamous cell carcinoma, GTV less than 250 cm3, irradiation dose more than 60 Gy, EGFR mutation and receiving target therapy could survive a longer progress free survival and overall survival. Multiple factors analysis of Cox regression model suggested radiation dose, targeted therapy, the curative effect were the main factors for patients' survival time(P<0.05). Conclusion Radiation dose, target treatment and curative effect were prognostic factors of locally advanced NSCLC. Radiotherapy combined targeted therapy was an effective method for locally advanced NSCLC.
carcinoma, non-small cell lung;chemo radiotherapy; prognosis
2016-12-03
2017-01-09
賈敬好(1980-),男,河北唐縣人,河北省唐山市人
R730.26
A
1007-3205(2017)03-0282-06
10.3969/j.issn.1007-3205.2017.03.009
民醫院主治醫師,醫學碩士,從事惡性腫瘤放化療研究。

