不同葡萄品種對灰霉病菌脅迫的響應
姜彩鴿,王國珍,張 怡,邵鵬梅
(1.寧夏農林科學院 植物保護研究所,銀川 750002;2.銀川市西夏區鎮北堡鎮人民政府農技服務中心,銀川 750021)
不同葡萄品種對灰霉病菌脅迫的響應
姜彩鴿1,王國珍1,張 怡1,邵鵬梅2
(1.寧夏農林科學院 植物保護研究所,銀川 750002;2.銀川市西夏區鎮北堡鎮人民政府農技服務中心,銀川 750021)
為了解賀蘭山東麓不同主栽葡萄品種對灰霉病的感病程度,依據不同品種抗性不同的分布特點制定相應的防治措施,提高防治效果。對各葡萄品種的內含物-花青素、酚類物、糖分、總抗壞血酸(或維生素C)及維生素E分別采用錦葵色素標準品法、Arnow試劑法、直接滴定法、熒光法(或2,6-二氯靛酚滴定法)、高效液相色譜法進行檢測。結果表明:發病果實的花青素等物質的質量分數與健康果實存在明顯差異,證明葡萄灰霉病的發生和花青素等物質有密切關系,質量分數較高抗病性較強,反之則弱;依不同葡萄品種被灰霉病菌侵染后各內含物的降幅進行比較判斷,其抗病性強弱依次為‘赤霞珠’>‘梅鹿輒’>‘西拉’>‘雷司令’>‘霞多麗’>‘白詩楠’。由此可見,室內檢測結果與田間發病表現一致,田間防治應以白色品種為重點。
葡萄;灰霉病菌;內含物監測;抗病性
葡萄灰霉病是制約葡萄產業發展的一大障礙,是常見、也是危害最大的病害之一[1],更是保護地葡萄生產和葡萄貯藏期最為重要的病害種類之一,在中國南方地區和北方溫室葡萄生產中發生尤為嚴重[2],每年該病造成巨大的經濟損失。葡萄灰霉病帶來的危害是雙重性的:一方面,由于果穗的減少而導致產量的降低。有些感病品種如遇持續高濕陰雨,花穗會嚴重受害,病穗率可達70%以上[3-4]。葡萄灰霉病在貯藏過程中發病是毀滅性的,每年因灰霉病造成的葡萄產后損失在20%~30%左右,最高可達50%[5-6]。另一方面,它還給葡萄酒帶來不良味感,同時使葡萄酒不耐陳釀,降低葡萄酒的質量[7]。隨著葡萄種植面積不斷擴大,葡萄灰霉病也逐漸成為寧夏葡萄生產中的主要病害之一,造成成熟期果實腐爛,病情一旦發生即發展迅速且難以控制[8-10],已影響到該地區葡萄的產量和品質。
目前,對于葡萄灰霉病的防治仍以化學防治為主[11-14],引發環境污染、農藥抗藥性、破壞生態平衡、農藥殘留等嚴重問題,對人們的健康極為不利。為此,本研究通過分析灰霉病與葡萄中花青素等物質的相關性,了解賀蘭山東麓不同的主栽葡萄品種對灰霉病的感病程度,以期為品種的合理布局制定相應的防治措施,為提高葡萄優質高產及可持續發展等奠定基礎。
1 材料與方法
1.1 材 料
在葡萄果實膨大期(6月28日)、轉色期(8月21日)、成熟期(9月4日)于寧夏玉泉營農場采集‘赤霞珠’‘梅鹿輒’‘西拉’‘霞多麗’‘雷司令’‘白詩楠’的果實。每個品種采集2份各1 kg,1份健康果穗作為對照,另1份在室內進行灰霉病菌接種。
1.2 接種方法
樣品經自來水沖洗3遍,蒸餾水沖洗3遍,φ=75%的酒精浸泡消毒1 min,無菌水沖洗3遍后,用消毒接種針在葡萄果實上刺小傷口,將果穗浸入孢子數密度為106mL-1菌懸液中1 h,使分生孢子充分發生作用,再分別轉入干燥器上層,干燥器底層注入 1 000 mL稀釋的菌懸液(飽和水)以保濕,上下分開以防果實腐爛。放入21 ℃人工氣候箱內培養1 d后進行檢測。孢子懸浮液的準備方法參照文獻[15],即配制菌懸液時可放入φ=0.05%的Tween-20,再加入質量濃度為0.005 g/mL 的葡萄糖和0.008 g/mL的磷酸二氫鉀以刺激分生孢子引起侵染。
1.3 各內含物質量分數檢測方法
依采集品種內含物的不同所需測定的指標也不同,深色品種進行花青素、酚類物、糖分、總抗壞血酸及維生素E檢測(維生素C測定法不適用于深色樣品,因此深色品種檢測總抗壞血酸),白色品種則進行酚類物、糖分及維生素C、E檢測(白色品種的花青素質量分數很低,不予檢測)。
1.3.1 花青素測定 花青素提取液的制備:先對葡萄果實進行預處理,用自來水和蒸餾水洗凈,晾干表面水分后,粉碎、勻漿冷凍,備用。參照Chiriboga和Francis的試驗方法并作改進提取花青素,取樣品10 g,提取溶劑為含φ=2%鹽酸的無水甲醇,料液比1∶10(質量與體積之比),提取溫度60 ℃,提取時間1 h。提取次數為2次,葡萄提取液在8 000 r/min離心10 min后,收集上清液,備用以檢測花青素質量分數。
參照文獻[16]的方法進行配比:精密稱取定量錦葵色素標準品溶液至10 mL容量瓶中,用φ=2%的鹽酸甲醇溶解,并定容到刻度,即得到0.1 mg/mL的錦葵色素標準品溶液,以φ=2%的鹽酸甲醇溶液為空白,通過紫外可見分光光度計的全波長掃描,確定花青素的最大吸收波長為546 nm。
配制0.1 mg/mL的錦葵色素標準品母液(表1)。分別精密移取上述溶液0、0.4、0.8、1.2、1.6、2.0、2.4 mL到10 mL容量瓶中,用φ=2%的鹽酸甲醇定容至刻度,即得到錦葵色素標準品的質量濃度分別為 0、4、8、12、16、20、24 μg/mL。用φ=2%的鹽酸甲醇作空白,在546 nm處測定其吸光度值,以3次平均值為數據進行回歸處理得回歸方程,并作標準曲線。
對果實中的花青素質量分數進行測定,平行測定3次,取平均值。從樣品提取液V2中精密稱定V3到容量瓶V1中,φ=2%的鹽酸甲醇溶解并定容到刻度。φ=2%的鹽酸甲醇作空白。在546 nm 處測定其吸光度值。花青素質量分數按下列公式計算:
花青素質量分數=(A/K)×V1×(V2/V3)×(10-6/W)×100%
式中,A為最大吸收峰位置處的吸光度;K為標準曲線斜率;V1為供試液體積(mL);V2為提取液總體積(mL);V3為吸取V2中用于檢測的提取液體積(mL);W為樣品的初始質量(g)。

表1 花青素標準曲線制作中所用到的溶液配比Table 1 Solution ratio used in the production of anthocyanin standard curve
1.3.2 酚類物質 采用Arnow試劑法進行測定[17]。取18只1.8 cm×18 cm的試管,按表2加液,每質量濃度重復3次。當NaOH液加入不久,管中溶液變為橙紅色。在721分光光度計515 nm處測OD值,以3次平均值作標準曲線。
采集樣品果實2 g進行預處理,研磨待測定。稱取樣品0.5 g,加10 mL無水乙醇進行勻漿,洗入大試管中(用少許無水乙醇洗勻漿器,洗液并入試管中),在90 ℃恒溫水浴中提取(試管加蓋),10 min后取出,冷卻。再在3 000 r/min離心10 min。取上清液倒入50 mL容量瓶中,沉淀再重復提取2次。合并上清液,用無水乙醇定容至50 mL即為樣品液。吸取樣品液1 mL于試管中,其余步驟同標準曲線的測定。以1 mLφ=95%的乙醇作對照,樣品與對照各重復3次,測定樣品中總酚質量分數。以3次重復的平均值查標準曲線,求樣品中總酚質量分數。
每克鮮組織中總酚質量分數=查標準曲線所得值(μg) / 樣品質量(0.5 g)
1.3.3 可溶性總糖 總糖測定方法均是先利用酸水解法使沒有還原性的雙糖和多糖徹底水解成有還原性的單糖,利用還原糖的測定方法來測總糖的質量分數。可溶性總糖質量分數按照GB/T 5009.7-2008[18]直接滴定法進行測定。
試樣處理:稱取粉碎后的樣品果實2.5~5 g,置250 mL容量瓶中,加50 mL水,慢慢加入5 mL 乙酸鋅溶液及5 mL亞鐵氰化鉀溶液,加水至刻度,混勻,靜置30 min,用干燥濾紙過濾,棄去初濾液,取續濾液,備用。
標定堿性酒石酸銅溶液:吸取5.0 mL堿性酒石酸銅甲液及5.0 mL堿性酒石酸銅乙液,置于150 mL錐形瓶中,加水10 mL,加入玻璃珠2粒,從滴定管滴加約9 mL葡萄糖或其他還原糖標準溶液,控制在2 min內加熱至沸,趁熱以每2 s加1滴的速度繼續滴加葡萄糖或其他還原糖標準溶液,直至溶液藍色剛好褪去為終點,記錄消耗葡萄糖或其他還原糖標準溶液的總體積,同時平行操作3份,取其平均值,計算每10 mL(甲、乙液各5 mL)堿性酒石酸銅溶液相當于葡萄糖的質量或其他還原糖的質量(mg)[也可以按上述方法標定4~20 mL堿性酒石酸銅溶液(甲、乙液各半)來適應試樣中還原糖的質量濃度變化]。

表2 Arnow法標準曲線的測定Table 2 Determination of Arnow standard curve
試樣溶液預測:吸取5.0 mL堿性酒石酸銅甲液及5.0 mL堿性酒石酸銅乙液,置于150 mL錐形瓶中,加水10 mL,加入玻璃珠2粒,控制在2 min內加熱至沸,保持沸騰,以先快后慢的速度從滴定管中滴加試樣溶液,并保持溶液沸騰狀態,待溶液顏色變淺時,以每2 s加1滴的速度滴定,直至溶液藍色剛好褪去為終點,記錄樣液消耗體積。當樣液中還原糖質量濃度過高時,應適當稀釋后再進行正式測定,使每次滴定消耗樣液的體積控制在與標定堿性酒石酸銅溶液時所消耗的還原糖標準溶液的體積相近,約10 mL左右,結果按下式(1)計算。當質量濃度過低時則采取直接加入10 mL樣品液,免去加水10 mL,再用還原糖標準溶液滴定至終點,記錄消耗的體積與標定堿性酒石酸銅溶液時消耗的還原糖標準溶液體積之差相當于10 mL樣液中所含還原糖的量,結果按下式(2)計算。
試樣溶液測定:吸取5.0 mL堿性酒石酸銅甲液及5.0 mL堿性酒石酸銅乙液,置于150 mL錐形瓶中,加水10 mL,加入玻璃珠2粒,從滴定管滴加比預測體積少1 mL的試樣溶液至錐形瓶中,在2 min內加熱至沸,保持沸騰繼續以每2 s加1滴的速度滴定,直至藍色剛好褪去為終點,記錄樣液消耗體積,同法平行操作3份,得出平均消耗體積。
試樣中還原糖的質量分數(以某種還原糖計)按式(1)進行計算:
X=m1/ (m×V/250×1 000) ×100
(1)
式中:X為試樣中還原糖的質量分數(以某種還原糖計),m1為堿性酒石酸銅溶液(甲、乙液各半)相當于某種還原糖的質量,m為試樣質量,V為測定時平均消耗試樣溶液體積。
當質量濃度過低時試樣中還原糖的質量分數(以某種還原糖計)按式(2)進行計算:
X=m2/(m×10/250×1 000) ×100
(2)
式中:X為試樣中還原糖的質量分數(以某種還原糖計),m2為標定時體積與加入樣品后消耗的還原糖標準溶液體積之差相當于某種還原糖的質量,m為試樣質量。
還原糖質量分數≥10 g/100 g時計算結果保留3位有效數字;還原糖質量分數<10 g/100 g時,計算結果保留2位有效數字。
1.3.4 總抗壞血酸 按照GB/T 5009.86-2003中熒光法[19]測定。
試劑:(1)抗壞血酸標準溶液(1 mg/mL)(臨用前配制)。準確稱取50 mg抗壞血酸,用偏磷酸-乙酸溶液溶于50 mL容量瓶中,并稀釋至刻度。(2)抗壞血酸標準使用液(100 μg/mL)。取10 mL抗壞血酸標準液,用偏磷酸-乙酸溶液稀釋至100 mL,定容前試pH,如其pH>2.2時,則應用偏磷酸-乙酸-硫酸溶液稀釋。(3)0.4 mg/mL的百里酚藍指示劑溶液。稱取0.1 g百里酚藍,加0.02 mol/L氫氧化鈉溶液,在玻璃研缽中研磨至溶解,氫氧化鈉的用量約為10.75 mL,磨溶后用水稀釋至250 mL。變色范圍:pH=1.2,紅色;pH=2.8,黃色;pH>4,藍色。
試樣的制備:稱取100 g鮮樣,加100 mL偏磷酸-乙酸溶液,倒入搗碎機內打成勻漿,用百里酚藍指示劑調試勻漿酸堿度。如呈紅色,即可用偏磷酸-乙酸溶液稀釋,若呈黃色或藍色,則用偏磷酸-乙酸-硫酸溶液稀釋,使其pH為1.2。勻漿的取量需根據試樣中抗壞血酸的質量濃度而定。當試樣液質量濃度為40~100 μg/mL時,一般取20 g勻漿,用偏磷酸-乙酸溶液稀釋至100 mL,過濾,濾液備用。
測定:(1)氧化處理。分別取試樣濾液及標準使用液各100 mL于200 mL帶蓋三角瓶中,加2 g 活化過的活性炭,用力振搖1 min,過濾,棄去最初數毫升濾液,分別收集其余全部濾液,即試樣氧化液和標準氧化液,待測定。(2)各取10 mL標準氧化液于2個100 mL容量瓶中,分別標明“標準”及“標準空白”。(3)各取10 mL試樣氧化液于2個100 mL容量瓶中,分別標明“試樣”及“試樣空白”。(4)于“標準空白”及“試樣空白”溶液中各加5 mL硼酸-乙酸鈉溶液,混合搖動15 min,用水稀釋至100 mL,在4 ℃冰箱中放置2~3 h,取出備用。(5)于“試樣”及“標準”溶液中各加5 mL 500 g/L乙酸鈉溶液,用水稀釋至100 mL,備用。
標準曲線的制備:取上述“測定(5)”中“標準”溶液(抗壞血酸質量濃度為10 μg/mL)0.5、1.0、1.5和2.0 mL標準系列,取雙份分別置于10 mL帶蓋試管中,再用水補充至2.0 mL。
熒光反應:取“測定(4)”中“標準空白”溶液、“試樣空白”溶液及“測定(5)”中“試樣”溶液各2 mL,分別置于10 mL帶蓋試管中。在暗室迅速向各管中加入5 mL鄰苯二胺溶液,振搖混合,在室溫下反應35 min,于激發光波長338 nm、發射光波長420 nm處測定熒光強度。標準系列熒光強度分別減去標準空白熒光強度為縱坐標,對應的抗壞血酸質量濃度為橫坐標,繪制標準曲線或進行相關計算,其直線回歸方程供計算使用。
計算公式見式(3):
X=c·V/m×F×100/1 000
(3)
式中:X為試樣中抗壞血酸及脫氫抗壞血酸總質量分數,c為由標準曲線查得或由回歸方程算得試樣溶液質量濃度,m為試樣的質量,V為熒光反應所用試樣體積,F為試樣溶液的稀釋倍數。計算結果表示到小數點后1位。
精密度:在重復性條件下獲得的兩次獨立測定結果的絕對差值不得超過算術平均值的10%。
1.3.5 維生素C 按照GB 6195-86 中2,6-二氯靛酚滴定法[20]測定。此方法不適用于深色樣品。
抗壞血酸標準溶液(1 mg/mL):稱取100 mg(準確至0.l mg)抗壞血酸,溶于浸提劑中并稀釋至100 mL。現配現用。
2,6-二氯靛酚(2,6-二氯靛酚吲哚酚鈉鹽)溶液:稱取碳酸氫鈉52 mg溶解在200 mL熱蒸餾水中,然后稱取2,6-二氯靛酚50 mg溶解在上述碳酸氫鈉溶液中。冷卻定容至250 mL,過濾至棕色瓶內,保存在冰箱中。每次使用前,用標準抗壞血酸標定其滴定度。即吸取1 mL抗壞血酸標準溶液于50 mL錐形瓶中,加入l0 mL浸提劑,搖勻,用2,6-二氯靛酚溶液滴定至溶液呈粉紅色15 s 不褪色為止。同時,另取10 mL浸提劑做空白試驗。
滴定度按式(4)計算:
T=(C·V) / (V1-V2)
(4)
式中:T為每毫升2,6-二氯靛酚溶液相當于抗壞血酸的毫克數;C為抗壞血酸的濃度,V為吸取抗壞血酸的體積,V1為滴定抗壞血酸溶液所用2,6-二氯靛酚溶液的體積,V2為滴定空白所用2,6-二氯靛酚溶液的體積。
樣液制備:稱取樣品100 g,放入組織搗碎機中,加100 mL浸提劑,迅速搗成勻漿。稱10~40 g 漿狀樣品,用浸提劑將樣品移入100 mL容量瓶,并稀釋至刻度,搖勻過濾。若濾液有色,可按每克樣品加0.4 g白陶土脫色后再過濾。
滴定:吸取l0 mL濾液放入50 mL錐形瓶中,用已標定過的2,6-二氯靛酚溶液滴定,直至溶液呈粉紅色15 s不褪色為止。同時做空白試驗。
結果按式(5)計算:
維生素C質量分數=[(V-V0)·T·A] /W×100
(5)
式中:V為滴定樣液時消耗染料溶液的體積,V0為滴定空白時消耗染料溶液的體積,T為2,6-二氯靛酚染料滴定度,A為稀釋倍數,W為樣品質量。
平行測定的結果用算術平均值表示,取3位有效數字,含量低的保留小數點后2位數字。平行測定結果的相對相差,在維生素C質量分數大于20 mg/100 g時,不得超過2%,小于20 mg/100 g 時,不得超過5%。
1.3.6 維生素E 按照GB/T 5009.82-2003中高效液相色譜法[21]測定。
維生素E標準液:α-生育酚(純度95%),γ-生育酚(純度95%),δ-生育酚(純度95%)。用脫醛乙醇分別溶解以上3種維生素E標準品,使其濃度大約為1 mL相當于1 mg。臨用前用紫外分光光度計分別標定此3種維生素E溶液的準確濃度。
內標溶液:稱取苯并[е]芘(純度98%),用脫醛乙醇配制成每1 mL相當10 μg苯并[е]芘的內標溶液。
試樣處理:(1)皂化。準確稱取1~10 g試樣(含維生素E各異構體約為40 μg)于皂化瓶中,加30 mL無水乙醇,進行攪拌,直到顆粒物分散均勻為止。加5 mL 100 g/L抗壞血酸,苯并[е]芘標準液2.00mL,混勻。10 mL氫氧化鉀(1+1),混勻。于沸水浴回流30 min使皂化完全。皂化后立即放入冰水中冷卻。(2)提取。將皂化后的試樣移入分液漏斗中,用50 mL水分2~3次洗皂化瓶,洗液并入分液漏斗中。用約100 mL乙醚分兩次洗皂化瓶及其殘渣,乙醚液并入分液漏斗中。如有殘渣,可將此液通過有少許脫脂棉的漏斗濾入分液漏斗。輕輕振搖分液漏斗2 min,靜置分層,棄去水層。(3)洗滌。用約50 mL水洗分液漏斗中的乙醚層,用pH試紙檢驗直至水層不顯堿性(最初水洗輕搖,逐次振搖強度可增加)。(4)濃縮。將乙醚提取液經過無水硫酸鈉(約5 g)濾入與旋轉蒸發器配套的250~300 mL球形蒸發瓶內,用約100 mL乙醚沖洗分液漏斗及無水硫酸鈉3次,并入蒸發瓶內,并將其接至旋轉蒸發器上,于55 ℃水浴中減壓蒸餾并回收乙醚,待瓶中剩下約2 mL乙醚時,取下蒸發瓶,立即用氮氣吹掉乙醚。立即加入2.00 mL乙醇,充分混合,溶解提取物。(5)將乙醇液移入一小塑料離心管中離心5 min(5 000 r/min)。上清液供色譜分析。如果試樣中維生素含量過少,可用氮氣將乙醇液吹干后,再用乙醇重新定容。并記下體積比。
標準曲線的制備:先標定維生素E標準濃度,采用內標法[21]定量繪制標準曲線。
高效液相色譜分析:色譜條件確定。
試樣分析:取試樣濃縮液20 μL,待繪制出色譜圖及色譜參數后,再進行定性和定量。(1)定性,用標準物色譜峰的保留時間定性。(2)定量,根據色譜圖求出某種維生素峰面積與內標物峰面積的比值,以此值在標準曲線上查到其質量濃度。或用回歸方程求出其質量濃度。
計算公式見式(6):
X=c/m×V×100/1 000
(6)
式中:X為維生素的質量分數,c為由標準曲線上查到某種維生素質量濃度,V為試樣濃縮定容體積,m為試樣質量。計算結果表示到3位有效數字。
精密度:在重復性條件下獲得的兩次獨立測定結果的絕對差值不得超過算術平均值的10%。
1.4 數據分析方法
對試驗數據采用Excel及DPS軟件進行統計分析。
2 結果與分析
2.1 不同葡萄品種中花青素等物質的動態質量分數變化
將采集的不同葡萄品種及接種灰霉病菌后花青素等物質的質量分數變化進行檢測,數據匯總、統計分析及柱形圖如表3、圖1~圖6。
從圖1~圖6中可看出:(1)從隨著葡萄生育期的發展其內含物變化的水平看,除酚類物質量分數呈現先下降后有所緩升的趨勢,與李楊昕等[22]的研究相一致,果實中總酚質量分數在漿果生長期開始下降,至漿果成熟期達最低點,之后有小幅度的上升;花青素、可溶性總糖、維生素C、總抗壞血酸及維生素E質量分數均呈現上升趨勢,符合生長規律。(2)從健康果實和接種發病后果實其內含物變化的水平看,同一品種的果實在接種發病后的花青素、酚類物、維生素C、總抗壞血酸的質量分數均比健康果實有所降低,而可溶性總糖和維生素E質量分數在接種發病后深色葡萄品種表現升高、白色品種表現下降,說明灰霉病菌均對這些內含物產生一定影響,且有規律可循。同時經方差分析結果表明(表3),大多數發病果實的花青素等物質的質量分數與健康果實存在一定差異,這就證明葡萄灰霉病的發生和花青素等物質有密切關系,質量分數較高抗病性較強,反之則弱。(3)深色品種各內含物質量分數基本上均較白色品種高,且接種后仍高于白色品種。

表3 不同葡萄品種及接種灰霉病菌后花青素等物質的質量分數Table 3 Mass fraction changes of anthocyanin and other material in different grape varieties and after inoculated with Botrytis cinerea
注: 數據為“平均值±標準誤”,同列不同小寫字母表示差異顯著(P<0.05)。下同。
Note:Date in the table means mean±SE,different small letters within a column showed significant difference (P<0.05).The same as below.

圖1 深色葡萄品種中花青素的質量分數Fig.1 Anthocyanin mass fraction in dark grape varieties

圖2 不同葡萄品種中酚類物質的質量分數Fig.2 Phenols mass fraction in different grape varieties

圖3 不同葡萄品種中可溶性總糖的質量分數Fig.3 Total soluble sugar mass fraction in different grape varieties

圖4 白色葡萄品種中維生素C的質量分數Fig.4 Vitamin C mass fraction in white grape varieties
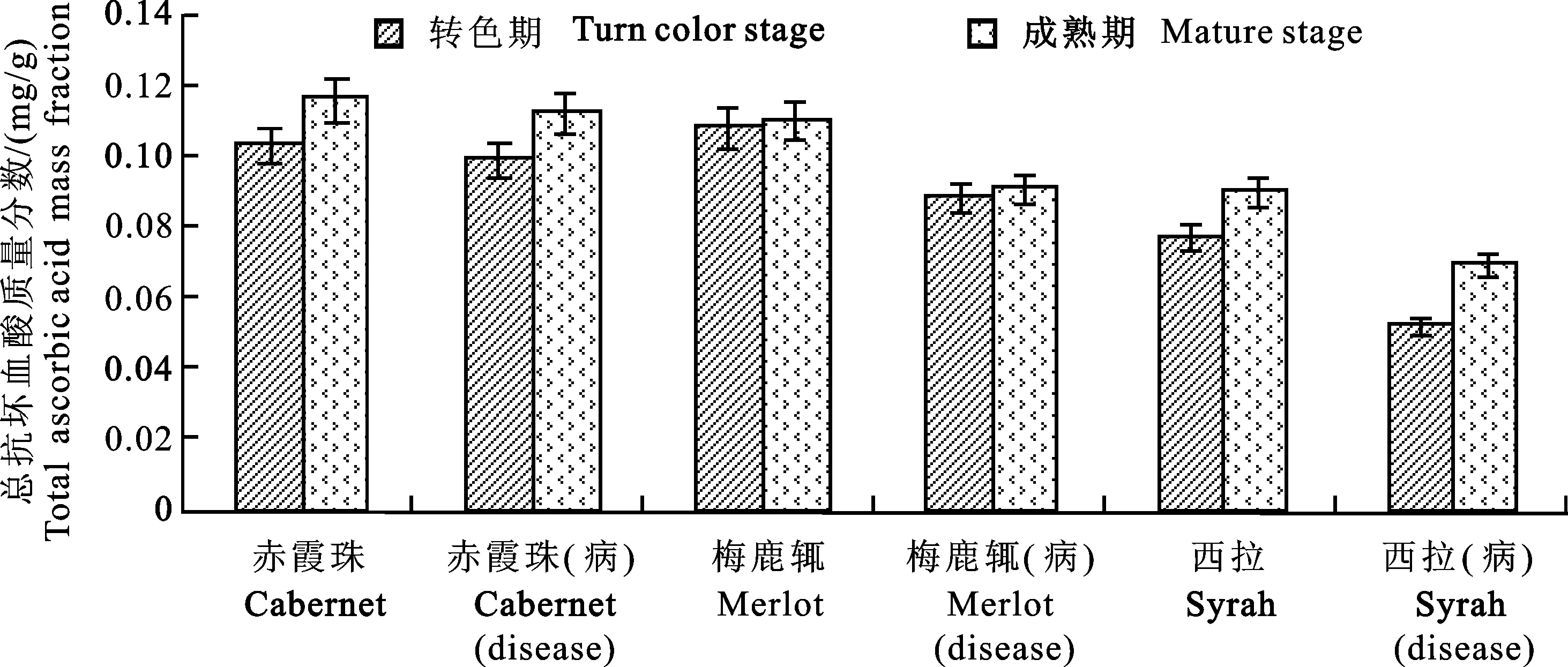
圖5 深色葡萄品種中總抗壞血酸的質量分數Fig.5 Total ascorbic acid mass fraction in dark grape varieties
2.2 賀蘭山東麓不同葡萄品種抗灰霉病差異
從圖7~12可看出: 在葡萄灰霉病菌侵染后,不同葡萄品種中花青素、酚類物、糖分、維生素C、總抗壞血酸及維生素E的降幅較一致,均為‘赤霞珠’<‘梅鹿輒’<‘西拉’<‘雷司令’<‘霞多麗’<‘白詩楠’,降幅越小,說明葡萄灰霉病菌對該品種的影響越小,其抗病性越強,反之越易感病。由此可知,深色品種由于含有較高抗氧化能力較強的花青素、酚類物等物質,且接種后仍高于白色品種,灰霉病菌對其影響較小,從而較白色品種具有很高的抗病性,尤其以‘赤霞珠’為最,其次為‘梅鹿輒’;白色品種以‘白詩楠’最易感病,其次是‘霞多麗’。

圖6 不同葡萄品種中維生素E的質量分數Fig.6 Vitamin E mass fraction in different grape varieties
2.3 不同葡萄品種各內含物與灰霉病發生情況的相關性分析
從表4可以看出,不同葡萄品種大田果穗發病率和室內接種后果粒發病率的發生規律與其相應的各內含物平均降幅高低相一致,呈正相關。比較抗灰霉病的品種(深色品種),各內含物平均降幅較小,品種之間無明顯差異;比較易感病的品種(白色品種),各內含物平均降幅較大,品種之間無明顯差異。而白色品種與深色品種相比差異明顯。

圖7 深色葡萄品種中花青素對葡萄灰霉病菌的響應Fig.7 Response of anthocyanin in dark grape varieties to Botrytis cinerea

圖8 不同葡萄品種中酚類物對葡萄灰霉病菌的響應Fig.8 Response of phenolic in different grape varieties to Botrytis cinerea
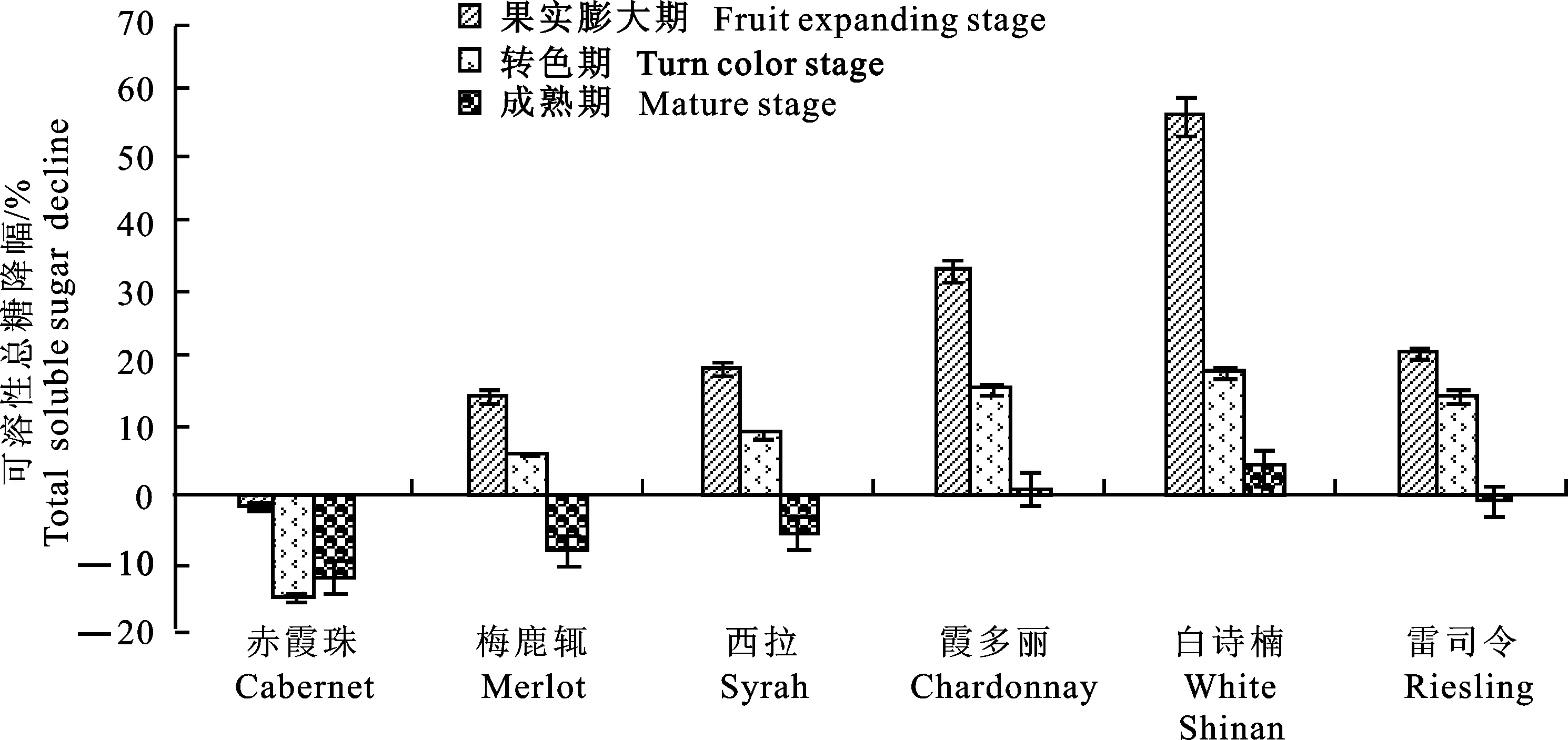
圖9 不同葡萄品種中可溶性總糖對葡萄灰霉病菌的響應Fig.9 Response of total soluble sugar in different grape varieties to Botrytis cinerea
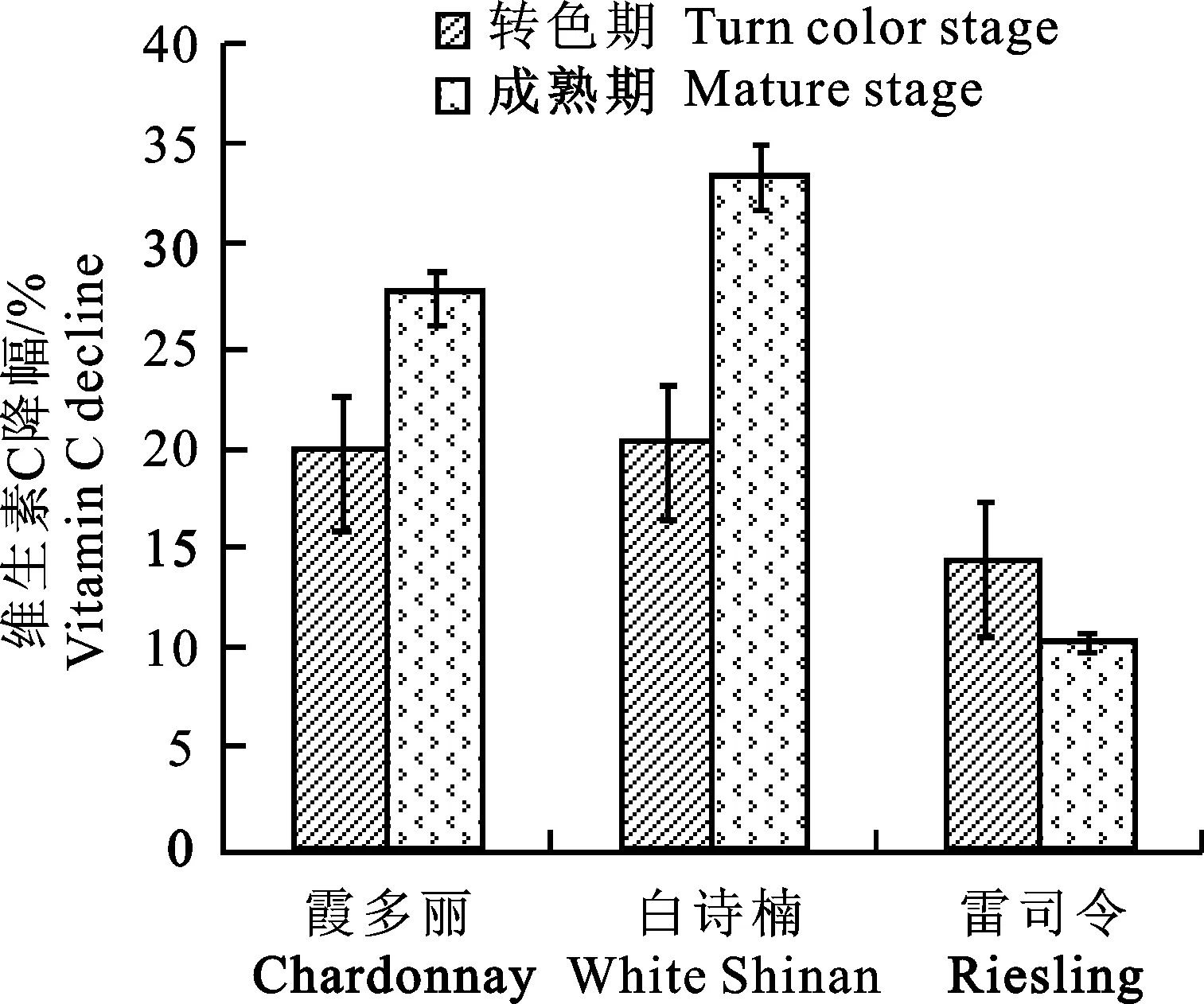
圖10 白色葡萄品種中維生素C對葡萄灰霉病菌的響應Fig.10 Response of vitamin C in white grape varieties to Botrytis cinerea

圖11 深色葡萄品種中總抗壞血酸對葡萄灰霉病菌的響應Fig.11 Response of total ascorbic acid in dark grape varieties to Botrytis cinerea

圖12 不同葡萄品種中維生素E對葡萄灰霉病菌的響應Fig.12 Response of vitamin E in different grape varieties to Botrytis cinerea

品種Varieties大田果穗發病率/%Incidenceofearinthefild室內接種后果粒發病率/%Incidencerateoffruitafterindoorinoculation平均降幅/% Averagedecline花青素Anthocyanin酚類物Phenols可溶性總糖Totalsolublesugar維生素CVitaminC總抗壞血酸Totalascorbicacid維生素EVitaminE赤霞珠 Cabernet1.0020.7613.24±1.15b14.14±1.69b-9.50±4.09c/3.67±0.22b-26.20±5.54c梅鹿輒 Merlot1.0035.1816.66±1.82b15.29±2.07ab4.34±6.64bc/17.90±0.62ab-17.07±2.76bc西拉 Syrah3.3361.1430.84±1.11a17.05±1.32ab7.55±7.02b/27.90±4.57a-13.17±3.86bc雷司令 Riesling5.7169.97/21.04±1.04ab11.78±6.44ab12.18±1.93a/0.25±7.01ab霞多麗 Chardonnay9.4372.23/26.20±3.07ab16.71±9.35ab23.68±3.85a/11.76±9.29a白詩楠 WhiteShinan10.8682.57/35.18±14.29a26.17±15.44a26.67±6.67a/15.87±6.92a
3 結論與討論
3.1 葡萄灰霉病與酚類物質質量分數的關系
葡萄中含有的酚類物質主要有類黃酮類物質、縮和單寧(即原花色素)、花色素和酚酸等。本試驗中從果實膨大期到轉色期,再到成熟期,不同葡萄品種的酚類物質量分數呈現先下降后有所緩升的趨勢,與李楊昕等[22]的研究相一致,果實中總酚質量分數在漿果生長期開始下降,至漿果成熟期達最低點,之后有小幅度上升。可能是由于隨著果實的成熟,果粒內部發生一系列復雜的生化變化:含糖量急劇增加,含酸量下降,果皮內芳香物質逐漸形成,單寧則不斷減少等;同時,種子由綠色變為棕褐色,種皮變硬。此時,果皮和果肉內的總酚質量分數降低至最低點,可能與此時的酚類物質大量向種子運輸有關。這與《葡萄學》(賀普超,1999)中關于葡萄果實發育和莖葉的生長特點相符合,為進一步深入闡明次生物質代謝途徑提供一定試驗數據。
3.2 不同葡萄品種抗灰霉病菌的差異
在葡萄灰霉病菌侵染后,不同葡萄品種中花青素、酚類物、糖分、維生素C、總抗壞血酸及維生素E的降幅較一致,均為‘赤霞珠’<‘梅鹿輒’<‘西拉’<‘雷司令’<‘霞多麗’<‘白詩楠’,降幅越小,說明葡萄灰霉病菌對該品種的影響越小,其抗病性越強,反之越易感病。由此可知,所測深色品種中以‘赤霞珠’最為抗病,其次為‘梅鹿輒’;白色品種以‘白詩楠’最易感病,其次是‘霞多麗’。
3.3 有利葡萄灰霉病的發病條件及防治
低溫、高濕、傷口是葡萄灰霉病流行的主要因素,一般在葡萄較為敏感的開花期及坐果期遇到這些條件,極易誘發病害流行。但在本研究中發現,葡萄灰霉病的防治還應注意兩點:一是在轉色期即漿果即將成熟時和果實成熟期也是病菌易侵染的時期,應適時通過減少菌源、農業措施、藥劑防治,以控制其大發生,降低損失。二是根據不同品種的抗性不同有針對性的進行防治,如易感染的白色品種‘白詩楠’‘霞多麗’可進行重點防治,抗性較強的深色品種‘赤霞珠’‘梅鹿輒’可根據環境條件進行靈活預防,減少投入與污染。
3.4 存在問題
隨著不同葡萄品種對灰霉病菌脅迫響應的深入研究,不斷有新的疑問和問題有待解決,如除果實外其他部位的內含物變化是否與灰霉病有相關?在大田環境下接種后的研究結果是否會和實驗室內接種研究結果一致?大田環境下怎樣實現有效接種?這些工作都還需進一步研究論證。
Reference:
[1] CAPPELIMI R A,CEPONIS M J,LIGHTNER G W.Disorders in table grape shipments to the New Yort market[J].PlantDisease,1986,70:1075-1079.
[2] 張 鵬.葡萄灰霉病發生規律及防治技術研究[D].北京:中國農業科學院,2011.
ZHANG P.Study on occurring regularity and control techniques of grape grey mould[D].Beijing: Chinese Academy of Agricultural Sciences,2011(in Chinese with English abstract).
[3] 王信遠,周緒元,賈忠金,等.木霉素防治大棚黃瓜藥效試驗[J].北方園藝,1996(6):31-32.
WANG X Y,ZHOU X Y,JIA ZH J,etal.Efficacy test of the control of cucumber gray mold of in greenhouse[J].NorthernHorticulture,1996(6):31-32(in Chinese).
[4] WISIEWSKI M E,WIISON C L.Biological control of postharvest disease of fruits and vegetables[J].RecentAdvancesHortiscience,1992,27(2):94-98,425-441.
[5] 劉三軍,蒯傳化.我國葡萄病害發生趨勢與防治工作中應注意的若干問題[J].果農之友,2007(2):4-5.
LIU S J,KUAI CH H.Some problems in the occurrence and control of grape diseases in China[J].FruitGrowers’Friend,2007(2):4-5(in Chinese).
[6] 郭小俠,唐周懷,陳 川,等.我國葡萄幾種主要病害的研究現狀[J].陜西農業科學,2002(11):18-21.
GUO X X,TANG ZH H,CHEN CH,etal.Research status of several main diseases of grape in China[J].ShaanxiAgriculturalSciences,2002(11):18-21(in Chinese).
[7] 李 華.葡萄灰霉病(Botrytiscinerea)及其合理防治[J].中外葡萄與葡萄酒,2003(6):41-42.
LI H.Botrytiscinereaand its reasonable control[J].Sino-OverseasGrapevine&Wine,2003(6):41-42(in Chinese).
[8] 王國珍,麻冬梅,樊仲慶,等.不同殺菌劑對葡萄灰霉病的藥效評價[J].中外葡萄與葡萄酒,2006(2):29-30,33.
WANG G ZH,MA D M,FAN ZH Q,etal.The resistance evaluation of different fungicides onBotrytiscinerea[J].Sino-OverseasGrapevine&Wine,2006(2):29-30,33(in Chinese).
[9] 雷百戰,李國英,石在強.葡萄灰霉病病原鑒定和生物學特性研究[J].石河子大學學報(自然科學版),2004(22):145-149. LEI B ZH,LI G Y,SHI Z Q.Identification and biological characteristics of the pathogen ofBotrytiscinereaon grape[J].JournalofShiheziUniversity(NaturalScienceEdition),2004(22):145-149(in Chinese with English abstract).
[10] 陳宇飛,文景芝,李立軍.葡萄灰霉病研究進展[J].東北農業大學學報,2006,37(5):693-699.
CHEN Y F,WEN J ZH,LI L J.Research advance of grape grey mould[J].JournalofNortheastAgriculturalUniversity,2006,37(5):693-699(in Chinese with English abstract).
[11] 張 鵬,劉長遠,梁春浩,等.7種殺菌劑對葡萄灰霉病的室內抑菌活性測定[J].園藝與種苗,2012(1):61-64.
ZHANG P,LIU CH Y,LIANG CH H,etal.Antibacterial activity determination of 7 different fungicides on grapeBotrytiscinereaPers[J].Horticulture&Seed,2012(1):61-64(in Chinese with English abstract).
[12] 陳宏州,楊敬輝,肖 婷,等.12種殺菌劑對葡萄灰霉病菌的毒力測定[J].江蘇農業科學,2015,43(1):124-127.
CHEN H ZH,YANG J H,XIAO T,etal.Virulence determination of 12 kinds of fungicides against grapeBotrytiscinereaPers[J].JiangsuAgriculturalSciences,2015,43(1):124-127(in Chinese).
[13] 陳月鳳,馬麗敏,高豫汝,等.幾種新型殺菌劑對葡萄灰霉病的防治效果[J].南京農專學報,2002(2):39-40,56.
CHEN Y F,MA L M,GAO Y R,etal.Control effect of several new types fungicide onBotrytiscinereaPers[J].JournalofNanjingAgriculturalTechnologyCollege,2002(2):39-40,56(in Chinese with English abstract).
[14] 董金皋.農業植物病理學(第二版)[M].北京:中國農業出版社,2007:322-335.
DONG J G.Agricultural Plant Pathology(Second Edition) [M].Beijing:China Agriculture Press,2007:322-335 (in Chinese).
[15] 李淑菊,馬德華,霍振榮.外源刺激物對黃瓜灰霉病菌分生孢子致病力的影響[J].天津農業科學,1996,2(2):21-22.
LI SH J,MA D H,HUO ZH R.Effects of exogenous stimuli on the pathogenicity of cucumber gray mold[J].TianjinAgriculturalSciences,1996,2(2):21-22 (in Chinese).
[16] 王二雷,林松毅,劉靜波,等.篤斯越桔中花青素含量分析[J].食品科學,2007,28(10):460-463.
WANG E L,LIN S Y,LIU J B,etal.Study on content analysis of Anthocyanidin inVacciniumuliginosumL.[J].FoodScience,2007,28(10):460-463(in Chinese with English abstract).
[17] 田香華,楊 軍,宋紀真,等.幾丁低聚糖誘導煙草幼苗抗黑脛病與木質素及酚類物質含量變化的關系[C]//中國植物病理學會2007年學術年會:植物抗病性.陜西楊凌:西北農林科技大學出版社,2007:334-339.
TIAN X H,YANG J,SONG J ZH,etal.The relationship between resistance of chitooligosaccharide induceding tobacco seedlings against black shank and content changes of phenolics and lignin[C]//China Society of Plant Pathology,2007 academic annual meeting:Plant disease resistance.Yangling Shaanxi:Northwest Agriculture and Forestry University Press,2007:334-339(in Chinese).
[18] 中華人民共和國衛生部.GB/T 5009.7-2008 食品中還原糖的測定[S].北京:中國標準出版社,2008.
Ministry of Health of the People’s Republic of China.GB/T 5009.7-2008 Determination of Reducing Sugar in Foods[S].Beijing:China Standard Press,2008(in Chinese).
[19] 中華人民共和國衛生部.GB/T 5009.86-2003 蔬菜、水果及其制品中總抗壞血酸的測定(熒光法和2,4-二硝基苯肼法)[S].北京:中國標準出版社,2003.
Ministry of Health of the People’s Republic of China.GB/T 5009.86-2003 Determination of Total Ascorbic Acid in Fruits,Vegetables and Derived Products-Flourometric Method and Colorimetric Method[S].Beijing:China Standard Press,2003(in Chinese).
[20] 中華人民共和國國家標準局.GB 6195-86 水果、蔬菜維生素C含量測定法(2,6-二氯靛酚滴定法)[S].北京:中國標準出版社,1986.
National Bureau of Standards of the People’s Republic of China.GB 6195-86 Determination of Vitamin C in Vegetables and Fruits(2,6-dichloro-indophenol titration method)[S].Beijing:China Standard Press,1986(in Chinese).
[21] 中華人民共和國衛生部.GB/T 5009.82-2003食品中維生素A和維生素E的測定[S].北京:中國標準出版社,2003. Ministry of Health of the People’s Republic of China.GB/T 5009.82-2003 Determination of Retinol and Tocopherol in Foods[S].Beijing:China Standard Press,2003(in Chinese).
[22] 李楊昕,張元湖,田淑芬,等.玫瑰香葡萄生長期酚類物質含量及抗氧化活性的變化[J].園藝學報,2007,34(5):1093-1097.
LI Y X,ZHANG Y H,TIAN SH F,etal.Dynamic changes of polyphenols and their relationship with antioxidant capacity in the muscat hamburg grapevine[J].ActaHorticulturaeSinica,2007,34(5):1093-1097(in Chinese with English abstract).
(責任編輯:郭柏壽 Responsible editor:GUO Baishou)
Response of Different Grape Cultivars toBotrytiscinereaStress
JIANG Caige1,WANG Guozhen1,ZHANG Yi1and SHAO Pengmei2
(1.Institute of Plant Protection,Ningxia Academy of Agriculture and Forestry Sciences,Yinchuan 750002,China; 2.Agricultural Technology Service Center of Zhenbeibao Township in Xixia District of Yinchuan,Yinchuan 750021,China)
In order to investigate the susceptibility of various leading grape cultivars toBotrytiscinereain the eastern foot of Helan Mountain,and to propose the corresponding control measures based on the distribution characteristics of various cultivars with different resistances,the contents of inclusions in various grape cultivars,namely,anthocyanins,phenols,sugar,total ascorbic acid (vitamin C) and vitamin E were detected using malvidin standard method,Arnow method,direct titration method,fluorescence method (or 2,6-two chlorine indophenol titration method) and HPLC detection respectively.The results showed that the mass fractions of various substances in the pathogenetic fruit were significantly different from those of the healthy fruit.It was proved that the incidence ofBotrytiscinereawas closely related to the grape inclusions,the higher the mass fraction,the stronger the disease resistance,and the weaker in the opposite.Judging by the decreasing amplitude of the inclusions of different grape cultivators infected byBotrytiscinerea,the disease resistances of various grape cultivators were in following sequence:‘Cabernet’>‘Merlot’>‘Syrah’>‘Riesling’>‘Chardonnay’>‘White Shinan’.The lab detecting results were consistent with the field incidence,and the field control should be focused on white cultivars.
Grape;Botrytiscinerea; Inclusion investigation; Disease resistance
JIANG Caige,female,master,assistant research fellow.Research area:grape diseases and pests.E-mail:jiangcaige168@126.com
ZHANG Yi,male,master,research fellow.Research area:prevention and control of diseases and pests in agriculture and forestry.E-mail:nxzhy0951@163.com
日期:2016-12-29
網絡出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161229.1008.030.html
2015-09-06
2016-07-27
國家科技支撐計劃(2013BAD09B02);現代農業產業技術體系專項資金(CARS-30);寧夏自然科學基金(NZ1168);寧夏農林科學院科技創新先導資金(NKYQ-15-05)。
姜彩鴿,女,碩士,助理研究員,從事葡萄病蟲害研究。E-mail:jiangcaige168@126.com
張 怡,男,碩士,研究員,主要從事農林病蟲害防治研究。E-mail:nxzhy0951@163.com
S436.631.1+9
A
1004-1389(2017)02-0262-12
Received 2015-09-06 Returned 2016-07-27
Foundation item Key Sci-tech Project of the“12th 5-Year-Plan”of China(No.2013BAD09B02);Special Fund for the Technical System of Modern Agricultural Industry(No.CARS-30);Natural Science Foundation of Ningxia(No.NZ1168);Science and Technology Innovation Pilot Project of Ningxia Academy of Agriculture and Forestry Sciences(No.NKYQ-15-05).

