表皮生長因子受體、切割修復交叉互補基因1、抑癌基因p53在非小細胞肺癌組織中的表達以及相關性研究
趙小云
表皮生長因子受體、切割修復交叉互補基因1、抑癌基因p53在非小細胞肺癌組織中的表達以及相關性研究
趙小云
(河西學院醫學院,甘肅 張掖 734000)
目的 探討非小細胞肺癌組織中表皮生長因子受體(EGFR)、切割修復交叉互補基因1(ERCC1)和p53蛋白表達情況與臨床分期、病理分型、臨床特征的關系。方法 用免疫組化法檢測60例非小細胞肺癌患者原發腫瘤組織中EGFR ERCC1和p53蛋白表達水平。結果 60例非小細胞肺癌組織的EGFR、ERCC1及p53蛋白的陽性表達率分別為58.3% (35/60)、63.3%(38/60)和51.7%(31/60);ERCC1和p53的表達與腫瘤分期、淋巴結轉移、腫瘤遠處轉移、細胞分化程度明顯相關(P<0.01),ERCC1與年齡、性別等臨床特征明顯相關(P<0.05),EGFR的表達與腫瘤病理分型有關(P<0.05);p53的表達分別與EFGR、ERCC1表達呈正相關(P<0.05)。結論 ERCC1、p53表達率隨腫瘤分級、分期的升高而明顯增高,EGFR、ERCC1、p53的表達與腫瘤臨床病理特征有關,且多個基因的共同表達也隨腫瘤分級、分期的升高而明顯增高。檢測EGFR、ERCC1和p53蛋白表達對非小細胞肺癌的診斷、治療及預后評價有重要意義。
非小細胞肺癌;EGFR;ERCC1;p53
肺癌是世界上發病率和病死率均居首位的惡性腫瘤。2010年,美國死亡分析報告指出,在所有癌癥致死患者中,肺癌占26%。非小細胞肺癌(non-small cell lung cancer,NSCLC)占肺癌總數的80%~85%,具有癌基因激活、抑癌基因失活以及生長因子受體過度表達等特點。
表皮因子受體(EGFR)是一種跨膜受體型酪氨酸激酶,在NSCLC中存在過表達并促進腫瘤生長,酪氨酸激酶編碼區基因突變是EGFR酪氨酸激酶抑制劑(EGFR—TKI)靶向治療的前提條件[1]。p53抑癌基因是一種多功能蛋白,在調節細胞周期、細胞凋亡、基因轉錄、應激反應和細胞DNA修復等腫瘤演變過程中發揮重要作用[2]。ERCC1基因在胞內DNA復制及損傷修復環節起關鍵作用,在核苷酸切除修復系統(NER)中起限速或調節作用[3]。在NSCLC中,ERCC1的表達與鉑類耐藥相關[4]。EGFR、ERCC1、p53在NSCLC中的表達均有報道,而其相互關系卻少有探討。本研究應用免疫組化法,對60例非小細胞肺癌標本進行EGFR、ERCC1以及p53蛋白檢測,了解其在肺癌中的表達特征,并探討其與非小細胞肺癌臨床分期、病理分型及臨床特征的關系,為非小細胞肺癌的診斷、治療及預后判斷提供依據。
1 材料與方法
1.1 研究對象
研究標本由河西學院附屬張掖人民醫院病理科提供,并經醫院倫理委員會審查批準,取得患者同意。標本取自外科2011 年6月至2014年10月住院接受手術的60例NSCLC患者,手術切除、經病理學證實為NSCLC。男性15例、女性45例,年齡33~81歲,中位年齡58歲。臨床TNM分期:Ⅰ期9例,Ⅱ期4例,Ⅲ期21例,IV期26例。術后病理檢查結果:低分化腺癌21例,中分化腺癌14例,高分化腺癌6例;低分化鱗癌10例,中分化鱗癌8例,高分化鱗癌1例。無淋巴結轉移11例,有淋巴結轉移49例。無遠處轉移34例,有遠處轉移26例(見表1)。

表1 EGFR、ERCC1、p53與NSCLC臨床病理參數之間的關系
1.2 方法
采用Elivision TM plus二步法,鼠抗人EGFR單克隆抗體(EGFR/113)、鼠抗人ERCC1蛋白單克隆抗體、鼠抗人p53單克隆抗體和Elivision TM plus試劑盒均購自福州邁新生物技術開發有限公司,工作濃度為1∶50,操作步驟參照試劑盒說明書進行,每批染色均設陽性和陰性對照。
1.3 判斷標準
EGFR陽性表達為胞質和胞膜著色,ERCC1陽性表達為胞核著色,結果判斷如下:每張切片隨機觀察5個高倍視野,計數不少于1 000個細胞。用各視野陽性細胞數的平均百分數計分:0%~24%為陰性,≥25%為陽性。
1.4 統計學方法
采用SPSS 17.0統計軟件,用χ2檢驗及確切概率法分析EGFR、ERCC1、p53陽性率與NSCLC患者臨床生物學特征的關系,用Spearman等級相關分析判斷ERCC1、EGFR、p53的相關性。P<0.05為差異有顯著性。
2 結果與分析
2.1 EGFR、ERCC1、p53在NSCLC中的表達
60例非小細胞肺癌的EGFR、ERCC1及p53蛋白陽性表達率分別為58.3%(35/60)、63.3%(38/60)和51.7%(31/60)。
2.2 EGFR、ERCC1、p53表達與NSCLC臨床病理特征的關系
EGFR陽性染色位于腫瘤細胞膜和胞質,呈棕黃色(見圖1)。EGFR表達與NSCLC病理分型、患者年齡有關(P<0.05),而與腫瘤分期、細胞分化程度、淋巴結轉移、遠處轉移及性別無明顯相關性(P>0.05)。
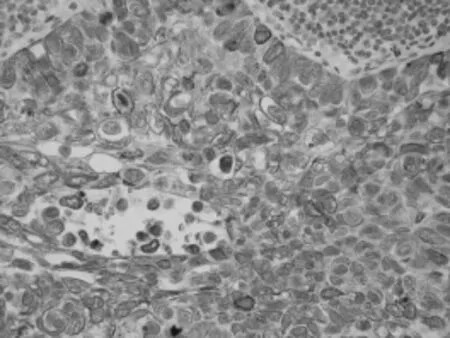
圖1 EGFR在非小細胞肺癌中的陽性表達(SP,×400)
ERCC1陽性產物主要位于腫瘤細胞核,呈棕褐色(見圖2)。ERCC1表達隨NSCLC腫瘤分期、細胞分化程度的升高而增多(P<0.05),且在有淋巴結轉移或遠處轉移的病例中表達明顯增多(P<0.05),與患者性別亦有關(P<0.05),而與腫瘤病理分型及患者年齡無關(P>0.05)。
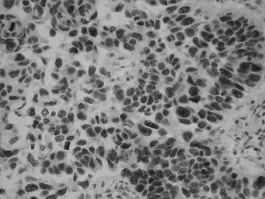
圖2 ERCC1在非小細胞肺癌中的陽性表達(SP,×400)
p53陽性染色位于腫瘤細胞核,呈棕黃色。p53表達隨NSCLC腫瘤分期、細胞分化程度的升高而增多(P<0.05),并且在有淋巴結轉移或遠處轉移的病例中表達明顯增多(P<0.05),與腫瘤病理分型及患者年齡、性別無關(P>0.05)。
2.3 p53、ERCC1及EGFR在NSCLC中表達的相關性
60例NSCLC患者中,EGFR陽性表達35例,其中ERCC1陽性表達24例(68.6%),p53陽性表達21例(60.0%)。在25例EGFR陰性表達患者中,ERCC1陽性表達14例(56.0%),p53陽性表達10例(40.0%);EGFR表達與p53正相關(P=0.038),而與ERCC1無相關性(P>0.05)。在38例ERCC1表達陽性患者中,EGFR陽性表達24例(63.2%),p53陽性表達25例(65.8%);在22例ERCC1陰性表達患者中,p53陽性表達6例(27.3%),p53表達與ERCC1表達正相關(P<0.01,見表2)。
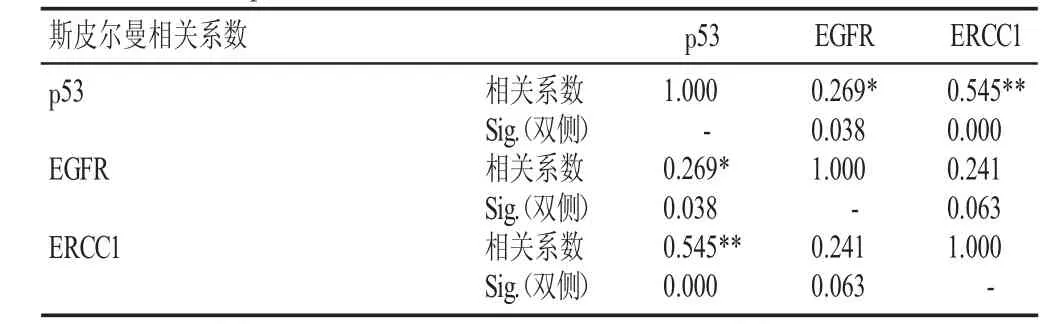
表2 p53、ERCC1、EGFR在NSCLC中表達的相關性
3 討論
EGFR在NSCLC中的陽性表達率為58.3%,在各種病理類型肺癌及有或無淋巴結轉移者中均有較高的表達率,提示肺癌的發展與EGFR過度表達及活性增強有關,EGFR陽性的癌細胞可能具有更強的分裂增殖活性和浸潤性。實驗數據顯示,EGFR與NSCLC腫瘤分期、淋巴結轉移、腫瘤細胞分化程度以及年齡、性別等臨床特征無明顯相關性,而與病理分型相關,說明EGFR可能多發于鱗癌,與腫瘤侵襲能力關系不密切,但EGFR并不能作為判斷肺癌患者預后的有效指標,需要擴大樣本量進一步研究。
p53在NSCLC中的陽性表達率為51.7%,與腫瘤分期、淋巴結轉移、腫瘤遠處轉移及腫瘤細胞分化程度有關,與之前研究相符,而與病理分型、患者年齡、性別等臨床特征無明顯相關性。實驗結果表明,p53蛋白的表達隨TNM分期的升高而增高,在有淋巴結轉移或腫瘤遠處轉移的病例中表達率明顯高于無轉移的病例,在中低分化的腫瘤細胞中表達率明顯增高,提示p53高表達的NSCLC惡性程度高,是預后不良的標志。
ERCC1蛋白在NSCLC中的表達陽性率為63.3%,與腫瘤分期、腫瘤細胞分化程度、淋巴結轉移、腫瘤遠處轉移及患者年齡、性別等臨床特征明顯相關,而與病理分型無關。腫瘤細胞TNM分期越高,ERCC1蛋白表達率也越高。在有淋巴結轉移的病例中陽性表達率遠遠高于無淋巴結轉移者,并在中低分化腫瘤細胞中陽性表達率明顯增高。ERCC1陽性多見于女性,尤其是老年女姓,其表達增強可能提示肺癌預后不良以及耐藥程度增高。
Spearman等級相關分析發現,EGFR與p53正相關(P= 0.038),而與ERCC1無相關性(P>0.05)。EGFR信號傳導通路主要包括MAPK通路、PI3K通路、c-Src通路,各個信號通路之間交聯,使細胞的最終效應受多種因素綜合調控[5]。腫瘤抑癌基因p53與多種基因存在相互調節作用。正常野生型p53蛋白的半衰期很短,用一般免疫組化法難以測出。p53突變后,半衰期明顯延長,穩定性增加,故用免疫組化法檢測到的p53蛋白多為突變p53蛋白,它不僅失去了正常抑癌作用,而且還有促進惡性轉化的作用,由抑癌基因轉變成癌基因[6]。有研究證實,p53能正向激活EGFR表達而促進細胞增殖[7],可增加ER和EGFR /HER-2旁路途徑,抵抗4-羥基三苯氧胺(OHT)細胞毒作用,影響內分泌治療效果[8];且有助于靶向藥物西妥昔單抗對EGFR受體下游信號通路的抑制[9]。本實驗結果與上述研究一致,EGFR 與p53正相關(P=0.038),提示p53可能影響EGFR信號傳導通路,兩者有互相促進的可能性,需要進一步研究證實。
惡性腫瘤是一個多因素、多步驟作用的結果,其發生要經過一系列基因表達變化的共同作用。EGFR、ERCC1和p53都是目前臨床上比較常用的腫瘤指標。通過檢測ERCC1基因mRNA表達,EGFR基因突變等分子標記物,制訂個體化治療方案,成為今后惡性腫瘤治療的趨勢。尋找并鑒定這類分子標志物,有助于指導臨床制訂治療方案,篩選獲益人群,真正做到“量體裁衣、對人下藥”,使治療更具針對性,效果更好。
[1]Yoshida T,Ishii G,Goto K,et al.Solid predominant histology predicts EGFR tyosine kinase inhibitor response in patients with EGFR mutationpositive lung adenocarcinoma[J].Cancer Res Clin Oncol,2013,139(10):1691-1700.
[2]Laura Breen,Mary Heenan.Investigation of the Role of p53 in Chemotherapy resistance of Lung Cancer Cell Lines[J].Anticancer Research,2007(27):1361-1364.
[3]P Ceppi,M Volante,S Novello L,et al.ERCC1 and RRM1 gene expressions but not EGFR are predictive of shorter survival in advanced nonsmall-cell lung cancer treated with cisplatin and gemcitabine[J].Annals of Oncology,2006(17):1818-1825.
[4]鞠放,汪青,清水旺.晚期非小細胞肺癌P53和ERCC1表達狀態與順鉑為主的聯合方案化療的近期有效率的相關性研究[J].現代生物醫學進展,2012(5):876-879.
[5]Makinoshima H,Takita M.Epidermal Growth Factor Receptor(EGFR)Signaling Regulates Global Metabolic Pathways in EGFR-mutated Lung Adenocarcinoma[J].Journal of Cellular and Molecular Medicine,2014,18 (2):218-230.
[6]Hidetaka Uramoto1,Kenji Sugio1,Tsunehiro Oyama2,et al.Expression of the p53 Family in Lung Cancer[J].Anticancer Research,2006(26):1785-1790.
[7]Norberg T,Klaar S,Karf G,et al.Increased p53 mutation frequency during tumor progpression,results from abreast cancer cohort[J].Cancer Ros,2001,61(22):8317-8321.
[8]Fernandez Cuesta L,Anaganti S,H ainaut P,et al.p53 status influences response to tamoxifen but not to fu lvestrant in breast cancer cell lines[J]. Int J Cancer,2010,7(10):214-215.
[9]Bouali S,Chrtien A S,Ramacci C,et al.p53 and PTEN express ion contribute to the inhibition of EGFR down stream signaling pathway by cetuximab[J].Cancer Gene Ther,2009,16(6):498-507.
R734.2
B
1671-1246(2017)05-0142-03
注:本文系2014年甘肅省高等學校科研項目(2014B-122)

