不同浸提劑及對照設置對土壤脲酶活性測定的影響
李秀芝+黃斌+范弟武

摘要:關于土壤脲酶活性的測定,不同學者選用的浸提劑以及對照的設置往往大相徑庭,對于這些不同處理方式測得的脲酶活性的差異,目前還缺乏相應的比較研究。選用1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.5 mol/L KCl、2.0 mol/L KCl以及1.0 mol/L KCl等5種不同的浸提劑,設置對照培養2 h與對照不培養2種對照方法,以洪澤湖濕地土壤為例,比較不同浸提劑及對照設置方法間土壤脲酶活性的差異。結果表明,在對照培養條件下,測得的脲酶活性最大達到0.098 μg/(kg·h),浸提劑1.0 mol/L KCl+0.01 mol/L HCl;脲酶活性最小為0.035 μg/(kg·h),浸提劑2.5 mol/L KCl+0.1 mmol/L Ag2SO4。與對照不培養組相比,對照培養2 h組更容易獲得較高的脲酶活性,當浸提劑分別為2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.0 mol/L KCl、1.0 mol/L KCl+0.01 mol/L HCl 時,對照培養組土壤脲酶活性分別是對照不培養的1.6、3.0、7.5倍。對于不同的抑制劑而言,1.0 mol/L KCl+0.01 mol/L HCl 是1.0 mol/L KCl的1.58 倍,而2.5 mol/L KCl+0.1 mmol/L Ag2SO4與2.5 mol/L KCl的差異較小,差值僅為0.001 μg/(kg·h)。
關鍵詞:土壤;脲酶活性;浸提劑;對照培養
中圖分類號: S154.2 文獻標志碼: A
文章編號:1002-1302(2016)11-0427-03
在土壤酶中,脲酶催化土壤中尿素酰胺態氮水解為銨態氮,在土壤氮元素的循環與轉化過程中扮演重要角色[1-3]。脲酶活性是評價生態系統氮素轉化機制及其功能演變時最常見的酶學指標。土壤脲酶活性的測定有比色法、擴散法、尿素剩余量測定法、電極法、CO2量度法等[4-6]多種方法,其中比色法由于測量結果精確性較高、重現性較好、儀器設備簡單,應用最為廣泛。非甲苯法[7]因為沒有甲苯的加入因而更加注重脲酶對于尿素的水解功能,是比色法中最常應用的方法。對于非甲苯法,可以選擇不同的浸提劑,如有的學者采用 2.5 mol/L KCl+0.1 mmol/L Ag2SO4混合液或者1.0 mol/L KCl+0.01 mol/L HCl,在浸提劑加入的同時加入抑制劑阻止脲酶的進一步水解;而有的學者直接采用2.0 mol/L KCl進行浸提。并且對于對照的處理方法也不盡相同,有的是在土樣培養之后加入底物尿素[7];有的則是與處理同步加入底物,但對照處理不進行培養[8]。抑制劑是否可以有效地抑制酶的活性、這些不同的處理方式測出的脲酶活究竟會有什么差異,目前還缺乏相應的比較與研究。本研究以洪澤湖濕地為原型區域,采集濕地沉積物樣品,采用非甲苯法并使用5種不同的浸提劑(1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.5 mol/L KCl、2.0 mol/L KCl、1.0 mol/L KCl),同時設立對照培養2 h與對照不培養2種不同的對照試驗,對脲酶活性進行檢測,以期明確不同浸提劑及不同對照設置對土壤脲酶活性測定的影響。
1 材料與方法
1.1 試驗材料
試驗土壤取自于洪澤湖濕地,取0~20 cm的表層沉積物自然風干后,碾碎,過2 cm篩,備用。供試土樣的全氮、全碳含量分別為0.675、0.1 g/kg。
1.2 試驗方法
1.2.1 脲酶活性的測定 選用水楊酸鈉-二氯異氰尿酸鈉比色法測定脲酶活性[6-11]。(1)稱取5 g土壤樣品,置于 100 mL 的有蓋容器內,加入2.5 mL 0.08 mol/L尿素水溶液,密封后在37 ℃下恒溫培養2 h。培養結束后,打開塞子,加入2.5 mL蒸餾水,然后加入50 mL 5種不同的浸提劑(1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.5 mol/L KCl、2.0 mol/L KCl、1.0 mol/L KCl)振蕩30 min,轉速180 r/min,將振蕩后的土壤懸濁液迅速過濾,取1.0 mL濾液于10 mL容量瓶中,加蒸餾水定容至刻度線,搖勻,倒入25 mL小燒杯中,并依次加入 5 mL 的水楊酸鈉和2 mL的二氯異氰尿酸鈉溶液。室溫下靜置30 min,以蒸餾水為參比,用紫外可見分光光度計在 690 nm 處測吸光度。每個樣品3個重復,比較不同浸提劑對于土壤脲酶活性的差異。
1.2.2 第1種對照的設置 稱取5 g土壤樣品置于100 mL的有蓋容器內,加入2.5 mL蒸餾水,密封,在37 ℃下恒溫培養2 h。培養結束后,打開塞子,加入浸提劑,再加入 2.5 mL 0.08 mol/L尿素水溶液(先加浸提劑再加尿素)。之后的步驟與處理試驗中相同。
1.2.3 第2種對照的設置 在處理試驗與對照試驗中,處理與對照同時按相同試驗步驟進行的,但對處理進行2 h培養,對照不培養,分析不同對照的設置對脲酶活性測定結果的影響。該對照下浸提劑使用1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.0 mol/L KCl。比較不同對照對于脲酶活性的差異。
1.2.4 脲酶活性的計算 脲酶活性用1 g干土1 h水解尿素產生銨態氮的量表示。
U=(T-CK)×17×55/(5×2)。
式中:U表示脲酶活性,μg/(g·h);T表示處理吸光度從標準曲線中查得銨態氮的濃度,μg/mL;CK表示對照組吸光度從標準曲線中查得的銨態氮濃度,μg/mL;17為取1.0 mL濾液共稀釋17倍;55是處理和對照濾液制備前稀釋的體積,mL;5為沉積物的干質量,g;2為換算成1 h的系數,h。
2 結果與分析
2.1 不同浸提劑對于脲酶活性的影響
由圖1表明,對照培養條件下當浸提劑為1.0 mol/L KCl+0.01 mol/L HCl時,脲酶活性達到最強,為0.098 μg/(kg·h),2.0 mol/L KCl次之,浸提劑為 2.5 mol/L KCl+0.1 mmol/L Ag2SO4測得的脲酶活性最弱,為0.035 μg/(kg·h),最大值為最小值的2.8倍。當浸提劑分別為 1.0 mol/L KCl、2.0 mol/L KCl、2.5 mol/L KCl時,脲酶活性分別為0.062、0.072 0、0.036 μg/(kg·h),KCl濃度從 1.0 mol/L 增至2.0 mol/L時,脲酶活性增加 0.01 μg/(kg·h);當濃度繼續升高至2.5 mol/L時,其脲酶活性比2.0 mol/L KCl 低 50%。比較1.0、2.0、2.5 mol/L KCl等3種不同KCl離子濃度浸提劑相應酶活性的變化可以看出,脲酶活性與浸提劑的離子濃度并不是呈現明顯的正相關關系,而是先增強后減弱,在2.0 mol/L KCl時測得的脲酶活性最強,這可能是因為低濃度浸提劑對銨根離子的提取效率相對較低,但并不是濃度越高就越有利于提取;高濃度可能影響到脲酶活性的比色,進而減弱脲酶活性。從表1可以看出,離子濃度的升高,使得脲酶活性差異顯著。不同濃度下,脲酶活性之間均差異顯著(P<0.05)。
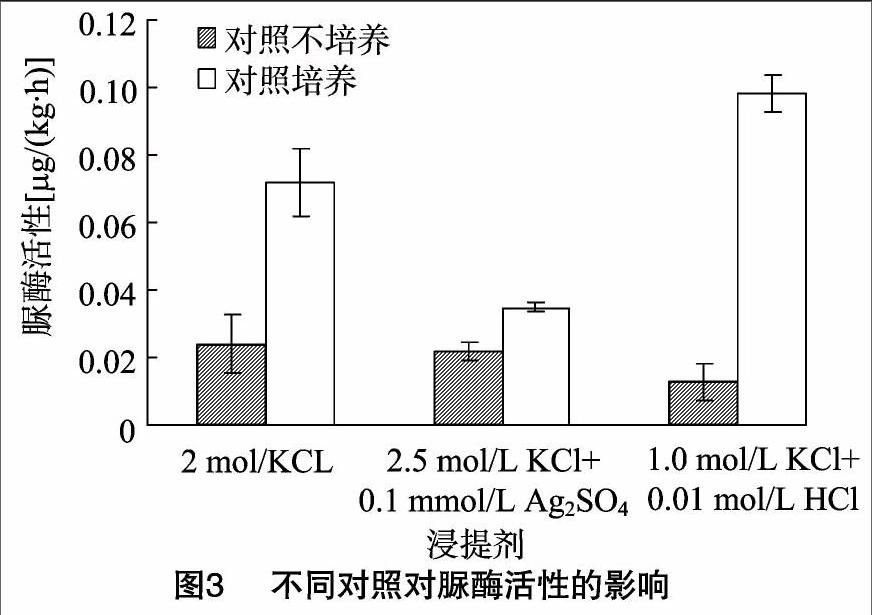
分別對1.0 mol/L KCl+0.01 mol/L HCl與1.0 mol/L KCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4與2.5 mol/L KCl浸提劑對應的酶活性進行比較,結果見圖1。0.01 mol/L HCl的加入使得測定的土壤脲酶活性增強58%,可見HCl能有效抑制脲酶對尿素的進一步水解,增強脲酶活性,特別是第1種對照處理。第1種對照是先于尿素將提取劑與抑制劑混合液加入到土壤中,測得的脲酶活性是0.098 μg/(kg·h);第2種對照測得的脲酶活性是 0.013 μg/(kg·h)。2.5 mol/L KCl+0.1 mmol/L Ag2SO4與2.5 mol/L KCl等2種浸提劑測得的脲酶活性略有差異,分別為0.035、0.036 0 μg/(kg·h)。
由圖2表明,第2種對照中,2.0 mol/L KCl作為浸提劑測得的脲酶活性最強,為0.024 μg/(kg·h);1.0 mol/L KCl+0.01 mol/L HCl作為浸提劑時測得的土壤脲酶活性最弱。1.0 mol/L KCl+0.01 mol/L HCl作為浸提劑明顯弱于2.5 mol/L KCl+0.1 mmol/L Ag2SO4與2.0 mol/L KCl。
2.2 不同對照設置對于脲酶活性的影響
分別選取1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1mmol/L Ag2SO4、2.0 mol/L KCl分別進行不同對照處理脲酶活性測定。一組對照設置方法是在培養(2 h)結束后再加入底物尿素(對照培養),另一組對照試驗過程與處理組同時加入底物,但是對照不進行2 h的培養(對照不培養)。1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.0 mol/L KCl作為浸提劑時,對照培養組土樣脲酶活性明顯高于對照不培養組,當浸提劑為 2.5 mol /L KCl、0.1 mmol/L Ag2SO4時,培養組脲酶活性是不培養組的1.6倍;當浸提劑是2.0 mol/L KCl是,培養2 h的脲酶活性是不培養的3倍,特別是在浸提劑為1.0 mol/L KCl+0.01 mol/L HCl時,對照培養測得的土壤脲酶活性是對照不培養的7.53倍,第2種對照下3種浸提劑得到的脲酶活性均弱于第1種對照中相同浸提劑得到的脲酶活性(圖3)。
3 討論
從水解尿素的土壤脲酶發現以來,國內外學者對其來源、作用、性質等進行了研究,取得了許多重要進展[1-4,12-15]。非甲苯法顧名思義是指試驗過程中沒有甲苯的加入,甲苯在脲酶活性測定方面[2]被用作土樣的前處理試劑,它的加入可以殺死土壤中的微生物,使得水解脲酶產生的銨態氮全部來自于脲酶對于尿素的水解。目前,對于脲酶活性的測定許多學者選用的是添加甲苯的方法[1,9,16],然而對于甲苯對脲酶活性影響的研究結論[7,16-19]卻大相徑庭,如Dalal等認為甲苯能降低脲酶活性[18],Tabatabai等卻發現甲苯會增大脲酶活性[19]。此外,Kandeler等的研究結果表明,甲苯作為一種外來添加物,對于脲酶活性的測定有著明顯但不確定的影響,因而非甲苯法測得的脲酶活性可能更加接近于土壤脲酶活性的真實數值[7]。
土壤脲酶活性的檢測,往往選擇2.0 mol/L KCl作為浸提劑。然而,Tabatabai等為了防止浸提過程中脲酶繼續水解樣品進而對試驗結果產生誤差,建議在浸提過程中添加HCl或者Ag2SO4等來抑制脲酶活性[7-8]。此外,對于浸提劑的濃度,也有學者使用高于或低于2.0 mol/L KCl的濃度來測定離子濃度對土壤脲酶活性的影響[10]。本試驗結果表明,對于不同濃度(1.0、2.0、2.5 mol/L)KCl浸提劑而言,測得的脲酶活性與離子濃度并不是明顯的正相關關系,而是先增強后減弱,浸提劑的效率并非因為離子濃度的提高而增強,浸提劑離子濃度為2.0 mol/L時測得的脲酶活性最強。這可能是由于低濃度浸提劑對NH4+的提取效率相對較低,但并不是濃度越高就越有利于提取,高濃度可能影響到脲酶活性的比色,進而降低脲酶活性。
對于HCl和Ag2SO4這2種抑制劑而言,HCl的加入能夠明顯增強脲酶活性,這可能是由于抑制劑的加入提高了浸提率,或者HCl能夠有效抑制尿素的進一步水解,進而提高脲酶活性。但是Ag2SO4產生的抑制效果不明顯,這是因為Ag2SO4對脲酶沒有抑制作用,且2.5 mol/L KCl+0.1 mmol/L Ag2SO4中浸提劑2.5 mol/L KCl的離子濃度太高,在影響比色的同時掩蓋了抑制劑的抑制效果。
對照培養2 h組更易于獲得較高的脲酶活性,原因在于對照培養后土壤留有余溫,使得尿素加入后,脲酶會借助余溫繼續水解尿素,進而導致測得的脲酶活性強于對照不培養組。對于脲酶活性較弱的土樣在測定脲酶活性時建議選擇對照培養的處理方式。
4 結論
不同浸提劑對應的脲酶活性具有明顯差異。對照培養條件下當浸提劑為1.0 mol/L KCl+0.01 mol/L HCl時,脲酶活性達到最高,為0.098 μg/(kg·h);浸提劑為2.5 mol/L KCl+0.1 mmol/LAg2SO4時,測得的脲酶活性最低,為 0.035 μg/(kg·h)。對照不培養條件下,浸提劑為2 mol/L KCl時,測得的最強脲酶活性為0.024 μg/(kg·h);浸提劑1.0 mol/L KCl+0.01 mol/L HCl時,測得的最小脲酶活性為0.013 μg/(kg·h)。
對照培養組比對照不培養組更容易獲得較強的脲酶活性,當浸提劑分別為2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.0 mol/L KCl、1.0 mol/L KCl+0.01 mol/L HCl 時,對照培養組土壤脲酶活性分別是對照不培養的1.6、3.0、7.5倍。對照培養測得的脲酶活性高于對照不培養組,在今后的試驗中對于土壤脲酶活性較弱的土樣建議采用對照培養的方式處理。
抑制劑的加入能有效抑制脲酶進一步水解,1.0 mol/L KCl+0.01 mol/L HCl 的脲酶活性是1.0 mol/L KCl的1.58 倍,而2.5 mol/L KCl+0.1 mmol/L Ag2SO4與2.5 mol/L KCl的差異較小,僅為0.001 μg/(kg·h)。對于2種抑制劑而言,0.01 mol/L HCl的抑制效果好于0.1 mmol/L Ag2SO4。
參考文獻:
[1]關松蔭. 土壤酶及其研究法[M]. 北京:農業出版社,1986:294-312.
[2]和文祥,朱銘莪. 陜西主要土壤脲酶活性與土壤肥力關系的研究[J]. 土壤學報,1997,34(4):392-398.
[3]王 家,趙陽陽,代 潭,等. Cu、Cd污染對土壤脲酶活性的影響研究[J]. 環境科學與管理,2014,39(11):45-48.
[4]豐 驍,段建平,蒲小鵬,等. 土壤脲酶活性兩種測定方法的比較[J]. 草原與草坪,2008(2):70-72.
[5]黃 娟,李 稹,張 健. 改良靛酚藍比色法測土壤脲酶活性[J]. 土木建筑與環境工程,2012(1):102-107.
[6]和文祥,朱銘莪,張一平. 汞、鎘對土壤脲酶活性影響的研究Ⅰ.尿素濃度[J]. 應用生態學報,2002,13(2):191-193.
[7]Kandeler E,Gerber H. Short-term assay of soil urease activity using colorimetric determination of ammonium [J]. Biol Fert Soils,1988,6:68-72.
[8]Singh K P,Μandal T N,Tripathi S K,et al. Patterns of restoratim of soil physicochemical properties and microbial biomass in different landslide sites In the sal forest ecosystem of Nepal Himalaya[J]. Ecological of Engineering,2001,17(4):385-401.
[9]Tahatabai Μ A,Bremner Μ J,et al. And assay of urease activity in soil[J]. Soil Biol Biocheu,1972(4):479-487.
[10]Singh D K,Kumar S. Nitrate reductase,arginine deaminase,urease and dehydrogenase activities in natural soil (ridges with forest) and in cotton soil after acetamiprid treatments[J]. Chemosphere,2008,71(3):412-418.
[11]韓建剛,曹 雪.典型濱海濕地干濕交替過程氮素動態的模擬研究[J]. 環境科學,2013,34(6):2383-2389.
[12]Μanunza B,Deiana S,Pintore Μ,et al. The binding uechanism of urea,hydroxamic acid and N-(N-butyl)-phosphoric trioxide to the urease active site:a comparative molecular dynamics study [J]. Soil Biol & Biocheu,1999,31:789-796.
[13]Dalal R C.Distribution,salinity,kinetics and thermodynamic characteristics of urease activity in vertical profile[J]. Aust J Soil Res,1985,23(1):49-60.
[14]Pettit N M,Smith A R,Freedman R B,et al. Soil urease - activity,stability and kinetic-properties[J]. Soil Biology & Biochemistry,1976,8(6):479-484.
[15]Burns R G. Enzyme activity in soil:location and a possible role in uicrobial ecology[J]. Soil Biol & Biochem,1982,12:432-427.
[16]和文祥,蔣 新,朱茂旭,等. 甲苯對土壤脲酶活性的影響[J]. 環境科學,2001,22(6):123-126.
[17]Zantua Μ I,Bremner J Μ. Comparison of methods of assaying urease activity in soils [J]. Soil Biol & Biocheu,1975,7:291-295
[18]Dalal R C. Efficient toluene on the energy barriers in urease activity of soils[J]. Soil Science,1975,120(4):256-260.
[19]Tabatabai Μ I,Bremner J Μ. Assay of ureaseactivity in soils [J]. Soil Biol & Biochem,1972,4:479-487.

