小兒顛茄合劑微生物限度方法學驗證
倪兆武,戴宇婷,陳睿彥
(昭通市食品藥品檢驗所,云南 昭通 657000)
小兒顛茄合劑屬于解痙止痛醫院制劑,用于緩解胃腸痙攣引起的疼痛、惡心、嘔吐等,為各醫院常規制劑。微生物限度檢查作為控制藥品質量的一項重要指標,為了保證方法的適、,可靠,按照《中國藥典》2015年版的規定,對小兒顛茄合劑的微生物限度檢查方法適用性進行驗證。
1 儀器與試藥
1.1 樣品、培養基及試藥
小兒顛茄合劑(批號:160301、160314、160329),由某醫院提供。胰酪大豆胨瓊脂培養基TSA(批號:1 5 1 2 2 3)、沙氏葡萄糖瓊脂培養基S D A(批號:1512292)、麥康凱液體培養基(批號:160111)、pH7.0氯化鈉-蛋白胨緩沖液(批號:1512292)等培養基,以上均為北京三藥科技開發公司產品,并進行過培養基適用性檢查。其他試劑均為分析純或化學純。
1.2 儀器與設備
LRH-250F生化培養箱(上海一恒科技有限公司生產),EZ-StreamTMPump六聯過濾系統(密理博公司生產),BHC-1300ⅡA2生物安全柜(蘇凈集團蘇州安泰空氣技術有限公司生產),YXQ-LS-75G壓力蒸汽滅菌器(上海博迅實業有限公司生產),Vitek2 Compact全自動微生物鑒定系統(法國梅里埃公司生產)。
1.3 試驗菌株
大腸埃希菌[CCMCC(B)44102]、金黃色葡萄球菌[CMCC(B)26003]、枯草芽孢桿菌[CMCC(B)63501]、銅綠假單胞菌[CMCC(B)10104]、黑曲霉[CMCC(F)98003]、白色念珠菌[CMCC(F)98001],以上均由中國食品藥品檢定研究院提供,且菌株傳代次數均為2代。
2 實驗方法及結果
2.1 菌液的制備
分別將大腸埃希菌、金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌、和黑曲霉培養物,用無菌0.9%氯化鈉溶液制成每1 mL含菌或孢子數小于1000CFU的菌或孢子懸液,備用。
2.2 供試品的制備
取每個批號樣品兩份,將其混合均勻并作為供試液,取供試液作為原液,取原液,再用胰酪大豆胨液體培養基將供試液進一步稀釋成1:10、1:100的供試液。
2.3 微生物計數法
2.3.1 傾注法回收率測定
2.3.1.1 試驗組
取各稀釋級供試液各9.9 mL,每個稀釋級5份,每份中加入0.1 mL的試驗菌懸液后搖勻,吸取1mL注入無菌平皿中。加金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌的平皿傾注15~20 mL溫度不超過45℃TSA,35℃培養3天,計數;加白色念珠菌、黑曲霉的平皿分別傾注15~20 mL溫度不超過45℃TSA和SDA,傾注TSA的平皿于35℃培養5天,傾注SDA的平皿于25℃培養5天,逐日觀察,計數。每種試驗菌每種培養基至少制備2個平皿,以算數平均值作為計數結果。
2.3.1.2 供試品對照組
取制備好的供試液1mL至平皿中,每個稀釋級平行4皿,其中2個傾注TSA,另2個傾注SDA,同法培養,計數。
2.3.1.3 菌液對照組
取不含中和劑及滅活劑的相應稀釋液(胰酪大豆胨液體培養基)替代供試液,按試驗組操作加入試驗菌液,同法培養,計數。
2.3.1.4 空白實驗
以稀釋液檢查,同法培養,計數。
2.3.2 實驗結果

采用常規法檢查,在TSA中:原液供試品對銅綠假單胞菌、枯草芽孢桿菌人工染菌回收率均小于 50%,其余3種菌回收率在 0.5~2 范圍內;1:10稀釋級對5種菌的人工染菌回收率均在 0.5~2 范圍內。在沙氏 葡萄糖瓊脂培養基中:原液供試品對2種菌的人工染菌回收率均在0.5~2范圍內。因此,本品原液需氧菌總數和霉菌及酵母菌總數的計數未達到要求,需要消除其抑菌活性或重新選擇適當的方法再進行驗證。但1:10稀釋級的需氧菌總數和霉菌及酵母菌總數的計數結果符合要求。見表1。
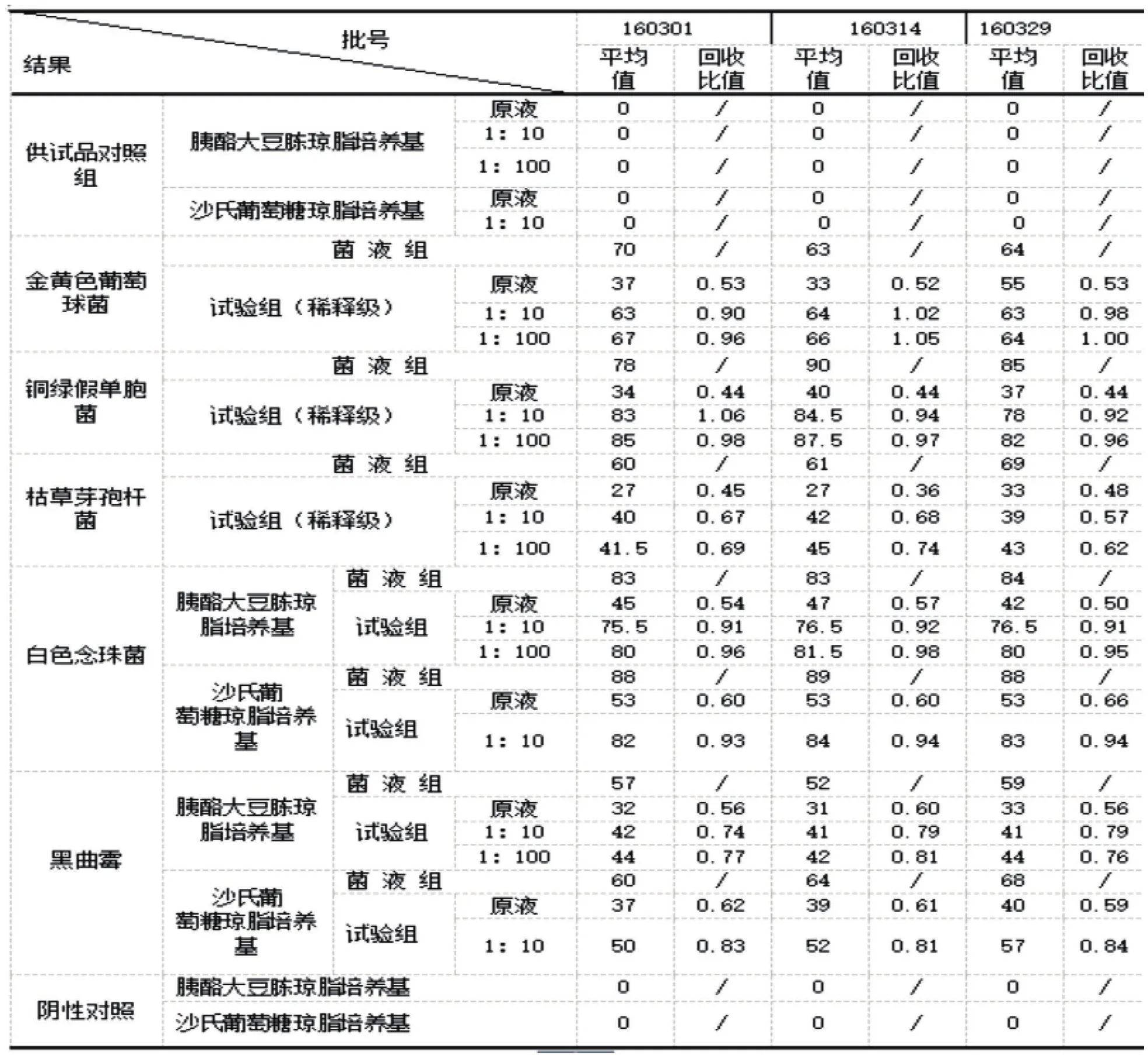
表1 需氧菌總數、霉菌和酵母菌總數計數驗證結果(CFU/mL)
2.3.3 薄膜過濾法
2.3.3.1 加入30 mL無菌pH7.0氯化鈉-蛋白胨緩沖液過濾潤濕濾膜,取2.3.1.1、2.3.1.2、2.3.1.3的供試液及緩沖液1 mL過濾,用100 mL緩沖液沖洗,反復沖洗3次,并按2.3.1.1要求進行培養;逐天觀察結果并記錄。
2.3.4 實驗結果
按傾注法回收率測定所述的計算公式,代入實驗結果計算。本品采用薄膜過濾法進行測定,5種菌原液時的回收率均在0.5~2范圍內。見表2。
2.4 大腸埃希菌檢查方法
2.4.1 試驗組
取原液及不大于100CFU的大腸埃希菌菌懸液各1 mL接種至100 mL胰酪大豆胨液體培養基中,混勻,35℃培養18~24 h。取上述培養物1 mL接種至100 mL麥康凱液體培養基中,42℃培養24~48 h。取麥康凱液體培養物劃線接種于麥康凱瓊脂培養基平板上35℃培養18~72 h。
2.4.2 陽性對照試驗
接種不大于100CFU的大腸埃希菌至100 mL胰酪大豆胨液體培養基中,照試驗組培養操作。
2.4.3 陰性對照試驗
以稀釋液代替供試液照試驗組培養操作,見表3。
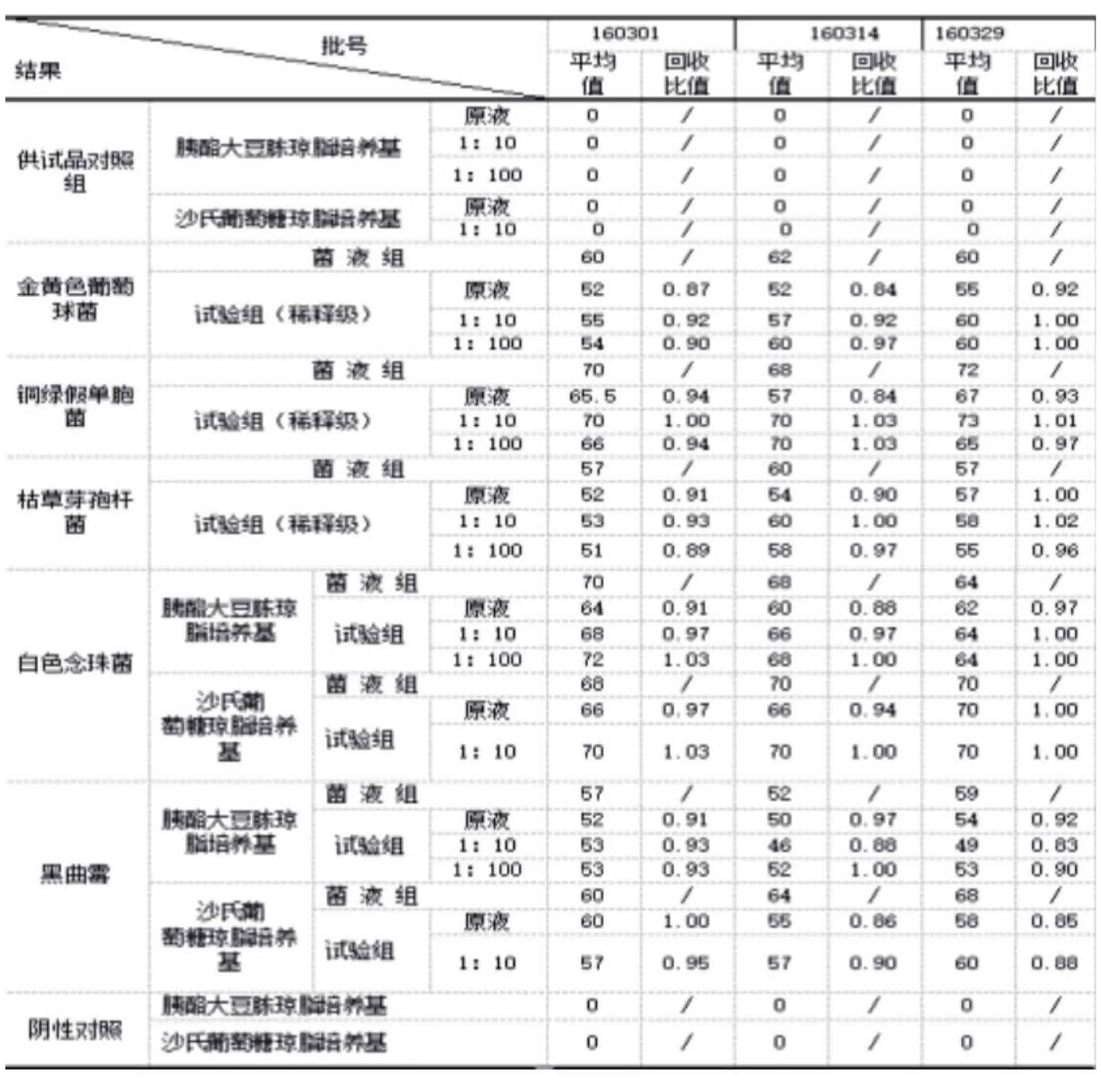
表2 需氧菌總數、霉菌和酵母菌總數計數驗證結果(CFU/mL)
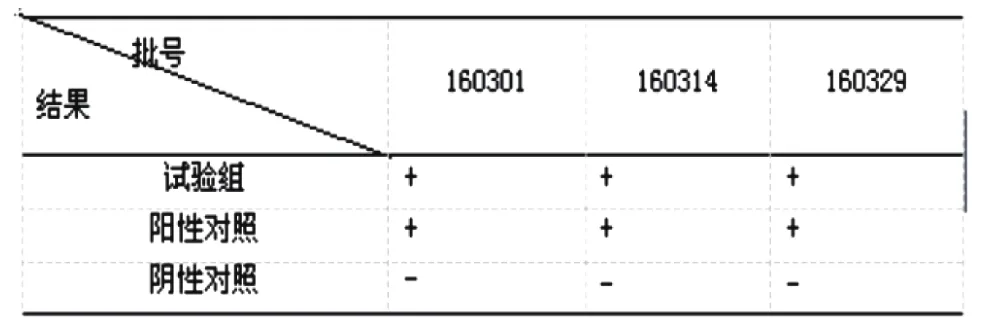
表3 大腸埃希菌結果
3 討 論
根據《中國藥典》2015版的相關規定,為了確認所采用的方法適合用于某制劑的微生物限度檢查,必須對相應檢驗方法進行方法學驗證。因無法判定小兒顛茄合劑的成分,工藝對需氧菌、霉菌和酵母菌以及控制菌大腸埃希菌的抑菌程度,因此對不同稀釋級的常規法進行考察。通過實驗表明,原液時對銅綠假單胞菌、枯草芽孢桿菌抑菌明顯,回收率達不到要求,以1:10的稀釋級為最低稀釋級可以開展檢驗,其次薄膜過濾法能很好消除抑菌影響,可以以原液為最低稀釋級。
[1] 中國藥典:四部[S].2015年:附錄136-151。
[2] 中國藥品生物制品檢定所.中國藥品檢驗標準操作規范[M].中國醫藥科技出版社.2010:351-382
[3] 嚴曉明,劉 萌,等.四種醫院制劑微生物限度檢查方法學驗證[J].中國藥事2015,29(5):485-491
[4] 曹 云,郭曉娟.藥品微生物限度檢查方法學驗證及其相關的技術問題[J].天津藥學,2006,18(06):259-260.

