過氧化氫(H2O2)對PC12細胞的氧化應激損傷的研究
趙立理,張振昶,蘇 剛,關智媛,姚春榮,石正洪*
(1.蘭州大學第二附屬醫院神經內科,甘肅 蘭州 730000;2.蘭州大學基礎醫學院遺傳所,甘肅 蘭州 730000;3.蘭州大學第二臨床醫學院,甘肅 蘭州 730000;4.甘肅省平涼市婦幼保健院,甘肅 平涼 744000)
腦神經系統是人體最精密,復雜的器官,并控制著軀體其他器官的功能等[1]。神經系統疾病是由于感染,腫瘤,血管病變,外傷,中毒,免疫障礙,變性,遺傳,先天發育障礙,代謝等引起的疾病。而腦神經系統疾病的發病率全球與日俱增,據報道現有150萬人患有神經系統疾病[2]。腦血管病具有較高的發病率,致殘率,死亡率[3]。近年來,氧化應激(oxidative stress)等非傳統風險因素已成為腦卒中的研究焦點,因為氧化應激反應始終貫穿于腦卒中發展的整個病理過程,且是早期發生,故目前諸多學者著眼于腦血管疾病的氧化應激機制的研究[4]。增強機體抗氧化應激能力為防治急性腦卒中的重要措施之一。大鼠腎上腺嗜鉻細胞系(pheochromocytoma cells,PC12)是一種很好的研究神經細胞生理,病理及藥理的模型[5]。本文采用了H2O2造成PC12細胞氧化應激損傷,通過觀察細胞形態的變化,MTT檢測及相關氧化應激指標MDA,SOD的檢測,Hoechest 33258凋亡檢測,及H2O2的作用下PC12細胞周期變化,來證明H2O2對PC12細胞的氧化應激損傷。
1 資料與方法
1.1 一般資料
H2O2(由Sigma公司購買),1640(Gibico),小牛血清(BI),超氧化物歧化酶(SOD),丙二醛(MDA)試劑盒,均購于南京建成生物技術研究所,批號(SOD A001-3,MDA A003-4)MTT(sigma公司)
1.2 儀器
超凈工作臺,流式細胞儀,超低溫-80℃冰箱(美國賽默飛世爾科技公司生產);脫色搖床(沃德生物醫學儀器公司生產),恒溫水浴箱(天津艾薇歐科技發展有限公司生產);臺式冷凍高速離心機(上海安亭科學儀器公司生產)。
1.3 方法
PC12氧化應激損傷模型的建立。
1.3.1 MTT法檢測細胞活力
取對數生長期PC12細胞,用含10%小牛血清的RPIM-1640完全培養液配成1×105個/mL單細胞懸液,接種于96孔板中,每孔100 uL,每組設6個平行孔,實驗分為3組,陰性對照組:不加藥物僅加基礎培養液;藥物組:分為5組,各組所加的H2O2濃度分別為200,100,50,25,12.5 mmol/L。空白組:不加藥物,而僅以RPIM-1640基礎培養液代替細胞。將以上的對照組,空白組,藥物組置于37.5℃,5%的CO2,相對濕度為95%培養箱中培養2,4,6 h后在每個實驗孔中加入MTT20 uL,孵育結束時棄上層清液,加入DMSO150 uL,用酶標儀570 nm波長處測定吸光度(A)值。各組細胞存活率按照如下公式計:細胞存活率=(測定組OD值一測定空白管OD值)/(正常組O值一測定空白管OD值)×100%。
1.3.2 細胞形態學的觀察,倒置顯微鏡下觀察細胞形態
1.3.3 細胞核Houchest33258凋亡染色
取蓋玻片在70%乙醇中浸泡5 min,將其放在六孔內,約為50%~80%。200,100,50,25,12.5 umol/mL的H2O2作用4 h后,每孔加入0.5 mL的固定液,固定10 min或更長時間(可4℃過夜)去固定液,用PBS洗兩遍。加入0.5 mL的Hoechst33258染色液,染色5 min,去染色液,用PBS洗兩遍,滴一滴抗熒光碎滅封片液于載玻片上,蓋上貼有細胞的蓋玻片,熒光顯微鏡檢測呈藍色的細胞核。
1.3.4 MDA含量、SOD活性的檢測,收集細胞及培養液,按照南京建成試劑盒說明書測定SOD及MDA含量。
1.3.5 流式細胞周期檢測
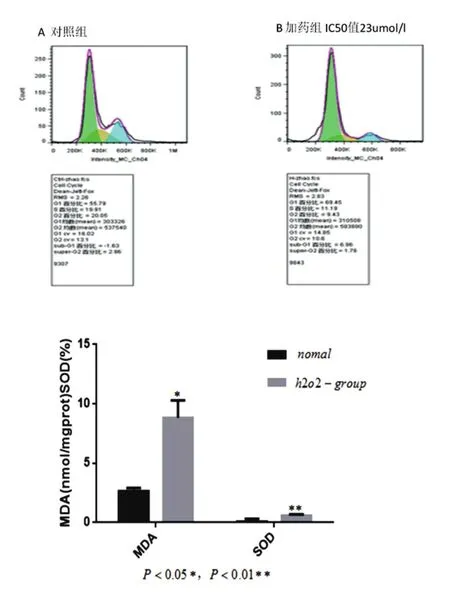
細胞鋪于6孔板內,培養過夜,IC50值23 umol/mL的H2O2孵育4 h。胰酶消化細胞后,離心1500 rpm 10 min,取上清,用300 uLPBS重懸細胞,將細胞液滴加入預冷的700 uL的無水乙醇中,4度避光固定過夜,固定過的細胞1500 rpm離心10 min,棄上清,用PBS洗滌,再用含RNageA重懸細胞,37℃避光孵育30 min,加入100 ug/mL PI 500 uL,4℃避光孵育30 min。用300目孔徑為40~50 unL尼龍網膜(篩網)過濾細胞。
1.3.6 結果分析
采用SPSS 19.0統計學軟件對數據進行處理,采用t檢驗,結合布爾邏輯運算符進行處理,以P<0.05為差異有統計學意義。
2 結 果
2.1 H2O2對PC12細胞形態的影響
IC50值H2O2作用于PC12細胞,正常對照組細胞為呈長梭形的貼壁細胞, 折光度強,生長速度快。而損傷組細胞折光度減弱,細胞圓縮、脫落。
2.2 H2O2作用于PC12細胞增殖活性的影響
H2O2作用于PC12細胞的活力影響,圖為200,100,50,25,12.5 mol/L的H2O2作用于PC12細胞4 h。H2O2的濃度分別為200,100,50,25,12.5 mmol/L,提示H2O2濃度為25,12.5 mmol/L時,差異有統計學意義,故其IC50值在25 mol/L到12.5 mol/L之間。
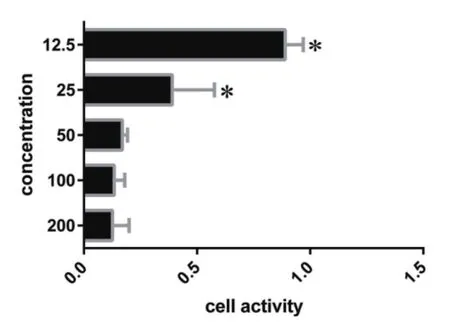
圖1 為不同濃度的H2O2對PC12細胞的氧化應激損傷MTT檢測,其中25 M和12.5 mM有明顯的統計學意義
2.3 不同濃度梯度的H2O2對PC12細胞凋亡染色Hoechst 33258(見圖2)
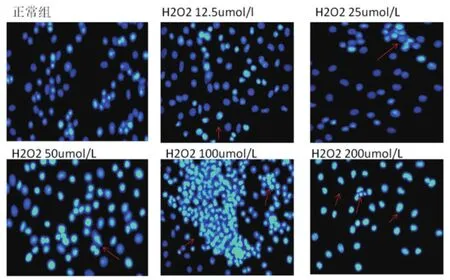
圖2
2.4 細胞周期結果
與正常對照組比較,給予與IC50值的H2O2損傷后的PC12細胞后,G1期細胞增多。
2.5 H2O2對PC12細胞MDA含量和SOD活性的影響
與正常組比較,隨著H2O2的濃度增加,損傷組的細胞MDA明顯增加(P<0.05),SOD活力明顯抑制(P<0.01)
3 討 論
缺血性腦卒中的發病機理復雜,而在急性腦卒中發生早期4 h,為腦卒中黃金搶救時間,已證實缺血性腦卒中的發病機理中氧化應激損傷占有重要的作用,故目前多數學者著眼于缺血性腦卒中氧化應激損傷的研究。ROS是氧化應激產物,釋放出的氧化應激酶可引起細胞線粒體損傷。如Cao.L.等人通過葡萄糖-6-磷酸脫氫酶(G6PD)過表達研究了G6PD在腦血管病的氧化應激損傷機制中的重要保護作用。PPP在腦血管病發生過程中起著保護神經元的作用,且會使NADPH合成增加,從而減少了rGSH的生成[6]。Zhang.Y.等人通過研究證明在腦卒中發生后的不同時間點里氧化應激損傷產生的NOX2表達不同,闡述了NOX2不是早期的腦卒中氧化應激損傷時出現的酶,而是持續再灌注損傷時重要的氧化應激酶,故此酶可以作為潛在的治療腦卒中的作用靶點。現今H2O2誘導PC12細胞氧化應激損傷模型為公認的腦血管病氧化應激模型[7]。
本研究顯示:與正常組細胞相比,損傷組的細胞存活率明顯降低,且MDA釋放量增加,SOD活力減弱,細胞核出現凋亡,G1期明顯阻滯,而G1期為開始合成細胞生長需要的各種蛋白質,糖類,脂類及RNA等,是DNA合成預備期。我們的實驗結果證明H2O2可引起PC12細胞停滯在G1,出現不分裂。且可出現細胞核明顯凋亡,故為今后的神經細胞氧化應激損傷機制的研究提供的新的思路及方向,但其具體相關信號通路機制還需進一步研究及探討。同時除了基礎的細胞研究以外,還需進行臨床觀察與基礎實驗相結合,通過對腦卒中氧化應激機制的研究尋找新穎和有效的藥物靶點。
[1] McKinnon PJ. Genome integrity and disease prevention in the nervous system[J]. Genes & development. 2017,31(12):1180-94.
[2] Huang L,Hu J,Huang S,Wang B,Siaw-Debrah F,Nyanzu M,et al.Nanomaterial applications for neurological diseases and central nervous system injury[J].Progress in neurobiology.2017.
[3] Feigin VL,Forouzanfar MH,Krishnamurthi R,Mensah GA,Connor M,Bennett DA,et al.Global and regional burden of stroke during 1990-2010:findings from the Global Burden of Disease Study 2010[J].Lancet (London,England).2014,383(9913):245-54.
[4] Francis A,Baynosa R.Ischaemia-reperfusion injury and hyperbaric oxygen pathways:a review of cellular mechanisms[J].Diving and hyperbaric medicine.2017,47(2):110-7.
[5] Chen L,Wei ML,Zhao JJ,Hong H,Qu W,Feng F,et al.GTS40,an active fraction of Gou Teng-San (GTS),protects PC12from H2O2-induced cell injury through antioxidative properties[J].Chinesejournal of natural medicines.2017,15(7):495-504.
[6] Cao L,Zhang D,Chen J,Qin YY,Sheng R,Feng X, et al.G6PD plays a neuroprotective role in brain ischemia through promoting pentose phosphate pathway[J].Free radical biology & medicine.2017.
[7] Che H,Fu X,Zhang L,Gao X,Wen M, Du L,et al.Neuroprotective Effects ofn-3 Polyunsaturated Fatty Acid-Enriched Phosphatidylserine Against Oxidative Damage in PC12 Cells[J].Cellular and molecular neurobiology.2017.

