以帕金森綜合征為主要表現的麻痹性癡呆1例并文獻復習
趙 興, 付希英, 張耀文, 馬倩倩, 李 鳴, 楊 薇
以帕金森綜合征為主要表現的麻痹性癡呆1例并文獻復習
趙 興1, 付希英2, 張耀文1, 馬倩倩1, 李 鳴1, 楊 薇1
麻痹性癡呆(general paresis of insane,GPI)是晚期神經梅毒最嚴重的類型之一,極易誤診及漏診。其中以帕金森綜合征為主要表現的病例少見,合并有癲癇發作的病例更加罕見。現將我科1例既往多次誤診為帕金森綜合征,同時在入院治療過程中伴有癲癇發作的GPI病例報道如下。
1 病例摘要
患者,男,59 y,司機。因“雙手抖動伴言語笨拙漸重12 m,加重伴行為異常1 d”于2015年12月17日入院。患者于入院前12 m無明顯誘因出現雙手不自主抖動,以左側為著。11 m前出現言語笨拙癥狀,就醫后考慮“帕金森病”,藥物治療后上述癥狀漸進性加重。3 m前就診于北京301醫院,行頭部MRI及PET/CT等相關輔助檢查,結果示未見明顯異常,給與口服“茴拉西坦”等藥物治療,言語笨拙癥狀較前略有好轉,但開始出現行為異常。雙手抖動癥狀較前未見明顯好轉。1 m前,右下肢活動不靈發作一次,給與改善循環等藥物治療,后未再發作。15 d前,出現無故發笑癥狀,出汗較前增多,伴步態異常,表現為軀干前傾、難以停止。同時出現睡眠變差。1 d前,上述精神行為異常癥狀突然加重,表現為無故使用電工刀刮手機,眼神散漫,不能認識家屬,并全身屈曲跪于床上,患者發現家屬后即藏于床下,持續時間約3 h好轉,好轉后不能回憶發病過程。入我院急診后行頭部核磁DWI檢查過程中言語笨拙逐漸加重至言語不能,伴尿失禁,惡心、嘔吐兩次,嘔吐物為胃內容物。病程中偶有飲水嗆咳、吞咽困難,無發熱,無特殊藥物、毒物接觸史。既往胃潰瘍、糖尿病、乙型肝炎病史,否認冶游史。入院查體:意識朦朧,言語不能,查體欠配合。記憶力、計算力、定向力不能配合。雙側瞳孔等大等圓,直徑約3.0 mm,對光反射遲鈍,雙眼向各方向活動靈活,無眼震,左側口角可見不自主抽動,頻率約1~2次/s,示齒口角略向左側歪斜,左上肢肌張力呈“齒輪樣強直”,左下肢肌張力增高,左手可見規律對指動作,約2~3 s/次,右上肢偶可見摸索動作,雙下肢可支離床面,雙側病理征未引出。頭部核磁檢查DWI未見明顯高信號。初步診斷:癲癇(待診)、帕金森綜合征。該患者病史復雜,病因不明。生化、凝血及其他血液檢查未見明顯異常。腦電圖結果(見圖2、圖3);梅毒抗體檢查(TP)11.631(參考值:0~1)。
入院后第2天出現抽搐范圍較前增大,表現為左側顏面部及口角抽動,左上肢抽動,根據腦電圖檢查結果考慮為癲癇發作,給與地西泮、苯巴比妥對癥處理,并給予卡馬西平0.1 g,TID口服預防發作。進一步查梅毒血清學試驗(RPR+TP):梅毒抗體檢查(TP)11.958(參考值:0~1),稀釋32倍陽性,稀釋64倍弱陽性。腰穿腦脊液初壓120 mmH2O, RPR+TP:[TP:10.994(參考值:0~1),RPR原倍弱陽性];常規、生化回報均處于正常值范圍之內。根據ICD-10神經梅毒的診斷標準,更改臨床診斷為“神經梅毒、麻痹性癡呆、帕金森綜合征、癲癇”。該患者青霉素G、頭孢唑肟、哌拉西林他唑巴坦均試敏陽性,給與多西環素口服,150 mg,q12 h,癥狀好轉后出院,共住院13 d。出院時查體:意識清楚,言語含糊,可交流,反應遲鈍,近記憶減退,遠記憶未見明顯異常,概測定向力、計算力差,雙側瞳孔等大等圓,直徑約3.0 mm,對光反射遲鈍,無眼震,雙眼向各方面活動靈活,伸舌居中,示齒口角略向左側歪斜,左上肢肌張力呈“齒輪樣強直”,左下肢肌張力增高,四肢肌力正常,雙側病理征未引出。
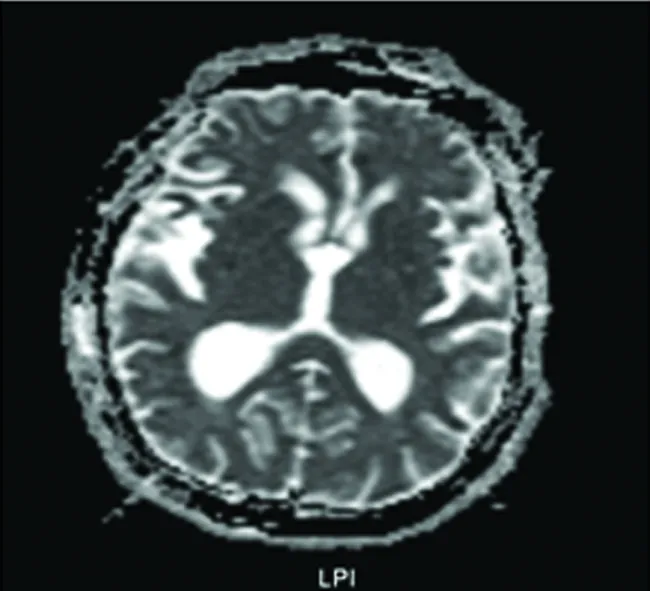
圖1 側腦室擴大,額葉、顳葉皮質萎縮明顯

圖2、圖3 基本節律消失,各導聯普遍呈中至高波幅3~4波/秒慢波活動,左側高于右側。快波:前部導聯偶見低波幅20~24波/秒的β波(因患者不自主抖動,干擾波較多)
2 討 論
GPI屬實質性神經梅毒,是晚期梅毒全身性損害的重要表現,由梅毒螺旋體直接侵犯腦組織所致,癡呆是最常見的癥狀,常伴有精神行為異常。病理改變以腦實質損害為主,常累及額葉、顳葉、頂葉。早期癥狀以抑郁、失眠為主;中期表現為記憶力及智力障礙;晚期可出現癲癇發作、雙下肢痙攣性癱瘓。目前GPI診斷尚無金標準,國內有學者統計其誤診率高達34.9%[1]。瞳孔變化是GPI患者較為常見的早期癥狀,但典型的Argyll-Robertson瞳孔(阿羅氏瞳孔)并不常見,約60%的患者表現陽性[2]。GPI的MRI檢查與腦實質損害密切相關,主要表現為彌漫性腦萎縮、雙側腦室呈對稱性擴大等[3],該患者頭部MRI亦提示彌漫性腦萎縮(見圖1),但在許多變性疾病如Alzheimer病、Pick病、Korsakoff綜合征、血管性癡呆、HIV腦病等多種疾病中可出現此種病理改變,故影像學檢查缺乏特異性。不過該患者提示我們,當發現青壯年出現與年齡不相符的顳葉、海馬萎縮時,應考慮到麻痹性癡呆的可能[4]。GPI的腦電圖主要表現為廣泛的低、中幅慢波,對診斷GPI意義也不大[5]。目前唯一可以作為確診手段為腦組織活檢,如活檢發現梅毒螺旋體伴有特征性的桿狀小膠質細胞增生便可以明確診斷,但作為有創檢查,在臨床工作中受到很大的限制。梅毒因其復雜且不典型的臨床表現被稱為“杰出的模仿者”(The Great Imitator),神經梅毒表現更是如此[6]。這也為臨床工作的鑒別診斷提出了嚴峻的挑戰。至今為止,臨床上表現為錐體外系癥狀的神經梅毒極為少見,繼發于神經梅毒的帕金森綜合征的文獻報道及相關研究也不多。神經梅毒引起繼發性帕金森綜合征的機制尚不明確,推測其機制可能和腦炎一樣引起基底節功能紊亂:(1)小動脈炎血管閉塞導致基底節區缺血性壞死,引起多巴胺神經元及多巴胺受體減少;(2)皮質-基底節區通路的多巴胺傳遞或代謝障礙[7]。帕金森綜合征是指除原發性帕金森病以外的各種原因引起的類似帕金森病表現的運動障礙。一般情況下,帕金森病對美多芭試驗反應良好,而帕金森綜合征則反應不良,該患者口服抗帕金森藥物無效,支持帕金森綜合征的診斷。經驅梅治療后,患者認知及精神障礙好轉,因而該患者的帕金森癥狀考慮是由于梅毒感染中樞神經系統所致。有文獻統計,在繼發性帕金森綜合征中,神經梅毒所致僅占0.3%[8]。
國外文獻報道約20%的麻痹性癡呆可合并癲癇發作[9]。其發病機制可能為:(1)長期的慢性炎癥刺激導致神經元細胞變性、壞死,炎性細胞浸潤、腦組織缺血缺氧、酸中毒使膜電位興奮性增高,導致癇性發作;(2)慢性炎癥累及腦膜和小動脈導致血管閉塞,侵犯腦實質使得腦皮質結構受損、萎縮,可能形成致癇灶,導致癲癇發生。治療上仍主張首先病因治療,兼顧對癥。該患者經多西環素驅梅治療,并加用卡馬西平后未再出現發作癥狀,證實有效。1 y后隨訪發現,經系統驅梅治療后,該患者未再出現帕金森癥狀及癲癇發作,病情得到控制,3種疾病共存的可能性不大[10]。
自從青霉素發明以后,一直為治療GPI最有效的藥物。該患者多種常規抗生素均試敏陽性。曾考慮給與阿奇霉素驅梅,但阿奇霉素在國人體內耐藥率高達95%[11]。與多西環素相比,四環素有較高的胃腸道反應,故改為口服多西環素治療,取得了一定的療效。這提示我們面對嚴重青霉素類過敏反應的患者,似乎有了替代藥物的存在,但整體大樣本數據分析還有待進一步研究。GPI治療效果取決于腦損害程度,經治療后癡呆可明顯改善,但其預后與開始治療的時間早晚明顯相關,1 y后隨訪患者,發現僅殘存部分性格改變,提示我們早期干預治療,獲益將會更大。
3 展 望
由于梅毒再度在我國流行已20余年,近年來發病率呈逐年上升趨勢,神經梅毒必然會有一個新的發病高峰,可以推測GPI的發病率也會呈上升趨勢,同時隨著我國社會老齡化進程的發展,其他病因引起的癡呆發病率也逐年上升,因此加強對GPI的認識,提高鑒別診斷水平具有十分重要的現實意義。GPI是一種可治的癡呆,及早的診斷及治療,對其預后較好,如不治療,生存期一般不超過3 y。本例患者病程已有1 y,由于未給予正確對癥治療以至患者病情加重。所以對臨床表現為認知障礙、精神癥狀、錐體外系癥狀的患者,如不能用常見疾病解釋時,尤其當青壯年患者出現上述表現且合并其他非原發性疾病表現時,在鑒別診斷中要警惕神經梅毒,盡早行梅毒特異性血清學檢查,爭取早期診斷、早期治療以改善預后。這就為廣大醫務工作者詳詢患者病史尤其是冶游史提出了迫切的要求。
[1]吳世韜,張 濤,顏 艷.麻痹性癡呆臨床特征與防治(附126例分析)[J].航空航天醫學雜志,2009,20(10):18-20.
[2]葉冬青.皮膚病流行病學[M].2001.328-332.
[3] Wang X,Yang Y,Wang X,et al.MRI findings and early diagnosis of general pares of the insane[J].Neurological Research,2014,36(2):137-142.
[4]靳 彪,趙康仁,張渭芳,等.麻痹性癡呆的臨床特征與診斷(附2例報告)[J].臨床神經病學雜志,2007,20(4):307-308.
[5]Sinha S,Harish T,Taly A B,et al.Symptomatic seizures in neurosyphilis:an experience from a university hospital in south India[J].Seizure,2008,17(8):711-716.
[6]Liis S,Mark B,Pille T.Neurosyphilis as a great imitator:a case report:[J].BMC Research Notes,2016,9(1):372.
[7]Chen Y F,Tseng Y L,Lan M Y,et al.The relationship of leukoaraiosis and the clinical severity of vascular Parkinsonism[J].Journal of the Neurological Sciences,2014,346(1~2):255-259.
[8]Pineda DA,Buritica O,Sanchez JL,et al.Parkinsonian syndromes in Medellin (Colombia)[J].Revista De Neurologia,2000,31(10):936-943.
[9]Yao Y,Huang E,Xie B,et al.Neurosyphilis presenting with psychotic symptoms and status epilepticus[J].Neurological Sciences Official Journal of the Italian Neurological Society & of the Italian Society of Clinical Neurophysiology,2011,33(1):99-102.
[10]Shah BB,Anthony E,Lang MD FRCPC.Acquired neurosyphilis presenting as movement disorders[J].Movement Disorders,2012,27(6):690-695.
[11]Martin I E,Gu W,Yang Y,et al.Macrolide resistance and molecular types of Treponema pallidum causing primary syphilis in Shanghai,China[J].Clinical Infectious Diseases,2009,49(4):515-521.
1003-2754(2017)02-0171-02
R742.5
2016-12-10;
2017-01-28
(1.吉林大學第二醫院神經內科,吉林 長春 130041;2.吉林大學第二醫院內分泌科,吉林 長春 130041)
楊 薇,E-mail:wei88linda@yahoo.com

