蕨麻多糖對缺氧損傷人臍靜脈內皮細胞的保護作用及機制
葛肖健,張永亮,師超峰,徐葳,李建宇, 李靈芝
(1天津中醫藥大學,天津300193;2武警后勤學院;3天津市職業與危害防制重點實驗室)
蕨麻多糖對缺氧損傷人臍靜脈內皮細胞的保護作用及機制
葛肖健1,2,張永亮2,3,師超峰2,徐葳2,李建宇2, 李靈芝2,3
(1天津中醫藥大學,天津300193;2武警后勤學院;3天津市職業與危害防制重點實驗室)
目的 探討蕨麻多糖對缺氧損傷人臍靜脈內皮細胞的保護作用及機制。方法 將培養好的人臍靜脈內皮細胞株EA.hy926隨機分為常氧對照組、缺氧模型組、復方丹參對照組及蕨麻多糖高、中、低濃度組,除常氧對照組外,其余5組構建缺氧損傷模型,同時復方丹參對照組加復方丹參片提取物(終濃度0.1 mg/mL),蕨麻多糖高、中、低濃度組加終濃度分別為0.1、0.05、0.025 mg/mL的蕨麻多糖,均培養2 h。采用MTT法檢測細胞活力,采用臺盼藍染色法測算細胞存活率,光學顯微鏡下觀察細胞形態變化,用比色法測定細胞培養基中乳酸脫氫酶(LDH)、一氧化氮(NO)水平,ELISA法測定培養基中誘導型一氧化氮合酶(iNOS)、內皮型一氧化氮合酶(eNOS)、內皮素1(ET-1)水平,比色法測定細胞內超氧化物歧化酶(SOD)、丙二醛(MDA)水平,RT-PCR技術測定細胞內iNOS、eNOS mRNA表達。結果 蕨麻多糖各濃度組、復方丹參組與缺氧模型組比較細胞形態均有不同程度改善。與缺氧模型組比較,蕨麻多糖各濃度組、復方丹參組細胞活力及存活率升高,細胞LDH外漏量下降,iNOS和ET-1水平降低,eNOS和NO水平升高,SOD水平升高,MDA水平降低,細胞eNOS mRNA表達升高,iNOS mRNA表達降低(P均<0.05)。結論 蕨麻多糖可能通過提高缺氧損傷EA.hy926細胞的抗氧化活性、調控ET-1與NO的動態平衡發揮保護作用。
缺氧損傷;蕨麻多糖;臍靜脈內皮細胞;一氧化氮;內皮素
蕨麻為薔薇科委陵菜屬鵝絨委陵菜的地下塊根。課題組前期研究證實,蕨麻對心肌細胞[1]、神經細胞[2]、內皮細胞缺氧損傷[3]及急性低壓缺氧和慢性缺氧導致的機體損傷[4]均有顯著的抗缺氧作用。初步研究還發現,蕨麻多糖可減輕缺氧導致的心肌細胞損傷,并能延長常壓缺氧狀態下小鼠的存活時間[5],提示蕨麻多糖可能是蕨麻重要的抗缺氧有效成分。2014年3月~2015年12月,本研究通過建立人臍靜脈內皮細胞缺氧損傷模型,探討蕨麻多糖對缺氧損傷內皮細胞的保護作用及可能的作用機制。
1 材料與方法
1.1 藥品、試劑及儀器 蕨麻(青海);蕨麻多糖,由本實驗室自行提取;復方丹參片(天津亞寶藥業科技有限公司),有效成分按藥典方法提取。人臍靜脈內皮細胞株EA.hy926(中科院上海細胞庫)。乳酸脫氫酶(LDH)、一氧化氮(NO)、超氧化物歧化酶(SOD)、丙二醛(MDA)試劑盒(南京建成生物工程公司);誘導型一氧化氮合酶(iNOS)、內皮型一氧化氮合酶(eNOS)、內皮素1(ET-1)檢測試劑盒(上海藍基生物科技有限公司);iNOS、eNOS及β-actin引物均由上海捷瑞生物公司合成;高糖DMEM培養基(美國GIBCO公司)。CO2培養箱(3111型,美國Thermo forma),混合氣體培養箱(3131型,美國Thermo forma),倒置顯微鏡(TS100型,日本Olympus),紫外分光光度儀(UV-1800型,日本島津),多功能顯微鏡(E-510型,日本Olympus),酶標儀(680型,美國Bio-Rad),PCR儀(PT-0200型,美國MJ Research),核酸定量儀(德國Eppendorf),凝膠成像分析系統(GelPro 4.5型,美國)。
1.2 細胞培養、分組及缺氧損傷模型構建 EA.hy926細胞培養于DMEM培養液,內含10%胎牛血清,2 mmol/L L-谷氨酰胺、100 U/mL青霉素和100 μg/mg 鏈霉素,于37 ℃、5% CO2環境培養。待細胞生長至80%融合時,消化并接種至培養皿繼續培養。待細胞融合度達90%時,將培養液換為無血清DMEM繼續培養24 h,將細胞分為常氧對照組、缺氧模型組、復方丹參對照組及蕨麻多糖高、中、低濃度組。棄上清液,除常氧對照組外,其余5組換預先用5% CO2、95% N2飽和了30 min的無糖無血清培養液,同時復方丹參對照組加入復方丹參片提取物(終濃度0.1 mg/mL),蕨麻多糖高、中、低濃度組加入蕨麻多糖(終濃度分別為0.1、0.05、0.025 mg/mL),于37 ℃下混合氣體培養箱中培養。常氧對照組棄上清液,換等體積含0.5% DMSO的培養液,于37 ℃、5% CO2培養箱中同步培養。
1.3 細胞活力檢測 采用MTT法。取各組細胞接種于96孔板,培養2 h后棄上清液,每孔加入MTT溶液20 μL,繼續在37 ℃、5% CO2環境下孵育4 h,加150 μL/孔DMSO充分溶解,于492 nm波長處測定各孔吸光度(A)值,細胞活力=實驗組A值/對照組A值×100%。
1.4 細胞存活率測算 采用臺盼藍染色法。取各組細胞接種于6孔板,培養2 h后棄上清液。PBS浸洗細胞,加入PBS稀釋的0.4%臺盼藍染液染色5 min后吸去染液,PBS浸洗2次,鏡下觀察并計數藍染細胞,計算細胞存活率。細胞存活率=(細胞總數-藍染細胞數)/細胞總數×100%。
1.5 細胞形態學觀察 將蓋玻片置于6孔培養板內,待細胞爬片后取出,以0.01 mol/L PBS洗滌,95%乙醇固定,按常規HE染色法染色,光學顯微鏡下觀察細胞形態。
1.6 細胞培養基中LDH、NO、iNOS、eNOS、ET-1水平檢測 取各組細胞接種于24孔板,培養2 h,用比色法測定細胞培養基中LDH、NO水平,ELISA法測定培養基中iNOS、eNOS、ET-1水平。操作按試劑盒說明書進行。
1.7 細胞內SOD、MDA水平檢測 取各組細胞接種于24孔板,培養2 h加0.25%胰酶消化,1 000 r/min離心10 min后去上清液,加0.01 mol/L PBS 1 mL制成細胞懸液,超聲破碎細胞后,比色法測定細胞內SOD、MDA水平。具體操作按試劑盒說明書進行。
1.8 細胞內iNOS、eNOS mRNA表達檢測 采用RT-PCR技術。提取各組內皮細胞總RNA,逆轉錄合成cDNA。根據GenBank庫序列設計內參β-actin及目的基因iNOS、eNOS的引物,進行逆轉錄產物的PCR擴增。iNOS上游:5′-GAGGAAGTGGGCAGGAGAATG-3′,下游:5′-GTAGTAGA AAGGGGACAGGAC-3′,擴增產物長度為294 bp。PCR反應條件:94 ℃ 45 s,55 ℃ 45 s,72 ℃ 30 s,30個循環,72 ℃延伸5 min。eNOS上游:5′-GCACAGGAAATGTTCACCTAC-3′,下游:5′-GTATCCAGGTCCATGCAGAC -3′,擴增產物長度為551 bp。PCR反應條件:94 ℃ 45 s,62 ℃ 45 s,72℃ 30 s,28個循環,72 ℃延伸5 min。擴增產物以1.5%瓊脂糖凝膠進行電泳分離,凝膠成像分析系統檢測各擴增條帶A值,目的基因mRNA相對表達量=目的基因擴增條帶A值/內參β-actin擴增條帶A值。

2 結果
2.1 蕨麻多糖對缺氧細胞活力及存活率的影響 見表1。
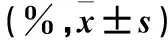
表1 各組細胞代謝活力及存活率比較
注:與常氧對照組比較,aP<0.05;與缺氧模型組比較,bP<0.05。
2.2 蕨麻多糖對缺氧細胞形態的影響 常氧對照組內皮細胞呈梭形,細胞核大而飽滿,胞質豐富,細胞呈緊密排列;缺氧模型組可見細胞發生皺縮,胞體變小,細胞核固縮深染,細胞之間聯系減少,間隙增大,且可見少數腫大淡染細胞;蕨麻多糖各濃度組、復方丹參組與缺氧模型組比較細胞形態均有不同程度改善。
2.3 蕨麻多糖對缺氧細胞LDH外漏及合成釋放NO、ET-1能力的影響 見表2。
2.4 蕨麻多糖對缺氧細胞內SOD、MDA水平的影響 見表3。
2.5 蕨麻多糖對缺氧細胞內 eNOS、iNOS mRNA表達的影響 見表4。

表2 各組培養基中LDH、NO、iNOS、eNOS、ET-1水平比較
注:與常氧對照組比較,aP<0.05;與缺氧模型組比較,bP<0.05。

表3 各組細胞內SOD、MDA水平比較
注:與常氧對照組比較,*P<0.05;與缺氧模型組比較,bP<0.05。

表4 各組細胞內eNOS、iNOS mRNA相對表達量比較
注:與常氧對照組比較,*P<0.05;與缺氧模型組比較,bP<0.05。
3 討論
近年來研究發現,天然多糖具有抗腫瘤、降糖、降脂、抗凝、抗衰老、抗輻射、抗缺氧、抗氧化等諸多生物活性[6]。多糖在蕨麻中占很大比例,蕨麻多糖對體外培養缺氧損傷心肌細胞具有保護作用[5],提示多糖可能是蕨麻抗缺氧的重要活性成分。本研究結果顯示,蕨麻多糖能顯著減少缺氧內皮細胞LDH外漏,增強細胞活力和提高細胞存活率,表明蕨麻多糖能減輕缺氧導致的細胞膜損傷,對缺氧損傷內皮細胞具有保護作用。超氧化物歧化酶(SOD)是體內清除氧自由基的重要抗氧化酶之一,SOD的活性可反映機體清除自由基的能力。丙二醛(MDA)是膜脂質過氧化的最終產物,是自由基對脂類損害的結果。本研究結果顯示,缺氧模型組內皮細胞SOD活性降低,MDA水平升高,表明缺氧導致了細胞抗氧化能力下降,發生了脂質過氧化損傷。給予不同濃度蕨麻多糖處理后,細胞SOD活性均升高,同時MDA的產生減少。說明蕨麻多糖可通過提高細胞的抗氧化能力對抗缺氧損傷。有文獻報道蕨麻多糖可通過清除自由基,提高大鼠抗氧化能力,從而對抗地塞米松導致的免疫抑制[7];蕨麻多糖在腦缺血再灌注模型中也可提高大鼠腦組織SOD、谷胱甘肽水平,減少MDA產生[8],進一步為本研究結果提供了佐證。蕨麻正丁醇部位可提高缺氧EA.hy926細胞SOD活性,降低MDA水平,減少低密度脂蛋白和肌酸激酶的釋放,提示在其中占有很大比例的蕨麻多糖也可能發揮了作用。
體內NO的合成受一氧化氮合酶(NOS)的調控,該酶有神經元型一氧化氮合酶(nNOS)、eNOS和誘導型一氧化氮合酶(iNOS)三種亞型,其中nNOS和eNOS催化產生的NO量少,主要參與生理過程。在正常狀態下,細胞內的eNOS可以催化生成低濃度的NO來維持正常的心血管收縮功能。而iNOS在正常狀態下表達水平極低,但在缺氧應激時可異常升高,且酶活力持續時間長,因而使NO過度生成,加重細胞損傷,而eNOS表達則被抑制[9]。過度生成的NO與機體氧化還原產物超氧陰離子自由基迅速反應生成過氧化亞硝酸離子(ONOO-)。ONOO-具有強氧化性,在酸性條件下可以分解形成如NO2+、NO2-、NO3-、OH-、OH和ONOO-·CO2加合物等多種有毒物質,促使細胞膜發生脂質過氧化,引起內皮細胞凋亡。本研究結果顯示,缺氧時細胞eNOS表達顯著降低而iNOS表達升高,但NO水平降低,推測缺氧時細胞活性氧產生增多,而內源性清除劑SOD水平降低,使得超氧陰離子自由基與生成的NO反應生成ONOO-,發揮毒性作用,從而表現為細胞活力和細胞存活率降低;預先給予各濃度蕨麻多糖干預均上調了eNOS水平,下調了iNOS水平,同時NO水平也升高,提示蕨麻多糖可通過調節不同亞型NOS的水平來調控NO的合成和釋放,可能通過抑制超氧陰離子自由基與NO反應來起到細胞保護作用。
ET、NO都是血管內皮細胞釋放的介質。ET-1具有強縮血管活性,NO則具有舒血管作用,二者在正常情況下處于動態平衡,共同維持血管的正常功能;二者失衡是動脈粥樣硬化、高血壓等心血管疾病的重要發病機制[10]。Teasauro等[11]提出ET和NO的失衡,損傷了血管穩態,是2型糖尿病患者發生血管功能障礙的主要原因。缺氧損傷后,內皮細胞釋放的NO顯著減少,而ET-1釋放增加[12],從而使內皮NO依賴性舒張功能受限。本研究結果顯示缺氧狀態下,內皮細胞ET-1水平升高,而NO水平降低,與文獻報道一致。蕨麻多糖干預后可提高NO水平,降低ET-1水平。文獻報道急性缺氧犬吸入NO后其血漿ET-1水平低于單純缺氧犬,提示NO能抑制ET-1的生成[13]。因此蕨麻多糖在缺氧時可能通過維持NO水平來抑制ET-1的高表達,從而參與維護ET-1和NO的動態平衡,發揮對血管內皮細胞的保護作用。
綜上所述,蕨麻多糖可通過提高EA、hy926細胞的抗氧化活性對缺氧損傷內皮細胞發揮保護作用;此外該保護作用還可能與其調控ET-1和NO的動態平衡有關。該保護作用是否與蕨麻多糖的濃度及作用時間有關,本研究未做分析,留待以后進一步研究探討。
[1] 蘇暢,王魯君,張永亮,等.蕨麻正丁醇部位下調缺氧心肌細胞Cav 1.2及Ryanodine受體表達[J].武警后勤學院學報(醫學版),2015,24(10):770-774.
[2] 卜婧,張永亮,李靈芝,等.蕨麻正丁醇提取物抑制大鼠海馬神經元缺氧所致一氧化氮生成的研究[J].中國中西醫結合急救雜志,2013,20(7):201-204.
[3] 楊碩,張嶺,龔海英,等.蕨麻正丁醇部位下調缺氧內皮細胞HIF-1α及ET-1表達[J].天津中醫藥,2015,32(3):168-172.
[4] 唐瓊琳,高宏生,劉麗華,等.急性高原缺氧大鼠腦皮質相關細胞因子變化及蕨麻的保護作用[J].中國中西醫結合急救雜志,2012,19(3):137-140.
[5] 韋維,李廣策,龔海英,等.蕨麻多糖抗缺氧作用初步研究[J]. 武警醫學院學報,2010,19(5):345-347.
[6] 吳笳迪.多糖的作用及其研究進展[J]. 沈陽師范大學學報(自然科學版),2008,26(2):221-223.
[7] 胡庭俊,鄭榮梁.蕨麻多糖對小鼠免疫功能的調節與體內自由基水平關系的實驗觀察[J].廣西農業生物科學,2007,26(s1):45-48.
[8] 張永慧,李月春,王寶軍,等.蕨麻多糖對大鼠腦缺血再灌注損傷的保護作用及其機制[J].內蒙古醫學雜志,2014,46(4):385-388.
[9] Ester WA, Coen AS, Prter H, et al. Protective role of endothelial nitric oxide synthase[J]. J Pathol, 2003,56(1):8-17.
[10] Tang EH, Vanhoutte PM. Endothelial dysfunction: a strategic target in the treatment of hypertension[J]. Pflugers Arch, 2010,459(6):995-1004.
[11] Tesauro M, Cardillo C. Obesity, blood vessels and metabolic syndrome[J]. Acta Physiol(Oxf), 2011,203(1):279-286.
[12] McQuillan LP, Leung GK, Marsden PA, et al. Hypoxia inhibits expression of eNOS via transcriptional and posttranscriptional mechanism[J]. Am J Physiol, 1994,267(5 Pt 2):H1921-H1927.
[13] 郭子健,曹偉標,朱元玨,等.一氧化氮對急性缺氧性肺動脈高壓及內皮素-1分泌的影響[J].中華結核和呼吸雜志,1999,22(6):366.
Protective effect of Potentilla anserine L. polysaccharide on human umbilical vein endothelial cells after hypoxia injury
GEXiaojian1,ZHANGYongliang,SHIChaofeng,XUWei,LIJianyu,LILingzhi
(1TianjinUniversityofTraditionalChineseMedicine,Tianjin300193,China)
Objective To investigate the protective effect and mechanism of Potentilla anserine L. polysaccharide on human umbilical vein endothelial cells injured by hypoxia. Methods The cultured human umbilical vein endothelial cells (EA.hy926) were randomly divided into the normoxic control group, hypoxia model group, Fufangdanshen control group (with 0.1 mg/mL Fufangdanshen tablet extract) and high-, medium- and low-concentration Potentilla anserine L. polysaccharide groups (with 0.1, 0.05, and 0.025 mg/mL Potentilla anserine L. polysaccharide, respectively). In addition to the normoxic control group, the hypoxia injury models were constructed in the other five groups. The cells were cultured for 2 h. The metabolic activity and the survive rate of the cells were determined with MTT assay and Trypan-blue staining. The morphological changes of the cells were observed under light microscope. The levels of lactate dehydrogenase (LDH) and nitric oxide (NO) in the culture medium were detected by colorimetric method as well as the levels of superoxide dismutase (SOD) and the content of malondialdehyde (MDA) in cells. The levels of the inducible NO synthase (iNOS) and the endothelial NO synthase (eNOS) and the endothelin 1(ET-1) in culture medium were measured by ELISA. The expression levels of iNOS mRNA and eNOS mRNA was detected by RT-PCR. Results Comparing with hypoxia model group, the morphology of the cells were improved significantly, the cell viability and survival rate increased, cell LDH leakage decreased, iNOS and ET-1 levels decreased, eNOS and NO levels increased, SOD levels increased, MDA levels decreased, cell eNOS mRNA expression increased, and iNOS mRNA expression decreased in the Fufangdanshen control group and each Potentilla anserine L. polysaccharide group (allP<0.05). Conclusion The Potentilla anserine L. polysaccharide could have protective effect on the endothelial cells during hypoxia by improving anti-oxide activity of the cells, and the effect might be related to its regulation of dynamic equilibrium between ET-1 and NO.
hypoxia injury; Potentilla anserine L. polysaccharide; umbilical veins endothelial cells; nitric oxide; endothelin
國家自然科學基金資助項目(81471823);天津市重點基金資助項目(12JCZDJC34700);武警后勤學院創新團隊課題項目(WHTD201303)。
葛肖健(1988-),女,在讀碩士,主要研究方向為天然產物的活性成分。E-mail:1012968746@qq.com
李靈芝(1963-),女,教授,主要研究方向為組織缺氧缺血損傷及防治。E-mail:13682196000@163.com
10.3969/j.issn.1002-266X.2017.05.003
R852.11
A
1002-266X(2017)05-0008-04
2016-09-30)

