低溫脅迫小麥苗冰結構蛋白純化的研究
焦宇知,徐 桃,梁家冰,朱 云,何志勇,張曉曉,劉永博,孫芝楊,翟瑋瑋
(1.江蘇食品藥品職業技術學院,江蘇淮安 223005;2. Purdue University,West Lafayette,IN,USA,47907;3.山東省莒縣人民醫院,山東莒縣 276511;4.江南大學,江蘇無錫 214122;5.山東朝能福瑞達生物科技有限公司,山東濟南 250031)
低溫脅迫小麥苗冰結構蛋白純化的研究
焦宇知1,2,徐 桃1,梁家冰3,朱 云1,何志勇4,張曉曉1,劉永博5,孫芝楊1,翟瑋瑋1
(1.江蘇食品藥品職業技術學院,江蘇淮安 223005;2. Purdue University,West Lafayette,IN,USA,47907;3.山東省莒縣人民醫院,山東莒縣 276511;4.江南大學,江蘇無錫 214122;5.山東朝能福瑞達生物科技有限公司,山東濟南 250031)
以研究低溫脅迫小麥苗冰結構蛋白(ISP)純化為目的,以小麥苗為對象,經低溫脅迫,并采用粗分離、飽和硫酸銨溶液沉淀、DEAE-Cellulose 52層析、sephadex-G75凝膠層析4個步驟對其中ISP進行純化,分別采用差示掃描量熱法(DSC)、熱休克處理法和聚丙烯酰氨凝膠電泳(SDS-PAGE)測定各純化步驟所得ISP的熱滯活性(THA)、冰晶重結晶抑制能力(ICP)和分子質量(MW),并計算小麥苗存活率和各純化步驟的得率。實驗結果表明,梯度低溫脅迫的小麥苗存活率與恒溫低溫脅迫相比提高了240%,小麥苗提取物(AWSE)中蛋白質含量與未低溫脅迫小麥苗提取物(NAWSE)相比提高了7.8%;以THA表征的純化倍數(T1)和以ICP表征的純化倍數(T2)分別為451.15和137.60,得率為2.85%,THA為0.180 ℃(5 mg/mL),ICP為70.03%,分子質量范圍為20.1~31.0 ku;與THA相比,ISP在較低濃度下即可達到ICP的峰值。小麥苗可作為制備冰結構蛋白的天然植物資源。
小麥苗,低溫脅迫,冰結構蛋白,熱滯活性,重結晶抑制能力
冰結構蛋白(ISP)作為一類對冰晶生長和重結晶有抑制能力的蛋白質,可非依數性的降低溶液冰點而不影響其熔點,從而引起熔點與冰點差異,這種差異被稱為熱滯活性(THA)[1]。ISP添加到冷凍面團[2-4]、冷凍肉制品[5]和冰淇淋[6-7]等冷凍食品或原料中,可通過吸附到冰晶表面并使冰晶的生長和重結晶而受到抑制,降低冰點,從而改善冷凍食品的質構和原料加工特性,應用潛力巨大。
目前已發現分布于植物、海洋魚類、昆蟲和微生物中的5類ISP,且發現和鑒定了越來越多不同來源的ISP,如沙棘[8]、黑麥草[9]、沙冬青[10]、白斑狗魚[11]和光滑鱉甲[12]等。獲取ISP的純化方法主要有層析分離法[9]、電泳分離法[13]、冰特異性吸附分離法[14-15]、核磁共振法[16]和濁點萃取法[17]等。
由于ISP降低冰點幅度有限且產量小,與傳統食用抗凍劑相比,ISP的高成本限制了其在食品中的廣泛應用。因此,轉基因[18]、低溫脅迫[19-21]等誘導ISP合成的方法和探究更為廉價的ISP來源成為研究熱點。植物由于原料廣泛、易得和廉價,且其中的ISP具有良好的冰晶重結晶抑制能力(ICP),已成為生產ISP的重要原料之一[22]。小麥苗作為一種廉價易得植物,對其低溫脅迫誘導產生具有抑制重結晶的蛋白質在國內外已有公開報道[6,9,23]。但麥種來源和低溫脅迫條件不同,ISP結構和活性可能有較大差異[22]。本工作擬以淮麥33為麥種,以低溫脅迫誘導產生ISP,利用粗分離、飽和硫酸銨溶液沉淀、DEAE-Cellulose 52層析、sephadex-G75凝膠層析對其進行純化,采用差示掃描量熱法(DSC)、熱休克處理法和聚丙烯酰氨凝膠電泳(SDS-PAGE)法分別測定純化各步驟所得ISP的THA、ICP和分子質量,計算低溫脅迫小麥苗存活率以篩選最優低溫脅迫方法,計算各純化步驟的得率以評價純化效果,以期為小麥苗來源的ISP開發提供參考。
1 材料與方法
1.1 材料與儀器
淮麥33 淮安市農科院提供;DEAE-Cellulose 52、考馬斯亮藍G250、N,N,N′,N′-四甲基乙二胺 美國sigma;sephadex-G75 瑞典Pharmacia公司;雞蛋清溶菌酶、胰蛋白酶抑制劑、牛碳酸酐酶、兔肌動蛋白、牛血清白蛋白、兔磷酸化酶B 上海普欣生物科技公司;十二烷基硫酸鈉(SDS)、巰基乙醇、溴酚藍、甘油、過硫酸銨、乙二胺四乙酸二鈉(EDTA)、苯甲基磺酰氟(PMSF)、硫酸銅、硫酸鉀、氯化鉀、硫酸、溴酚藍、硫酸銨、鹽酸等 國藥集團;透析膜上海生工生物,截留分子質量MWCO 3.5 ku。
DSC-7差熱分析儀 美國PE公司;GTOP-158D光照培養箱 浙江托普儀器公司;DW-86L288超低溫冰箱 海爾公司;CX41顯微鏡、DP20成像系統 日本OLYMPUS公司;HCS410冷熱臺 美國INSTEC;GL-20G-II高速冷凍離心機 上海安亭科學儀器廠;K9840/SH220N凱氏定氮儀 濟南海能儀器公司;HDB-3紫外檢測儀、TH-1000梯度混合器、EBS-20自動部份收集器和記錄儀 上海滬西儀器廠;FD-1臺式冷凍干燥機 上虞艾科儀器公司;BG垂直電泳儀 北京百晶生物科技公司。
1.2 實驗方法
1.2.1 小麥苗的低溫脅迫 參照文獻[6]的方法稍作改動。小麥苗長至一葉一心后,采用梯度低溫脅迫,降溫至8 ℃培育24 h,然后降至6 ℃培育48 h,再降至4 ℃培育96 h,晝夜溫度一致。解除低溫脅迫72 h后取小麥苗并超低溫保存備用,以未低溫脅迫處理的小麥苗和4 ℃低溫脅迫168 h作為對照。以解除低溫脅迫后72 h后恢復長勢的小麥苗計算存活率(SR)。
其中:NR為解除低溫脅迫后72 h后恢復長勢的小麥苗數,NNCA為低溫脅迫前小麥苗數。
1.2.2 小麥苗初提物(AWSE)的制備 每次稱取150 g超低溫小麥苗,加 600 mL預冷緩沖液(25 mmol/L Tris-HCl,pH7.8,0.1 mmol/L EDTA,1 mmol/L PMSF,0.1 mol/L KCl),攪拌粉碎,提取液于13000 r/min條件下冷凍離心30 min,上清液75 ℃水浴15 min后,于冰水浴中冷卻,13000 r/min冷凍離心30 min,上清液冷凍干燥得AWSE,用同樣方法制備未低溫脅迫小麥苗初提物(NAWSE)。
1.2.3 飽和硫酸銨溶液沉淀初分離 AWSE復溶后用100%飽和度的硫酸銨溶液4 ℃低溫沉淀10 h后,于13000 r/min條件下冷凍離心15 min。沉淀用超純水復溶,用透析膜(MWCO 3.5 ku)對純水透析過夜后濃縮凍干。
1.2.4 DEAE-Cellulose 52層析 參照文獻[24]方法并作改動。層析柱(2.5 cm×45 cm)經緩沖液(5 mmol/L Tris-HCl,pH7.8,0.1 mmol/L EDTA,0.1 mol/L KCl)平衡后,用緩沖液配制20 mg/mL的樣品,經0.45 μm 微濾膜過濾后進行離子交換層析:上樣量5 mL,先用25 mmol/L Tris-HCl 緩沖液(pH7.8)洗脫1 h,再用0~1 mol/L的KCl溶液(含5 mmol/L Tris-HCl,pH7.8,0.1 mmol/L EDTA)進行梯度洗脫,流速1 mL/min,檢測波長280 nm,收集熱滯活性組分,對純水透析過夜后濃縮凍干。
1.2.5 Sephadex-G75凝膠層析 參照文獻[25]方法并作改動。經離子交換層析純化后的凍干樣品20 mg溶于0.5 mL洗脫液中(5 mmol/L Tris-HCl,pH7.8,0.1 mmol/L EDTA,0.1 mol/L KCl)中,經0.45 μm微濾膜過濾后進行凝膠層析:層析柱(1.5 cm×50 cm)先用洗脫液充分平衡,上樣量0.5 mL,流速0.2 mL/min,檢測波長280 nm,收集熱滯活性組分,對純水透析過夜后濃縮凍干。
1.2.6 THA測定 采用DSC法測定,參照文獻[26]方法并作改動。取經離子交換和凝膠層析純化的ISP組分各5 mg,用1 mL蒸餾水復溶,取10μL溶液密封于鋁制坩堝中,置于DSC儀器樣品池中央,以空池為參比。儀器穩定后,首先以1 ℃/min降溫至-25 ℃,然后升溫至25 ℃,再降溫至-25 ℃,從掃描曲線上得到結晶溫度(Tf,結晶放熱峰起始點溫度)、體系結晶熱(ΔAm)和熔點(Tm,熔化吸熱峰值溫度)。以1 ℃/min升溫至保持溫度(Th,樣品熔融峰所涵蓋溫度區間的某一溫度),Th保持5 min后再降溫至-25 ℃。記錄掃描曲線上結晶放熱峰初始溫度T0和體系結晶熱(ΔAf)。設定ΔAf為60%±10%時的Th為實驗保留溫度。冰晶含量(φ)的計算公式和熱滯活性THA計算公式分別如下:
THA=Th-T0
1.2.7 ICP測定 參照文獻[6]方法并稍作改動。冰淇淋中AWSE和NAWSE添加量均為10 mL(5 mg/mL),其與水的總體積保持75 mL不變,以基礎配方為對照。冰淇淋硬化后置于程序制冷器中,待冰淇淋升溫至-20 ℃后進行熱休克處理,以1.67 ℃/h加熱至-10 ℃后保溫42 h,再以相同的速度冷卻至-20 ℃并保溫42 h,每周期共96 h,8個周期后測定熱休克始末冰淇淋冰晶大小均值X50,冰晶大小增長百分比(IGP)定義為熱休克處理周期末與周期始相比X50增加百分比;小麥苗ICP定義為與參照物水相比AWSE降低IGP的百分比,ICP計算公式如下:
1.2.8 ISP分子質量測定 采用SDS-PAGE電泳法,參照文獻[27]方法并作改動。樣品的制備:凝膠層析純化后凍干樣品10 mg溶于1 mL蒸餾水,10000 r/min離心5 min,取50 μL上清液加等體積樣品緩沖液,沸水浴3 min后取出立刻離心并取上清液。濃縮膠濃度5%,分離膠濃度12%。
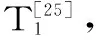
1.2.10 蛋白質含量測定 參照GB 5009.5-2010采用凱氏定氮法測定。
1.3 數據統計分析
所有實驗均重復3次,采用IBM SPSS 20和OriginPro 8對數據進行分析。
2 結果與分析
2.1 低溫脅迫對小麥苗存活率的影響結果分析
與對照組相比,低溫脅迫處理后,小麥苗雖出現枯萎或長勢明顯下降的現象(表1),但采用梯度低溫脅迫后,仍有76.8%的小麥苗存活并在測定期內恢復長勢;與4 ℃恒溫低溫脅迫相比,梯度低溫脅迫小麥苗存活率顯著提高(表1,p<0.05),相比較提高了240%。由于恒溫低溫脅迫小麥苗的存活率低,后期實驗未將其作為研究對象。梯度低溫脅迫后,AWSE的蛋白質含量顯著上升(表1,p<0.05),相比較提高了7.8%。原因可能是,蛋白質作為植物細胞保護物質之一,在低溫脅迫下可通過調節滲透濃度從而啟動脫落酸的形成,誘發新蛋白質的合成以提高抗寒性[28]。研究者常使用體內標記和mRNA 體外翻譯等方法分離出低溫誘導蛋白并獲得其氨基酸序列,從而篩選出特異性基因用于作物抗凍性能和材料冷凍儲藏性能的改良[29]。

表1 低溫脅迫對小麥苗存活率和AWSE蛋白質含量的影響Table 1 Changes of survival rate of wheat seedling and protein content in AWSE after chilling stress
注:abcde值同一列不同字母差異性顯著(p<0.05),數據為3次平行實驗的均值±標準偏差,表2~表4同。
2.2 小麥苗ISP分離純化結果分析
2.2.1 各純化階段得率和純化倍數結果分析 AWSE經過飽和硫酸銨沉淀、離子交換和凝膠層析等純化步驟后,ISP得率達到2.85%。以THA表征的純化倍數T1和以ICP表征的純化倍數T2分別為451.15和137.60(表2),兩者存在較大差異的原因可能是AWSE初提物中ISP濃度低從而導致DSC儀器測定中取值方式的誤差增加。由于除初始冰晶含量和一定范圍內蛋白濃度等部分可控因素對ISP的THA測定結果有一定影響外,THA測定結果較為穩定,因此,本工作仍將THA變化作為純化倍數的計算依據之一。有研究表明,低溫脅迫誘導產生的ISP熱穩定性高[30-31],因此本實驗在制備AWSE時,加熱處理去除了部分熱不穩定蛋白,為ISP的后續純化提供了便利,理論上提高了純化倍數。
經低溫脅迫后,AWSE初提物的質量高于NAWSE初提物(表2),表明低溫脅迫誘導了新蛋白的合成,這與2.1的實驗結果一致。
凝膠層析后的AWSE在5 mg/mL時THA達到了0.180 ℃,與Jia Chunli等[32]報道植物源ISP的活性在0.1~0.6 ℃之間一致。隨著純化的進行,AWSE中ISP濃度升高,THA也隨之增加,表明ISP降低溶液冰點雖具有非依數性,ISP的THA與其濃度仍有一定的關系,這與張暉等[33]報道ISP非依數性約為具有依數活性物質的500倍,但在一定濃度范圍內THA隨濃度緩慢變化的結果一致[27]。
純化過程中,ISP的ICP從AWSE初提物的17.83%增加至離子交換層析純化后的69.65%(表2,p<0.05)。表明隨著ISP濃度增加,AWSE對冰晶重結晶抑制能力顯著增強。凝膠層析后,AWSE中的ISP濃度進一步增加,但其ICP增加不顯著(p>0.05),說明ISP的非依數性存在極限濃度,達到該濃度時,其活性趨于飽和[33]。

表2 AWSE純化過程參數變化Table 2 Variation of parameters during purification process of AWSE
注:停留溫度Th=-2.00 ℃。表3、表4同。
原因可能是,根據“吸附-抑制”模型和“石頭壓海綿”模型理論,ISP分子在與冰淇淋冰晶表面結合時會導致冰晶局部表面曲率發生變化,覆蓋的ISP分子之間存在尺度空間,覆蓋率無法達到100%,同時冰淇淋冰晶分子表面積本身也有限,從而導致ISP的THA和ICP都存在閾值。與ISP的THA活性相比,AWSE的ISP在相對較低濃度下即可達到ICP最大值,因此可預測AWSE抑制冰晶重結晶能力要比其熱滯活性更高,這與Hassas-Roudsari M等[1]報道一致,植物來源ISP主要作用不是阻止冰晶形成,而是抑制重結晶和降低過冷點[9,22]。經過8個周期的熱休克處理后,NAWSE也檢測出1.33%的ICP,可能是由于NAWSE的加入導致冰淇淋混合溶液冰點下降。
2.2.2 離子交換層析分離純化結果分析 飽和硫酸銨沉淀所得AWSE在離子交換色譜圖上出現8個洗脫峰(圖1)。其中,P1、P2和P3與飽和硫酸銨沉淀初分離后AWSE相比,THA顯著增加,ICP顯著增加并接近或達到最高值(表3)。AWSE所含ISP在120 min內即可洗脫完全,這與公開報導的結果不完全一致[34],這可能與小麥苗品不同有關,另外低溫脅迫方法不同誘導產生的ISP的結構和性質可能也存在較大差異[22],從而導致離子交換特性發生變化。P4的THA和ICP較無活性的P5~P8要高(表3),可能是由于組分分步收集時,微量P3組分混入P4所致,也有可能是DSC儀器測定中取值方式的誤差所致。
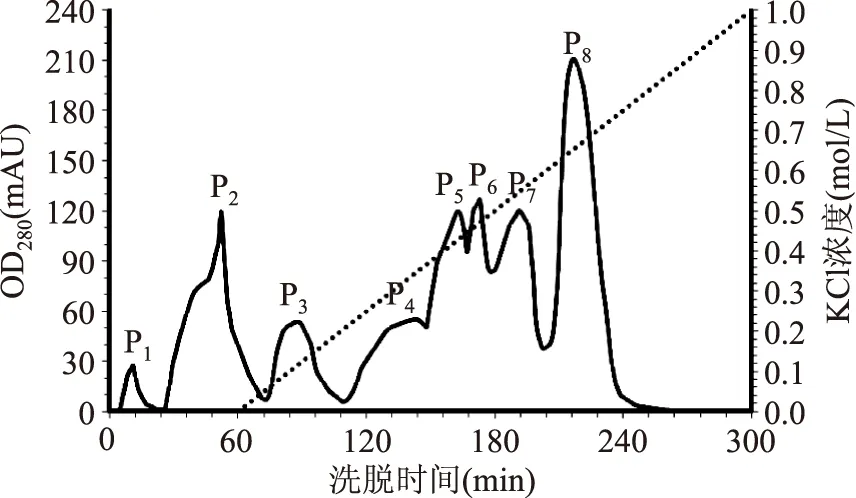
圖1 AWSE離子交換層析圖Fig.1 Ion exchange chromatography profile of AWSE

表3 AWSE離子交純化后參數變化Table 3 Parameters variation after purification of AWSE by ion exchange chromatography
2.2.3 凝膠層析分離純化結果分析 對離子交換色譜獲得的P1、P2和P3(圖1)進行凝膠層析分離后。P13、P23和P33顯示出THA和ICP(圖2~圖4)。與凝膠色譜純化前相比,THA顯著增加,ICP達到飽和(表4)。電泳實驗結果顯示,P13、P23和P33的洗脫時間雖然存在差異,但電泳結果顯示P13、P23、P33分子質量范圍相同,為20.1~31.0 ku(圖5),這與公開報道的結果20~40[9]和20~34 ku[34]一致但不完全相同,可能與麥種和低溫脅迫方法的不同導致誘導產生的ISP不同有關系。P13、P23略有拖尾現象,可能是因為樣品是具有相近相對分子質量的蛋白質混合物,也可能是由于在濃縮膠中蛋白質濃度過高而導致沉淀。P12、P22和P32的THA和ICP較P11、P21和P31高(表4),可能是由于分步收集時,微量活性組分混入P12、P22和P32所致,也有可能是DSC儀器測定中取值方式的誤差所致。

圖2 P1凝膠過濾色譜圖Fig.2 Gel filtration chromatography profile of P1

圖3 P2凝膠過濾色譜圖Fig.3 Gel filtration chromatography profile of P2

圖4 P3凝膠過濾色譜圖Fig.4 Gel filtration chromatography profile of P3
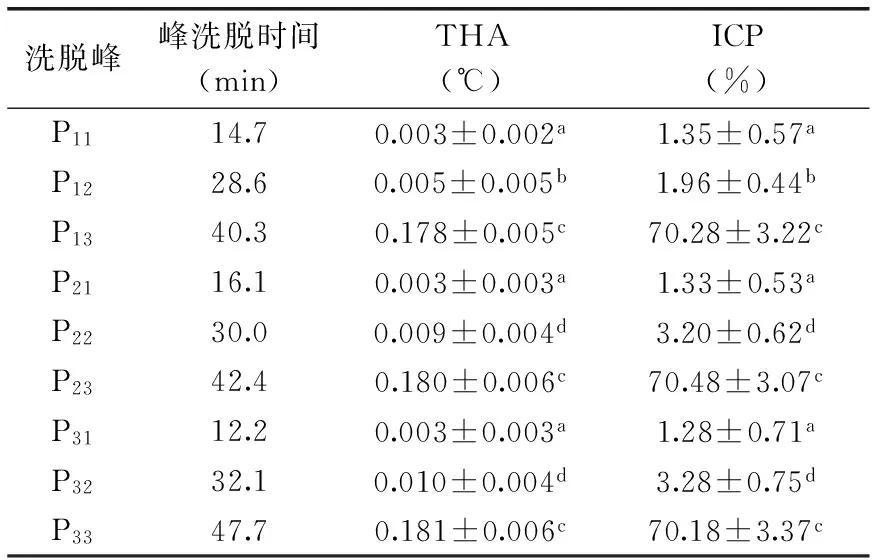
表4 AWSE凝膠層析純化后參數變化Table 4 Parameters variation during purification of AWSE by iron exchange chromatography

圖5 凝膠層析后AWSE各活性峰電泳圖Fig.5 SDS-PAGE profile of P13、P23和P33 after gel filtration of AWSE
3 結論
以低溫脅迫小麥苗為對象,采用粗分離、飽和硫酸銨溶液沉淀、DEAE-Cellulose 52層析、sephadex-G75凝膠層析對其中的ISP進行純化,測定了純化過程中樣品的THA、ICP和分子質量,計算了小麥苗存活率和各純化步驟的得率。梯度低溫脅迫小麥苗存活率與恒溫低溫脅迫相比提高了240%,AWSE中蛋白質含量與NAWSE相比提高了7.8%;以THA表征的純化倍數(T1)和以ICP表征的純化倍數(T2)分別為451.15和137.60,得率為2.85%,THA為0.180 ℃(5 mg/mL),ICP為70.03%,分子質量(MW)范圍為20.1~31.0 ku;與THA相比,ISP在較低濃度下即可達到ICP的峰值。
[1]Hassas-Roudsari M,Goff H.D. Ice structuring proteins from plants:Mechanism of action and food application[J]. Food Research International,2012,46(1):425-436.
[2]JIA Chunli,HUANG Weining,WU Chao,et al. Frozen bread dough properties modified by thermostable ice structuring proteins extract from Chinese Privet(Ligustrumvulgare)leaves[J]. Cereal Chemistry,2012,89(3):162-167.
[3]Zhang Yanjie,Zhang Hui,Wang Li,et al. Extraction of oat(AvenasativaL.)antifreeze proteins and evaluation of their effects on frozen dough and steamed bread[J]. Food & Bioprocess Technology,2015,8(10):2066-2075.
[4]Ding Xiangli,Zhang Hui,Wang Li,et al. Effect of barley antifreeze protein on thermal properties and water state of dough during freezing and freeze-thaw cycles[J]. Food Hydrocolloids,2015,47(5):32-40.
[5]Olijve L.L.,Meister K.,DeVries A.L.,et al. Blocking rapid ice crystal growth through nonbasal plane adsorption of antifreeze proteins[J]. Proceedings of the National Academy of Sciences,2016,113(14):3740-3745.
[6]焦宇知,翟瑋瑋. 低溫脅迫小麥苗在小麥苗汁冰淇淋中的應用[J].食品科學,2014,35(12):249-253.
[7]Regend A,Goff H D. Ice Recrystallization inhibition in ice cream as affected by ice structuring proteins from winter wheat grass[J]. Journal of Dairy Science,2006(89):49-57.
[8]Gupta R,Deswal R. Low temperature stress modulated secretome analysis and purification of antifreeze protein from Hippophae rhamnoides,a Himalayan wonder plant[J]. Journal of Proteome Research,2012,11(5):2684-96.
[9]Gupta R,Deswal R. Antifreeze protein from freeze-tolerant grass has a beta-roll fold with an irregularly structured ice-binding site[J]. Journal of Molecular Biology,2012,416(5):713-724.
[10]Deng Longqun,YuHaoqiang,Liu Yanping,et al. Heterologous expression of antifreeze protein gene AnAFP from Ammopiptanthus nanus enhances cold tolerance in Escherichia coli and tobacco[J]. Gene,2014,539(1):132-140.
[11]鞏子路,田童童,張建,等. 白斑狗魚魚肉中抗凍蛋白的分離純化[J].中國釀造,2015,34(2):120-125.
[12]MAO Xianfang,LIU Zhongyuan,MA Ji,et al. Characterization of a novelβ-helix antifreeze protein from the desert beetle Anatolica polita[J]. Cryobiology,2011,62(2):91-99.
[13]丁香麗. 大麥籽粒抗凍蛋白的制備及抗凍機制的研究[D].無錫:江南大學,2015:1 28-32.
[14]Kuiper M.J.,Lankin C.,Gauthier S.Y.,et al. Purification of antifreeze proteins by adsorption to ice[J]. Biochemical and Biophysical Research Communications,2003,30(3):645-648.
[15]Gupta R.,Deswal R. Low temperature stress modulated secretome analysis and purification of antifreeze protein from Hippophae rhamnoides,a Himalayan wonder plant[J]. Journal of Proteome Research,2012,11(5):2684-2696.
[16]Brown J.R.,Seymour J.D.,Brox. T.I.,et al. Recrystallization inhibition in ice due to ice binding protein activity detected by nuclear magnetic resonance[J]. Biotechnology Reports,2014,3:60-64.
[17]Becker J S,Thomas O R T,Franzreb M. Protein separation with magnetic adsorbents in micellar aqueous two-phase systems[J]. Separation and Purification Technology,2009,65(1):46-53.
[18]陳亮亮,王達,張大偉,等.昆蟲抗凍蛋白轉基因植物表達載體的構建及轉基因棉花T1代的檢測[J]. 新疆農業科學,2012,49(10):1779-1786.
[19]Ding Xiangli,Zhang Hui,ChenHaiying.,et al. Extraction,purification and identification of antifreeze proteins from cold acclimated malting barley(HordeumvulgareL.).[J]. Food Chemistry,2015,175(5):74-81.
[20]Gupta R.,Deswal R. Refolding ofβ-stranded class I chitinases of Hippophae rhamnoides enhances the antifreeze activity during cold acclimation[J]. Plos One,2014,9(3):e91723.
[21]Ding Xiangli,Zhang Hui,Chen Haiying,et al. Extraction,purification and identification of antifreeze proteins from cold acclimated malting barley (HordeumvulgareL.)[J]. Food Chemistry,2015,175(5):74-81.
[22]徐化能,馬淑鳳,張連富. 植物抗凍蛋白分離純化方法的研究進展[J].食品與生物技術學報,2013,32(4):347-352.
[23]Regend A,Goff H D. Freezing and ice recrystallization properties of sucrose solutions containing ice structuring proteins from cold-acclimated winter wheat grass extract[J],Journal of Food Science,2005(70):552-556.
[24]王維香,魏令波,張虎. 沙冬青熱穩定抗凍蛋白的分離純化及其部分性質研究[J],四川大學學報:自然科學版,2007,44(4):912-917.
[25]金周筠,劉寶林. 小麥麩皮抗凍蛋白的純化及理化性質的研究[J],食品工業科技,2015,36(20):159-164.
[26]徐化能,黃衛寧,陳海英(江南大學). 一種植物冰結構蛋白的分離純化方法[P].中國:200910033924.0,2009.5.27.
[27]張超,趙曉燕,馬越,等. 使用差示掃描量熱儀測定抗凍蛋白熱滯活性方法的研究[J]. 生物物理學報,2008,24(6):465-473.
[28]Weiser C J. Cold resistance and injury in woody plants:knowledge of hardy plant adaptations to freezing stress may help us to reduce winter damage.[J]. Science,1970,169(3952):1269-1278.
[29]楊剛,史鵬輝,孫萬倉,等. 白菜型冬油菜質外體抗凍蛋白研究[J]. 中國生態農業學報,2016,24(2):210-217.
[30]Kazuoka T.,Oeda K.. Heat stable COR(cold-regulated)proteins associated with freezing tolerance in spinach[J]. Plant and Cell Physiology,1992,33(8):1107-1114.
[31]Houde M.,Danyluk J.,Laliberté J.F.,et al. Cloning,characterization,and expression of a cDNA encoding a 50-kilodalton protein specifically induced by cold acclimation in wheat[J]. Plant Physiology,1992,99(4):1381-1387.
[32]Jia Chunli,Huang Weining,Wu Chao,et al. Characterization and yeast cryoprotective performance for thermostable ice-structuring proteins from Chinese Privet(LigustrumVulgare)leaves[J]. Food Research International,2012,49(1):280-284.
[33]張暉,張艷杰,王立,等. 抗凍蛋白在食品工業中的應用現狀及前景[J]. 食品與生物技術學報,2012,31(9):897-903.
[34]郭麗紅,仝向榮,王德斌,等. 小麥幼苗抗凍蛋白的分離及其抗氧化活性的研究[J]. 昆明師范高等專科學校學報,2006,28(4):71-74.
Studies on purification of ice structuring protein from cold-acclimated wheat seedlings
JIAO Yu-zhi1,2,XU Tao1,LIANG Jia-bing3,ZHU Yun1,HE Zhi-yong4,ZHANG Xiao-xiao1,LIU Yong-bo5,SUN Zhi-yang1,ZHAI Wei-wei1
(1.Jiangsu Food & Pharmaceutical Science College,Huai’an 223005,China;2.Purdue University,West Lafayette,IN,USA,47907;3.Civil Hospital of Juxian,Juxian 276511,China;4.Jiangnan University,Wuxi 214122,China;5.Chaoneng Freda Bio Co. Ltd.,Jinan 250031,China)
To investigate purification of ice structuring protein(ISP)from cold-acclimated wheat seedlings,wheat seedlings underwent cold acclimation and ISP from cold-acclimated wheat seedlings was purified by 4 sequential steps including coarse separation,saturated ammonium sulphate precipitation,DEAE-Cellulose 52 chromatography and sephadex-G75 gel filtration chromatography. Differential scanning calorimetry(DSC),heat shock treatments and polyacrylamide gel electro-phoresis(SDS-PAGE)were employed respectively for determination of thermal hysteresis activity(THA),ice recrystallization inhibition power(ICP)and molecular weight(MW)of ISPs during process of purification. Survival rate of cold-acclimated wheat seedlings and purification times of ISP during each purification step were calculated as well. Results showed an increase of 240% in survival rate of wheat seedlings using gradient cold-acclimation compared with constant cold-acclimation. Protein content of cold-acclimated wheat seedlings extract(AWSE)was increased by 7.8% in comparison to non-cold-acclimated wheat seedlings extract(NAWSE). Eventual purification times based on THA and ICP were 451.15 and 137.60 respectively. Yield,THA at 5 mg/mL,ICP and MW range of ISP were 2.85%,0.180 ℃,70.03% and 20.1~31.0 ku respectively. Maximal ICP of ISP was achieved at lower concentration compared with THA. Wheat seedlings can be a potential plant resource in production of ISP.
wheat seedlings;cold-acclimation;ISP;THA;ICP
2016-09-29
焦宇知(1979-),男,碩士,副教授,研究方向:植物功能因子開發,E-mail:ningmen3749574@163.com。
淮安市產學研協同創新計劃(HAC2015006);江蘇省“青藍工程”中青年學術帶頭人計劃(蘇教師(2014)23號);淮安市食品技術研究院(HAP201301);江蘇省首批高校優秀中青年教師境外研修計劃(蘇教師[2011]34號);企業委托橫向項目(蘇食院合字(2015)432號)。
TS229
A
:1002-0306(2017)03-0102-06
10.13386/j.issn1002-0306.2017.03.011

