廣西巴馬小型豬PERV-env基因克隆及其組織表達譜分析
鐘 華,潘漢世,馬 玲,龍 寒,陳鳳蓮,廖艷娟,唐海波,吳健敏
(1. 廣西民族大學海洋與生物技術學院,南寧,廣西 530006; 2. 廣西獸醫研究所 廣西獸醫生物技術重點實驗室, 南寧,廣西 530001)
研究報告
廣西巴馬小型豬PERV-env基因克隆及其組織表達譜分析
鐘 華1,潘漢世2,馬 玲2,龍 寒1,陳鳳蓮2,廖艷娟1,唐海波2,吳健敏2
(1. 廣西民族大學海洋與生物技術學院,南寧,廣西 530006; 2. 廣西獸醫研究所 廣西獸醫生物技術重點實驗室, 南寧,廣西 530001)
目的 克隆廣西巴馬小型豬PERV-env部分基因,并研究其在不同組織中的表達差異。方法 利用RT-PCR方法從巴馬小型豬外周血白細胞中擴增PERV-env基因,并與部分國內外已發表的PERV-env 基因序列進行同源性及遺傳進化分析。以擴增獲得的廣西巴馬小型豬PERV-env基因為模板設計引物,利用半定量RT-PCR的方法對廣西巴馬小型豬不同組織中PERV mRNA表達情況進行分析。結果 在所檢測的9個組織樣品中PERV mRNA相對表達水平存在差異,腎及外周血淋巴細胞中PERV mRNA豐度最高,肺、心、肝、脾、胸腺、卵巢次之,且表達豐度差異不顯著(P>0.05),胰腺PERV mRNA表達豐度最低。結論 以巴馬小型豬胰島細胞進行異種移植發生PERV感染的潛在危險性可能要低于其它器官,但仍需進一步研究證實。
巴馬小型豬;PERV-env基因;半定量RT-PCR;組織表達譜
廣西巴馬小型豬具有遺傳性能穩定,遺傳相似性及近交系數高等優點,是國家重點扶持發展的小型豬種之一。目前在醫學及生物學方面的應用涉及到腫瘤、心血管病、糖尿病、皮膚燒傷、血液病、遺傳病、營養代謝病、新藥評價等等。它不僅是發展高級醫學實驗用豬的優良品系,同時也有望成為異種移植的最佳供體之一。
自從豬內源性反轉錄病毒(Porcine endogenous retrovirus,PERV)被認為在豬—人異種移植中存在潛在危險以來,有關PERV病原安全性問題成為研究的熱點[1]。PERV基因組結構由5′、3′非編碼區及gag、pol、env 3個編碼基因組成,它能夠以前病毒DNA形式整合進豬細胞基因組中,并隨細胞染色體復制而復制。PERV-env基因編碼病毒的囊膜蛋白(Env蛋白), 由貫穿病毒囊膜的穿膜(transmembrane,TM)蛋白及暴露于囊膜表面的表面蛋白(surface glycoprotein,SU)組成。SU有許多糖基化位點,不但具有受體結合的功能,與PERV A、B、C亞型的分類、細胞的嗜性、宿主感染范圍等相關,還具有誘導宿主產生中和抗體的作用,同時還非常容易變異[2]。而TM蛋白則相對保守,參與感染過程中病毒與宿主細胞膜的融合,因此Env蛋白一直是PERV研究的重點。
本試驗通過RT-PCR技術從巴馬小型豬外周血淋巴細胞中克隆PERV-env基因,并以巴馬小型豬PERV-env基因中TM蛋白編碼區為模板設計引物,應用半定量RT-PCR方法對巴馬小型豬各個組織中PERV-env基因的mRNA豐度進行檢測,以了解廣西巴馬小型豬各組織器官中PERV的表達情況,為臨床異種移植選擇低拷貝負載的豬器官、組織或細胞提供依據,同時也為進一步開展異種移植的安全性評估打下基礎。
1 材料和方法
1.1 檢測樣品
6月齡的巴馬小型豬3頭,由廣西大學巴馬小型豬封閉養殖場提供[SCXK桂2013-0003]。實驗在廣西麗原生物股份有限公司實驗動物中心內進行[SYXK桂2012-0002],所有的操作必須遵守實驗動物中心的規章制度和操作規程(SOP)進行。豬宰殺后迅速采集肺、心、肝、腎、脾、胰、胸腺、卵巢、外周血,液氮速凍,-80℃冰箱保存,用于總RNA的提取。
1.2 工具酶及試劑
M-MLV反轉錄酶、Pyrobest Taq DNA聚合酶、pGEM-T載體、瓊脂糖等購自Promega公司,Trizol試劑為Invitrogen公司產品,BioredTM全血基因組DNA小量純化試劑盒、DNA marker DL2000購自大連寶生物公司(TaKaRa),E.coliDH 5α為本室保存。
1.3 基因的選擇及引物設計
根據 Genbank已發表的PERV核苷酸序列(登錄號:AJ133817),設計一對引物,用于擴增PERV-env全基因。此外,由于PERV有A、B、C三種亞型,其分型主要由Env蛋白中的SU蛋白的差異來決定[2],因此本試驗以擴增獲得的巴馬小型豬PERV-env基因為模板,選擇避開SU蛋白編碼區,以相對保守的TM蛋白編碼區設計引物,擴增PERV-env部分基因作為檢測PERV表達譜的待測目的基因。同時以管家基因(house-keeping genes)β肌動蛋白(β-actin)為內參基因。β-actin是細胞的一種重要骨架蛋白,在不同物種之間高度保守。因此在進行半定量RT-PCR時,選擇管家基因可以通過計算目的基因和內參的比值,得到基因表達的相對濃度。根據Genebank已發表的β-actin基因序列(登錄號:U07786)設計引物,引物序列見表1。
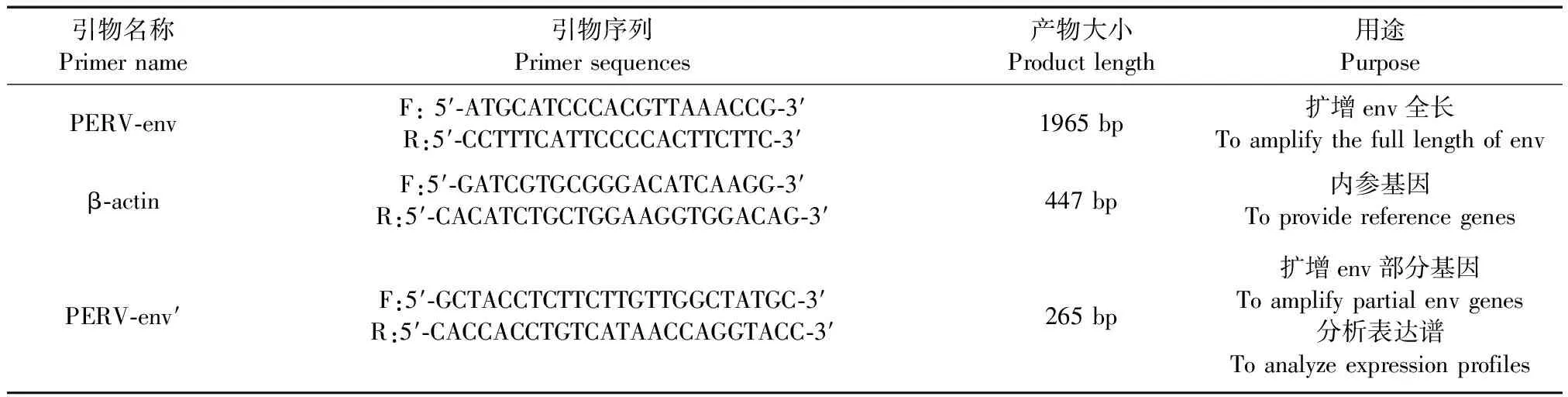
表1 PERV-env基因和β-actin基因引物序列
1.4 RNA的制備及含量測定
總RNA的制備:按Trizol 試劑盒說明書進行操作,提取巴馬小型豬各種組織及外周血白細胞的總RNA,取5 μL按一定的倍數稀釋,以紫外分光光度計檢測總RNA純度并進行RNA含量的測定。總RNA含量計算方法:(A260× 核酸稀釋倍數 × 40)/1000,單位為 μg/μL。提取的總RNA儲存于-80℃備用。
1.5 cDNA的合成
分別取巴馬小型豬各個組織提取的總RNA 2 μg,分別加到1.5 mL EP管中,然后各加1 μL的Olige(dT)17(50 pmol/μL)混勻,再加無RNA酶水至15 μL,于PCR儀中70℃ 變性5 min后,迅速冰浴2 min。短暫離心后再加入5× buffer 5 μL、dNTP (2.5 mmol/L) 4 μL、RNasin 0.5 μL、M-MULV 0.5 μL。于PCR儀中42℃作用 1 h 后,70℃15 min滅活反轉錄酶。再加入1μL RNase H (2U/μL) 37℃消化20 min,立即使用或-20℃保存備用。
1.6 PCR擴增
1.6.1 PERV-env全基因擴增及分析: 參照文獻[3]的方法,利用PERV-env全基因引物,從巴馬小型豬外周血白細胞中擴增PERV-env全基因。具體擴增條件為:94℃ 5 min,94℃30 s、56℃ 30 s、72℃ 2 min循環35次,最后72℃延伸10 min。擴增產物經克隆后送北京奧科生物有限公司測序。測序結果登錄GenBank并與國內外已發表的PERV-env 全基因序列進行同源性及遺傳進化分析。
1.6.2 PERV-env部分基因及β-actin基因的擴增:
1.6.2.1 PCR反應條件:PERV-env部分基因與β-actin基因PCR反應條件為: 0.5 μL cDNA模板,0.25 μL Taq酶,上、下游引物各0.25 μL(50 pmol),dNTP (2.5 mmol/L each) 1 μL,10× PCR buffer 2.5 μL,MgCl2(25 mmol/L) 1.5 μL,最后加無RNA酶水至25 μL。將上述各成分置PCR 管混勻后于PCR儀上進行反應,反應程序: 94℃ 4 min; 94℃ 30 s,退火溫度45 s(溫度待定),72℃ 30 s;72℃ 5 min。PCR產物以1.0%瓊脂糖凝膠電泳檢測。
1.6.2.2 最佳Mg2+濃度的確定:在其它條件相同的情況下,觀察Mg2 +終濃度在1.0、1.25、1.5、1.75、2.0 mmol/L 的情況下,PCR擴增結果。根據其亮度和特異性,確定適宜的MgCl2濃度。
1.6.2.3 PCR擴增最佳循環數的確定:循環次數決定PCR擴增程度。在其它條件相同的情況下,觀察PERV-env部分基因在循環數為:26、28、30、32、34;β-actin基因在循環數為22、24、26、28、30時PCR 擴增結果。根據其亮度確定適宜的PCR擴增循環數。
1.7 電泳圖片的獲得和定量分析
將PCR產物按常規方法電泳,經凝膠成像儀拍照后,用定量分析軟件UN-SCAN-IT分別測定目的基因片段OD值和內參β-actin基因片段A值。以待測目的基因片段實測A值/β-actin基因片段實測A值的比值,代表目的基因片段mRNA的相對含量。每個反應重復3次,然后用SAS軟件對數據進行統計分析。
目的基因mRNA相對含量=
2 結果
2.1 PERV-env全基因擴增及分析結果
通過RT-PCR從巴馬小型豬外周血白細胞中擴增得到長度約2 000 bp的片段,將該片段克隆、測序,結果獲得的廣西巴馬小型豬PERV-env全長基因大小為1 983 bp,編碼660 aa,GenBank登錄號為:EU086225。將該毒株序列與國外AF417232(美國)、AY534306(德國)、EU789636(俄國)、LC03396(日本)、HQ540591(韓國)、AJ288588(法國)、AF014162(英國)及國內AY751803(中國版納小型豬)、AF507940(中國實驗小型豬)、AY850198(中國五指山小型豬)進行同源性比較,結果同源性在75.7-99.3之間,與法國毒株同源性最低,與中國實驗小型豬及韓國毒株同源性最高,與國內五指山豬PERV及版納豬PERV的同源性分別為96.2和95.4。遺傳進化分析亦可看出巴馬小型豬PERV與中國實驗小型豬及韓國毒株位于同一簇(圖1)。由此看出要想較準確的測定廣西巴馬小型豬PERV組織表達譜,應該選用來自廣西巴馬小型豬PERV-env基因序列設計引物。
2.2 半定量RT-PCR反應條件的篩選
2.2.1 內參基因β-actin及目的基因PERV-env退火溫度的確定 :β-actin基因擴增片段大小為447 bp,經測序證實擴增得到的基因序列與參考序列同源性為99%。按方法1.6.2.1,選擇了58℃、60℃、62℃、64℃等4個退火溫度,經PCR反應后,通過測定目的片段的凈灰度,確定其最佳退火溫度為64℃(圖2A)。按同樣的方法,PERV-env部分基因PCR擴增片段大小約265 bp,通過測定目的片段的凈灰度,確定其最佳退火溫度為58℃(圖2B)。
2.2.2 Mg2+濃度對PERV-env部分基因和β-actin擴增效率的影響 :擴增結果顯示:PERV-env部分基因和β-actin基因在Mg2+濃度為1.0、1.25、1.5和2.0 mmol/L時PCR擴增效率均過低,只有在1.75 mmol/L 時PCR的特異性和擴增效率良好(圖3 A;B)。
2.2.3 PCR擴增循環數對PERV-env部分基因和β-actin擴增產物的影響:試驗結果顯示目的基因PERV-env和內參β-actin PCR產物量均隨著PCR循環數的增加而增強(圖4A,B),說明PCR反應均未達到反應的平臺期。為避免平臺效應的影響,選擇擴增反應在到達平臺期前的線性范圍內且電泳條帶清晰的相應循環數作為PCR反應最佳循環數。

圖1 巴馬小型豬PERV-env基因遺傳進化樹分析Fig.1 Phylogentic analysis of PERV-env genes in the Bama minipigs
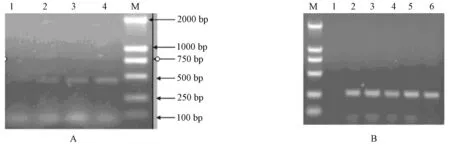
A:β-actin基因; B: PERV-env部分基因圖A泳道:1. 58℃;2. 60℃;3. 62℃;4. 64℃;M. DL-2000 DNA marker圖B泳道:M. DL-2000 DNA marker;1. 54℃;2. 56℃;3. 58℃;4. 60℃;5. 62℃,6. 64℃圖2 不同退火溫度下β-actin基因及PERV-env部分基因擴增結果A:β-actin:1. 58℃;2. 60℃;3. 62℃;4. 64℃;M. DL-2000 DNA marker.B:PERV-env:M. DL-2000 DNA marker;1. 54℃;2. 56℃;3. 58℃;4. 60℃;5. 62℃;6. 64℃.Fig.2 Amplification products of β-actin and PERV-env at different annealing temperatures

A:PERV-env部分基因;B:β-actin基因圖A、圖B泳道(相同):1. 1.0 mmol/L;2. 1.25 mmol/L;3. 1.5 mmol/L;4. 1.75 mmol/L;5. 2.0 mmol/L圖3 不同Mg2+濃度對PERV-env部分基因和 β-actin基因擴增效率的分析Note. A:PERV-env; B:β-actin. 1. 1.0 mmol/L; 2. 1.25 mmol/L; 3. 1.5 mmol/L; 4. 1.75 mmol/L; 5. 2.0 mmol/L.Fig.3 Analysis of amplification efficiency of PERV-env and β-actin with different Mg2+ concentration
本試驗選取30個循環作為待測PERV-env基因的最佳循環數;而選取28個循環為內參β-actin基因最佳循環數。
2.3 以β-actin為內參對PERV-env部分基因定量測定
以β-actin為內參,采用雙管法對不同組織樣品進行半定量RT-PCR分析,分別測定各自PCR產物電泳條帶的OD值,每個反應重復3次取均值,經計算各個組織mRNA相對含量分別為:肝臟:0.85;心臟:0.90;胰腺:0.70;腎臟:1.31;脾臟:0.89;胸腺:0.86;肺:0.85;卵巢:0.84;外周血:1.28。以SAS軟件統計分析結果表明PERV-env在mRNA上述組織中均有表達,但在不同組織中表達存在明顯差異,腎臟和外周血白細胞表達豐度最高(P<0.05),胰腺的表達豐度最低,其它組織表達豐度差異無顯著性(P>0.05)。
3 討論
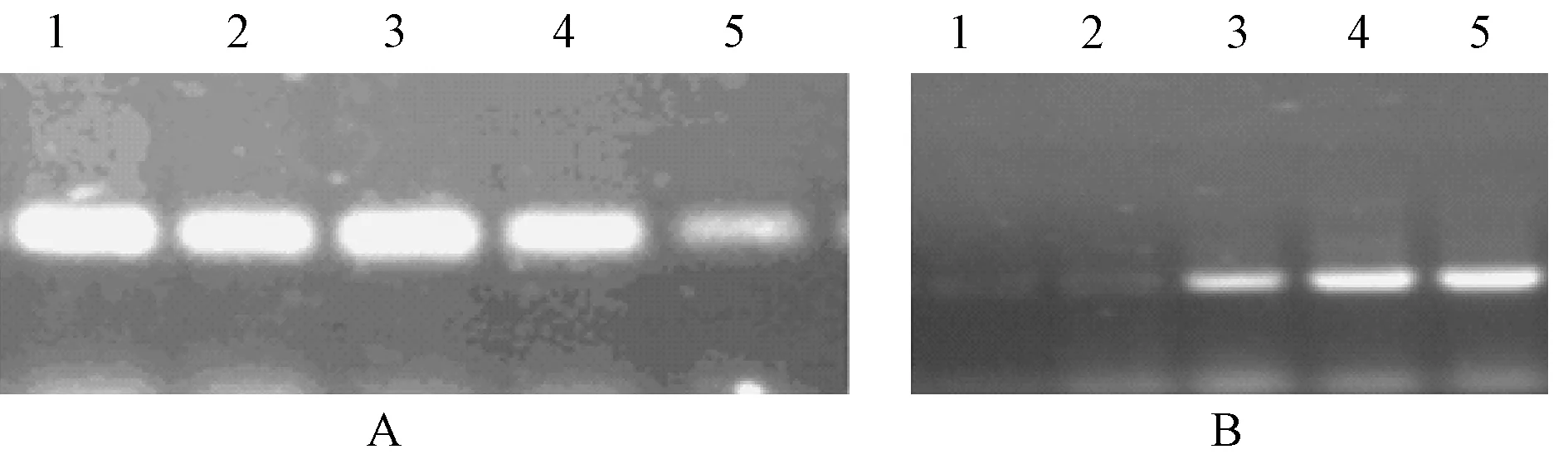
A:PERV-env部分基因;B:β-actin基因圖A泳道:1. 34循環;2. 32循環;3. 30循環;4. 28循環;5. 26循環圖B泳道:1. 22循環;2. 24循環;3. 26循環;4. 28循環;5. 30循環圖4 不同循環數對PERV-env部分基因及 β-actin擴增效率影響Note. A:PERV-env:1. 34 cycles; 2. 32 cycles; 3. 30 cycles; 4. 28 cycles; 5. 26 cycles.B:β-actin:1. 22 cycles; 2. 24 cycles; 3. 26 cycles; 4. 28 cycles ; 5. 30 cycles.Fig.4 Effects of different cycles on the amplification efficiency of PERV-env partial gene and β-actin.
目前用于定量分析mRNA表達量主要方法有:半定量RT-PCR、Northern印跡雜交、cDNA微陣列和寡聚核苷酸微陣列技術以及目前發展迅速的實時熒光定量PCR等。后幾種方法特異性好、具有較高的敏感性和準確性,但是成本高,對儀器設備和樣品處理要求高且步驟繁瑣。半定量RT-PCR以其簡單、快速、方便、可同時測定幾個基因且所需費用低、普通實驗室均可開展等優點而被廣泛應用。但利用半定量RT-PCR法分析基因表達水平的影響因素較多,要提高半定量RT-PCR法的準確性,最關鍵的是優化試驗條件。首先必須選擇一個表達穩定的基因作為參照,如常用的有GAPDH、β-actin、18S等;其次所提的mRNA純度要高,完整性要好并達到一定的濃度,以紫外分光光度計測定,其吸光度值A260/A280在1.8~2.0 時,符合實驗要求。在優化試驗條件中,選擇合適的循環數是PCR 半定量方法的關鍵因素,但它必須在指數內進行PCR擴增,保證產物與循環數呈線性關系。此外合適的退火溫度與Mg2+濃度也會對試驗結果造成影響。
自從發現PERV對異種移植存在潛在的病毒生物安全性以來,尋找無PERV或低拷貝PERV的小型豬,開展小型豬中內源性反轉錄病毒的存在狀況調查及其潛在的危害性的研究一直是研究的熱點[4-6]。目前的研究發現PERV在不同的豬種之間負載不平衡,不同豬種攜帶PERV亞型也不盡相同[7,8]。雖然PERV在腎、肝、脾、肺、胸腺、胰腺、卵巢、腦神經、外周血白細胞及內皮細胞等組織均有表達,但表達的拷貝數有差異。靳二輝[9]采用RT-PCR技術對近交系五指山小型豬15種組織內PERV的表達情況進行了檢測,發現PERV在心臟、肝臟、腎臟表達較弱,在免疫組織表達較強。因此檢測PERV mRNA在不同豬種、不同組織中的表達情況對醫學實驗用豬的挑選及豬—人異種器官移植均具有重要意義。在進行豬—人異種移植時,可以選用病毒負載較低組織作為供體,可以降低異體移植潛在的危險性。
本試驗采用半定量RT-PCR方法,首次對PERV-env mRNA在巴馬小型豬各個組織中表達量進行測定。結果發現在所采集的十個組織樣品中均可以檢測到PERV-env mRNA的表達。SAS軟件統計分析結果表明,腎、外周血白細胞中PERV表達豐度最高,肺、心、肝、脾、胸腺、卵巢次之,胰腺中PERV表達豐度最低。肺、心、肝、脾、胸腺、卵巢表達豐度差異不顯著(P>0.05),這與國內外的研究結果基本一致[10,11]。
關于選擇PERV低拷貝豬及PERV表達豐度較低的器官進行異種移植,以降低其潛在的危害性問題學者們進行了大量研究。Patience 等[1]在1997年首先提出PERV5′端或部分結構基因的缺失會造成部分拷貝失去轉錄活性和功能,因此并不是所有的拷貝都具有感染活性。然而,PERV各基因可以通過互補或重組產生具有生物活性的病毒顆粒,因此可以通過選擇性育種降PERV的拷貝數以達到降低異種移植風險的目的。Clemenceau等[10]在1999年通過試驗發現,豬胰島細胞和腦神經細胞所含PERV前病毒的負荷相對較低,認為進行豬胰島細胞和腦神經細胞異種移植發生PERV感染的潛在危險性可能要比移植豬腎、肝等器官要小。最近,國際異種器官移植協會發表了一份聯合聲明,啟動在上個世紀九十年代被停止的豬胰島產品在1型糖尿病治療方面的臨床試驗, 重新評價胰島在異種移植方面的安全性[12]。總之,在未來的5到10年,在適當的指導和監管控制下,豬的胰島異種移植材料被認為是一種可行的手段,解決臨床上胰島遠遠不能滿足需求的問題[13]。本研究發現巴馬小型豬胰腺中PERV表達豐度最低,可初步認為以巴馬小型豬胰島細胞進行異種移植發生PERV感染的潛在危險性可能要低于其它器官。由于本實驗所用動物個體數量有限,只得出了初步的結論,還需要做更多細致的工作。
[1] Patience C, Takeuchi Y, Weiss RA. Infection of human cells by an endogenous retrovirus of pigs [J]. Nat Med, 1997, 3(3): 282-286.
[2] Takeuchi Y, Patience C, Magre S, et al. Host range and interference studies of three classes of pig endogenous retrovirus [J]. J Virol, 1998, 72: 9986-9991.
[3] 吳健敏,呂茂民,陳鳳蓮,等.中國特有小型豬內源性反轉錄病毒囊膜基因的克隆及進化分析 [J].中國人獸共患病學報, 2006, 22 (10): 925-928.
[4] Ma Y, Yang Y, Lv M, et al. Real-time quantitative polymerase chain reaction with SYBR green I detection for estimating copy numbers of porcine endogenous retrovirus from Chinese miniature pigs [J].Transplant Proc, 2008, 28(3): 160-163.
[5] 李金澤, 岳敏, 張建明,等. 四種小型豬內源性逆轉錄病毒基因研究 [J]. 實驗動物與比較醫學, 2008, 28(3): 160-163.
[6] 連正興, C. Rogel-Gaillard, 李寧, 等. 利用半定量PCR方法分析中國地方豬種內源病毒序列拷貝數的多態性 [J]. 畜牧獸醫學報, 2002, 33(6): 521-524.
[7] Heneine W, Tibell A, Switzer WM, et al. No evidence of infection with porcine endogenous retrovirus in recipients of porcine islet-cell xenografts [J]. Lancet, 1998, 352(9129): 695-699.
[8] Blusch JH, Roos C, Nitschko H. A polymerase chain reaction-based protocol for the detection of transmission of pig endogenous retroviruses in pig to human xenotransplantation [J]. Transplantation, 2000, 69(10): 2167-2172.
[9] 靳二輝. 近交系五指山小型豬解剖和組織學研究及內源性反轉錄病毒(PERV)的檢測 [D]. 華中農業大學, 2008.
[10] Clemenceau B, Lalain S, Martignat L, et al. Porcine endogenous retroviral mRNA in pancreas and a panel of tissues from specific pathogen free pig [J]. Diabetes Metab,1999, 25(6): 518-525.
[11] 丁生財,陳意生,魏私,等. PERV在豬外周血白細胞DNA和組織mRNA中的表達及其差異性分析 [J]. 實驗生物學報,2004, 37(5): 351-358.
[12] Matsumoto S,Tomiya M, Sawamoto O. Current status and future of clinical islet xenotransplantation [J]. J Diabetes. 2016, 10: 1753-0407.
[13] Spizzo T, Denner J, Gazda L, et al. First update of the International Xenotransplantation Association consensus statement on conditions for undertaking clinical trials of porcine islet products in type 1 diabetes — Chapter 2a: source pigs-preventing xenozoonoses [J]. Xenotransplantation, 2016, 23(1): 25-31.
Cloning of PERV-env in GXBM minipig and analysis of its tissue expression profile
ZHONG Hua1,PAN Han-shi2,MA Ling2, LONG Han1, CHEN Feng-lian2, LIAO Yan-juan1, TANG Hai-bo2, WU Jian-min2
(School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning 53001, China; 2. Guangxi Key Laboratory of Veterinary Biotechnology, Guangxi Veterinary Research Institute, Nanning 53001 )
Objective To clone partial env genes of porcine endogenous retrovirus (PERV) isolated from Guangxi Bama minipigs and study their expression differences in different organ tissues. Method The PERV-env genes from peripheral blood leukocytes of Bama minipigs were amplified by RT-PCR, and their homology and phylogenetic analysis were compared with those of some other PERV-env genes published home and abroad. The PERV-env genes obtained by amplification from Bama minipig were used as templates to design primers for analysis on the expressions of PERV mRNA in different tissues of the Bama minipig with a semi-quantitative RT-PCR analysis. Result Differences in the expression levels of PERV mRNA were detected in nine organ tissues of Bama minipig, in which the abundance of PERV mRNA in kidney and peripheral blood lymphocytes was the highest, followed by that in lung, heart, liver, spleen, thymus and ovary, but the expression differences among the six organs were not significant (P>0.05), while the expression abundance of PERV mRNA in pancreas was the lowest. Conclusions The potential risk of PERV infection in using the islet cells of Bama mini pig for xenotransplantation is probably lower than using the other organs. However, further research is still needed.
Bama minipig; PERV-env genes; Semi-quantitative RT-PCR; Tissue expression profile; Xenotransplantation
國家自然科學基金(31260613);廣西自然科學基金(2013GXNSFBA019123); 廣西獸醫生物技術重點實驗室開放基金(12-071-28-B-3)。
鐘華(1981-),女,碩士,助理研究員,研究方向:生物化學與分子生物學。Email: 17737290@qq.com。
吳健敏(1963-),女,研究員,博士生導師,研究生方向:動物傳染病與分子免疫學。E-mail: wu-jm20@163.com。
R-33
A
1671-7856(2017) 02-0001-06
10.3969.j.issn.1671-7856. 2017.02.001
2016-08-05

