復方苦參注射液聯合含奧沙利鉑化療方案治療大腸癌療效與安全性的系統評價
吳駐林,譚婉君,連寶濤,彭立生#(.廣州中醫藥大學第四臨床醫學院/深圳市中醫院,廣東深圳 58033;.廣州中醫藥大學第二臨床醫學院,廣州 50405)
復方苦參注射液聯合含奧沙利鉑化療方案治療大腸癌療效與安全性的系統評價
吳駐林1*,譚婉君1,連寶濤2,彭立生1#(1.廣州中醫藥大學第四臨床醫學院/深圳市中醫院,廣東深圳 518033;2.廣州中醫藥大學第二臨床醫學院,廣州 510405)
目的:系統評價復方苦參注射液聯合含奧沙利鉑化療方案治療大腸癌的療效和安全性,為臨床提供循證參考。方法:計算機檢索中國期刊全文數據庫、萬方數據庫、中國生物醫學文獻數據庫、中文科技期刊數據庫、PubMed、Cochrane圖書館,收集復方苦參注射液聯合含奧沙利鉑化療方案(試驗組)對比常規化療方案(對照組)治療大腸癌的隨機對照試驗(RCT),提取資料并依據改良的Jadad量表進行質量評價后,采用Rev Man 5.3統計軟件進行Meta分析。結果:最終納入33項RCT,合計2 801例患者。Meta分析結果顯示,試驗組患者近期有效率[RR=1.34,95%CI(1.24,1.46),P<0.001]、功能狀態(KPS)評分改善率[RR=1.87,95%CI(1.65,2.14),P<0.001]、CD4+/CD8+[WMD=0.49,95%CI(0.26,0.72),P<0.001]、CD4+水平[WMD=10.34,95%CI(7.00,13.69),P<0.001]、CD3+水平[WMD=5.85,95%CI(4.07,7.62),P<0.001]、自然殺傷細胞水平[WMD=3.52,95%CI(1.76,5.27),P<0.001]、白細胞介素(IL)-2水平[WMD=12.96,95%CI(10.39,15.53),P<0.001]顯著高于對照組,CD8+水平[WMD=—5.89,95%CI(—11.39,—0.40),P=0.04]、IL-10水平[WMD=—21.04,95%CI(—29.15,—12.94),P<0.001]、惡心嘔吐發生率[RR=0.72,95%CI(0.67,0.78),P<0.001]、白細胞減少發生率[RR=0.52,95%CI(0.45,0.61),P<0.001]、肝功能異常發生率[RR=0.63,95%CI(0.53,0.74),P<0.001]、周圍神經毒性發生率[RR=0.77,95%CI(0.64,0.92),P=0.005]顯著低于對照組,差異均有統計學意義。結論:復方苦參注射液聯合含奧沙利鉑化療方案治療大腸癌療效優于單純化療,可以提高患者生存質量,改善免疫功能,降低化療引起的不良反應。
復方苦參注射液;化療;大腸癌;系統評價;療效;安全性
隨著生活與飲食方式的改變,我國大腸癌(Colorectal cancer,CRC)發病率逐年上升,多數患者就診時已為中晚期。CRC包括結腸癌和直腸癌,位居我國癌癥死亡第5位[1]。化療是目前CRC的主要治療手段之一。隨著20世紀90年代奧沙利鉑(Oxaliplatin)等化療藥物的出現,晚期CRC患者的生存率得到一定提高。奧沙利鉑是第3代鉑類抗癌藥,目前為CRC輔助和姑息化療的主要藥物,具有抑制腫瘤細胞的DNA復制、轉錄,誘導腫瘤細胞內的免疫反應等作用[2];但含奧沙利鉑的多周期聯合化療方案毒性較大,化療嚴重毒副反應常導致化療終止,這在很大程度上限制了化療的應用。因此,尋求高效低毒的抗CRC聯合用藥一直是臨床研究的熱點。
復方苦參注射液是含有苦參堿、氧化苦參堿等多種生物堿的中藥注射液,有研究表明其具有減少化療毒性、提高抗腫瘤療效的作用[3]。已有多項研究報道了復方苦參注射液聯合含奧沙利鉑化療方案治療CRC的療效和安全性,但各研究樣本量較小,確切療效缺乏大樣本、多中心臨床試驗的證據支持,所得結論參考價值有限。因此,本研究采用Meta分析的方法系統評價了復方苦參注射液聯合含奧沙利鉑化療方案治療CRC的療效和安全性,以期為臨床提供循證依據。
1 資料與方法
1.1 納入與排除標準
1.1.1 研究類型 國內外公開發表的隨機對照試驗(RCT),無論是否使用盲法,語種限定為中文和英文。
1.1.2 研究對象 納入符合《中國結直腸癌診療規范(2015版)》[4]診斷標準的患者,包括結腸癌、直腸癌。患者年齡、性別不限。
1.1.3 干預措施 對照組患者給予奧沙利鉑、氟尿嘧啶、亞葉酸鈣組成的各類FOLFOX化療方案[4];試驗組患者在對照組治療基礎上給予復方苦參注射液12~30 mL,靜脈滴注,每日1次。
1.1.4 結局指標和療效評價標準 療效指標——①近期有效率:按照世界衛生組織(WHO)實體瘤近期療效指標及實體瘤療效評價標準(RECIST)分別進行評價,分為完全緩解(CR)、部分緩解(PR)、穩定(SD)、進展(PD),總有效率=(CR例數+PR例數)/總例數×100%;②生存質量(KPS)評分改善率:改善率=提高例數/總例數×100%;③免疫功能指標;④安全性指標:化療不良反應發生率,包括惡心嘔吐、白細胞減少、肝功能異常、周圍神經毒性。
1.1.5 排除標準 ①干預措施的化療方案中不含奧沙利鉑;②動物實驗以及綜述文獻;③未實施隨機方法,研究設計不嚴謹、回顧性研究等;④包含其他干預措施,如放療、其他中藥治療、同時進行手術;⑤無本研究觀察的結局指標。
1.2 檢索策略
計算機檢索中國期刊全文數據庫(CJFD)、萬方數據庫、中國生物醫學文獻數據庫(CBM)、中文科技期刊數據庫(VIP)、PubMed、Cochrane圖書館,檢索時限為各數據庫建庫起至2016年3月。根據循證醫學PICOS原則(即患者、干預措施、對照措施、結局、隨機對照試驗),中文檢索詞為“復方苦參注射液”“大腸癌”“結腸癌”“結直腸癌”“直腸癌”“化療”“隨機對照試驗”;英文檢索詞為“Compound kushen injection”“Colon cancer”“Rectal cancer”“Chemotherapy”“Randomized controlled trial”。檢索方式為主題詞與自由詞結合檢索。
1.3 資料提取及質量評價
兩位研究者獨立對符合納入標準的文獻進行資料提取和質量評價,并交叉核對,如有分歧由第三位評價者討論解決。本研究所有作者協商制定信息提取表格,由兩人獨立對文獻的基線情況、干預措施、評價指標等資料進行提取,如遇分歧則由第三方裁定。
采用改良后的Jadad量表對文獻進行質量評價,主要包括隨機產生、隨機化隱藏、盲法和撤出與退出等4個方面。總分為0~7分,得分1~3分為低質量研究,4~7分為高質量研究。文獻的篩選與質量評價由兩位研究者獨立進行,如有不一致則討論解決[5]。
1.4 統計學方法
采用Rev Man 5.3統計軟件進行Meta分析。二分類資料使用相對危險度(RR),連續變量使用加權均數差(WMD),兩類指標均以95%置信區間(CI)表示。臨床異質性方面,如果各研究間無統計學異質性(P>0.1或I2<50%),運用固定效應模型Peto法進行Meta分析;如果存在異質性,則首先分析原因,再確定是否采用隨機模型或只進行描述性分析。檢驗結果在森林圖或表格中列出,通過倒漏斗圖對稱程度表示發表偏倚。
2 結果
2.1 檢索結果
檢索文獻并閱讀篇名、摘要、關鍵詞,對可能符合納入標準的文獻進行全文閱讀,篩選納入Meta分析。初檢出可能符合的文獻145篇,其中CJFD 44篇、萬方數據庫38篇、VIP 43篇、CBM 20篇,外文數據庫未檢出相關文獻,查重后初步納入54篇;根據納入與排除標準再次篩選,最終納入33項研究[3,6-37]。
2.2 納入研究方法學質量評價
納入的33項研究均為RCT,所有研究均提及分組由隨機產生,僅有7項研究描述了具體隨機方法(均采用了隨機數表法)及隨機化隱藏[3,5,13,19,23,27,31],所有研究均未描述盲法和失訪。納入研究得分范圍為1~3分,平均2.2分,均屬低質量研究。
2.3 納入研究基本信息
33項研究合計納入2 801例患者,KPS評分均>60分。各納入研究中均提及兩組患者例數、年齡、性別等資料比較差異無統計學意義(P>0.05),具有可比性。CRC類型包括結腸癌及直腸癌,并采用美國癌癥聯合委員會(AJCC)/國際抗癌聯盟(UICC)結直腸癌分期系統進行分期(腫瘤TNM分期或大腸癌dukes分期)[4],尚有部分文獻僅說明晚期或中晚期[3,6,10-11,13-15,17-18,24,27,31-32]。對照組患者僅給予含奧沙利鉑的常用化療方案,試驗組患者在對照組治療基礎上給予復方苦參注射液12~30 mL,靜脈滴注,每日1次。化療周期為1~6個周期,眾數及中位數為2。每個化療周期的療程為5~28 d,眾數及中位數為10。
2.4 Meta分析結果
2.4.1 近期有效率 共計25項研究報道了近期有效率[6-7,9-18,20-23,26-27,29-32,34-36],各研究間無統計學異質性(P=0.79,I2=0),采用固定效應模型分析,詳見圖1。Meta分析結果顯示,試驗組患者近期有效率顯著高于對照組,差異有統計學意義[RR=1.34,95%CI(1.24,1.46),P<0.001]。按照療效判定標準不同分為兩個亞組進行分析。其中19項研究采用WHO實體瘤近期療效指標評價療效[6-7,9-11,13-15,18,20,23,26-27,29,31-32,34-36],各研究間無統計學異質性(P=0.48,I2=0),采用固定效應模型分析。Meta分析結果顯示,試驗組患者近期有效率顯著高于對照組,差異有統計學意義[RR=1.38,95%CI(1.26,1.51),P<0.001]。6項研究采用RECIST療效標準評價療效[12,16-17,21-22,30],各研究間無統計學異質性(P=0.98,I2=0),采用固定效應模型分析。Meta分析結果顯示,兩組患者近期有效率比較差異無統計學意義[RR=1.19,95%CI(0.94,1.49),P=0.15]。
2.4.2 KPS評分改善率 21項研究報道了KPS評分改善率[6-7,9,12,15-17,20-28,30-32,35-36],各研究間無統計學異質性(P=0.92,I2=0),采用固定效應模型分析,詳見圖2。Meta分析結果顯示,試驗組患者KPS評分改善率顯著高于對照組,差異有統計學意義[RR=1.87,95%CI(1.65,2.14),P<0.001]。
2.4.3 免疫功能指標 11項研究報道了免疫功能指標[3,13,18,20,23,26,29-30,33,36-37],主要包括T淋巴細胞亞群功能細胞、自然殺傷(NK)細胞和白細胞介素(IL-2、IL-10),結果見表1。由表1可知,試驗組患者CD4+、CD3+、CD4+/ CD8+、NK細胞、IL-2水平顯著高于對照組,CD8+、IL-10水平顯著低于對照組,差異均有統計學意義。
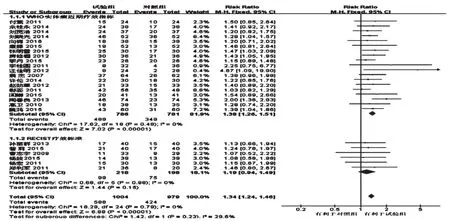
圖1 兩組患者近期有效率的Meta分析森林圖Fig 1 Forest plot of Meta-analysis of short-term effective rate in 2 groups
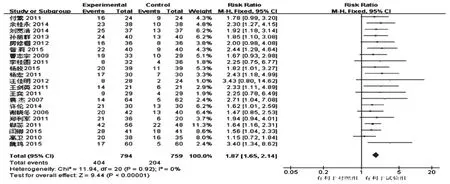
圖2 兩組患者KPS評分改善率的Meta分析森林圖Fig 2 Forest plot of Meta-analysis of KPS improvement rate in 2 groups
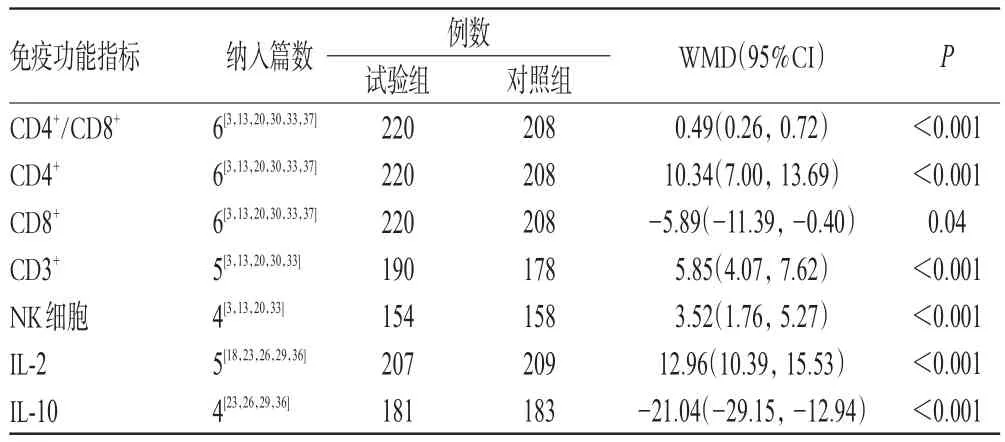
表1 免疫功能指標的Meta分析結果Tab 1 Meta-analysis results of immune function indexes
2.4.4 安全性評價 16項研究報道了化療不良反應發生率[3,8-9,11,13,19-21,23-24,26,30-32,34-35],按胃腸道反應(惡心嘔吐)、骨髓抑制(白細胞減少)、周圍神經毒性、肝功能異常(轉氨酶異常)4項指標進行Meta分析,結果見表2。由表2可知,試驗組患者惡心嘔吐、白細胞減少、肝功能異常、周圍神經毒性的發生率顯著低于對照組,差異均有統計學意義。
2.5 發表偏倚分析
對25項報道了近期有效率的研究進行倒漏斗圖分析,詳見圖3。由圖3可知,除1項研究的散點在漏斗圖外,其余研究散點都在漏斗之內,但對稱性欠佳,提示存在發表偏倚的可能。這可能與部分研究的樣本量較小及陰性結果難發表等因素有關。
3 討論
國內外學者曾對評價近期有效率的WHO與RECIST標準進行對比研究,結果發現兩種標準具有相同的總有效率,兩種評價方法具有較好的一致性[38]。而本次Meta分析結果提示,試驗組患者WHO實體瘤療效標準的近期有效率高于對照組,而RECIST療效標準的近期有效率與對照組比較差異無統計學意義,這可能與納入文獻數量偏少有關,尚需進一步研究。
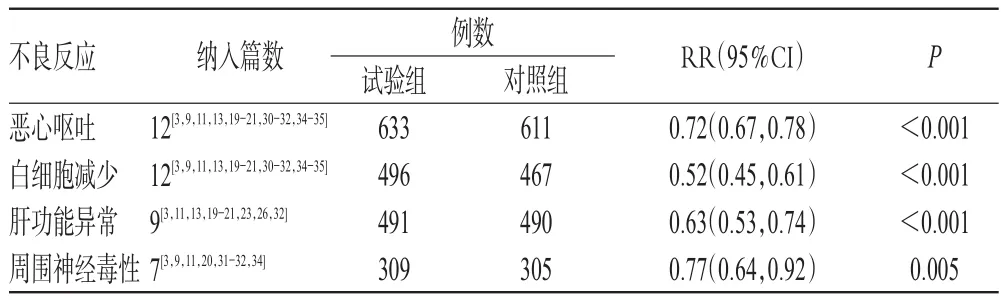
表2 化療不良反應發生率的Meta分析結果Tab 2 Meta-analysis results of the incidence of adverse reaction induced by chemotherapy
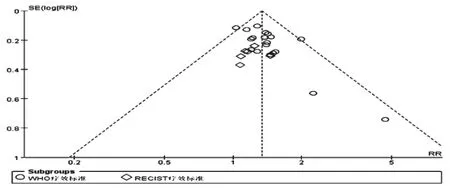
圖3 近期有效率的倒漏斗圖Fig 3 Inverted funnel plot of short-term effective rate
由于腫瘤本身和對腫瘤進行治療均可引起患者身體不適,降低患者的生存質量。因此,腫瘤患者生存質量的評估亦可作為評估治療效果的標準之一。本次Meta分析結果顯示,試驗組患者KPS評分改善率、CD4+/ CD8+、CD4+水平、CD3+水平、NK細胞水平、IL-2水平顯著高于對照組,CD8+、IL-10水平顯著低于對照組,差異均有統計學意義。這說明復方苦參注射液聯合含奧沙利鉑化療方案治療CRC可以提高患者的生存質量和免疫功能。化療期間,腫瘤患者的免疫功能均會下降,T細胞亞群數值也會隨之降低。T細胞亞群在抗腫瘤的免疫反應中起著重要作用,CD3+是所有T細胞表面共同標志,CD4+和CD8+分別在輔助T細胞和細胞毒性T細胞表面,而NK細胞無需抗原致敏就能夠殺傷敏感的腫瘤細胞,在免疫監視中也起主要作用[20]。此外,IL-2具有保障機體免疫功能作用,IL-10為腫瘤生長過程中的免疫抑制因子,因此腫瘤患者存在著IL-10升高而IL-2下降現象[23]。
安全性方面,試驗組患者惡心嘔吐、白細胞減少、肝功能異常、周圍神經毒性的發生率顯著低于對照組,差異均有統計學意義。說明復方苦參注射液聯合含奧沙利鉑方案治療CRC可以顯著降低化療不良反應發生率。納入研究中有2篇單獨報道了復方苦參注射液的不良反應。其中,1篇提及試驗組2例患者使用復方苦參注射液后出現面色潮紅,其余患者無不適[20];1篇提及試驗組患者注射復方苦參注射液后未出現不適[37],說明復方苦參注射液的安全性較好,但樣本量較小,仍需進一步研究。
復方苦參注射液聯合含奧沙利鉑方案治療CRC臨床療效的提高可能是復方苦參注射液與化療綜合作用的結果。復方苦參注射液中含苦參與白土苓提取物,其苦參堿成分可通過影響端粒酶對惡性腫瘤細胞有殺傷作用,并可提高機體免疫功能[37-38]。含奧沙利鉑方案的化療方法雖有殺滅CRC細胞的作用,但明顯的抗癌毒性反應影響了其臨床療效,通過聯合復方苦參注射液,不僅提高了機體免疫能力,也增強了殺傷腫瘤細胞的作用,起到了“增效減毒”的效果。
本系統評價納入的研究主要存在以下問題:(1)納入研究質量不高,大部分僅描述采用隨機分組,可能對整體研究結論可靠性產生影響;(2)以近期有效率為指標納入的25項研究繪制的倒漏斗圖呈不對稱分布,提示可能存在選擇性偏倚;(3)大部分研究忽視了中藥注射劑可能出現的副反應,安全性觀察有待提高;(4)以RECIST為標準納入文獻的數量較少,結果可能不穩定,仍需更多相關文獻進一步研究。
綜上所述,復方苦參注射液聯合含奧沙利鉑化療方案治療CRC療效優于單純化療,可以提高患者生存質量,改善免疫功能,降低化療引起的不良反應。但聯合治療能否提高患者的長期生存率及其作用機制仍需進一步研究。
[1] 石會勇,徐忠法.結直腸癌化療的研究進展[J].中華腫瘤防治雜志,2012,19(24):1915-1918.
[2] 程小偉,文洽先,朱婭,等.中藥熏洗治療奧沙利鉑化療后神經毒副反應療效觀察[J].實用臨床醫藥雜志,2015,19(24):117-119.
[3] 丁新,肖秀英,楊曉燕,等.復方苦參注射液聯合FOLFOX4方案治療晚期結直腸癌的臨床觀察[J].中國癌癥雜志,2010,20(11):860-862.
[4] 國家衛生和計劃生育委員會醫政醫管局,中華醫學會腫瘤學分會.中國結直腸癌診療規范:2015版[J].中華消化外科雜志,2015,14(10):783-784.
[5] 連寶濤,吳駐林,李澤彰,等.喜炎平對比利巴韋林治療小兒皰疹性咽峽炎的Meta分析[J].中國藥房,2016,27(3):337-340.
[6] 付鶯,戴泉.復方苦參注射液聯合化療治療中晚期大腸癌臨床觀察[J].光明中醫,2011,26(2):343-344.
[7] 余桂永,賈振和,陳新義,等.復方苦參注射液配合化療治療晚期大腸癌76例療效分析[J].中國實用醫藥,2014,9(23):154-155.
[8] 劉勁松,李麗萍,劉俊.復方苦參注射液聯合化療治療對結直腸癌患者血清血管內皮生長因子的影響[J].中國老年學雜志,2014,34(2):333-334.
[9] 劉寬浩,王藝卓,蘇滑.復方苦參注射液聯合化療治療晚期大腸癌的療效觀察[J].河南外科學雜志,2014,20(4):39-40.
[10] 劉曉光.復方苦參注射液聯合化療治療晚期結腸癌的可行性分析[J].中國現代藥物應用,2014,8(19):150-151.
[11] 向梅,劉愛華.復方苦參注射液聯合雷替曲塞和奧沙利鉑治療晚期結腸癌的療效觀察[J].現代藥物與臨床,2016,31(1):84-87.
[12] 孫麗群.復方苦參注射液聯合化療治療轉移性結直腸癌臨床研究[J].吉林中醫藥,2013,33(1):53-54.
[13] 康婷,劉敏,段偉.復方苦參注射液聯合常規化療治療結腸癌效果觀察[J].人民軍醫,2015,58(11):1336-1337.
[14] 張明雷.用復方苦參注射液聯合化療治療晚期結腸癌的效果研究[J].當代醫藥論叢,2015,13(10):241-242.
[15] 房修椢,張可帥.復方苦參注射液聯合化療治療晚期結腸癌的臨床療效分析[J].腫瘤藥學,2012,2(4):293-295.
[16] 昝莉,鄭丹.復方苦參注射液聯合化療治療結直腸癌40例的療效分析[J].臨床心身疾病雜志,2015,21(10):231-232.
[17] 曹志宇,蒲永東,何建苗,等.晚期結直腸癌應用復方苦參注射液聯合FOLFOX-4方案化療的臨床觀察[J].中國醫院用藥評價與分析,2009,9(12):940-941.
[18] 李丹,張啟洪,吳盛,等.復方苦參注射液聯合化療治療晚期結腸癌臨床研究[J].遼寧中醫雜志,2015,42(5):1021-1022.
[19] 李曉琳,馮妮.復方苦參注射液聯合化療治療大腸癌術后319例患者的療效分析[J].中國醫藥指南,2015,13(14):199-200.
[20] 李桂圓,易升明.復方苦參注射液治療中晚期結直腸癌的臨床觀察[J].中國藥房,2011,22(8):720-723.
[21] 楊姣,韓黎麗,鄧文英,等.復方苦參注射液聯合化療治療晚期結直腸癌的臨床觀察[J].中國實用醫刊,2015,42(9):76-78.
[22] 楊宏,李慧,張英,等.復方苦參注射液聯合化療治療結直腸癌30例[J].中國醫藥導報,2011,8(5):67-68.
[23] 汪佳明,任紅梅.復方苦參注射液聯合FOLFOX7方案化療治療大腸癌的臨床研究[J].中國新藥雜志,2012,21(17):2060-2062.
[24] 王劍英,崔曉梅,杜云英,等.復方苦參注射液配合化療治療晚期大腸癌的臨床觀察[J].中國現代藥物應用,2011,5(6):146-147.
[25] 王奕,唐求,龍志雄.復方苦參注射液對直腸癌患者CEA、CA199及生存質量的影響[J].中國腫瘤臨床與康復,2011,18(3):285-286.
[26] 袁杰,陳翔,曾小兵,等.復方苦參聯合化療藥物治療大腸癌的臨床研究[J].醫學綜述,2007,13(23):1872-1874.
[27] 許倫.淺談復方苦參注射液聯合化療治療晚期結腸癌的臨床療效[J].當代醫藥論叢,2014,12(11):38-39.
[28] 謝曉冬,鄭振東,劉大為,等.復方苦參注射液對晚期大腸癌患者生存質量影響的臨床對照研究[C]//第十屆全國中西醫結合腫瘤學術大會論文匯編.沈陽:中國中西醫結合腫瘤學會,2006:294-295.
[29] 趙勁草,舒鵬.復方苦參聯合化療治療大腸癌的臨床研究[J].實用臨床醫藥雜志,2012,16(11):101-103.
[30] 鄭利軍,龐爾國,楊智文,等.復方苦參注射液治療結腸癌的臨床療效觀察[J].內蒙古中醫藥,2011,30(10):1-2.
[31] 郗蕊.復方苦參注射液聯合化療治療晚期大腸癌的臨床效果[J].醫藥論壇雜志,2011,32(14):52-53.
[32] 閆卿,劉全華,尹宜發.復方苦參注射液聯合奧沙利鉑治療直腸癌療效觀察[J].現代中西醫結合雜志,2015,24(31):3488-3489.
[33] 陳光,于波,苑樹俊,等.復方苦參注射液對結直腸癌術后化療患者免疫功能的影響[J].中國醫院用藥評價與分析,2009,9(9):696-697.
[34] 陶春良,徐劍鋒.復方苦參注射液聯合化療治療晚期結腸癌74例臨床觀察[J].中醫藥導報,2013,19(11):42-44.
[35] 高衛,李紅宇,黨琦.復方苦參注射液聯合化療治療轉移性結直腸癌療效觀察[J].山東醫藥,2010,50(41):85-86. [36] 魏鴻,王燦,馬丹.復方苦參注射液配合化療治療結直腸癌及對預后的影響[J].陜西中醫,2015,36(4):446-448.
[37] 黃琳,李彬,胡作為,等.復方苦參注射液聯合化療對大腸癌術后化療患者免疫功能的影響[J].中國新藥雜志,2011,20(6):526-528.
[38] 王健,曹東,顧文靜,等.WHO標準與RECIST標準評價惡性腫瘤治療效果的比較[J].中國基層醫藥,2013,20(5):652-654.
(編輯:申琳琳)
Efficacy and Safety of Compound Kushen Injection Combined with Oxaliplatin-based Chemotherapy Regimen in the Treatment of Colorectal Cancer:ASystematic Review
WU Zhulin1,TAN Wanjun1,LIAN Baotao2,PENG Lisheng1(1.Fourth Clinical Medical College,Guangzhou University of Traditional Chinese Medicine/Shenzhen Traditional Chinese Medicine Hospital,Guangdong Shenzhen 518033,China;2.Second Clinical Medical College,Guangzhou University of Traditional Chinese Medicine,Guangzhou 510405,China)
OBJECTIVE:To systematically review the efficacy and safety of Compound kushen injection combined with oxaliplatin-based chemotherapy regimen in the treatment of colorectal cancer,and provide evidence-based reference for clinic.METHODS:Retrieved from CJFD,Wanfang Database,CBM,VIP,PubMed and Cochrane Library,randomized controlled trials(RCT)about Compound kushen injection combined with oxaliplatin-based chemotherapy(test group)versus conventional chemotherapy(control group)in the treatment of colorectal cancer were collected.Meta-analysis was performed by using Rev Man 5.3 software after data extraction and quality evaluation by modified Jadad scale.RESULTS:Totally 33 RCTs were included,involving 2 801 patients.Results of Meta-analysis showed the short-term effective rate[RR=1.34,95%CI(1.24,1.46),P<0.001],improvement rate of KPS score[RR=1.87,95%CI(1.65,2.14),P<0.001],CD4+/CD8+values[WMD=0.49,95%CI(0.26,0.72),P<0.001],CD4+level[WMD=10.34,95%CI(7.00,13.69),P<0.001],CD3+level[WMD=5.85,95%CI(4.07,7.62),P<0.001]、nature kill cell level [WMD=3.52,95%CI(1.76,5.27),P<0.001]、IL-2 level[WMD=12.96,95%CI(10.39,15.53),P<0.001]in test group were significantly higher than control group,CD8+level[WMD=—5.89,95%CI(—11.39,—0.40),P=0.04],IL-10 level[WMD=—21.04,95%CI(—29.15,—12.94),P<0.001],the incidence of nausea and vomiting[RR=0.72,95%CI(0.67,0.78),P<0.001],white blood cell reduction[RR=0.52,95%CI(0.45,0.61),P<0.001],abnormal liver function[RR=0.63,95%CI(0.53,0.74),P<0.001],peripheral neurotoxicity[RR=0.77,95%CI(0.64,0.92),P<0.001]was significantly lower than control group,with statistical significances.CONCLUSIONS:Compound kushen injection combined with oxaliplatin-based chemotherapy is superior to conventional chemotherapy alone in the treatment of colorectal cancer,which can improve life quality and immune functions,reduce the adverse reactions induced by chemotherapy.
Compound kushen injection;Chemotherapy;Colorectal cancer;Systematic review;Efficacy;Safety
R287
A
1001-0408(2017)03-0369-05
2016-03-08
2016-10-21)
*碩士研究生。研究方向:中醫內科學。E-mail:489482017@qq. com
#通信作者:主任醫師,教授,碩士生導師。研究方向:癌癥、肝病的中西醫結合診治。E-mail:szpengls@163.com
DOI10.6039/j.issn.1001-0408.2017.03.23

