吖啶類衍生物的合成研究進展
魏 強, 耿新樂
(蘭州交通大學 化學與生物工程學院,甘肅 蘭州 730070)
·綜合評述·
吖啶類衍生物的合成研究進展
魏 強, 耿新樂*
(蘭州交通大學 化學與生物工程學院,甘肅 蘭州 730070)
吖啶類衍生物具有良好的生物活性,在生物制藥,功能材料和熒光標記物等領(lǐng)域有重要應用,但合成難度較大。綜述了通過催化劑活化酰基的成環(huán)反應(分子內(nèi)成環(huán)反應和分子間成環(huán)反應)合成吖啶衍生物的方法,并對其未來的發(fā)展進行了展望。參考文獻19篇。
吖啶類衍生物; 分子內(nèi)成環(huán)反應; 分子間成環(huán)反應; 合成; 研究進展; 綜述
吖啶衍生物因其獨特的物理、化學性質(zhì)和生物活性而倍受研究者們的關(guān)注。吖啶衍生物在化學工業(yè)(如顏料和染料等[1]),醫(yī)學(如抗菌,抗瘧藥,抗腫瘤,DNA和RNA嵌入等[2-6])等領(lǐng)域有廣泛應用。此外,含有大共軛體系的吖啶衍生物因其具有特別的電子和光物理性質(zhì)而有望作為新型有機半導體材料[7]。通過吖啶衍生物中齒狀氮原子形成剛性結(jié)構(gòu),從而制備新型催化劑,也是催化工作者努力的方向[8-9]。
然而,吖啶類衍生物的高效合成是限制其深入研究的障礙。對吖啶類衍生物的合成方法進行系統(tǒng)研究顯得尤為重要。通過催化劑活化酰基的成環(huán)反應是合成吖啶衍生物的重要途徑之一,該方法的主要優(yōu)點為原子利用率較高,副產(chǎn)物主要為水,對環(huán)境較為友好。成環(huán)反應合成吖啶類衍生物的方法主要有兩種:分子內(nèi)成環(huán)和分子間成環(huán)。本文對該類合成方法進行了概述,并對其未來的發(fā)展進行了簡要展望。
1 分子內(nèi)成環(huán)反應
分子內(nèi)成環(huán)反應是成環(huán)反應合成吖啶衍生物的重要方法之一。研究人員通過考察多種合成路線,希望探索出普適性較好、反應條件溫和的合成方法。

Scheme 1
Scheme 2
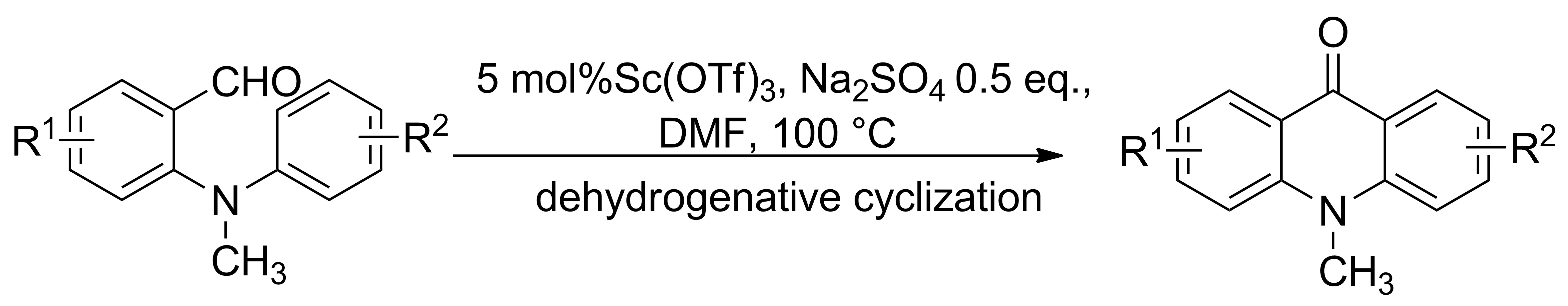
Scheme 3
2010年,Tsvelikhovsky等[10]報道了一種合成吖啶類衍生物的新方法。2-溴苯乙烯和2-氯苯胺在鈀催化下縮合制得二苯胺中間體,中間體在不同配體的鈀的催化下經(jīng)一步關(guān)環(huán)反應合成了吖啶類衍生物(Scheme 1)。該方法反應速率快,反應條件溫和,產(chǎn)率較高,但對催化劑配體的要求比較苛刻,底物的普適性也較差。
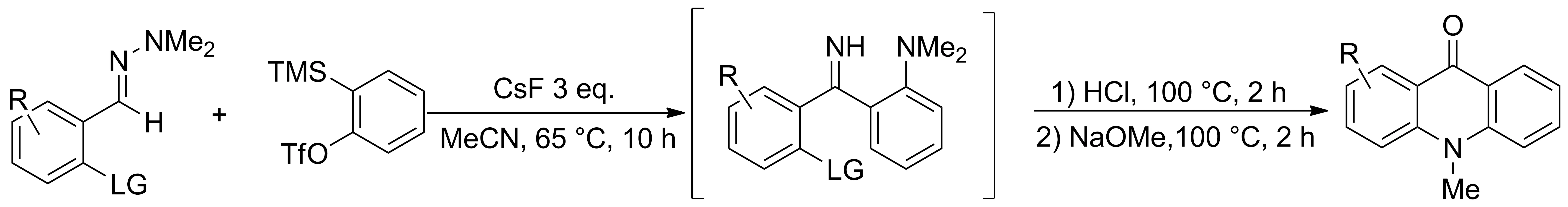
2012年,Dubrovskiy等[11]先通過CsF催化1,1-二甲基芳腙類化合物與芳炔反應制得亞胺中間體,再經(jīng)鹽酸和甲醇鈉作用,合成了N-甲基吖啶酮類化合物(Scheme 2)。該方法底物普適性較好,底物不論含吸電子基團,還是供電子基團,均能反應,且產(chǎn)率較高,成本較低。用該方法已經(jīng)成功合成了多種具有藥物活性的天然產(chǎn)物(Chart 1)。
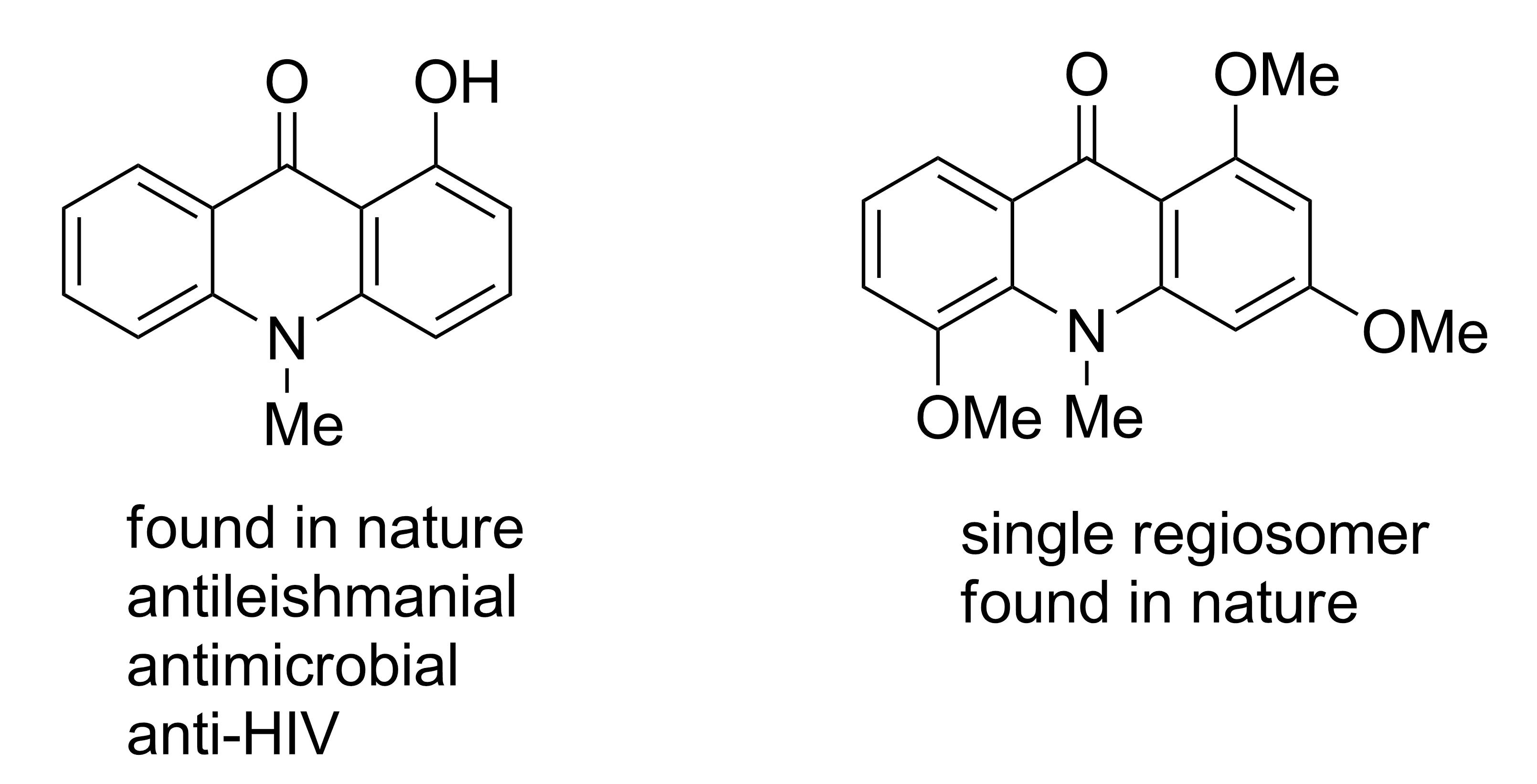
Chart 1
2014年,Zheng等[13]提出可通過分子內(nèi)的芳基醛以Csp2—Csp2方式構(gòu)筑吖啶酮衍生物。值得注意的是,該方法不使用金屬催化,方法較新穎。以多種2-(N-芳基氨基)醛為原料,通過PhI(OAc)2和過氧化苯甲酰為媒介的分子內(nèi)交叉脫氫偶聯(lián)反應,直接與芳醛形成Csp2—Csp2鍵(Scheme 5)。該方法不需要醛基的預活化過程,適用范圍較廣,是一種構(gòu)建含吖啶酮骨架的便利方法。
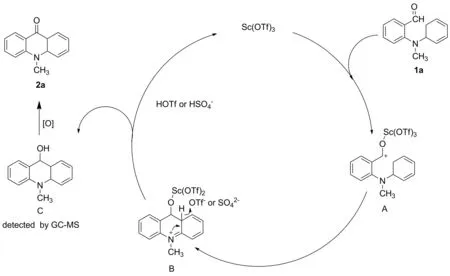
Scheme 4

Scheme 6
2014年,Su等[14]報道了一種簡單高效合成吖啶類衍生物的方法。利用ZnCl2與鄰芳基氨基苯席夫堿亞胺的氮原子形成ZnCl2絡合物,鋅原子誘導亞胺碳氮雙鍵極化,使碳原子帶正電荷,然后通過環(huán)化反應促使芳環(huán)上的分子內(nèi)電子進攻胺基的鄰位生成兩性離子中間體,烯丙基碳正離子上的質(zhì)子轉(zhuǎn)移到氮負離子上形成取代9,10-二氫吖啶,最后在催化劑ZnCl2的作用下消去一分子芳胺并進一步芳構(gòu)化形成穩(wěn)定的吖啶類衍生物(Scheme 6)。通過氯化鋅促進的鄰苯基芳基胺類席夫堿化合物的環(huán)化反應合成吖啶衍生物,路線簡潔,產(chǎn)率較高。該類環(huán)化反應也可通過雙雙環(huán)化反應應用到復雜多環(huán)氮雜芳族化合物的合成中。
綜上可見,近年來分子內(nèi)環(huán)化反應合成吖啶類衍生物的方法已經(jīng)有了較大的發(fā)展與突破創(chuàng)新,但仍有一些無法克服的弊端和局限性,如催化劑成本較高,反應原料需有較高的活性等。
分子間環(huán)化反應合成吖啶類衍生物有多種方法,其中大多數(shù)化合物是通過[4+2]環(huán)加成反應和Lewis酸催化的Friedel-Crafts反應合成的。該方法具有反應條件溫和,催化劑成本低廉,產(chǎn)率較高等優(yōu)點,是今后的研究重點。
2010年,Rogness等[15]報道了通過分子間[4+2]環(huán)加成反應合成一系列吖啶酮類衍生物的方法。以芳炔和鄰雜原子取代苯甲酮類化合物為原料,在氟化銫催化下合成吖啶酮類衍生物(Scheme 7)。該反應條件比較溫和,催化劑價格低廉,且方法簡單便捷,原料易得,唯一副產(chǎn)物為水,不足之處在于產(chǎn)率不高。
2012年,Huang等[16]從鄰二鹵代苯和N-甲基苯磺酰腙出發(fā),經(jīng)“一鍋法”合成了含有多種官能團的吖啶類化合物(Scheme 8)。“一鍋法”相對于已報道的兩種耦合法,適用范圍更廣泛,反應步驟更簡單,唯一不足之處在于催化劑較昂貴。
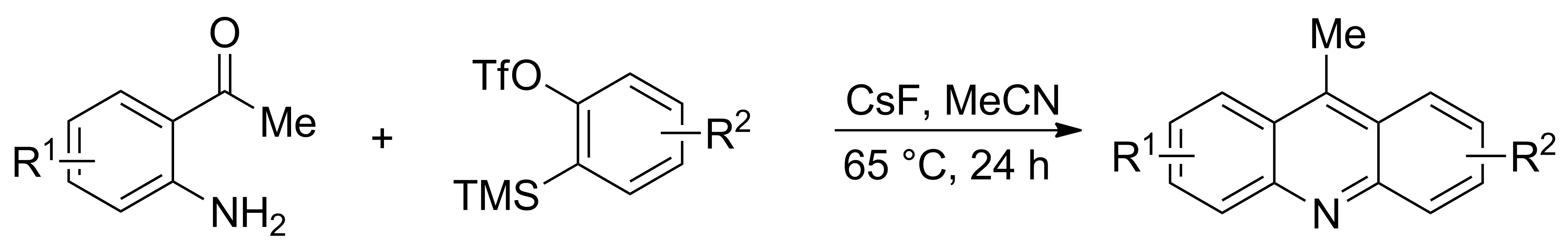
Scheme 7

Scheme 8

Scheme 9

Scheme 10
2013年,Lian等[17]通過芳基亞胺與偶氮苯的芳香疊氮化物的[3+3]環(huán)化反應,合成了一系列吖啶類衍生物(Scheme 9)。在Rh(Ⅲ)催化下先進行胺化,隨后通過分子內(nèi)的芳族親電取代和芳構(gòu)化的級聯(lián)過程合成吖啶類衍生物。
其反應機理為:亞胺或偶氮苯經(jīng)過正交的C—H鍵活化,隨后經(jīng)配位和遷移插入疊氮化物提供金屬環(huán),金屬環(huán)質(zhì)子化釋放二芳基胺和銠催化劑,最后進行分子內(nèi)的芳香親電取代和芳構(gòu)化反應生成吖啶或吩嗪(Scheme 10)。反應一步完成,反應底物普適性好,產(chǎn)率較高,但對催化劑要求苛刻。
2015年,Pang等[18]報道了一種合成吖啶的全新方法。通過串聯(lián)芳基化和Friedel-Crafts反應,由鄰氰基苯胺和二芳基鹽合成了9-氨基吖啶。在此基礎上,他們又提出了更常用的方法,以鄰酰基苯胺和二芳基鹽為原料合成吖啶和吖啶酮。該反應在銅催化下或通過串聯(lián)芳基化/Friedel-Crafts反應在高溫下進行(Scheme 11)。該合成方法較為新穎,反應條件溫和,催化劑廉價,無需貴金屬催化也可以進行反應,產(chǎn)率較高。
同年,Wang等[19]以取代2-溴苯甲醛和苯胺為原料,經(jīng)串聯(lián)耦合和環(huán)化反應,成功合成吖啶類化合物(Scheme 12)。反應在三(二亞芐基丙酮)二鈀和1,1′-雙(二苯基膦)二茂鐵催化下進行,產(chǎn)率較高。此外,抗白血病劑(DACA)也可以通過使用此方法制得。這一合成吖啶類衍生物的方法有良好的應用前景。

Scheme 11

Scheme 12
3 吖啶類化合物合成方法的展望
吖啶類衍生物的合成雖然已經(jīng)取得了諸多成果,但報道的方法基本沒有能夠工業(yè)化。且大部分方法存在污染嚴重,催化劑昂貴,反應條件苛刻等缺點,高效綠色合成吖啶類衍生物仍然是一個難題。這就需要我們不斷的探索研究,通過簡單易得的原料,廉價、綠色的催化劑以及溫和的反應條件,找到更環(huán)保的方法,使原子經(jīng)濟性更高,對環(huán)境更為友好,爭取早日實現(xiàn)工業(yè)化生產(chǎn)。
[1] Geddes C D. Optical thin film polymeric sensors for the determination of aqueous chloride,bromide and iodide ions at high pH,based on the quenching of fluorescence of two acridinium dyes[J].Dyes Pigm,2000,45:243-251.
[2] Dollinger S, Lober S, Klingenstein R,etal. A chimeric ligand approach leading to potent antiprion active acridine derivatives:Design,synthesis,and biological investigations[J].J Med Chem,2006,49:659-6595.
[3] Ma Z, Choudhury J R, Saluta G,etal. A non-cross-linking platinum-acridine agent with potent activity in non-small-cell lung cancer [J].J Med Chem,2008,51:7574-7580.
[4] Denny W A. Acridine derivatives as chemotherapeutic agents[J].J Med Chem,2002,9:1655-1665.
[5] Goodell J R, Ougolkov A V, Hiasa H,etal. Acridine-based agents with topoisomerase II activity inhibit pancreatic cancer cell proliferation and induce apoptosis[J].J Med Chem,2008,51:179-182.
[6] Cheng M K, Modi C, Cookson J C,etal. Antitumor polycyclic acridines. Search for DNA quadruplex binding selectivity in a series of 8,13-dimethylquino[4,3,2-kl]acridinium salts:Telomere-targeted agents[J].J Med Chem,2008,51:963-975.
[7] Zhang D, Jiang X, Yang H,etal. Acridine-based macrocyclic fluorescent sensors:Self-assembly behavior characterized by crystal structures and a tunable bathochromic-shift in emission induced by H2PO4viaadjusting the ring size and rigidity[J].Org Biomol Chem,2013,11:3375-3381.
[8] Ye X, Plessow P, Brinks M K,etal. Alcohol amination with ammonia catalyzed by an acridine-based ruthenium pincer complex:A mechanistic study[J].J Am Chem Soc,2014,136:5923-5929.
[9] Graham L A, Suryadi J, West T K,etal. Synthesis,aqueous reactivity,and biological evaluation of carboxylic acid ester-functionalized platinum-acridine hybrid anticancer agents[J].J Med Chem,2012,55:7817-7827.
[10] Tsvelikhovsky D, Buchwald S. Synthesis of heterocyclesviaPd-ligand controlled cyclization of 2-chloro-N-(2-vinyl)aniline:Preparation of carbazoles,indoles,dibenzazepines,and acridines[J].J Am Chem Soc,2010,132:14048-14051.
[11] Dubrovskiy A, Larock R. Synthesis ofo-(dimethylamino)aryl ketones,acridones,acridinium salts,and 1H-indazoles by the reaction of hydrazones and arynes[J].J Org Chem,2012,77:11232-11256.
[12] Li X A, Wang H L, Yang S D. Sc(OTf)3-catalyzed dehydrogenative cyclization for synthesis ofN-methylacridones[J].Org Lett,2013,15(8):1794-1797.
[13] Zheng Z S, Dian L Y, Yuan Y C,etal. PhI(OAc)2-mediated intramolecular oxidative aryl-aldehyde Csp2—Csp2bond formation:Metal-free synthesis of acridone derivatives[J].J Org Chem,2014,79(16): 7451-7458.
[14] Su Q, Li P, He M N,etal. Facile synthesis of acridine derivatives by ZnCl2-promoted intramolecular cyclization ofo-arylaminophenyl Schiff bases[J].Org Lett,2014,16(1):18-21.
[15] Rogness D C, Larock R C. Synthesis of acridines by the [4+2]annulation of arynes and 2-aminoaryl ketones[J].J Org Chem,2010,75:2289-2295.
[16] Huang Z X, Yang Y, Xiao Q,etal. Auto-tandem catalysis:Synthesis of acridines by Pd-catalyzed C=C bond formation and C(sp2)-Ncross-coupling[J].Eur J Org Chem,2012,33:6586-6593.
[17] Lian Y J, Hummel J R, Bergman R G,etal. Facile synthesis of unsymmetrical acridines and phenazines by a Rh(III)-catalyzed amination/cyclization/aromatization cascade[J].J Am Chem Soc,2013,135(34):12548-12551.
[18] Pang X L, Lou Z B, Li M,etal. Tandem arylation/Friedel-Crafts reactions ofo-acylanilines with diaryliodonium salts:A modular synthesis of acridine derivatives[J].Eur J Org Chem,2015,15:3361-3369.
[19] Wang T J, Chen W W, Li Y,etal. Facile synthesis of acridinesviaPd(0)-diphosphine complex-catalyzed tandem coupling/cyclization protocol[J].Org Biomol Chem,2015,13:6580-6586.
Research Progress on Synthesis of Acridine Derivatives
WEI Qiang, GENG Xin-le*
(College of Chemical and Biological Engineering, Lanzhou Jiaotong University, Lanzhou 730070, China)
Acridine derivatives were widely used in biological pharmacy, function material, fluorescent mark, etc, due to its well bio-activities. However, the difficulties in synthesizing of acridine derivatives limited its application. The synthesis methods for acridine derivatives through catalyst-activited acyl cyclization, including intramolecular cyclization and intermolecular cyclization, were reviewed with nineteen references. The future development was prospected as well.
acridine derivative; intramolecular; intermolecular; synthesis; research advance; review
2016-11-06
國家自然科學基金資助項目(51402324)
魏強(1994-),男,漢族,山西太原人,碩士研究生,主要從事有機合成的研究。
耿新樂,碩士研究生, E-mail: gengxl007@163.com
O629.34
A
10.15952/j.cnki.cjsc.1005-1511.2017.02.16288

