蘋果輪紋病菌對戊唑醇的敏感性及其抗性突變體的致病力
范 昆, 付 麗, 李曉軍, 翟 浩, 劉 璐, 曲健祿*
(1. 山東省果樹研究所,泰安 271000; 2. 山東省泰安市林業局,泰安 271000)
蘋果輪紋病菌對戊唑醇的敏感性及其抗性突變體的致病力
范 昆1, 付 麗1, 李曉軍1, 翟 浩1, 劉 璐2, 曲健祿1*
(1. 山東省果樹研究所,泰安 271000; 2. 山東省泰安市林業局,泰安 271000)
為明確蘋果輪紋病菌對戊唑醇的敏感性及其抗性突變體的致病力,采用菌絲生長速率法測定了130株蘋果輪紋病菌菌株對戊唑醇的敏感性,采用藥劑馴化和紫外線誘導的方式獲得抗性突變體,并研究其生存適合度。結果表明,戊唑醇對130個菌株的EC50分布在0.051 6~1.925 4 μg/mL,均值為(0.799 6±0.039 1)μg/mL,表明蘋果輪紋病菌開始出現敏感性下降的亞群體。供試蘋果輪紋病菌菌株的抗性頻率為71.54%,各省份均未出現高抗菌株。藥劑馴化、紫外誘導共獲得3株抗性倍數分別為58.82倍、41.60倍、38.19倍的高抗菌株。抗性突變體致病力、適合度指數與敏感菌株相比沒有顯著性差異。無藥培養9代后,各抗性突變體EC50逐漸下降,所獲抗性可能不能穩定遺傳。表明蘋果輪紋病菌對戊唑醇的抗性在田間自然選擇壓力下可能會逐漸降低。
蘋果輪紋病菌; 戊唑醇; 敏感性; 突變體; 致病力
三唑類殺菌劑是20世紀70年代中后期開發的一類新型廣譜殺菌劑,是殺菌劑發展史上里程碑式的創新,歷經幾十年的發展,在殺菌劑市場中的銷售份額位列第一[1-2]。戊唑醇的作用機理是抑制真菌麥角甾醇中間體的氧化脫甲基反應,具有內吸、高效、廣譜、安全等特點[3],對鏈格孢屬Alternaria、疫霉屬Phytophthora、黑星菌屬Venturia、白粉菌屬Erysiphe、鐮刀菌屬Fusarium、柄銹菌屬Puccinia、喙孢屬Rhynchosporium、尾孢屬Cercospora、叢赤殼屬Nectria、核腔菌屬Pyrenophora、殼針孢菌屬Septoria、灰葡萄孢屬Botrytis引起的病害均有良好的防治效果[4-5]。該藥20世紀90年代中期正式在中國蘋果樹上登記使用[6],對蘋果輪紋病具有優良的防治效果[5],近年來一直是防治蘋果輪紋病的首選藥劑。
戊唑醇因其強選擇性和作用位點專一性,使用中可能會導致病原菌產生抗藥性。據報道葡萄灰霉病菌Botrytiscinerea[7]、大麥云紋病菌Rhynchosporiumsecalis[8]、開心果枝枯病菌Botryosphaeriadothidea[9]、桃褐腐病菌Moniliniafructicola[10]、禾谷鐮刀菌Fusariumgraminearum[11]、紅球叢赤殼菌Nectriahaematococca[12]等病原菌均對戊唑醇產生了不同程度的抗性。目前,尚未見到關于蘋果輪紋病菌Botryosphaeriadothidea對戊唑醇產生抗性的報道,因此,本研究2013年采集了我國主要蘋果產區蘋果輪紋病菌,并測定了其對戊唑醇的敏感性,比較室內誘導的抗藥性突變體與敏感菌株的適合度,以期預測該病原菌群體抗性發展趨勢,為制定正確的防治策略及指導生產用藥提供依據。
1 材料和方法
1.1 材料
1.1.1 供試菌株
2013年8-10月從我國主要蘋果產區(山東省、河北省、陜西省、河南省、遼寧省、山西省)的果園內, 隨機采集枝干輪紋病病瘤、病果 (每個病瘤、病果采自相距10 km以上的果園),分離、純化、鑒定,共獲得130個蘋果輪紋病菌菌株,其中山東26株、河北22株、陜西21株、河南18株、遼寧23株、山西20株。
1.1.2 供試藥劑
98%戊唑醇(tebuconazole)原藥,江蘇常隆化工有限公司生產。將其溶于丙酮,配制成1×104μg/mL的母液,放置于4℃冰箱中保存備用。
1.2 含藥培養基的配制
將戊唑醇母液用體積分數為0.05%吐溫-80溶液稀釋,稀釋液中丙酮的含量控制在0.1%以下。用微量移液器吸取1 mL不同濃度的藥劑稀釋液分別加入到49 mL冷卻至50℃左右PDA培養基中,充分搖勻,配制成戊唑醇終濃度分別為2.0、1.0、0.5、0.25、0.125 μg/mL的含藥培養基,以添加相同濃度吐溫-80和丙酮溶液為空白對照。
1.3 蘋果輪紋病菌對戊唑醇的抗性測定
采用菌絲生長率法[13]測定。在26℃下培養5 d 的PDA平板的菌落邊緣打取d=7 mm 的菌餅,分別移到1.2制備的含藥PDA平板上,26℃培養4 d,每處理(每菌株每濃度水平)重復4 次。用十字交叉法測定各處理的菌落生長直徑,測定菌落徑向線性生長量,確定藥劑對菌落生長的抑制率,通過菌絲生長抑制率概率值和藥劑濃度對數值之間的線性回歸分析求出各藥劑對菌株的有效抑制中濃度(EC50),并依據范昆等[14]建立的蘋果輪紋病菌對戊唑醇的敏感基線,計算抗性倍數(Rf)和抗性頻率。
試驗數據均由Microsoft Excel 2013、SPSS數據處理工作平臺進行統計分析。
抗性倍數(Rf)=供試菌株的EC50/敏感基線值,其中:Rf<2為敏感菌株;2≤Rf<5為低抗菌株;5≤Rf<10為中抗菌株;Rf≥10為高抗菌株[15]。
抗性頻率(%)=抗性菌株/供試菌株數×100。
1.4 蘋果輪紋病菌抗藥性突變體的誘導
以山東泰山南天門未施用過戊唑醇的蘋果樹上分離的菌株TS1 (EC50=0.011 1 μg/mL)[14]作為野生相對敏感型菌株。將TS1菌株穩定培養后,接種到含1 μg/mL戊唑醇的PDA培養基上,26℃培養10~15 d后,選擇生長相對較快的菌落再轉移至含2 μg/mL戊唑醇的培養基上,以此類推逐漸增加戊唑醇的質量濃度。每選擇3代測定EC50,比較菌株對戊唑醇的抗性變化,連續選擇30代,每代篩選時每個菌株均接種30皿,每皿5個d=7 mm的菌餅。以親本菌株為對照,計算抗藥性突變體的抗性倍數。
抗性倍數=抗性突變體菌株的EC50/親本菌株的EC50
1.4.2 紫外誘導
參照Bruin等[16]、葉滔等[17]的方法并加以改進。選擇采自泰山南天門野生蘋果樹上的菌株TS2、TS3、TS7、TS9、TS11、TS12,26℃培養5 d后打取d=7 mm的菌餅,接入含2 μg/mL戊唑醇(經預試驗,該濃度下供試菌株不能生長)的PDA培養基上,每個菌株50皿,每皿4個菌餅。開蓋狀態下,將菌落置于紫外燈(30 W、波長254 nm)下方垂直距離25 cm處分別照射30、45、75、110、140、180 s后立即置于黑暗條件下培養10 d(26℃),能正常生長的菌落為疑似抗性突變體。將該疑似抗性突變體轉移到含2 μg/mL戊唑醇的PDA平板上繼續活化培養7~10 d(黑暗),將能較好生長的抗藥性突變體記為第1代,并測定EC50(戊唑醇濃度1、2、4、8、16、32 μg/mL),計算抗性倍數和突變頻率。每處理平行測定4次,試驗重復2次。
突變頻率(%)=(出現突變的菌餅數/供試菌餅數)×100。
1.5 抗藥性突變體的適合度測定
參照Tooley等[18]、Kadish等[19-20]和朱書生等[21]的方法進行適合度測定。比較藥劑馴化、紫外誘變的抗藥性菌株和敏感菌株接種蘋果離體果實和田間枝條后的發病率、病斑面積(接菌后7 d)和病斑長度(接菌后10 d),并計算菌株的適合度指數。
綜合適合度指數=發病率×病斑面積(病斑長度)。
1.5.1 離體果實接種
不管是什么建筑工程,都需要滿足功能要求才能夠開始施工建設,以保證建筑工程的適用性,保證建筑工程的功能均能夠正常運行。
參照Johnson等[22]的接種方法略作調整。健康‘富士’果實用75%的乙醇表面消毒,滅菌水沖洗晾干后,在蘋果上相對應的位置打2個孔(3 mm×3 mm)并接種d=3 mm的菌餅,接種后的蘋果放入托盤中用保鮮膜保濕。以與菌餅相同大小的培養基接種傷口作為對照。每個菌株設5次重復,26℃下培養7 d,觀察果實發病情況,測量病斑直徑。
1.5.2 田間活體枝條接種
參照劉保友等[23]的方法,2014年5月在山東省曲阜市吳村果園,選取當年生‘富士’蘋果樹枝條進行接種試驗。每菌株接種20個枝條,每個枝條接種1個7 mm的菌餅,以不接種菌餅處理為對照,10 d后調查發病率、病斑長度。
1.6 抗性突變體的遺傳穩定性測定
將藥劑馴化、紫外誘變的抗藥性突變體在無藥PDA培養基上、26℃下連續培養9代,測定第1、3、5、7、9 代突變體的EC50,計算抗性倍數,分析其抗藥性能否穩定遺傳。
2 結果與分析
2.1 蘋果輪紋病菌對戊唑醇的敏感性
戊唑醇對130個菌株的EC50分布在0.051 6~1.925 4 μg/mL,最高值是最低值的37.31倍,EC50均值為(0.799 6±0.039 1)μg/mL。與范昆等[14]測定的蘋果輪紋病菌對戊唑醇的敏感基線(0.254 1±0.015 1)μg/mL相比,抗性倍數整體提高3.15倍,雖然抗性倍數沒有顯著性變化,但通過SPSS 分析S-W法正態檢驗得知: W=0.932,P=0.000<0.05,偏度Skew=0.586,頻次分布圖呈負偏態(圖1),對戊唑醇敏感性的頻次分布不符合正態分布,這表明蘋果輪紋病菌對戊唑醇的藥劑敏感性開始出現分化,且出現敏感性降低的亞群體。

圖1 2013年蘋果輪紋病菌菌株對戊唑醇的敏感性頻次分布圖Fig.1 Frequency distribution of susceptibility of Botryosphaeria dothidea isolates to tebuconazole in 2013
2.2 2013年山東、河北、陜西、河南、遼寧、山西輪紋病菌對戊唑醇的敏感性測定
不同省份菌株對戊唑醇敏感性見表1。結果表明,不同省份菌株的敏感性存在一定的差異,其中河南省的平均EC50最高, 達0.934 9 μg/mL,平均抗性水平為1.17倍;其次為山東省、河北省、陜西省、山西省,EC50分別為0.928 1、0.832 0、0.774 8、0.701 4 μg/mL,平均抗性水平依次是1.16、1.04、0.97、0.88倍。遼寧省的EC50最低,為0.627 8 μg/mL,平均抗性水平為0.79倍。同一省份不同地區菌株的敏感性也存在較大的差異,以遼寧省為例,EC50的最低值是0.051 6 μg/mL,最大值則達1.621 7 μg/mL。
2.3 2013年山東、河北、陜西、河南、遼寧、山西蘋果輪紋病菌對戊唑醇的抗性水平
不同省份蘋果輪紋病菌對戊唑醇的抗性頻率見表2。供試菌株的抗性頻率高達71.54%, 但各省份均未出現高抗菌株,抗性倍數最高的菌株出現在山東省,抗性倍數為8.12倍,其他省份菌株抗性水平差異不明顯,其中山西省、遼寧省抗性菌株頻率很低,分別為65.00%、56.52%,出現的中抗性水平菌株頻率最低,分別為10.00%、17.39%,與其EC50平均值(0.701 4、0.627 8 μg/mL)均較低相呼應。從抗性水平的分布來看,51.54%的菌株對戊唑醇的抗性水平在2~5倍之間,表明菌株對戊唑醇雖然產生抗性,但大部分菌株的抗性為低抗性水平。
表1 2013年不同地理來源蘋果輪紋病菌對戊唑醇的敏感性1)
Table 1 Susceptibility ofBotryosphaeriadothideato tebuconazole from different regions in 2013

省份Province菌株數/株No.ofisolateEC50范圍/μg·mL-1RangeofEC50valueEC50均值/μg·mL-1Mean±SD變異系數(CV)Coefficientofvariation平均抗性水平Meanresistancefactor山東Shandong260.2524~1.9254(0.9281±0.0921)aA0.50591.16河南Henan180.2846~1.6242(0.9349±0.1002)aA0.45451.17河北Hebei220.1069~1.6172(0.8320±0.0938)bB0.52891.04陜西Shaanxi210.1216~1.5216(0.7748±0.0974)cC0.57600.97遼寧Liaoning230.0516~1.6217(0.6278±0.0918)eE0.70150.79山西Shanxi200.1304~1.4309(0.7014±0.0906)dD0.57740.88平均Average--(0.7996±0.0391)cBC0.55791.00
1) 表中EC50均值為平均值±標準差。同列數據后標相同小寫(大寫)字母者表示經 Duncan’s 新復極差測驗,在P=0.05 (P=0.01)水平上差異不顯著。下同。 EC50are given as mean±SD. Data in a column followed by the same small (capital) letters are not significantly different atP=0.05 (P=0.01) by Duncan’s new multiple range test, respectively.The same below.
表2 2013年不同地理來源蘋果輪紋病菌對戊唑醇的抗性頻率
Table 2 Resistance frequency ofBotryosphaeriadothideato tebuconazole from different regions in 2013

省份Province抗性分布/%FrequencyofisolateswithdifferentresistancefactorsRf<22≤Rf<55≤Rf<10Rf≥10最高抗性倍數Thehighestresistanceratio抗性頻率/%Frequencyofresistance山東Shandong23.0853.8523.08-8.1276.93河北Hebei22.7354.5422.73-6.8277.27山西Shanxi35.0055.0010.00-6.0465.00遼寧Liaoning43.4839.1317.39-6.8756.52陜西Shaanxi33.3338.1028.57-6.4266.67河南Henan11.1161.1127.78-6.8588.89總計Total28.4651.5420.00-8.1271.54
2.4 抗藥性突變體的獲得及抗性水平測定
2.4.1 藥劑馴化誘導菌株的抗藥性
敏感菌株TS1在含藥培養基上連續培養至30代,EC50由0.011 1 μg/mL(F0)增加到0.652 9 μg/mL(F30),F30代菌株為F0代的58.82倍,形成了較高水平的抗性菌株。蘋果輪紋病菌對戊唑醇抗性發展規律為(圖2):F0~F9為抗性緩慢發展階段,EC50由0.011 1 μg/mL增至0.073 4 μg/mL,抗性僅提高至F0的6.61倍;F9~F27為抗性快速發展階段,其EC50由0.073 4 μg/mL增至0.616 2 μg/mL,抗性由6.61倍增至55.51倍;F27~F30抗性發展較為平緩,進入平臺期,抗性倍數由55.51倍增至58.82倍,形成了對戊唑醇具有較高抗性水平的菌株。
2.4.2 紫外馴化誘導菌株的抗藥性
采用紫外線對相對敏感菌株TS2、TS3、TS7、TS9、TS11、TS12進行不同時間照射處理,75 s為最佳紫外線照射時間,共獲得15株疑似抗藥性突變體,其中能在含2 μg/mL戊唑醇的培養基上正常穩定生長的為5株抗性突變體,整體抗性突變頻率為0.417%,其親本菌株分別為TS7、TS11,抗性突變頻率分別為1.0%、1.5%。

圖2 蘋果輪紋病菌對戊唑醇的抗性發展規律Fig.2 Resistance development of Botryosphaeria dothidea to tebuconazole
測定抗性突變體對戊唑醇的敏感性,結果顯示EC50分布在0.300 6~0.911 1 μg/mL之間,對戊唑醇的敏感性均顯著下降(表3)。與敏感菌株相比,抗性突變體的抗性倍數在9.16~41.60之間,參照范昆[14]劃定的蘋果輪紋病菌對戊唑醇的抗性水平標準,UV-TS7-3、UV-TS7-4、UV-TS11-6、UV-TS11-10為高抗突變體,UV-TS11-2為中抗突變體。
表3 抗藥性突變體及其親本菌株對戊唑醇的敏感性及其抗性水平
Table 3 Susceptibility and resistance level of parental isolates and resistant mutants to tebuconazole

菌株Isolate毒力回歸方程Regressionequation有效抑制中濃度/μg·mL-1EC50相關系數(r)Correlationcoefficient抗性倍數ResistanceratioTS7y=6.9869+1.1977x0.0219(0.0181~0.0266)0.99291.00UV-TS7-3y=5.8610+0.9372x0.8364(0.6091~1.0637)0.988938.19UV-TS7-4y=5.7868+0.9418x0.9111(0.6868~1.1354)0.989041.60TS11y=6.4841+1.0001x0.0328(0.0279~0.0386)0.99351.00UV-TS11-2y=5.5469+1.0476x0.3006(0.2526~0.3577)0.99359.16UV-TS11-6y=5.2126+1.1013x0.6412(0.5189~0.7923)0.989819.55UV-TS11-10y=5.0749+1.0217x0.8446(0.7160~0.9963)0.993825.75
2.5 抗藥性突變體適合度的測定
2.5.1 藥劑馴化抗藥性突變體的適合度
以藥劑馴化抗藥性突變體(F12、F21、F30)及敏感菌株TS1分別接種蘋果果實、枝條后,被接種的果實、枝條全部發病,且致病力未發生明顯變化,抗藥性突變體的適合度指數與敏感菌株相比沒有顯著性差異(表4),對病果、病枝條進行再分離均可得到Botryosphaeriadothidea。
表4 藥劑馴化抗藥性突變體適合度的測定
Table 4 Fitness parameters of resistant mutants by chemical screening

菌株Isolate離體果實接種Fruitinoculation發病率Diseaseincidence病斑直徑/cmLesiondiameter綜合適合度Fitnessparameter活體枝條接種Branchinoculation發病率Diseaseincidence病斑長度/cmLesionlength綜合適合度FitnessparameterTS11.003.203.20aA1.004.504.50aAF121.003.403.40aA1.004.704.70aAF211.003.303.30aA1.004.404.40aAF301.003.203.20aA1.004.604.60aA
2.5.2 紫外誘導抗藥性突變體的適合度
紫外誘導抗藥性突變體(UV-TS7-3、UV-TS7-4、UV-TS11-2、UV-TS11-6、UV-TS11-10)及敏感菌株(TS7、TS11)分別接種蘋果果實、枝條后,被接種的果實、枝條全部發病,且致病力未發生明顯變化,病斑面積與敏感菌株差異不顯著。離體果實法測定中,除UV-TS11-2外,其他抗性突變體的綜合適合度指數均高于敏感菌株,活體枝條法測定的適合度也表現出類似的趨勢,除UV-TS11-2外,其他抗性突變體的綜合適合度指數均高于敏感菌株(圖3)。
2.6 抗性突變體的遺傳穩定性測定
將藥劑馴化、紫外線誘導獲得的8個抗戊唑醇突變體及其親本菌株在無藥PDA 培養基上繼代培養9代后,各抗性突變體EC50均呈逐漸下降趨勢(表5~6),表明所獲得的抗性可能不能穩定遺傳。其中,UV-TS7-3、UV-TS7-4的EC50降幅相對緩慢,在轉接至第9代時相較于其親本菌株抗性倍數仍很高,F12、F21、F30、UV-TS11-2、UV-TS11-6、UV-TS11-10的EC50降幅相對較大可能不能穩定遺傳。
3 討論
戊唑醇是高效、廣譜、內吸、輸導性、高選擇性的C-14α-脫甲基化酶抑制劑(C-14α-demethylation inhibitors,DMIs)[24],作用機制是抑制病原真菌麥角甾醇的合成,導致真菌細胞膜結構破壞和細胞死亡,對多種重要作物病害具有良好的防治效果[3],現已成為果樹、農作物、蔬菜等真菌病害化學防治的主要藥劑之一[25-26]。
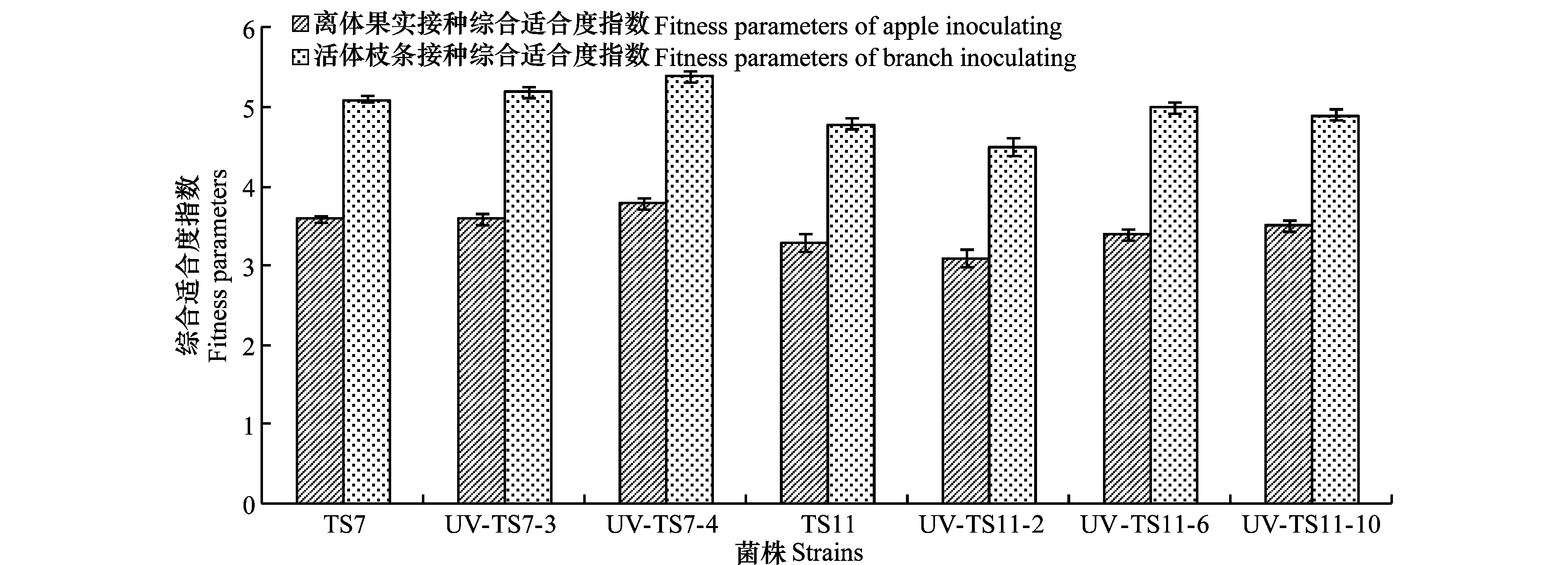
圖3 紫外誘導抗藥性突變體適合度的測定Fig.3 Fitness parameters of resistant mutants by UV irradiating
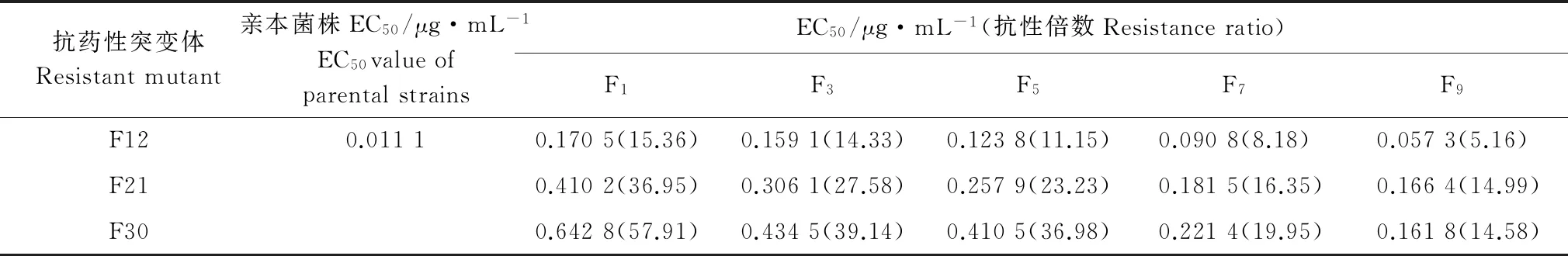
抗藥性突變體Resistantmutant親本菌株EC50/μg·mL-1EC50valueofparentalstrainsEC50/μg·mL-1(抗性倍數Resistanceratio)F1F3F5F7F9F120.01110.1705(15.36)0.1591(14.33)0.1238(11.15)0.0908(8.18)0.0573(5.16)F210.4102(36.95)0.3061(27.58)0.2579(23.23)0.1815(16.35)0.1664(14.99)F300.6428(57.91)0.4345(39.14)0.4105(36.98)0.2214(19.95)0.1618(14.58)
表6 紫外誘導抗藥性突變體的抗性遺傳穩定性
Table 6 Resistance genetic stability ofBotryosphaeriadothideamutants by UV irradiation to tebuconazole
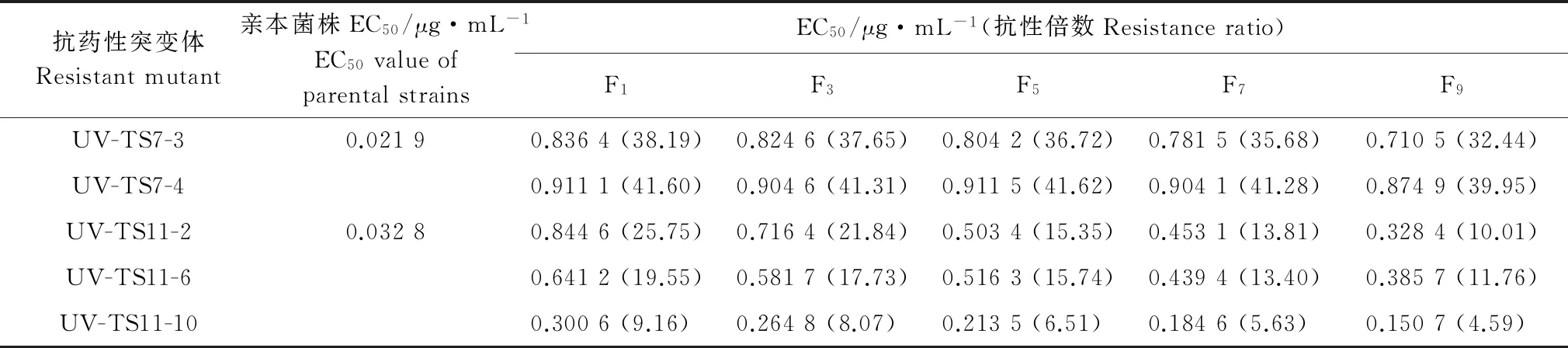
抗藥性突變體Resistantmutant親本菌株EC50/μg·mL-1EC50valueofparentalstrainsEC50/μg·mL-1(抗性倍數Resistanceratio)F1F3F5F7F9UV-TS7-30.02190.8364(38.19)0.8246(37.65)0.8042(36.72)0.7815(35.68)0.7105(32.44)UV-TS7-40.9111(41.60)0.9046(41.31)0.9115(41.62)0.9041(41.28)0.8749(39.95)UV-TS11-20.03280.8446(25.75)0.7164(21.84)0.5034(15.35)0.4531(13.81)0.3284(10.01)UV-TS11-60.6412(19.55)0.5817(17.73)0.5163(15.74)0.4394(13.40)0.3857(11.76)UV-TS11-100.3006(9.16)0.2648(8.07)0.2135(6.51)0.1846(5.63)0.1507(4.59)
本實驗室從2007年起就我國蘋果主產區輪紋病菌對戊唑醇的敏感性進行連續監測,2007年采集的51株菌株EC50平均值為(0.254 1±0.015 1)μg/mL,田間沒有出現敏感性下降的亞群體[14]。2013年測定130個供試菌株的EC50均值為(0.799 6±0.039 1)mg/L,表明對戊唑醇的敏感性顯著降低且敏感性開始出現分化,出現敏感性降低的亞群體,這是因為戊唑醇長期大面積使用導致病原菌對戊唑醇產生抗性,但整體抗性倍數比2007年僅提高3.15倍,抗性未出現顯著性提高,田間也未監測到高抗性水平菌株,這可能與果園施藥方式、藥劑輪換使用、果實套袋及枝干對藥劑吸收程度差等因素有關,同時與戊唑醇防治范圍廣泛密切相關。除蘋果輪紋病外,戊唑醇對蘋果斑點落葉病、炭疽病、褐斑病等蘋果主要病害均有良好的防治效果,使用范圍和次數越來越頻繁,已經成為防治蘋果病害的主要藥劑,在DMIs類殺菌劑的選擇壓力下,田間病原菌都會相應提高自己的適應水平,于是敏感菌株的數量逐漸減少,抗性菌株的數量逐漸增多,而且這種情況會一直持續下去,直到抗性經常發生從而變成一種常態,藥劑就失去了防控作用。本試驗結果表明,供試菌株的抗性頻率高達71.54%,從抗性水平的分布來看,20%的菌株對戊唑醇的抗性水平在5倍以上,屬中抗藥性水平,抗藥性綜合治理工作依然形勢嚴峻。
20世紀70年代研究認為,真菌對DMIs類殺菌劑產生抗性受多基因控制,抗性突變體的適應性差,在自然界中難以形成抗性群體,因此認為病原菌對DMIs類殺菌劑在田間產生抗性的風險很低[27-28]。但近幾十年來因為DMIs殺菌劑大量推廣使用,目前如葡萄灰霉病菌Botrytiscinerea[7]、大麥云紋病菌Rhynchosporiumsecalis[8]、開心果枝枯病菌Botryosphaeriadothidea[9]、大麥白粉病菌Erysiphegraminis[29]、葡萄白粉病菌Uncinulanecator[30]、甜菜葉斑病菌Cercosporabeticola[31]、番茄葉霉病菌Fluviafulva[32]、草莓枯萎病菌Fusariumoxysporum[33]等病原菌均對DMIs殺菌劑產生了不同程度的抗藥性。因此,定時監測蘋果輪紋病菌對戊唑醇的抗藥性對于今后田間抗藥性監測和治理至關重要。
評價病原菌對殺菌劑的抗性風險,國內外一般采用藥劑馴化、紫外誘導菌絲或孢子突變的方法獲得抗性菌株[34-37]。經過36代連續戊唑醇藥劑誘導,獲得的抗性倍數為34.22倍的草莓枯萎病菌抗性菌株,與同類藥劑具有較高水平的交互抗性,抗性遺傳穩定[33];利用戊唑醇進行室內誘導,獲得了抗性倍數達33.4 倍的禾谷絲核菌抗性菌株[24];Akallal等[12]室內誘導獲得了紅球叢赤殼菌的戊唑醇抗性菌株,與其他三唑類殺菌劑具有明顯的交互抗性。本研究對蘋果輪紋病菌進行藥劑馴化和紫外誘導,獲得抗性突變體的抗性倍數明顯高于田間采集菌株,藥劑馴化30代后獲得抗性倍數達58.82倍的較高水平的抗性菌株;紫外誘導抗性突變頻率較高,且能獲得抗性倍數達41.60倍的較高水平的抗性菌株。繼代培養9代后,各抗性突變體EC50均呈逐漸下降趨勢,藥劑馴化突變體均不能穩定遺傳,部分紫外誘導抗性突變體抗藥性能夠穩定遺傳;但所有抗性突變體的適合度與敏感菌株之間無顯著性差異,由此說明,蘋果輪紋病菌抗性突變體與敏感菌株之間具有相似的生存適合度,在田間產生抗性突變種群的風險很大,在以后的病害防治中,應注意藥劑的輪換使用或藥劑混配,以延緩田間蘋果輪紋病菌抗藥性的產生,但這一結論與田間菌株抗性發展緩慢不相符合,這可能與室內誘導抗性突變體、田間自然抗性突變體及敏感菌株在自然環境下群體生存時競爭力強弱有關,本課題組會對敏、抗菌株生存競爭力進行后續研究。
4 結論
2013年測定130個供試菌株的EC50均值為(0.799 6±0.039 1)mg/L,與2007年相比出現對戊唑醇敏感性降低的亞群體;供試菌株的抗性頻率高達71.54%,20%的菌株對戊唑醇的抗性水平在5倍以上,屬中抗藥性水平,田間未監測到高抗性水平菌株。藥劑馴化和紫外誘導獲得的部分較高水平的菌株抗藥性無法穩定遺傳;抗性突變體的抗性倍數明顯高于田間采集菌株,但適合度無顯著性差異,在田間產生抗性突變種群的風險很大。
[1] 張一賓. 全球三唑類殺菌劑的市場、品種、特點及發展[J]. 中國農藥, 2010(12): 11-13.
[2] 孫克. 全球十大殺菌劑的市場與展望[J]. 農藥, 2013, 52(7): 469-475.
[3] 李富根, 吳新平, 劉乃熾.戊唑醇的作用特點及其應用概況[J]. 農藥科學與管理, 2001, 22(3): 40-41.
[4] 林才華, 王開運, 顧春波, 等. 山東省草莓枯萎病菌對四種三唑類殺菌劑的敏感性檢測[J]. 植物保護學報, 2009, 36(1): 55-60.
[5] 蘇平, 周增強, 朱建蘭, 等. 河南省蘋果輪紋病菌對戊唑醇的敏感性檢測[J]. 中國農學通報, 2010, 26(13): 312-318.
[6] 王英姿, 張偉, 劉保友, 等. 山東省蘋果輪紋病菌對戊唑醇的抗藥性及其地理分布[J]. 果樹學報, 2010, 27(6): 961-964.
[7] Leroux P, Chapeland F, Desbrosses D, et al. Patterns of cross-resistance to fungicides inBotryotiniafuckeliana(Botrytiscinerea) isolates from French vineyards [J]. Crop Protection, 1999, 18(10): 687-697.
[8] Robbertse B, van der Rijst M, van Aarde I M R, et al. DMI sensitivity and cross-resistance patterns ofRhynchosporiumsecalisisolates from South Africa [J]. Crop Protection, 2001, 20(2): 97-102.
[9] Ma Zhonghua, Mougan D P, Felts D, et al. Sensitivity ofBotryosphaeriadothideafrom California pistachio to tebuconazole[J]. Crop Protection, 2002, 21(9): 829-835.
[10]Yoshimura M A, Luo Yong, Ma Zhonghua, et al. Sensitivity ofMoniliniafructicolafrom stone fruit to thiophanate-methyl, iprodione, and tebuconazole [J]. Plant Disease, 2004, 88: 373-378.
[11]Spolti P, Emerson M, Del Ponte E M, et al. Triazole sensitivity in a contemporary population ofFusariumgraminearumfrom New York wheat and competitiveness of a tebuconazole-resistant isolate [J]. Plant Disease, 2014, 98(5): 607-613.
[12]Akallal R, Debieu D, Lanen C, et al. Inheritance and mechanisms of resistance to tebuconazole, a sterol C14-demethylation inhibitor, inNectriahaematococca[J]. Pesticide Biochemistry and Physiology, 1998, 60(3): 147-166.
[13]翟明濤, 王開運, 許輝, 等. 抗氟吡菌胺辣椒疫霉菌株的誘導及其生物學特性的研究[J]. 植物病理學報, 2014, 44(1): 88-96.
[14]范昆,曲健祿,李林光,等.蘋果輪紋病菌對戊唑醇的敏感基線及其室內抗藥突變體研究[J]. 果樹學報, 2013, 30(4): 650-656.
[15]FAO.Recommended methods for the detection and measurement of resistance of resistance of agricultural pests to pesticides [J].FAO Plant Protection Bulletin,1982,30(2): 30-36.
[16]Bruin G C A, Edgington L V.Induction of fungal resistance to metalaxyl by ultraviolet irradiation [J]. Phytopathology, 1982, 72(5): 1209-1212.
[17]葉滔, 馬志強, 王文橋, 等. 禾谷鐮孢菌對戊唑醇抗藥性的誘導及抗性菌株特性研究[J]. 農藥學學報, 2011, 13(3): 261-266.
[18]Tooley P W, Sweigard J A, Fry W E.Fitness and virulence ofPhytophthorainfestansisolates from sexual and asexual populations [J]. Phytopathology, 1986, 76(11): 1209-1212.
[19]Kadish D, Cohen Y.Fitness ofPhytophthorainfestansisolates from metalaxyl-sensitive and resistant populations [J]. Phytopathology, 1988, 78(7): 912-915.
[20]Kadish D, Cohen Y.Competition between metalaxyl-sensitive and metalaxyl-resistant isolatesPhytophthorainfestansin the absence of metalaxyl [J]. Plant Pathology, 1988, 37(4): 558-564.
[21]朱書生, 王巖, 劉鵬飛, 等. 黃瓜霜霉病菌抗氟嗎啉菌株的適合度研究[J]. 植物病理學報, 2005, 35(6): 532-538.
[22]Johnson E M, Sutton T B, Hodges C S.Etiology of apple sooty blotch disease in North Carolina[J]. Phytopathology, 1997, 87(1): 88-95.
[23]劉保友, 張偉, 欒炳輝, 等. 蘋果輪紋病菌對苯醚甲環唑和氟硅唑的敏感性及其交互抗性[J]. 植物病理學報, 2013, 43(5): 541-548.
[24]Hamamoto H, Hasegawa K, Nakaune R, et al. Tandem repeat of a transcriptional enhancer upstream of the sterol 14α-demethylase gene(CYP51) inPenicilliumdigitatum[J]. Applied and Environmental Microbiology, 2000, 66(8): 3421-3426.
[25]汪漢成, 周明國, 張艷軍, 等. 戊唑醇對立枯絲核菌的抑制作用及在水稻上的應用[J]. 農藥學學報, 2007, 9(4): 357-362.
[26]胡燕, 王懷訓, 夏曉明, 等. 四地區小麥紋枯病菌對6種殺菌劑的抗性比較[J]. 植物保護學報, 2006, 33(4): 55-60.
[27]Fuchs A, Drandarevski C A.The likelihood of development of resistance to systemic fungicides which inhibit ergosterol biosynthesis [J]. Netherlands Journal of Plant Pathology, 1976, 82(2): 85-87.
[28]K?ller W, Scheinpflug H.Fungal resistance to sterol biosynthesis inhibitors: a new challenge [J]. Plant Disease, 1987, 71(12): 1066-1074.
[30]Steva H, Clerjeau M.Cross resistance to sterol biosynthesis inhibitor fungicides in strains ofUncinulanecatorisolated in France and Portugal [J].Mededelingen van de Faculteit Landbouwwetenschappen, Rijksuniversiteit Gent, 1990, 42(3): 983-988.
[31]Karaoglanidis G S, Loannidis P M, Thanassouiopoulos C C.Reduced sensitivity ofCercosporabeticolaisolates to sterol-demethylation-inhbiting fungicides [J].Plant Pathology, 2000, 49(5): 567-572.
[32]張馳, 紀明山, 王英姿, 等. 番茄葉霉病菌對氟硅唑抗藥性的初步研究[J].沈陽農業大學學報, 2003, 34(4): 255-258.
[33]顧春波, 姜莉莉, 王開運, 等. 抗戊唑醇草莓枯萎病菌ZY-W 的誘導及其生物學特性[J]. 中國農業科學, 2010, 43(14): 2897-2904.
[34]崔曉嵐, 孟慶曉, 畢揚, 等. 辣椒疫霉對烯酰嗎啉的敏感性基線及室內抗藥突變體研究[J]. 植物病理學報, 2009, 39(6): 630-637.
[35]趙衛松, 韓秀英, 齊永志, 等. 辣椒疫霉對雙炔酰菌胺的敏感性測定及其抗藥突變體的生物學性狀研究[J]. 農藥學學報, 2011, 13(1): 21-27.
[36]Young D H, Spiewak S L, Slawecki R A.Laboratory studies to assess the risk of development of resistance to zoxamide [J]. Pest Management Science, 2001, 57(11): 1081-1087.
[37]Bi Yang, Cui Xiaolan, Lu Xiaohong, et al. Baseline sensitivity of natural population and resistance of mutants inPhytophthoracapsicito zoxamide [J]. Phytopathology,2011,101(9):1104-1111.
(責任編輯:楊明麗)
Susceptibility ofBotryosphaeriadothideato tebuconazole and virulence of its resistant mutants
Fan Kun1, Fu Li1, Li Xiaojun1, Zhai Hao1, Liu Lu2, Qu Jianlu1
(1.ShandongInstituteofPomology,Tai’an271000,China; 2.Tai’anCityForestryBureau,Tai’an271000,China)
130Botryosphaeriadothideaisolates were collected from major apple-produced regions to assess the susceptibility to tebuconazole by mycelium growth rate method and to test the virulence of resistance mutants. Resistant mutants were obtained by chemical screening and UV irradiation in the laboratory, and the fitness parameters of resistant and susceptible isolates were measured. The results showed that the EC50values of 130 isolates varied from 0.051 6-1.925 4 μg/mL with the mean of (0.799 6±0.039 1)μg/mL and low resistant subcolony has been discovered. The resistant ratio of tested isolates was 71.54% and high-resistant strains has not discovered in major apple-produced regions. The resistance level of three resistant mutants was high with the resistant ratio of 58.82, 41.60 and 38.19 times, respectively. The fitness and virulence of resistant mutants had no significant difference between resistant and susceptible isolates. The resistance ratio of mutants decreased gradually after 9 generations of subcultures in the absence of fungicides and the resistance could not inherit stably. The results indicated that the resistance ofB.dothideato tebuconazole could gradually decline when the field selection pressure became lower.
Botryosphaeriadothidea; tebuconazole; susceptibility; mutant; pathogenicity
2016-02-16
2016-04-26
山東省自然科學基金(ZR2013CQ040);國家現代農業產業技術體系(CARS-28);泰安市科技攻關項目(201540699);山東省農業科學院農業科技創新工程(CXGC2016B07);山東省農業科學院青年科研基金(2016YQN32);山東省果樹研究所所長基金(2013ky02)
S482.2
A
10.3969/j.issn.0529-1542.2017.01.024
* 通信作者 E-mail:qujianlu@sina.com

